© Borgis - Postępy Nauk Medycznych 3/2000, s. 51-53
Jolanta Wołkanin-Bartnik, Tomasz Zieliński
Tętniak rzekomy jako powikłanie kaniulacji tętnicy udowej – diagnostyka i postępowanie
Pseudoaneurysm as a complication of the catheterization of the femoral artery – diagnosis and treatment
II Klinika Wad Serca Instytutu Kardiologii w Warszawie
Kierownik Kliniki: prof. dr hab. med. Jerzy Korewicki
Streszczenie
Tętniak rzekomy tętnicy udowej jest istotnym powikłaniem diagnostycznych i terapeutycznych procedur stosowanych w kardiologii interwencyjnej. Występuje według różnych autorów z częstością 1,2 % do 9% kaniulacji.
W pracy przedstawiono współczesne poglądy na temat diagnostyki i leczenia, ze szczególnym uwzględnieniem znaczenia ultrasonografii w rozpoznawaniu i niechirurgicznym leczeniu tego powikłania.
Summary
Femoral arterial pseudoaneurysm is an important complication of interventional cardiology procedures occurring in 1.2 to 9% of patients.
We present current opinions concerning diagnosis and treatment, particularly the role of ultrasound methods in prognosis, and the possibilities of non-surgical treatment.

Rosnąca liczba zabiegów cewnikowania serca i inwazyjnego leczenia choroby wieńcowej a także coraz szersze zastosowanie usg i metody kolorowego dopplera, spowodowały wzrost liczby rozpoznań miejscowych powikłań po kaniulacji.
Lepsza diagnostyka, precyzyjniejsza ocena, pozwalają z kolei na wybór optymalnej metody leczenia.
Wśród powikłań po nakłuciu tętnicy udowej wymienić należy: tętniaki rzekome, krwiaki, zakrzepicę tętnicy lub żyły udowej, krwawienie, zakażenie, niedokrwienie kończyny, uszkodzenie nerwu udowego.
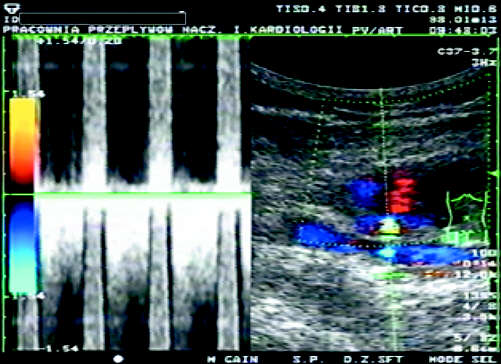
Ryc. 1. Po prawej: obraz w prezentacji 2D tetniaka rzekomego tetnicy udowej. Po lewej: dwukierunkowy przeplyw w badaniu metoda dopplera miedzy tetnica udowa wspólna i tetniakiem rzekomym.
Spośród wymienionych powikłań aż 2/3 przypadków stanowi tętniak rzekomy. Tętniak rzekomy (TR) jest to przestrzeń wykazująca komunikację z naczyniem tętniczym poprzez kanał określany szyją tętniaka. Między światłem TR a tętnicą odbywa się stały przepływ krwi. W odróżnieniu od tętniaka prawdziwego, TR nie posiada w swojej ścianie żadnego z elementów ściany naczynia.
Klinicznie TR charakteryzuje się obecnością tętniącego bolesnego guza. Zwykle wysłuchuje się nad nim szmer, który jest skutkiem burzliwego przepływu przez wąski kanał łączący i/lub jest spowodowany uciskiem tętnicy przez TR albo też współistnieniem przetoki tętniczo-żylnej. Niekiedy występują objawy neuropatii związanej z uciskiem na nerw udowy (przeczulica i ból przednio-przyśrodkowej powierzchni uda) lub objawy niedokrwienia kończyny. Sekwestracja dużej objętości krwi lub towarzyszące duże wynaczynienie mogą być powodem anemizacji.
Ultrasonograficznie TR przedstawia obraz przestrzeni płynowej (hypoechogenicznej) z widocznym kanałem łączącym go z naczyniem. W badaniu metodą kolorowego dopplera widoczny jest przepływ między tętnicą a TR i krążenie krwi w jego obrębie. Spektrum dopplerowskie wykazuje typowy dwukierunkowy przepływ o charakterze „do i od” .W czasie skurczu strumień krwi wpływa do TR a w rozkurczu cofa się do tętnicy.
Częstość występowania TR jest różnie oceniana – od 1,2% kaniulacji (1) w pracach, gdzie rozpoznanie było oparte na ocenie klinicznej do 7,7% (2), gdy analizę opierano o badanie usg i kolorowego dopplera wszystkich cewnikowanych pacjentów. Podkreślić należy w tym miejscu dużą wartość diagnostyczną usg z prawie 100% czułością i specyficznością.
Na ryzyko powstania TR wpływają różne czynniki (3). Należą do nich: starszy wiek, płeć żeńska, otyłość, źle kontrolowane nadciśnienie, miażdżyca tętnic.
Ryzyko powstania TR zależy też od rodzaju wykonywanego zabiegu. W wielu pracach podkreśla się częstsze występowanie tego powikłania u pacjentów po założeniu stentu, niż po cewnikowaniu diagnostycznym, co tłumaczy się użyciem większych rozmiarów cewników i związaną z tym większą traumatyzacją naczynia. W materiale przedstawionym przez Katzenchlagera wśród 581 wykonanych cewnikowań, TR obserwowano w 14 % przypadków przezskórnej plastyki tętnicy i tylko w 1,2 % angiografii. W starszym opracowaniu Kresowika, częstość TR po przezskórnej plastyce tętnicy wieńcowej, wynosiła 9% .
W analizie 894 pacjentów poddanych inwazyjnym zabiegom wieńcowym, Waksman stwierdził występowanie różnych miejscowych powikłań naczyniowych aż w 20,5% przypadków implantacji stentów w porównaniu z 5,3% zabiegów plastyki wieńcowej.
Implantacja stentu jest uważana przez wielu autorów za niezależny czynnik powstania miejscowych powikłań naczyniowych, zwłaszcza dotyczy to przypadków ostrego zamknięcia tętnicy wieńcowej i jest dodatkowo uwarunkowany bardziej agresywnym leczeniem przeciwkrzepliwym z zastosowaniem dekstranu, aspiryny, przedłużonego wlewu heparyny i stosowaniem antykoagulantów (2, 3, 4, 5, 6).
Istotną rolę odgrywa też czas i technika ucisku naczynia po zabiegu – ręczny czy przy pomocy mechanicznych urządzeń uciskowych (1) lub ewentualne zastosowanie aplikacji kolagenu w miejsce nakłucia (18, 19).
Postępowanie, w przypadku rozpoznania TR, jest najczęściej zachowawcze. Wynika to z analizy historii naturalnej, która pokazuje, iż ok. 90% TR zamyka się spontanicznie w czasie od kilku dni do 2 miesięcy (2, 8), choć opisywano zamykanie się TR po 180 dniach. Prawdopodobieństwo samoistnego wyleczenia wybitnie spada u pacjentów z dużym TR pozostających na przewlekłym leczeniu przeciwkrzepliwym.
Na przyjęcie postępowania zachowawczego wpływa też stosunkowo rzadkie występowanie powikłań takich jak: zakażenie, zapalenie żył czy pęknięcie. To ostatnie groźne powikłanie wystąpiło w materiale 25 tys. cewnikowań w Duke University Medicine Center w 3 przypadkach (9).
Również nie bez znaczenia jest ryzyko samej operacji TR i związany z tym przedłużony pobyt w szpitalu.
Strategia postępowania zachowawczego polega na zastosowaniu w pierwszej kolejności ponownego opatrunku uciskowego na 24 godziny i unieruchomieniu pacjenta w łóżku a następnie kontrolne usg.
Badanie usg jest metodą z wyboru w rozpoznawaniu TR i prognozowaniu jego przebiegu. Są próby znalezienia ultrasonograficznych markerów samoistnego zamknięcia się TR (11). Należą do nich:
– wielkość poniżej 3 cm,
– długość szyi tętniaka przekraczająca 1 cm,
– duży stopień wypełnienia tętniaka skrzepliną,
– lokalizacja tętniaka (łatwiej zamykają się te w tętnicy udowej wspólnej niż powierzchownej lub głębokiej).
Ucisk pod kontrolą usg jest także metodą stosowaną w leczeniu TR. Od kiedy Fellmeth i współpracownicy w roku 1991 po raz pierwszy zastosowali tę metodę, wiele prac dokumentowało jej dużą skuteczność i bezpieczeństwo (4, 6, 11, 12, 13, 14, 20).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Pracyk J.B., Wall Th., Longabaugh J. i wsp.: A randomized trial of vascular hemostasis techniques to reduce femoral vascular complications after coronary intervention. Am. J. Cardiol. 1998; 981: 970-976.
2. Katzenschlager R., Ugurluoglu A., Ahmadi A. i wsp.: Incidens of pseudoaneurysm after angiography. Radiology 1995; 195: 463-466.
3. Waksman R., Spencer B.,Douglas J. i wsp.: Predictors of groin complications after ballon and new-device coronary intervention. Am. J. Cardiol 1995; 75: 886-889.
4. Hertz S., Brener B.: Ultrasound-guided pseudoaneurysm compression:efficacy after coronary stenting and angioplasty. J. Vasc. Surg. 1997; 26: 913-918.
5. Muller D.W. i wsp.: Peripherial vascular complication after conventional and complex percutaneous coronary interventional procedures. Am. J. Cardiol. 1992; 69: 63-68.
6. Hood D., Mattos M., Douglas M. i wsp.: Determinants of succsess of color-flow duplex-guided compression repair of femoral pseudoaneurysms. Surgery 1996; 120: 585-590.
7. Kussmaul W., Buchbinder M., Whitlow P. i wsp.: Rapid arterial hemostasi and decrised acces site complications after cardiac catheterization and angioplasty: results of randomized trial of a novel hemostatic device. JACC 1995, vol. 25:.1685-92.
8. Tourkissian B., Brent T., Drazen P. i wsp.: Spontaneous closure of selected iatrogenic pseudoaneurysms and arteriovenous fistule. J. Vasc. Surg. 1997; 25: 803-809.
9. McCan M. I wsp.: Vascular complications od cardiac catheterization. J. Vasc. Surg. 1991; 14: 375.
10. Samuels D., Orron D., Kessler A. i wsp.: Femoral artery pseudoaneurysm:doppler sonographic features predictive for spontaneous thrombosis. J Clin Unltrasound 1997, 25: 497-500.
11. Schaub F., Theis W., Heinz M. i wsp.: New aspects in ultrasound-guided compression repair of postcatheterization femoral artery injuries. Circulation 1994; 90: 1861-65.
12. Chatterje T., Do D., Mahler F., Meier B. i wsp.: Pseudoaneurysm of femoral artery after catheterization: treatment by a mechanical compressiondevice guided by coloro Doppler ultrasound. Heart 1998; 79: 502-504.
13. Fellmeth M i wsp.: Repair of postcatheterization femoral pseudoaneurysm by color flow ultrasound guided compression. Am. J. Heart. J. 1992; 13: 328-35.
14. Schaub F., Theiss W., Busch R. i wsp.: Management of 219 consecutive cases of postcatheterization pseudoaneurysm. JACC. 1997; 30: 670-675.
15. Kresowik i wsp.: A prospective study of the incidens and the natural history of femoral vascular complications after PTCA. J. Vasc. Surg. 1991; 13: 328-35.
16. Pan M., Medina A., Suarez J. i wsp.: Obliteration of pseudoaneurysm complicating coronary artery intervention by direct puncture and permanent or removable coil insertion. Am. J. Cardiol. 1997; 80: 786-90.
17. Kang S. i wsp.: Percutaneus ultrasound guided thrombin injection: a new method of treating postcatheterization femoral pseudoaneurysms. J. Vasc. Surg. 1998; 27: 1032-8.
18. Sjef M.: Immediate sealing of arterial puncture sites after cardiac catheterization and coronary angioplasty using a biodegradable collagen plug: results of an International Registry. JACC. 1993, vol. 21, no 4: 851-5.
19. Camenzind E., Grossholz M., Urban Ph. i wsp.: Collagen application vs manual compression: a prospective randomized trial for arterial puncture site closure after coronary angioplasty. JACC. 1994, vol 124, no 3, 655-62.
20. Rocha-Singh K., Schwend R., Otis S. i wsp.: Frequency and nonsurgical therapy of femoral artery pseudoaneursm complicating interventional cardiology procedures. Am. J. Cardiol. 1994, 75: 1012-1014.

