© Borgis - Postępy Nauk Medycznych 4/2011, s. 286-294
*Anna Kempisty
Sarkoidoza
Sarcoidosis
I Klinika Chorób Płuc Instytutu Gruźlicy i Chorób Płuc w Warszawie
Kierownik Kliniki: prof. dr hab. Jan Kuś
Streszczenie
Sarkoidoza jest wielonarządową chorobą ziarniniakową o nieustalonej etiologii, zajmującą najczęściej węzły chłonne wnęk, miąższ płucny, narząd wzroku oraz skórę. Ostatni oficjalny dokument podsumowujący dotychczasową wiedzę na temat sarkoidozy opublikowany w 1999 pod patronatem trzech międzynarodowych stowarzyszeń medycznych opiera się przede wszystkim na opinii ekspertów. Od tego czasu nasza wiedza o sarkoidozie poprawiła się. Pojawiły się nowe metody poprawiające diagnostykę bronchoskopową wykorzystujące wewnątrzoskrzelową i przezprzełykową ultrasonografię. Badane są alternatywne do glikokortykosteroidów leki, takie jak inhibitory czynnika martwicy nowotworów. Nadal jednak nie ustalono czynnika etiologicznego. W ostatnich latach największą uwagę poświęca się potencjalnej roli prątków, zarówno gruźliczych jak i niegruźliczych w etiologii sarkoidozy.
Choroba ma różne oblicza, więc każdy chory na sarkoidozę musi być traktowany indywidualnie.
W pracy podsumowano wiedzę dotyczącą sarkoidozy na podstawie piśmiennictwa z ostatnich lat, ze szczególnym uwzględnieniem sarkoidozy płucnej.
Summary
Sarcoidosis is a systemic granulomatous disease of unknown etiology, which involves especially lung, hilar lymph nodes, eye and skin. The last official document on sarcoidosis published in 1999 by three international societies was based mainly on experts’ opinions. Since ten our knowledge on sarcoidosis improved. New methods using endobronchial and transesophageal ultrasonography in bronchoscopic diagnosis of sarcoidosis have been used. New therapetic alternatives to corticosteroids, such as tumor necrosis factor inhibitors, are tested . Unfortunately etiology of sarcoidosis still remains unknown. In the past years many studies concerning potential role of mycobacteria in etiology of sarcoidosis were published.
The clinical presentation of sarcoidosis is different in each patient, so the approach should be individualized.
In this article we summarize the present knowledge about disease, with special attention to pulmonary sarcoidosis.

Wstęp
Sarkoidoza jest wielonarządową chorobą ziarniniakową o nieustalonej etiologii, zajmującą najczęściej węzły chłonne wnęk, miąższ płucny, narząd wzroku oraz skórę.
Pierwsze wzmianki o chorobie pojawiły się w 1869 roku, kiedy to angielski lekarz Jonathan Hutchinson przedstawił na kongresie w Londynie przypadek chorego na sarkoidozę. Jednak dopiero trzydzieści lat później, w 1899, norweski dermatolog Caesar Boeck po raz pierwszy użył terminu zbliżonego brzmieniem do obecnej nazwy choroby (1).
Sarkoidoza była i jest nadal przedmiotem licznych badań. Główne wysiłki naukowców skierowane są na zidentyfikowanie czynnika etiologicznego, bo od tego zależy właściwe leczenie choroby.
Ostatni oficjalny dokument będący podsumowaniem dotychczasowej wiedzy na temat sarkoidozy został opublikowany w 1999 pod patronatem trzech międzynarodowych stowarzyszeń medycznych (2). Rekomendacje dotyczące rozpoznawania oraz leczenia sarkoidozy zawarte w tym dokumencie oparte zostały przede wszystkim na opinii ekspertów. Autorzy mieli świadomość wielu ograniczeń związanych z brakiem wiedzy na temat etiologii sarkoidozy, czynników prognostycznych czy też znaczenia sterydów w naturalnym przebiegu choroby.
W pracy podsumowano wiedzę dotyczącą sarkoidozy na podstawie piśmiennictwa z ostatnich lat, ze szczególnym uwzględnieniem sarkoidozy płucnej.
Epidemiologia
Dane epidemiologiczne cytowane w różnych opracowaniach pochodzą z badań wykonanych w ubiegłym wieku. Wartości mogą być nieobiektywne ze względu na brak jednoznacznych kryteriów przy ich przeprowadzaniu. Część chorych pozostaje, ze względu na bezobjawowy charakter choroby, poza systemem opieki medycznej. W krajach o wysokiej zapadalności na gruźlicę liczba chorych może być niedoszacowana ze względu na pomyłki diagnostyczne (3). Żaden kraj nie posiada rejestru chorych na sarkoidozę.
Zachorowalność na sarkoidozę różni się miedzy poszczególnymi krajami. W Europie największa chorobowość dotyczy krajów skandynawskich, przede wszystkim Szwecji i Danii. Rzadko chorują mieszkańcy południowej Europy. Polska nie dysponuje aktualnymi badaniami epidemiologicznymi. W latach 50. ubiegłego wieku dane oparte jedynie na przesiewowych badaniach radiologicznych w grupie studentów oceniły chorobowość na 10,7/100 000 (4). Badania przeprowadzone przez Jaroszewicz i wsp. w latach siedemdziesiątych wykazały niższe wskaźniki chorobowości: 7,1/100 000 (4). W Stanach Zjednoczonych więcej zachorowań dotyczy rasy czarnej niż białej, odpowiednio 35,5/100 000 i 10,9/100 000 (5). Rzadko dochodzi do zachorowań w Azji i Afryce.
Sarkoidoza dotyczy najczęściej młodych dorosłych pomiędzy 20. a 40. rokiem życia (2). W niektórych krajach obserwuje się bimodalny rozkład chorującej populacji (3, 6). W Japonii drugi szczyt zachorowań występuje u kobiet po 50. roku życia, a w krajach skandynawskich dotyczy kobiet między 65-69 r.ż. (7). Rzadko choroba dotyczy dzieci i ludzi w podeszłym wieku. Kobiety chorują nieco częściej niż mężczyźni.
Przebieg kliniczny także wykazuje różnice między krajami. W Europie częściej występuje zespół Löfgrena, w Stanach Zjednoczonych więcej jest przypadków sarkoidozy przewlekłej, a w Japonii częściej występuje sarkoidoza serca.
Śmiertelność wynosi 1-5%. Najczęstszymi przyczynami zgonów są: niewydolność oddechowa, sarkoidoza serca i sarkoidoza ośrodkowa układu nerwowego (OUN) (2).
Etiologia
Mimo wielu wysiłków nie udało się ustalić czynnika etiologicznego dla sarkoidozy. Pojawiały się na przestrzeni lat liczne koncepcje dotyczące infekcyjnego (wirusy, bakterie, prątki gruźlicy, prątki niegruźlicze) i nieinfekcyjnego ( aluminium, talk, pyłki sosny) podłoża choroby (2). Jednak żadna z nich nie została potwierdzona.
Najwięcej uwagi naukowcy poświęcają potencjalnej roli prątków, zarówno gruźliczych (ang. Mycobacterium tuberculosis – MTB), jak i niegruźliczych (ang. nontuberculous mycobacteria – NTM) w etiologii sarkoidozy. Powodem tego zainteresowania jest fakt podobieństwa obrazu kliniczno-radiologicznego i histopatologicznego sarkoidozy i gruźlicy. W ostatnich 30. latach ukazało się kilkaset prac dotyczących tego zagadnienia. Wiele z nich wykorzystuje czulsze niż konwencjonalne posiewy, metody molekularne i immunologiczne. Gupta i wsp. dokonali metaanalizy ponad 30 badań, w których wykorzystano metody molekularne do identyfikacji prątków u chorych na sarkoidozę (8). W przebadanym materiale stwierdzono u 1/3 chorych obecność materiału genetycznego prątka gruźlicy lub innych mikobakterii. To, że nie zawsze udaje się zidentyfikować prątki w tkankach chorych na sarkoidozę, tłumaczone jest w wieloraki sposób. Jedni uważają, że prątki mają zmienioną formę i w związku z tym trudno jest je zidentyfikować i wyhodować na konwencjonalnych podłożach. Inni zaś przypuszczają, że reakcja immunologiczna prowadząca do powstania choroby mogła być zapoczątkowana przez prątki na tyle wcześnie, że w chwili wystąpienia choroby nie są one wykrywane. Kolejnym głosem w dyskusji są badania immunologiczne identyfikujące w krwi obwodowej chorych na sarkoidozę swoiste dla MTB antygeny. Drake i wsp. zidentyfikowali u 57% chorych immunologiczną odpowiedź na antygeny ESAT-6 (ang. early secreted antigenic target-6) i KatG (ang. catalase-peroxidase) (9). Podobne wyniki uzyskali Carlisle i wsp., którzy oceniali odpowiedź immunologiczną na 3 antygeny: ESAT-6, KatG oraz sodA (ang. superoxide dismutase A). U 53% chorych na sarkoidozę zidentyfikowano odpowiedź na przynajmniej jeden z tych antygenów (10). Oswald-Richter i wsp. badając odpowiedź na antygeny ESAT-6 i katG w płynie z płukania oskrzelowo-pęcherzykowego (ang. bronchoalveolar lavage – BAL), uzyskali pozytywne wyniki u 73% chorych na sarkoidozę (11).
Teoria, że Mycobacterium tuberculosis może być czynnikiem etiologicznym w sarkoidozie ma też swoich przeciwników. Ponieważ nie zaobserwowano zwiększonej liczby przypadków gruźlicy u chorych na sarkoidozę leczonych sterydami, może być to argumentem przeciw bezpośredniemu udziałowi MTB w etiologii choroby.
Dopóki nie mamy jednoznacznych danych, konieczne jest na etapie diagnostyki różnicowanie tych dwóch chorób.
Obraz kliniczny
Każdy chory na sarkoidozę choruje inaczej. Nawet połowa chorych nie ma żadnych objawów klinicznych i choroba wykrywana jest przypadkowo. 30% chorych ma objawy ogólne: gorączkę, osłabienie, chudnięcie, poty nocne. Kolejna grupa objawów wynika z zajęcia poszczególnych narządów.
W przebiegu sarkoidozy najczęściej dochodzi do zajęcia układu oddechowego. U prawie wszystkich chorych (> 90%) zmiany lokalizują się w miąższu płuc i w węzłach chłonnych wnęk płucnych. Także w tym przypadku wykrycie choroby może być przypadkowe. Pozostali skarżą się na suchy kaszel, duszność wysiłkową, pogorszenie tolerancji wysiłku, bóle w klatce piersiowej. Zajęcie węzłów chłonnych wnęk może przebiegać ze zmianami skórnymi o typie rumienia guzowatego, gorączką, bólami i obrzękami stawów. Taka manifestacja choroby nazwana została zespołem Löfgrena. W badaniu przedmiotowym zazwyczaj nie stwierdza się zmian osłuchowych nad płucami. Trzeszczenia występują w stadium włóknienia. Palce pałeczkowate występują rzadko.
Na podstawie obrazu radiologicznego klatki piersiowej podzielono sarkoidozę na 5 stadiów (12).
W stadium 0 stwierdza się prawidłowy radiogram klatki piersiowej. Dotyczy on 10% chorych na sarkoidozę. Stadium I, w którym zajęte są węzły chłonne wnęk, występuje u połowy chorych (ryc. 1, 2). Powiększenie węzłów chłonnych jest najczęściej symetryczne, często też obserwuje się powiększenie węzłów chłonnych przytchawiczych prawych. Choroba na tym etapie ma korzystne rokowanie, a remisje samoistne obserwuje się w 60-90% przypadkach. U większości zmiany cofają się w ciągu 2 lat od rozpoznania choroby. Rzadko u tych chorych dochodzi do progresji choroby.
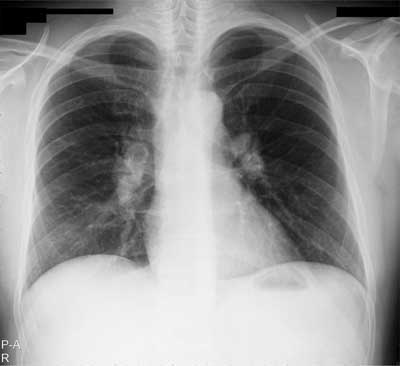
Ryc. 1. RTG klatki piersiowej chorego na sarkoidozę w stadium I – obustronnie, symetrycznie powiększone węzły chłonne wnęk.
Ryciny pochodzą z materiału własnego Kliniki.
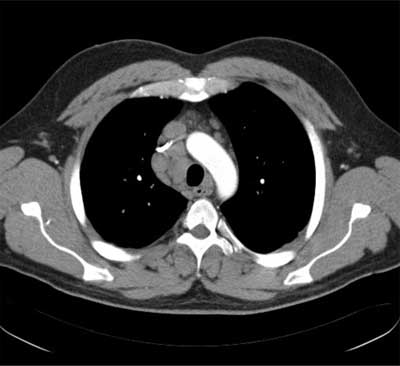
Ryc. 2. Tomografia komputerowa – okno śródpiersiowe, obraz sarkoidozy w stadium I – znacznie powiększone węzły chłonne wnęk i śródpiersia.
W stadium II obok limfadenopatii wnęk opisywane są zmiany drobnoguzkowe zlokalizowane w górnych i środkowych polach płuc (ryc. 3). Badanie tomografii klatki piersiowej wysokiej rozdzielczości (TKWR) pozwala na uwidocznienie charakterystycznej dla sarkoidozy dystrybucji zmian guzkowych wzdłuż pęczków naczyniowo-oskrzelowych i podopłucnowo (ryc. 4).
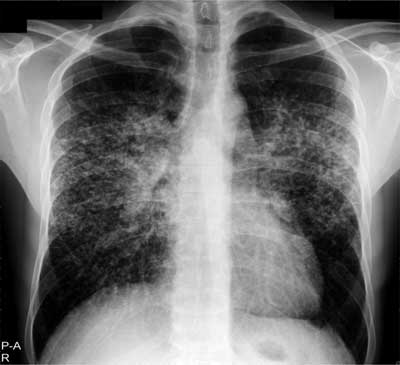
Ryc. 3. RTG klatki piersiowej chorego na sarkoidozę w stadium II – powiększone węzły chłonne wnęk oraz drobnoguzkowe zmiany rozsiane w polach środkowych i górnych płuc.
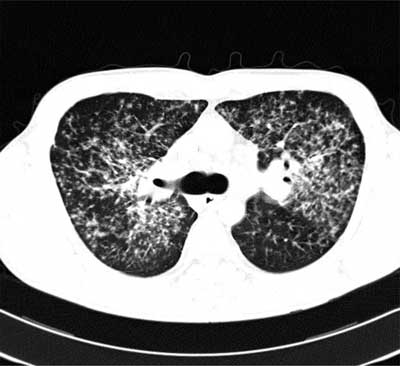
Ryc. 4. Obraz TKWR sarkoidozy w stadium II – liczne drobne guzki zewnątrzzrazikowe, układające się wzdłuż pęczków naczyniowo-oskrzelowych i pod opłucną, miejscami zlewające się w konglomeraty.
W stadium III występują zmiany jedynie śródmiąższowe. W stadium IV stwierdza się objawy włóknienia płuc z obrazem plastra miodu, rozstrzeniami z pociągania, retrakcją wnęk (ryc. 5, 6).
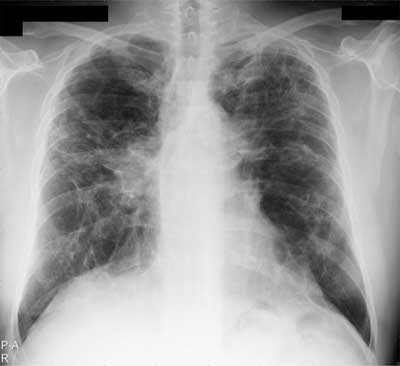
Ryc. 5. RTG klatki piersiowej u chorego na sarkoidozę w stadium IV – zaawansowane włóknienie powodujące zniekształcenie i podciągnięcie wnęk ku górze.
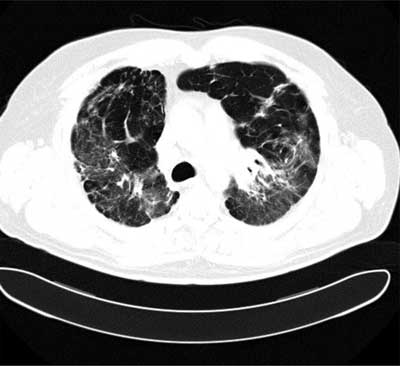
Ryc. 6. Obraz TKWR sarkoidozy w stadium IV – zaburzenie architektoniki miąższu płuc, zniekształcenie wnęk, zmiany siateczkowate, pęcherze rozedmy.
Zajęcie miąższu płuc może powodować zaburzenia funkcji płuc. Do najczęściej występujących należą zaburzenia typu restrykcyjnego, obniżenie zdolności dyfuzyjnej dla tlenku węgla (ang. carbon monoxide diffusion capacity – DL,CO) oraz obniżenie podatności statycznej (ang. static lung compliance – CLs) (13, 14). Boros i wsp. analizując grupę 830 chorych na sarkoidozę, wykazali, że statystycznie częściej występuje upośledzenie DL,CO i CLs niż obniżenie całkowitej pojemności płuc (ang. total lung capacity – TLC) (15).
Zajęcie opłucnej w przebiegu sarkoidozy występuje nawet u 10% chorych, ale obecność płynu w opłucnej występuje tylko w 1-3%. Płyn jest zazwyczaj jednostronny z predylekcją do prawej strony. Najczęściej towarzyszy zmianom płucnym w stadium II i III.
W przebiegu sarkoidozy obserwuje się także zajęcie dróg oddechowych: krtani, tchawicy i oskrzeli. Konsekwencją tych zmian są objawy obturacji stwierdzane u 20% chorych. Obturacja dróg oddechowych może wynikać nie tylko z obecności ziarniniaków, ale może być spowodowana uciskiem z zewnątrz przez powiększone węzły chłonne, czy też być wtórna do zaburzeń architektoniki płuc u chorych w stadium włóknienia. Częściej niż obturację u tych chorych stwierdza się obniżenie maksymalnych przepływów wydechowych przy małych objętościach (MEF50%FVC, MEF25%FVC) (16).
Ostatnim elementem układu oddechowego zajętym w przebiegu sarkoidozy są naczynia płucne. Objawowe zajęcie naczyń płucnych, pod postacią nadciśnienia płucnego, zatorowości płucnej czy ziarniniakowego zapalenia naczyń występuje w 1-4% przypadków (13).
Zmiany pozapłucne w sarkoidozie mogą dotyczyć każdego narządu i mieć różny przebieg kliniczny. Zajęcie skóry, wątroby czy śledziony rzadko wymaga leczenia. Nieleczone zaś zmiany w sercu i ośrodkowym układzie nerwowym mogą doprowadzić do zgonu chorego. Poniżej przedstawione zostaną wybrane lokalizacje pozapłucne.
Skóra zajęta jest u 25% chorych. W Europie najczęściej występuje rumień guzowaty. Lokalizuje się on zazwyczaj na powierzchniach wyprostnych podudzi, nad stawami skokowymi lub nadgarstkowymi. Zmiany ustępują samoistnie w ciągu kilku tygodni. Drugą charakterystyczną zmianą dla sarkoidozy jest toczeń odmrozinowy, lokalizujący się najczęściej na twarzy. Jego obecność jest związana z przewlekłym przebiegiem choroby.
Zajęcie narządu wzroku dotyczy 11-83% chorych. Najczęściej zajęta jest błona naczyniowa oka. Nieleczone zmiany zapalne mogą spowodować nawet utratę wzroku.
Zmiany ziarniniakowe w wątrobie stwierdzane są u 50-80% chorych. Przebieg choroby jest łagodny i rzadko powoduje dysfunkcję narządu.
Układ nerwowy zajęty jest u 5-15% chorych. Chorzy prezentują różne objawy. Najczęściej zajęte są nerwy czaszkowe: wzrokowy i twarzowy. Inne objawy to zapalenie opon mózgowo-rdzeniowych, wodogłowie, guzy mózgu, napady drgawek, zaburzenia psychiatryczne czy też obwodowa neuropatia. Diagnostyka jest trudna i postawienie pewnego rozpoznania wymaga potwierdzenia histopatologicznego zajęcia układu nerwowego, co nie zawsze jest możliwe. Badaniem z wyboru jest rezonans magnetyczny głowy. Pomocne przy rozpoznaniu jest badanie płynu mózgowo-rdzeniowego i oznaczenie w nim indeksu limfocytów CD4+/CD8+ oraz aktywności enzymu konwertującego angiotensynę (ang. angiotensin converting enzyme – ACE), badanie TKWR płuc, scyntygrafia z galem (17).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Danbolt N: The historical aspects of sarcoidosis. Postgrad Med J 1958; 34: 245-267.
2. American Thoracic Society/European Respiratory Society/Worlf Association of Sarcoidosis and Other Granulomatous Disorders: Statement on Sarcoidosis. Am J Respir Crit Care Med 1999; 160: 736-755.
3. Lazarus A: Sarcoidosis: Epidemiology, etiology, pathogenesis, and genetics. Dis Mon 2009; 55: 649-660.
4. Jaroszewicz W: Sarkoidoza. PZWL, Warszawa 1976.
5. Grutters JC, Drent M, Bosch JMM: Sarcoidosis. Eur Respir Mon 2009; 46: 126-154.
6. Hosomosa Y, Sasagawa S, Yasuda N: Epidemiology of sarcoidosis: new frontiers to explore. Curr Op in Pulm Med 2002; 8: 424-428.
7. Iannuzzi MC, Rybicki BA, Teirstein AS: Sarcoidosis. N Engl Med 2007; 357: 2153-65.
8. Gupta D, Agarwal R, Aggarwal AN, Jindal SK: Molecular evidence for the role of mycobacteria in sarcoidosis: a meta-analysis. Eur Respir J 2007; 30: 508-516.
9. Drake WP, Dhason MS, Nadaf M et al.: Cellular recognition of Mycobacterium tuberculosis ESAT-6 and KatG in systemic sarcoidosis. Infect Immun 2007; 75: 527-39.
10. Carlise J, Evans W, Hajizadeh R et al.: Multiple Mycobacterium antigens induce interferon-γ production from sarcoidosis peripheral blood mononuclear cells. Clin Exp Imm 2007; 150: 460-468.
11. Oswald-Richter KA, Culver DA, Hawkins C et al.: Cellular responses to mycobacterial antigens are present in bronchoalveolar lavage fluid used in the disgnosis of sarcoidosis. Infect Immun 2009; 77 (9): 3740-3748.
12. DeRemee RA: The roentgenographic staging of sarcoidosis. Chest 1983; 83: 128-133.
13. Fuhrer G, Meyers JN: Intrathoracic sarcoidosis. Dis Mon 2009; 55: 661-674.
14. Kowalski J, Radwan L, Boros P: zaburzenia czynności układu oddechowego w chorobach śródmiąższowych. [W:] Kowalski J, Koziorowski A, Radwan L: Ocena czynności płuc w chorobach układu oddechowego. I wydanie: Borgis, Warszawa 2004: 129-145.
15. Boros PW, Enright PL, Quanjer PH et al.: Impaired lung compliance and DLCO but no restrictive ventilatory defect in sarcoidosis. Eur Respir J 2010; 36: 1315-1322.
16. Radwan L, Zielonka TM, Maszczyk Z et al.: Zaburzenia czynnościowe u chorych na śródmiąższowe choroby płuc bez cech restrykcji. Pneumonol Alergol Pol 1999; 67 (5-6): 180-188.
17. Hoitsma E, Drent M, Sharma OP: A pragmatic approach to diagnosing and treating neurosarcoidosis in the 21st century. Curr Op Pulm Med 20010; 16: 472-479.
18. Holmes J, Lazarus A: Sarcoidosis: extratoracic manifestations. Dis Mon 2009; 55: 675-692.
19. Pirożyński M: Bronchofiberoskopia. Alpha-medica Press Bielsko Biała 1999.
20. Costabel U: Sarcoidosis: clinical update. Eur Respir J 2001; 18 (Suppl 32): 56-68.
21. Parrisch S, Turner JF: Diagnosis of sarcoidosis. Dis Mon 2009; 55: 693-703.
22. Shorr AF, Torrington KG, Hnatiuk OW: Endobronchial biopsy for sarcoidosis: a prospective study. Chest 2001; 20: 109-114.
23. Tremblay A, Stather DR, Mav Eachern P et al.: A randomized controlled trial of standard vs endobronchial ultrasonography-guided transbronchial needle aspiration in patient with suspected sarcoidosis. Chest 2009; 136: 240-246.
24. Costabel U, Bonella F, Ohshimo S, Guzman J: Diagnostic modalities in sarcoidosis: BAL, EBUS, and PET. Semin Respir Crit Care Med 2010: 31: 404-408.
25. Grunewald J: Clinical aspects and immune reactions in sarcoidosis. Clin Resp J 2007; 1: 64-73.
26. Laviolette M, La Forge J, Tennina S, Boulet LP: Prognostic value of bronchoalveolar lavage lymphocyte count in recently diagnosed pulmonary sarcoidosis. Chest 1991; 100: 380-384.
27. Gottlieb JE, Israel HL, Steiner HL et al.: Outcome in sarcoidosis: The relationship of relapse to corticosteroid therapy. Chest 1997; 111: 623-631.
28. Schutt AC, Bullington WM, Judson MA: Pharamacotherapy for pulmonary sarcoidosis: A delphi consensus study. Respir Med 2010; 104: 717-723.
29. Paramothayan NS, Lasserson TJ, Jones P: Corticosteroids for pulmonary sarcoidosis. Cochrane Database of Systematic Reviews 2005, Issue 2. Art. No.: CD001114.
30. Jindal SK: Practical issues and challenges in the diagnosis and treatment of pulmonary sarcoidosis. Drugs 2007; 67 (1): 17-26.
31. Lazar CA, Culver DA: Treatment on sarcoidosis. Semin Respir Crit Care Med 2010; 31: 501-518.
32. Baughman RP, Lower EE: A clinical approach to the use of methotrexat for sarcoidosi. Thorax 1999; 54: 742-746.
33. Vucinic VM: What is the future of metotrexate in sarcoidosis? A study and review. Current Opinion in Pulm Med 2002; 8: 470-476.
34. Baughman R, Drent M, Kavuru M et al.: Infiximab Therapy in patients with chronic sarcoidosis and pulmonary involvement. Am J Respir Crit Care Med 2006; 174: 795-802.
35. Rossman M, Newman L, Baughman R et al.: A double-blinded, randomized, placebo-controlled tral of infliximab in subject with active sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 2006; 23: 201-208.
36. Doty J, Mazur J, Judson M: Treatment of sarcoidosis with infliksimab. Chest 2005; 127: 1064-1071.
37. Utz JP, Limper AH, Kalra S et al.: Etanercept for the treatment of stage II and III progresiive pulmonary sarcoidosis. Chest 2003; 124: 177-185.
38. Sweiss N, Baughman R, Curran J et al.: 52-week trial results of Adalimumab as Novel Threapy for refractory, progressive, pulmonary sarcoidosis. Am J Respir Crit Care Med 2010; 181: A2370.
39. Sweiss N, Hushaw L, Curran J et al.: TNF inhibition as novel therapy for refractory sarcoidosis: Long term follow-up. Am J Respir Crit Care Med 2010; 181: A6008.
40. Baughman RP, Lower EE, Drent M: Inhibitors of tumor necrosis factor (TNF) in sarcoidosis: who, what, ad how to use them. Sarcoidosis Vasc Diffuse Lung Dis 2008; 25: 76-89.






