© Borgis - Postępy Nauk Medycznych 10/2011, s. 819-823
*Agnieszka Napiórkowska, Zofia Zwolska, Ewa Augustynowicz-Kopeć
Oporność na pirazynamid (PZA) wśród prątków gruźlicy wyizolowanych od chorych z województwa mazowieckiego w latach 2008-20101)
Resistance to pyrazinamide among Mycobacterium tuberculosis strains isolated from patients from the Mazovian Voivodeship in 2008-2010 years
Zakład Mikrobiologii, Instytut Gruźlicy i Chorób Płuc w Warszawie
Kierownik Zakładu: prof. nadzw. dr hab. med. Ewa Augustynowicz-Kopeć
Streszczenie
Wstęp. Właściwości przeciwprątkowe pirazynamidu poznano już ponad 50 lat temu i od tego czasu lek ten stosowany jest w leczeniu gruźlicy jako jeden z najważniejszych obok RMP, INH, EMB i SM. Pomimo że PZA zajmuje tak ważne miejsce w leczeniu gruźlicy, WHO do tej pory nie zalecało zbierania danych o częstości występowania oporności na PZA wśród szczepów Mycobacterium tuberculosis oraz nie rekomendowało oznaczenia lekooporności na ten lek. Wynika to głównie z trudności w wykonaniu testu lekooporności na PZA. Nie wiadomo więc, jak szeroko rozpowszechniona jest na świecie oporność na PZA.
Cel pracy. Celem naszej pracy była analiza oporności na PZA szczepów Mycobacterium tuberculosis wyizolowanych od chorych z województwa mazowieckiego w latach 2008-2010.
Materiał i metody. Analizie poddano szczepy M. tuberculosis o różnym fenotypie oporności na 4 podstawowe leki wyizolowane od 462 chorych. Fenotyp oporności na PZA określono metodą radiometryczną Bactec 460-TB. Szczepom opornym na PZA określono MIC dla stężeń PZA: 100, 300, 600, 900 μg/ml.
Wyniki. W grupie chorych nowo wykrytych 5,9% chorych wydalało szczepy oporne na PZA. W grupie chorych wcześniej leczonych szczepy oporne na PZA wydalało 14% chorych. W obu grupach chorych oporność na PZA była połączona z opornością na 4 leki INH+RMP+SM+EMB (14% u chorych nowo wykrytych i u 25% chorych wcześniej leczonych). Szczepy oporne wyłącznie na PZA występowały u 50% chorych nowo wykrytych. Dla 23,5% szczepów wartość MIC PZA wynosiła > 100 μg/ml, dla 17,6% ≥ 300 μg/ml, dla 14,7% ≥ 600 μg/ml i aż dla 44,1% ≥ 900 μg/ml.
Wnioski. Wśród szczepów M. tuberculosis stwierdzono wysokie odsetki oporności na PZA (5,9% u chorych nowo wykrytych, 14% u chorych wcześniej leczonych).
Większość szczepów opornych na PZA (44,1%) posiadała wysokie miana oporności – MIC PZA ≥ 900 μg/ml.
Summary
Introduction. The anti-tuberculous properties of pyrazinamide (PZA) were identified over 50 years ago, and since that time it has been one of the most important drugs used for the treatment of tuberculosis, in addition RMP, INH, EMB i SM. Although PZA plays such an important role in the treatment of tuberculosis, the World Health Organisation (WHO) has not issued a recommendation to collect data on the prevalence of PZA resistance among Mycobacterium tuberculosis strains or to perform susceptibility testing for this drug. This mainly results from the difficulty of the PZA susceptibility test. It is therefore unknown how prevalent PZA resistance is worldwide.
The aim of study. The aim of our study was to estimate the resistibility for PZA among M. tuberculosis isolates from patients from the Mazovian Voivodeship in 2008-2010 years.
Material and methods. We analysed M. tuberculosis strains with different resistibility to first-line antituberculous drugs. The strains were isolated from 462 patients with tuberculosis. The strains were examined for PZA resistibility by the radiometric Bactec 460-TB method. The PZA-resistant strains were examined for the following MIC PZA for drug concentration: 100, 300, 600, 900 μg/ml.
Results. PZA resistance among M. tuberculosis strains was found in 5,9% untreated patients and in 14% previously treated patients. In both groups resistance to PZA was correlated with drug resistance for INH+RMP+SM+EMB in 14% untreated patients and in 25% previously treated ones. The PZA-monoresistant strains were observed in 50% untreated patients groups.
Among resistant strains for 23,5% strains MIC for PZA was > 100 μg/ml, for 17,6% MIC for PZA ≥ 300 μg/ml 14,7% ≥ 600 μg/ml and 44,1% ≥ 900 μg /ml.
Conclusisons. Among M. tuberculosis strains PZA resistance was found in 5,9% untreated patients and in 14% previously treated patients.
Among the PZA-resistant strains very high MIC value for PZA (≥ 900 μg/ml) was revealed for 44% M. tuberculosis strains.

Wstęp
Pirazynamid (PZA) należy do grupy leków przeciwprątkowych tzw. pierwszej linii, razem z izoniazydem (INH), rifampicyną (RMP), streptomycyną (SM) i etambutolem (EMB) stosowany jest w rekomendowanym przez WHO schemacie leczenia przeciwprątkowego. Lek ten odgrywa kluczową rolę w pierwszej fazie antybiotykoterapii, działa silnie wewnątrzkomórkowo, gdzie przeżywają prątki gruźlicy (1).
Pomimo że PZA zajmuje tak ważne miejsce w leczeniu gruźlicy, WHO jak do tej pory nie zalecało zbierania danych o częstości występowania oporności na PZA wśród szczepów Mycobacterium tuberculosis oraz nie rekomendowało oznaczenia lekooporności na ten lek. Nie wiadomo więc, jak szeroko rozpowszechniona jest na świecie oporność Mycobacterium tuberculosis na PZA (2).
Pirazynamid jest lekiem, który swoją aktywność przeciwprątkową wykazuje jedynie w środowisku kwaśnym (pH 5,0-5,5), dlatego działa silnie wewnątrz makrofagów oraz w masach martwiczych. Strukturalnie PZA jest analogiem nikotynamidu i jest aktywowany przez enzym pirazynamidazę, wytwarzaną przez komórki prątków, który deaminuje lek do kwasu pirazynowego (POA). Szczepy oporne M. tuberculosis i naturalnie oporne M. bovis i M. bovis BCG nie posiadają enzymu deaminującego lek.
Mechanizm działania pirazynamidu jest najmniej poznany ze wszystkich stosowanych leków przeciwprątkowych. Pirazynamid do komórki bakteryjnej przenika głównie na drodze pasywnej dyfuzji, choć podejrzewa się, że pewną rolę odgrywa tu również aktywny transport leku przez pompę sodowo-potasową.
We wnętrzu komórki pirazynamid, pod wpływem enzymu ulega przekształceniu do anionu kwasu pirazynowego (POA–). Na drodze pasywnej dyfuzji POA– zostaje usunięty z komórki M. tuberculosis, a następnie w kwaśnym środowisku jam gruźliczych zostaje zobojętniony przez jony wodorowe (H+). Jako elektrycznie obojętna cząsteczka – kwas pirazynowy (HPOA) wnika z powrotem do komórki bakteryjnej, gdzie odłączają się od niego jony wodorowe i obniżają pH cytoplazmy, co inaktywuje wiele kluczowych enzymów dla procesów metabolicznych prątków gruźlicy oraz najprawdopodobniej hamuje wbudowywanie metioniny w procesie syntezy białek oraz uracylu do RNA. Wzrost stężenia jonów wodorowych wewnątrz komórki wpływa również negatywnie na potencjał błony komórkowej oraz uszkadza kanały jonowe, a tym samym zakłóca jej normalne funkcjonowanie. Nie stwierdzono, aby pirazynamid wiązał się z jakimkolwiek składnikiem ściany komórkowej prątków (badania in vitro) (3, 4, 5, 6) (ryc. 1).
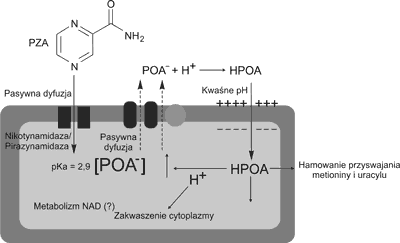
Ryc. 1. Mechanizm działania pirazynamidu (Zhang Y. i wsp., J Med Microbiol 2002).
Pierwsza teoria dotycząca mechanizmu działania pirazynamidu zakładała, że związek ten jest inhibitorem syntazy kwasów tłuszczowych I (Fas-I, fatty acid synthase-I). Badania laboratoryjne podają tę teorię w wątpliwość, ze względu na fakt, że nie wyizolowano, jak dotąd, szczepów bakterii opornych na pirazynamid, które posiadałyby mutacje w Fas-I (3).
Cel pracy
Celem pracy była analiza częstości występowania oporności na pirazynamid wśród szczepów M. tuberculosis wyizolowanych od chorych z województwa mazowieckiego.
Materiał i metody
Analizie poddano szczepy prątków gruźlicy wyizolowane w latach 2008-2010 od 462 chorych z województwa mazowieckiego.
W badanej grupie chorych było 360 (77,9%) mężczyzn w wieku od 10 do 97 lat oraz 102 (22,1%) kobiety w wieku od 14 do 88 lat. Chorych nowo wykrytych było 376 (81,4%), a wcześniej leczonych – 86 (18,6%).
Wszystkie szczepy były wyhodowane według standardowych metod, miały wykonaną identyfikację gatunkową z zastosowaniem testu niacynowego oraz metodą spoligotyping (7). Wszystkie analizowane szczepy należały do gatunku Mycobacterium tuberculosis, nie stwierdzono ani jednego szczepu należącego do gatunku M. bovis lub M. bovis BCG.
Lekooporność szczepów na cztery podstawowe leki oznaczano metodą klasyczną na pożywce Löwensteina-Jensena.
Fenotyp oporności na PZA określano metodą radiometryczną Bactec 460-Tb. W systemie Bactec 460-Tb oporność na PZA wykonuje się z zastosowaniem płynnej pożywki Middlebrooka 7H12 o pH w zakresie 5,9-6,0 zawierającej kwas palmitynowy znakowany 14C. Rosnące prątki metabolizują zawarty w pożywce substrat do 14CO2. Ilość produkowanego 14CO2 jest wprost proporcjonalna do intensywności wzrostu prątków w pożywce. Dodanie PZA w stężeniu 100 μg/ml do pożywki powoduje zahamowanie wzrostu M. tuberculosis. Znajduje to odzwierciedlenie w spadku ilości 14CO2 w stosunku do kontroli, w której ilość 14CO2 oraz indeks wzrostu systematycznie rośnie. W przypadku szczepów opornych obserwuje się nieznaczną różnicę lub całkowity jej brak w indeksie wzrostu pomiędzy kontrolą, a badanym szczepem.
Wartości MIC PZA wyznaczano również w systemie Bactec 460TB dla następujących stężeń leku 100, 300, 600 i 900 μg/ml.
Wyniki
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Pyrazinamide. Tuberculosis 2008; 88 (2): 141-144.
2. Yeager R, Monroe WGC, Dessau FI: Pyrazinamide (aldinamide) in the treatment of pulmonary tuberculosis. Am Rev Tuberc 1952; 65: 523-546.
3. Zhang Y, Mitchison D: The curious characteristics of pyrazinamide: a review. Int J Tuberc Lung Dis 2003; 7 (1): 6-21.
4. Butler WR, Kilburn JO: Susceptibility of Mycobacterium tuberculosis to pyrazinamidaze and its relationship to pyrazinamidase activity. Antimicrob Agents Chemother 1983; 24: 600-601.
5. Heifets LB, Flory MA, Lindholm-Levy P: Does pyrazinoic acid as an active moiety of pyrazinamide have specific activity against Mycobacterium tuberculosis? Antimicrob Agents Chemother 1989; 33: 1252-1254.
6. Raynaud C, Laneelle MA, Senaratne RH et al.: Mechanisms of pyrazinamide resistance in mycobacteria: importance of lack of uptake in additional to lack of pyrazinamidase activity. Microbiology 1999; 145: 1359-1367.
7. Augustynowicz-Kopeć E, Kozińska M, Zabost A et al.: Molekularne dochodzenia epidemiologiczne wśród ludzi blisko spokrewnionych chorujących na gruźlicę płuc. Pneumo Info 2007; 4 (3): 14-22.
8. Hewlett D, Horn DL, Alfata C: Drug-resistant tuberculosis: inconsistent results of pyrazinamide susceptibility testing. JAMA 1995; 273: 916-917.
9. Salfinger M, Hale YM, Driscoll JR: Diagnostic tools in tuberculosis: present and future. Respiration 1998; 65: 163-170.
10. Salfinger M, Heifets LB: Determination of pyrazinamide MICs for Mycobacterium tuberculosis at different pH by the radiometric method. Antimicrob. Agents Chemother 1988; 32: 1002-1004.
11. Siddiqi SH: Antimicrobial susceptibility testing: radiometric (BACTEC) tests for slow growing mycobacteria. [W:] Isenberg HD Clinical microbiology procedure handbook. ASM Press. Washington, DC 1992: 14-25.
12. Fernandes P, Ferreira BS, Cabral JMS: Solvent tolerance in bacteria: role of efflux and cross-resistance with antibiotics. Int J Antimicrob Agents 2003; 2: 211-216.
13. Ordway D, Viveiros M, Leandro C et al.: Clinical concentrations of thioridazine kill intra-cellular multi-drug-resistant Mycobacterium tuberculosis. Int J Antimicrob Agents 2003; 47: 917-922.
14. Zhang Y, Permar S, Sun Z: Conditions that may affect the results of susceptibility testing of Mycobacterium tuberculosis to pyrazinamide. J Med Microbiol 2002; 51: 42-49.
15. Napiórkowska A, Augustynowicz-Kopeć E, Zwolska Z: Fenotyp oporności prątków gruźlicy na pirazynamid (PZA) w badaniach ogólnopolskich. Pneumonologia i Alergologia Polska 2010; 78, 4: 256-262.
16. Cheng S, Thilbert L, Sanchez T et al.: pncA mutations as a major mechanism of pyrazinamide resistance in Mycobacterium tuberculosis: spread of a monoresistant strain in Quebec, Canada. Antimicrob. Agents Chemother 2000; 44: 528-532.
17. Nguyen D, Brassard P, Westley J et al.: Widespread pyrazinamide – resistant Mycobacterium tuberculosis family in low-incidence setting. J Clin Microbiol 2003; 41: 2878-2883.
18. Augustynowicz-Kopeć E: Gruźlica lekooporna w Polsce. Analiza epidemiologiczna, mikrobiologiczna i genetyczna. Rozprawa habilitacyjna. Akademia Medyczna w Warszawie. Warszawa 2007.
19. Grosset JH: Bacteriologic basis of short-course chemotherapy for tuberculosis. Clin Chest Med 1980; 1: 231-241.
20. Zwolska Z, Augustynowicz-Kopeć E: Prawidłowa realizacja programów monitorowania gruźlicy lekoopornej w Polsce. Konferencja Naukowo-Szkoleniowa Specjalistów Chorób Płuc, Zakopane 2007.
21. Zwolska Z: Propozycja włączenia testu PZA-oporności do podstawowego antybiogramu prątków gruźlicy. Konferencja Naukowo-Szkoleniowa Specjalistów Chorób Płuc, Zakopane 2007.

