© Borgis - Nowa Medycyna 4/2012, s. 76-81
Anita Biela, *Joanna Pacholska-Bogalska
Nowotwory hormonozależne u kobiet
Hormone-dependent carcinomas in women
Zakład Fizjologii i Biologii Rozwoju Zwierząt, Uniwersytet im. Adama Mickiewicza w Poznaniu
Kierownik Zakładu: prof. dr hab. Grzegorz Rosiński
Summary
Hormonal regulation has a crucial role in the physiology of female genital system and mammary gland. Female sex hormones are responsible for the right course of such processes as proliferation, diferentiation or apoptosis of cells in tissues, like uterus, ovaries and breast. Experimental data show that hormones can be the factors of endometrial, ovarian and breast cancer development. It is proved that they do not initiate the cancerogenesis directly but they can be the stimulators (estrogens, androgens, pituitary gonadotropins) or inhibitors of cancer promotion (progesterone). Higher level of gonadotropins, estrogens or androgens can be the risk factor of cancer development when in protooncogenes or suppressor genes mutations occur. Progesterone inhibits cells proliferation and can protect from cancer promotion. However, lower level of progesterone in opposite to estrogens, androgens and pituitary gonadotropins levels cannot stop cancer development. Hypothalamic gonadoliberin inhibits cancer cells proliferation, but also protects them from apoptosis.
To sum up, hormonal imbalance caused by higher levels of gonadotropins, estrogens and androgens and lower level of progesterone, increases the risk of cancer development in uterus, ovaries and mammary gland, when mutations in crucial cancerogenesis genes occur.

WSTĘP
Ze względu na brak skutecznych sposobów wczesnego wykrywania, nowotwory złośliwe stanowią poważny problem współczesnej medycyny. Wśród Polek nowotwory złośliwe to przyczyna około 23% zgonów (1). U kobiet najczęściej diagnozuje się nowotwory piersi oraz organów układu rozrodczego, takich jak jajniki, szyjka macicy czy trzon macicy (tab. 1). Proces powstawania nowotworu, od momentu ekspozycji na kancerogeny do detekcji guza, może trwać nawet 15 do 20 lat (2, 3). W tym czasie komórki rakowe nabywają zdolności do nieograniczonych podziałów, inwazji i przerzutowania. Bodźcem do wstąpienia na drogę transformacji nowotworowej dla komórek są mutacje w protoonkogenach, genach supresorowych, genach mutatorowych oraz innych genach, których produkty kontrolują pośrednio lub bezpośrednio podziały, proliferację i różnicowanie komórek (2, 4).
Tabela 1. Struktura zachorowań na nowotwory u kobiet w 2008 roku. Według (1).
| Rodzaj nowotworu | % zachorowań |
| Pierś | 22,2 |
| Płuco | 8,1 |
| Trzon macicy | 7,3 |
| Okrężnica | 6,0 |
| Jajnik | 5,0 |
| Szyjka macicy | 5,3 |
| Odbytnica | 3,3 |
| Żołądek | 2,8 |
| Tarczyca | 2,6 |
| Nerka | 2,6 |
| Inne | 35,0 |
Czynniki mutagenne (kancerogeny) uszkadzają DNA i prowadzą do powstania mutacji w genomie prawidłowej komórki. Zalicza się do nich czynniki genotoksyczne, oddziałujące bezpośrednio z DNA, takie jak: wolne rodniki, promieniowanie jonizujące i UV, niektóre związki chemiczne, barwniki akrydynowe, czy wirusy określane mianem onkogennych. Czynniki mitogenne, nazywane czynnikami kancerogennymi, sprzyjają natomiast mitotycznym podziałom komórkowym. Mogą należeć do nich na przykład niektóre hormony (2).
Nowotwory, których rozwój uwarunkowany jest odpowiednim stanem hormonalnym organizmu, określa się mianem nowotworów hormonozależnych. U kobiet do nowotworów hormonozależnych zalicza się raki: endometrium, jajnika i gruczołu piersiowego.
RAK BŁONY ŚLUZOWEJ TRZONU MACICY
Rak błony śluzowej trzonu macicy, nazywany inaczej rakiem endometrium, zajmuje czwarte miejsce wśród zachorowań na raka u kobiet (1). W 80% przypadków diagnozuje się go w okresie pomenopauzalnym. W okresie premenopauzalnym notuje się zaledwie 5% przypadków zachorowań (5).
Na podstawie aktualnej wiedzy na temat biologii i morfologii nowotworów macicy wyróżnia się dwa typy raka endometrium:
– endometrioidalny (EEC, ang. endometrioid endometrial carcinoma) – diagnozowany w 80% przypadków raka endometrium, rozwijający się z rozrostowo zmienionego endometrium, pojawia się u relatywnie młodych kobiet, tuż przed menopauzą albo po menopauzie. W komórkach budujących guz zidentyfikowano receptory dla estrogenów, co wskazuje na to, że jego etiologia jest ściśle powiązana z ekspozycją na estrogeny, których działanie nie jest przeciwstawione oddziaływaniem progesteronu (ryc.1),
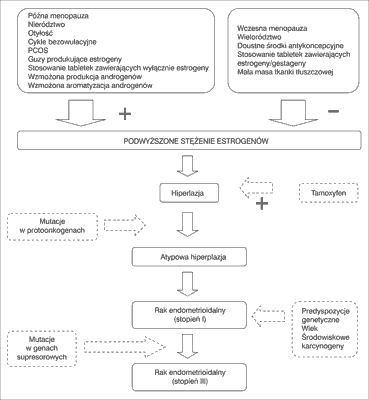
Ryc. 1. Model kancerogenezy raka endometrioidalnego błony śluzowej trzonu macicy. ‘-‘ – hamowanie, ‘+’ – indukowanie. Według (8, zmienione).
– nieendometrioidalny (NEEC, ang. non-endometrioid endometrial carcinoma) – diagnozowany 20% przypadków raka błony śluzowej trzonu macicy. Wywodzi się z atroficznego endometrium, rozwija się u starszych kobiet, wykazuje większą złośliwość niż rak endometrioidalny (6), jego rozwój wydaje się niezależny od nadmiernej ekspozycji na estrogeny.
Estrogeny, ich metabolity i receptory a rak endometrium
Wzrost błony śluzowej macicy zależy od oddziaływań hormonów steroidowych jajnika – estrogenów. Estrogeny w fazie folikularnej stymulują podziały komórek nabłonka oraz fibroblastów zrębu warstwy czynnościowej, co oznacza, że są hormonami mającymi wpływ mitogenny na endometrium.
Długotrwała i nadmierna ekspozycja na estrogeny, nieprzeciwstawiona antyproliferacyjnym działaniem progesteronu, może prowadzić w konsekwencji do rozwoju raka (ryc. 1). Wyróżnia się więc następujące czynniki ryzyka raka błony śluzowej trzonu macicy:
– wczesne rozpoczęcie miesiączkowania i późna menopauza (wydłużone działanie estrogenów),
– brak owulacji, nierództwo i zespół policystycznych jajników (chroniczna stymulacja estrogenami, niskie stężenie progesteronu),
– guzy produkujące estrogeny (podwyższony poziom estrogenów),
– otyłość (zwiększone wydzielanie estrogenów przez jajnik, obniżenie stężenia globuliny wiążącej hormony steroidowe SHBG, wysoki poziom niezwiązanych, a co za tym idzie biologicznie czynnych estrogenów we krwi),
– hiperandrogenizm (wzmożona konwersja androgenów do estrogenów – szczególnie do estronu – katalizowana przez kompleks aromatazy, zaburzenia cyklu miesiączkowego),
– leczenie estrogenami bez osłony gestagennej (chroniczna stymulacja estrogenami, niskie stężenie progesteronu) (7, 8).
Estrogeny oddziałują na komórki poprzez receptory estrogenowe ERα i ERβ. W macicy obecne są oba typy receptorów, natomiast w samym endometrium zachodzi głównie ekspresja receptora ERα. Badania na modelu mysim sugerują, że receptor estrogenowy β jest modulatorem ERα, blokuje jego aktywność i w konsekwencji nadmierne namnażanie się komórek (9). Zaburzenie równowagi między ekspresją receptora ERα i ERβ może więc stanowić kluczowy, krytyczny etap w estrogenozależnej kancerogenezie.
Na rozwój nowotworu mogą mieć także wpływ błędy podczas splicingu mRNA, z którego w wyniku translacji powstają białka budujące receptory α i β. Na przykład, błąd w alternatywnym splicingu mRNA ERα może skutkować produkcją transkryptów, w których brak jest jednego lub kilku egzonów. Δ5ERα jest wariantem mRNA ERα, w którym nastąpiła delecja egzonu 5. Δ5 jest jedyną odmianą błędnie złożonego mRNA, która ulega translacji (10). Białko Δ5 nie zostało wykryte w prawidłowym endometrium, znalezione zostało natomiast w komórkach raka błony śluzowej trzonu macicy. Okazało się, że jest ono zdolne do aktywacji transkrypcji genów zależnych od receptorów estrogenowych, nawet gdy nie jest związane z ligandem, jakim jest estrogen. Może to prowadzić do niekontrolowanej proliferacji komórek guza (6).
Również katecholoestrogeny, będące metabolitami estrogenów, mogą mieć działanie potencjalnie genotoksyczne, prowadząc do powstania mutacji inicjujących rozwój raka. Ich mutagenność przejawia się zdolnością wiązania się kowalencyjnie z DNA. Udowodniono takie działanie dla 4-hydroksyestronu. Stwierdzono także, że w tkankach podatnych na estrogenozależną karcinogenezę, m.in. w endometrium, częściej dochodzi do hydroksylacji estronu w pozycji 4, niż do hydroksylacji w pozycji 2 (11).
Progesteron i jego receptory a rak endometrium
Progesteron oddziałując na komórki endometrium, hamuje ich podziały, zapobiegając nadmiernemu rozrostowi błony śluzowej trzonu macicy. Wykazuje więc funkcjonalny antagonizm w stosunku do estrogenów. Efektem antyestrogennego działania progesteronu jest zmniejszanie liczby receptorów ERα i ERβ. Poza tym progesteron hamuje wzmożoną konwersję 17β-estradiolu do estronu, którego zbyt wysokie stężenie może być czynnikiem ryzyka rozwoju raka endometrium (7). Odpowiedni stosunek stężenia progesteronu do stężeń estrogenów chroni przed rozwojem raka błony śluzowej trzonu macicy. Natomiast zbyt niski poziom progesteronu w porównaniu z poziomem estrogenów znacznie zwiększa ryzyko wystąpienia raka.
Progesteron działa na komórki endometrium poprzez receptory progesteronowe (PR). Ich ekspresja pozostaje pod kontrolą estrogenów i progesteronu. Estrogeny indukują syntezę PR, natomiast progesteron hamuje ją. PR-A funkcjonuje jako represor, natomiast PR-B jako aktywator transkrypcji genów zależnych od progesteronu. Główną funkcją PR-A w endometrium jest zapobieganie aktywacji ERα. PR-B działa natomiast jako agonista estrogenów. Na tej podstawie uważa się, że PR-A jest ważnym inhibitorem komórkowej proliferacji indukowanej estrogenami. Przejawia się to w hamowaniu efektów działania PR-B. W komórkach raka endometrium najczęściej występuje tylko jedna z izoform receptora progesteronowego. Ekspresja tylko jednej z izoform wskazuje na wysoki stopień zaawansowania nowotworu. Wczesna zmiana w poziomie ekspresji obu izoform poprzedza prawdopodobnie rozwój raka. To, jak ważny jest wyrównany stosunek ekspresji obu izoform receptora progesteronowego, zostało potwierdzone przez wykrycie funkcjonalnego polimorfizmu w promotorze genu kodującego PR, który skutkuje wzmożoną transkrypcją PR-B, co wiąże się ze wzrostem ryzyka rozwoju raka endometrium (6).
RAK JAJNIKA
Rak jajnika zajmuje szóste miejsce wśród zachorowań na raka u kobiet (1). Najczęściej diagnozuje się go w okresie około- i pomenopauzalnym u kobiet, które skończyły 45 lat. W 85% wywodzi się z komórek nabłonka pokrywającego jajnik (12).
Nabłonkowy rak jajnika powstaje poprzez powolny rozwój z początkowo niezłośliwej wewnątrzjajnikowej cysty (typ I) albo pojawia się spontanicznie, rozwija szybko, agresywnie i nie wykrywa się go na podłożu żadnej wcześniejszej zmiany chorobowej (typ II) (13).
Hipotezy dotyczące etiologii raka jajnika
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Didkowska J, Wojciechowska U, Zatoński W: Nowotwory złośliwe w Polsce w 2008 roku. Centrum Onkologii – Instytut im. M. Skłodowskiej-Curie, Warszawa 2010. 2. Goździcka-Józefiak A, Bobowicz MA, Kędzia H: Geny a nowotwory. [W:] Genetyka molekularna i biochemia wybranych chorób u ludzi. Wydawnictwo Naukowe UAM, Poznań 2001, 142-172. 3. Loeb LA, Loeb KR, Anderson JP: Multiple mutations and cancer. Proc Natl Acad Sci USA 2003; 3: 776-781. 4. Hahn WC, Weinberg RA: Rules for making human tumor cells. N Engl J Med 2002; 20: 1593-1603. 5. Szyłło K, Smolarz B, Romanowicz-Makowska H et al.: Ryzyko występowania raka endometrium w kontekście wpływu polimorfizmów genów CYP19 i COMT. Pol Merk Lek 2007; 129: 208-210. 6. Doll A, Abal M, Rigau M et al.: Novel molecular profiles of endometrial cancer – new light through old windows. J Steroid Biochem Mol Biol 2008; 3-5: 221-229. 7. Schindler AE: Progestogen deficiency and endometrial cancer risk. Maturitas 2009; 4: 334-337. 8. Emons G, Fleckenstein G, Hinney B et al.: Hormonal interactions in endometrial cancer. Endocr Relat Cancer 2000; 4: 227-242. 9. Weihua Z, Saji S, Makinen S et al.: Estrogen receptor (ER)β, a modulator of ERα in uterus. Proc Natl Acad Sci USA 2000; 11: 5936-5941. 10. Bryant W, Snowhite AE, Rice LW, Shupnik MA: The estrogen receptor (ER)α variant Δ5 exhibits dominant positive activity on ER-regulated promoters in endometrial carcinoma cells. Endocrinology 2005; 2: 751-759. 11. Foksiński M, Piekutowski M, Roszkowski K, Oliński R: Rola estrogenów w procesie karcinogenezy. Współcz Onkol 2002; 3: 137-140. 12. Auersperg N, Wong AS, Choi KC et al.: Ovarian surface epithelium: biology, endocrinology and pathology. Endocr Rev 2001; 2: 255-288. 13. Fleming JS, Beaugie CR, Haviv I et al.: Incessant ovulation, inflammation and epithelial ovarian carcinogenesis: Revisiting old hypotheses. Mol Cell Endocrinol 2006; 1-2: 4-21. 14. Leung PC, Choi JH: Endocrine signaling in ovarian surface epithelium and cancer. Hum Reprod Update 2007; 2: 143-162. 15. Choi JH, Wong AS, Huang HF, Leung PC: Gonadotropins and ovarian cancer. Endocr Rev 2007; 4: 440-461. 16. McSorley MA, Alberg AJ, Allen DS et al.: Pre-diagnostic circulating follicle stimulating hormone concentrations and ovarian cancer risk. Int J Cancer 2009; 3: 674-679. 17. Grundker C, Gunthert AR, Westphalen S, Emons G: Biology of the gonadotropin-releasing hormone system in gynecological cancers. Eur J Endocrinol 2002; 1: 1-14. 19. Antoniou A, Pharoah PD, Narod S et al.: Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet 2003; 72: 1117-1130. 20. Noruzinia M, Coupier I, Pujol P: Is BRCA1/BRCA2-related breast carcinogenesis estrogen dependent? Cancer 2005; 104: 1567-1568. 21. Lange CA: Challenges to defining a role for progesterone in breast cancer. Steroids 2008; 9-10: 914-921. 22. Martin AM, Weber BL: Genetic and hormonal risk factors in breast cancer. J Natl Cancer Inst 2000; 14: 1126-1135. 23. Phillips LS, Millikan RC, Schroeder JC et al.: Reproductive and hormonal risk factors for ductal carcinoma in situ of the breast. Cancer Epidemiol Biomarkers Prev 2009; 5: 1507-1514. 24. Parl FF, Egan KM, Li C, Crooke PS: Estrogen exposure, metabolism and enzyme variants in a model for breast cancer risk prediction. Cancer Inform 2009; 7: 109-121. 25. Powell BL, Piersma D, Kevenaar ME et al.: Luteinizing hormone signaling and breast cancer: polymorphisms and age of onset. J Clin Endocrinol Metab 2003; 4: 1653-1657. 26. Monteiro AN: BRCA1: the enigma of tissue-specific tumor development. Trends Genet 2003; 19: 312-315. 27. Gorski JJ, Kennedy RD, Hosey AM, Harkin DP: The complex relationship between BRCA1 and ERα in hereditary breast cancer. Clin Cancer Res 2009; 15:1514-1518.


