Ewa Orlewska1, 2, Piotr Zaborowski3
Koszty i efekty terapii skojarzonej pegylowanym interferonem alfa -2a z rybawiryną w porównaniu do standardowej terapii skojarzonej interferonem alfa-2b z rybawiryną w przewlekłym wirusowym zapaleniu wątroby typu C u dorosłych w Polsce
The cost and effects of combination of peginterferon alfa-2a and ribavirin versus combination of conventional interferon (alfa-2b) and ribavirin in chronic hepatitis C in adults in Poland
1 Katedra i Zakład Farmakologii Doświadczalnej i Klinicznej Akademii Medycznej, Warszawa
2 Centrum Farmakoekonomiki, Warszawa
3 Klinika Chorób Odzwierzęcych i Tropikalnych Instytutu Chorób Zakaźnych i Pasożytniczych Akademii Medycznej, Warszawa
Streszczenie
Cel badania: Celem badania było porównanie kosztów i efektów stosowania pegylowanego intereferonu a-2a (180 mcg/tydz.) z rybawiryną (1000 mg/d) (PegIFN+R) oraz IFN a2b (3 mln j.m. 3 razy w tygodniu) z rybawiryną (1000 mg/d) (INF+R) w leczeniu przewlekłego wirusowego zapalenia wątroby typu C (wzw C) u dorosłych w wieku 40 lat, bez marskości wątroby, zakażonych genotypem HCV-1 (grupa I) lub genotypem HCVnie-1 (grupa II)
Metody: Obliczenia kosztów i efektów stosowania PegIFN+R oraz INF+R dokonano, posługując się modelem decyzyjnym Markowa, w którym wykorzystano opublikowane randomizowane międzynarodowe badanie kliniczne PegIFN+R vs INF+R, międzynarodowe, opublikowane dane na temat naturalnego przebiegu wzw C, specyficzne dla płci i wieku tabele wymieralności w populacji ogólnej, międzynarodowe opublikowane dane na temat użyteczności stanów zdrowia oraz wyniki przeprowadzonego wśród polskich ekspertów badania ankietowego, które dostarczyło danych o praktyce klinicznej, zużytych zasobach i kosztach jednostkowych, specyficznych dla polskich warunków ekonomicznych. Badanie jest analizą efektywności kosztów. Miarą wyniku są zyskane lata życia oraz zyskane lata życia skorygowane o jakość (QALY). Oceny kosztów dokonano z perspektywy płatnika za świadczenia zdrowotne (pacjent i płatnik publiczny), uwzględniając tylko bezpośrednie koszty medyczne. Koszty i wyniki dyskontowano przy użyciu 5% stopy dyskontowej. Granicę opłacalności leczenia skalkulowano na podstawie rocznego kosztu leczenia hemodializami (60000 PLN w 2003). Przeprowadzono jednokierunkowe analizy wrażliwości.
Wyniki: PegIFN+R w porównaniu do IFN+R wydłuża oczekiwane przeżycie o 0,78 roku lub 0,46 QALY w grupie I i o 1,17 roku lub 0,78 QALY w grupie II. Koszt/pacjenta leczonego PegIFN+R lub IFN+R wynosi odpowiednio 101908 PLN i 99710 PLN w grupie I oraz 53646 PLN i 65466 PLN w grupie II. PegIFN+R w porównaniu do IFN+R jest alternatywą opłacalną w grupie I (ICER, czyli inkrementalny współczynnik efektywności kosztów, wynosi 2826 PLN/zyskany rok życia i 4793 PLN/zyskany QALY) oraz alternatywą dominującą w grupie II. Zmiana wartości kluczowych parametrów w jednokierunkowych analizach wrażliwości nie ma znaczącego wpływu na ICER.
Wniosek: U chorych na wzwC zakażonych genotypem HCV-1 PegIFN+R vs. IFN+R wydaje się być alternatywą opłacalną, a u chorych zakażonych genotypem HCV nie-1 – alternatywą dominująca (lepszy wynik, niższy koszt).
Summary
Objective: The aim of the study was a comparison of the costs and effects of peginterferon alfa-2a 180 mcg/week and ribavirin 1000 mg/d (PegIFN+R) versus interferon alfa-2b 3 mln units thrice weekly and ribavirin 1000 mg/d (INF+R) in chronic hepatitis C adults without preexisting cirrhosis.
Methods: A Markov model was developed to project lifelong clinical and economic outcomes in 40 year-old patients based on published in literature transition probabilities and utility values and Polish data on health care resource utilisation and unit cost. The duration of treatment was 48 weeks and 24 weeks respectively in patients with HCVgenotype-1 (group I) and non-1 (group II). Predictability test was performed after 12 weeks and 24 weeks in those receiving PegIFN+R and IFN+R respectively. Effectiveness was expressed in LY and QALY. Only direct medical costs were analysed from health-care payer´s perspective. The cost-effectiveness threshold was calculated on the basis of 1-year haemodialysis treatment cost (60000 PLN, 1 EUR=4 PLN; in 2003). Sensitivity analyses were performed to test the robustness of the model.
Results: PegIFN+R in comparison to IFN+R increased life expectancy by 0,78 LY or 0,46 QALY in group I and 1,17 LY or 0,78 QALY in group II. The cost/patient treated with PegIFN+R or IFN+R was 101908 PLN and 99710 PLN respectively in group I, and 53646 PLN and 65466 PLN respectively in group II. PegIFN+R in comparison to IFN+R was cost-effective in group I, with ICER 2826 PLN/LYG and 4793 PLN/OALY gained, and dominant in group 2. Changing in value of key drivers for sensitivity analysis did not have any significant effect on the ICER.
Conclusion: PegIFN+R vs. IFN+R appears to be costs-effective for HCV genotype1 infected patients and is considered to be dominant for HCV genotype non1 infected patients

WSTĘP
Wirusowe zapalenie wątroby typu C stanowi obecnie jeden z najważniejszych problemów epidemiologicznych, klinicznych i ekonomicznych w dziedzinie chorób zakaźnych. Ogólną liczbę zakażonych na świecie szacuje się na ponad 170 milionów osób, a liczbę zgonów w samych tylko Stanach Zjednoczonych AP na około 8000 rocznie [1]. Wprowadzenie do leczenia przewlekłych wirusowych zapaleń wątroby typu C pegylowanych interferonów, a wcześniej kombinowanego leczenia rekombinowanymi interferonami z rybawiryną raczej skomplikowało niż uprościło sytuację chorych i lekarzy kwalifikujących ich do leczenia przeciwwirusowego. Wszelkie dotychczasowe kryteria włączenia do leczenia ulegają szybkim zmianom, a metaanalizy dotyczące ich skuteczności, zwłaszcza trwałego zahamowania replikacji wirusa wykazują dość znaczny rozrzut wyników, często rzędu 15-20%. W oczywisty sposób jest to spowodowane zarówno doborem chorych, jak i odmiennymi schematami leczenia. Jeszcze trudniejsza jest ocena finansowych skutków takiego postępowania dla systemów ochrony zdrowia. Wśród większości chorych zakażonych wirusem zapalenia wątroby typu C (HCV) panuje niemal powszechne i skądinąd zrozumiałe przekonanie, że leczyć powinno się każdego i to niemal natychmiast po ustaleniu rozpoznania. Pewna część tych chorych nie akceptuje jednak konieczności wykonania diagnostycznego nakłucia wątroby (biopsji), mającego na celu doprecyzowanie wskazań do terapii. Inni, którzy temu badaniu poddali się, uważają że odwleczenie leczenia z powodu miernego nasilenia procesu zapalnego i braku cech włóknienia nie znajduje wystarczającego uzasadnienia. Podobne poglądy można znaleźć także w niektórych opracowaniach, gdzie wykazano, że wykonywanie biopsji wątroby podraża leczenie, a i tak nie zapobiega pominięciu około 6% chorych, którzy osiągnęliby trwałe zahamowanie replikacji HCV-RNA, gdyby to leczenie u nich wdrożono [2]. Inne, nie mniejsze problemy stwarzają: przemijająca, nietrwała odpowiedź na zastosowane leczenie lub jej brak. Dotyczy to nie tylko chorych leczonych dawniej lekami i według schematów mniej skutecznych od dzisiejszych. Jest to również problem ponownego leczenia chorych, którzy nie zareagowali na leczenie skojarzone standardowym interferonem z rybawiryną. W takich sytuacjach szczególnego znaczenia nabiera analiza ekonomiczna, która umożliwia oszacowanie finansowych skutków zarówno korzystnych, jak i niekorzystnych wyników terapii.
SCHEMATY LECZENIA CHORYCH Z PRZEWLEKŁYM WIRUSOWYM ZAPALENIEM WĄTROBY TYPU C
W ciągu ostatnich 15 lat dokonał się ogromny postęp w zakresie leczenia interferonami przewlekłych wirusowych zapaleń wątroby typu B i C. Od krótkotrwałych, 3 – 4 miesięcznych monoterapii standardowymi interferonami (głównie rekombinowanymi alfa-2a i alfa-2b, ale także limfoblastycznymi), poprzez leczenie wydłużone do 6, potem 12 miesięcy oraz terapie skojarzone interferonem i rybawiryną aż do skojarzonego leczenia pegylowanymi interferonami z rybawiryną i innymi analogami nukleozydów. Odsetki trwałych zahamowań replikacji HCV zwiększyły się od kilku do blisko 50%, a w przypadku zakażeń genotypami 2 i 3 nawet do 68-82% [3-5]. Ciągle jednak nie ma pełnej zgody co do zasad kwalifikacji poszczególnych chorych oraz skutków leczenia lub jego zaniechania u niektórych z nich. Zasadniczymi problemami są:
– nieprzewidywalność jednostkowej dynamiki progresji zmian chorobowych oraz trudności z uzyskaniem bądź potwierdzeniem wiarygodnych danych prognostycznych dotyczących konkretnych chorych [6-8],
– nieprzewidywalność występowania niepożądanych objawów i następstw leczenia przeciwwirusowego oraz kosztów ich opanowania, także w kontekście konieczności zmniejszania dawek lub ich okresowego odstawienia (ang. – adherence) i wpływu tego zjawiska na prawdopodobieństwo uzyskania trwałego zahamowania replikacji wirusa [3, 9-12],
– spory co do zasadności leczenia niektórych grup chorych, np. z długo utrzymującymi się wzrostami aktywności aminotransferazy alaninowej (ALT), ale bez cech włóknienia w badaniu histologicznym wątroby lub chorych bez objawów klinicznych choroby i prawidłowymi wartościami aktywności ALT, czy wreszcie chorych z wyrównaną marskością wątroby i trudnym do przewidzenia ryzykiem pojawienia się pierwotnego raka wątroby [13,14].
Standardy leczenia przewlekłego zapalenia wątroby typu C w Polsce u chorych dorosłych, uzgodnione przez Grupę Ekspertów w lutym 2003 roku [15], obejmują:
1. Objęcie leczeniem chorych a) antyHCV+, HCV-RNA+; b) antyHCV(-), HCV-RNA+; c) antyHCV+, HCV-RNA(-) w dwukrotnych oznaczeniach co 4 tygodnie po wykonaniu HCV-RNA w tkance wątrobowej i/lub mononuklearach krwi obwodowej; d) z aktywnością aminotransferazy alaninowej (ALT)> 1,5-2 x N i włóknieniem (staging) co najmniej stopnia 2 w skali Knodella, po oznaczeniu genotypu i ilościowo HCV-RNA,
2. Leczenie chorych zakażonych HCV z manifestacjami pozawątrobowymi (także z krioglobulinemią), niezależnie od stopnia włóknienia w obrazie histologicznym,
3. Za standardowy lek uznano interferon pegylowany (PEG-Intron i PEGASYS) w skojarzeniu z rybawiryną. Dawkowanie: PegIFN alfa-2b w zależności od masy ciała 1,5 mg/kg 1 x w tygodniu; PegIFN-alfa-2a 180 mg niezależnie od masy ciała; rybawiryna – przy zakażeniu genotypami 1,4,5,6 – 1000-1200 mg/dobę w zależności od masy ciała odpowiednio 75kg; w genotypach 2 i 3 – 800 mg/dobę.
4. Monoterapia PegIFN-alfa jest dopuszczalna i wskazana w przypadku przeciwwskazań do podawania rybawiryny,
5. Czas trwania terapii jest uzależniony od genotypu i wynosi: 48 tygodni dla genotypów 1,4,5 i 6; 24 tygodnie dla genotypów 2 i 3.
6. Dodatkowym kryterium czasu leczenia jest oznaczenie wiremii HCV w 12. tygodniu leczenia (nie w przypadku genotypów 2 i 3). Jeżeli HCV-RNA jest ujemny – leczenie kontynuuje się do 48. tygodnia. Jeżeli w 12. tyg. nastąpiło zmniejszenie replikacji HCV o minimum log2 – leczenie przez następne 12 tygodni i ponowne oznaczenie wiremii. Dalsze leczenie tylko w wypadku ujemnego HCV-RNA.
7. Parametrami oceny skuteczności są: ETR (wynik bezpośrednio po leczeniu) i SVR (trwała odpowiedź mierzona zanikiem HCV-RNA w 24. tygodniu po zakończeniu leczenia,
8. Reterapia – wskazana u chorych z nawrotem wiremii w ciągu 24 tygodni po zakończeniu leczenia pierwotnego standardowym interferonem w monoterapii lub z rybawiryną.
Ze względu na sytuację finansową płatnika świadczeń nie uwzględniono w zaleceniach warunków i sposobu leczenia chorych z wyrównaną marskością wątroby typu C oraz chorych dializowanych zakażonych HCV, chociaż celowość takiego postępowania, zwłaszcza u chorych kwalifikowanych do przeszczepienia wątroby lub nerek, uznano za bezdyskusyjną. Za wskazane uznano także włączenie leczenia kombinowanego w ostrym objawowym wzwC i krótko trwających przewlekłych zapaleniach wątroby typu C.
CEL BADANIA
Celem badania było porównanie kosztów i efektów stosowania pegylowanego intereferonu a-2a (Peg-IFN a2a) z rybawiryną oraz IFN a2b z rybawiryną w leczeniu przewlekłego wirusowego zapalenia wątroby typu C (wzw C) w Polsce.
MATERIAŁ I METODY
Obliczenia kosztów i efektów stosowania IFN a2b z rybawiryną oraz Peg-IFN a2a z rybawiryną w leczeniu przewlekłego wzw C w Polsce dokonano, posługując się modelem decyzyjnym Markowa. Modele Markowa są szczególnie przydatne, gdy przedmiotem badania jest choroba przewlekła [16-19]. Zastosowanie modelu, w którym zintegrowano dane pochodzące z różnych źródeł było konieczne z powodu braku bezpośrednich badań kliniczno-ekonomicznych.
Badanie jest analizą efektywności kosztów. Miarą wyniku są zyskane lata życia oraz zyskane lata życia skorygowane o jakość. Oceny kosztów dokonano z perspektywy płatnika za świadczenia zdrowotne (pacjent i płatnik publiczny), uwzględniając tylko bezpośrednie koszty medyczne. Koszty i wyniki dyskontowano przy użyciu 5% stopy dyskontowej.
Populację badaną stanowią chorzy na przewlekłe wzw C, uprzednio nie leczeni interferonem, u których nie stwierdzono cech marskości wątroby, a wiremia HCV-RNA wynosiła wyjściowo 2,7-6,0 x 106 kopii/ml surowicy. Wiek badanej populacji wynosi 40 lat, 70% populacji stanowią mężczyźni. Charakterystyka tej populacji odpowiada charakterystyce chorych biorących udział w badaniu klinicznym, wykorzystanym w modelu jako źródło danych o skuteczności porównywanych alternatyw terapeutycznych [3]. Wybrane do analiz schematy leczenia chorych są obecnie najczęściej stosowane w Polsce. Analizę przeprowadzono oddzielnie w populacji chorych zakażonych genotypem HCV 1 i genotypem HCV nie-1.
MODEL DECYZYJNY
Struktura modelu Markowa
Model Markowa składa się z 7 stanów zdrowia:
– przewlekłe wzw C,
– trwała odpowiedź wirusologiczna (niewykrywalny HCV RNA w surowicy 24 tyg. po zakończeniu leczenia),
– wyrównana marskość wątroby,
– niewyrównana marskość wątroby,
– rak wątroby,
– przeszczepienie wątroby,
– zgon.
Hipotetyczna kohorta chorych wprowadzona zostaje do modelu Markowa w stanie przewlekłego wzw C. Pod wpływem leczenia skojarzonego IFN a2b z rybawiryną lub Peg-IFN a2a z rybawiryną u pewnego odsetka chorych uzyskuje się trwałą odpowiedź wirusologiczną, a pozostali chorzy pozostają w stanie przewlekłego wzw C. W czasie trwających 1 rok cykli modelu stan zdrowia pacjentów może nie zmieniać się (chorzy pozostają w tym samym stanie klinicznym) albo ulegać poprawie lub pogorszeniu (chorzy przechodzą do innych stanów klinicznych), aż do zgonu, który jest stanem absorbującym. Możliwe przejścia do poszczególnych stanów przedstawia ryc. 1. Dla przejrzystości analizy w modelu przyjęto jednokierunkowość zdarzeń według następujących założeń:
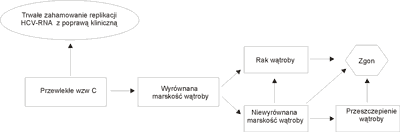
Ryc. 1. Przebieg wirusowego zapalenia wątroby C (model)
– chorzy w stanie „trwałe zahamowanie replikacji HCV-RNA z poprawą kliniczną” nie przechodzą do innych stanów.,
– chorzy w stanie „wyrównana marskość wątroby” nie przechodzą ani do stanu „przewlekłe wzw C”, ani „trwała odpowiedź wirusologiczna”,
– chorzy w stanie „niewyrównana marskość wątroby” przechodzą tylko do stanów: „rak wątroby”, „przeszczep wątroby” lub „zgon” (nie uwzględniono możliwości okresowej poprawy do stanu względnego wyrówniania oraz tzw. technik pomostowych przed przeszczepieniami wątroby:TIPS, ELAD, MARS i inne techniki wspomagania czynności wątroby),
– chorzy w stanie „rak wątroby” oraz „przeszczep wątroby” przechodzą tylko do stanu „zgon”.
Horyzont czasowy badania wynosi 55 lat (w tym czasie prawie wszyscy chorzy umierają).
Alternatywy do porównania
W badaniu porównywano następujące alternatywy:
1) pegylowana postać IFN a2a (PEGASYS, Roche) w dawce 180 mcg s.c. 1 raz w tygodniu, z rybawiryną (Copegus, Roche) w dawce 1000 mg/d doustnie
2) IFN a2b w dawce 3 mln j.m. 3 razy w tygodniu z rybawiryną 1000 mg/d (Rebetron, Schering-Plough)
IFN a2b z rybawiryną jest ciągle jeszcze najczęściej stosowanym w Polsce schematem leczenia wzw C. Peg IFN a2a wybrano do analizy, ponieważ kontrolowane, randomizowane badania kliniczne wykazały jego znamiennie wyższą skuteczność w porównaniu z nie-pegylowanym interferonem [3, 20-22], a skojarzone podawanie pegylowanego interferonu z rybawiryną staje się obecnie coraz powszechniejszym schematem leczenia, także w Polsce.
Dawkowanie leków, odpowiadające polskiej praktyce klinicznej, ustalono na podstawie schematu dawkowania w badaniach klinicznych, służących jako źródło danych o skuteczności leków, mierzonej odsetkiem trwałych odpowiedzi wirusologicznych po upływie 24 tygodni od zakończenia podawania leków [3].
ŹRÓDŁA DANYCH
W modelu Markowa wykorzystano opublikowane wyniki randomizowanych międzynarodowych badań klinicznych terapii skojarzonej IFN a2b z rybawiryną i Peg-IFN a2a z rybawiryną w leczeniu przewlekłego wzw C [3], międzynarodowe, opublikowane dane na temat naturalnego przebiegu wzw C [23-32], specyficzne dla płci i wieku tabele wymieralności w populacji ogólnej [33], międzynarodowe opublikowane dane na temat użyteczności stanów zdrowia [25, 29, 34,35] oraz wyniki przeprowadzonego wśród polskich ekspertów badania ankietowego, które dostarczyło danych o praktyce klinicznej, zużytych zasobach i kosztach jednostkowych, specyficznych dla polskich warunków ekonomicznych. Wykorzystanie międzynarodowych danych klinicznych było możliwe, ponieważ w przeciwieństwie do danych ekonomicznych, wyniki badań klinicznych w przypadku większości chorób nie są uważane za specyficzne dla danego kraju [36, 37].
Dane wykorzystane w modelu ogólnie można podzielić na:
1) dane kliniczne specyficzne dla porównywanych alternatyw leczenia (prawdopodobieństwo uzyskania trwałej odpowiedzi wirusologicznej, czas stosowania leczenia),
2) dane na temat prawdopodobieństwa przejść niespecyficzne dla porównywanych alternatyw leczenia,
3) dane o użyteczności stanów zdrowia wyodrębnionych w modelu,
4) dane ekonomiczne (zużyte zasoby, koszty jednostkowe).
Dane kliniczne
Prawdopodobieństwo uzyskania trwałej odpowiedzi wirusologicznej
Prawdopodobieństwo uzyskania trwałej odpowiedzi wirusologicznej po zastosowaniu pegylowanej postaci IFN a2a z rybawiryną oraz IFN a2b z rybawiryną określono na podstawie wyników badania klinicznego spełniającego kryteria jakościowe medycyny opartej na dowodach (EBM, evidence based medicine) [3]. Prawdopodobieństwa uzyskania trwałej odpowiedzi wirusologicznej użyte w analizie podstawowej i analizach wrażliwości przedstawia tab. 1.
Tabela 1. Prawdopodobieństwa uzyskania trwałej odpowiedzi wirusologicznej użyte w analizie podstawowej i analizach wrażliwości.
| Populacja | Porównywane alternatywy | Prawdopodobieństwo uzyskania trwałej odpowiedzi wirusologicznej | Zródło danych |
| Wartość podstawowa | Zakres w analizie wrażliwości |
Genotyp
HCV 1 | Peg-IFN a2a z rybawiryną
IFN a2b z rybawiryną | 0,46
0,36 | 0,4 - 0,521
0,3 - 0,411 | 3 |
Genotyp
HCV nie-1 | Peg-IFN a2a z rybawiryną
IFN a2b z rybawiryną | 0,76
0,59 | 0,68 - 0,821
0,5 - 0,671 | 3 |
1 95% przedział ufności
Tabela 2. Prawdopodobieństwo przerwania leczenia przeciwwirusowego
| Parametr | Peg-IFN a2a z rybawiryną | IFN a2a z rybawiryną |
| Genotyp HCV-1 | Genotyp HCV-nie1* | Genotyp HCV-1 | Genotyp HCV-nie1* |
| Czas leczenia (tyg) | 48 | 24 | 48 | 24 |
| Czas wykonania testu predykcyjny (tydz.) | 12 | - | 24 | |
| Odsetek chorych, u których zaprzestaje się leczenia po teście predykcyjnym (5) | 21 | | 52 | |
* chorzy zakażeni genotypem HCV-nie1 i zwłóknieniem wątroby są leczeni 48 tygodni.
Czas stosowania leczenia
Według wytycznych postępowania w wzw C [13] czas stosowania interferonu alfa w skojarzeniu z rybawiryną wynosi:
1) u chorych zakażonych genotypem HCV nie-1 – 24 tygodnie (z wyjątkiem chorych z marskością wątroby, u których leczenie trwa 48 tygodni)
2) u chorych zakażonych genotypem HCV-1 – 48 tygodni.
Ponieważ u chorych zakażonych genotypem HCV-1 istnieje korelacja pomiędzy brakiem wczesnej odpowiedzi wirusologicznej (EVR), definiowanej jako zmniejszenie co najmniej 2 log HCV RNA, a niepowodzeniem w uzyskaniu trwałej odpowiedzi wirusologicznej (SVR) [38-40], wykonywanie testu wykrywania HCV-RNA metodą reakcji polimerazy łańcuchowej powinno być rutynowym elementem monitorowania tych chorych [13]. Leczenie należy kontynuować tylko u tych chorych zakażonych genotypem HCV-1, u których uzyskano EVR [13]. Test predykcyjny należy wykonywać w 12 tygodniu w przypadku stosowania Peg-IFN a2a z rybawiryną [3, 38-40] oraz w 24 tygodniu w przypadku stosowania IFN a2b z rybawiryną [41-44].
Zgodnie z optymalnym algorytmem leczenia wzw C, zalecanym w wytycznych [13], w modelu założono, że u chorych zakażonych genotypem HCV-nie1 leczenie trwa 24 tygodnie. Postępowanie u chorych zakażonych genotypem HCV-1 określono na podstawie danych o odsetku chorych, u których nie uzyskano EVR, pochodzących z badań klinicznych [3, 44].
W przypadku Peg-IFN a2a z rybawiryną brak EVR w 12 tygodniu stwierdzono u 14% wszystkich chorych [3]. Ponieważ prawie wszyscy chorzy, u których z powodu braku odpowiedzi zaprzestaje się leczenia Peg-IFN a2a z rybawiryną są zakażeni genotypem HCV-1 a odsetek chorych zakażonych tym genotypem w badanej populacji wynosił 66% [3], w modelu przyjęto założenie, że na podstawie wyniku testu wykrywania HCV-RNA po 12 tygodniach zaprzestano stosowania Peg-IFN a2a z rybawiryną u 21% chorych zakażonych genotypem HCV-1.
W przypadku IFN a2b z rybawiryną odsetek chorych nie odpowiadających na leczenie po 24 tygodniach wynosi 45% (41-49%) [44]. W badanej populacji chorzy zakażeni genotypem HCV-nie1 stanowili średnio 33% [3]. Ponieważ u chorych zakażonych genotypem HCV nie -1 leczenie zawsze trwa 24 tygodnie [13], a SVR uzyskano u około 70% [3] odsetek chorych zakażonych genotypem HCV-1 nie odpowiadających na leczenie w 24 tygodniu wynosi 52% (46-58%).
Prawdopodobieństwa przejść w modelu Markowa
Ryzyko progresji do wyrównanej marskości wątroby dla chorych z wzw C, u których nie uzyskano trwałej odpowiedzi wirusologicznej, zależy od stadium zaawansowania włóknienia wątroby i wynosi od 2,7-3,3% rocznie w początkowej fazie włóknienia do 23,3% rocznie w stadium zaawansowanego włóknienia [23]. W analizie podstawowej posłużono się średnią ważoną ryzyka progresji, która wynosi 7,3% rocznie [23], natomiast w analizie wrażliwości uwzględniono opisany powyżej zakres (tab. 3). Na podstawie wyników uzyskanych w retrospektywnym badaniu obserwacyjnym, którym objęto 384 chorych [24], w analizie podstawowej przyjęto, że ryzyko progresji z wyrównanej do niewyrównanej marskości wątroby wynosi 3,9% rocznie. Zapadalność na raka wątroby wynosi dla chorych z wyrównaną lub niewyrównaną marskością wątroby 1,4% [24]. Przeszczepienia wątroby dokonuje się w ciągu roku u 3,1% chorych z niewyrównaną marskością wątroby [25]. Ryzyko zgonu wynosi rocznie:
Tabela 3. Prawdopodobieństwa przejść (wartości użyte w analizie wyjściowej i analizie wrażliwości) w modelu Markowa.
| Przejście | Prawdopodobieństwo | Piśmiennictwo |
| Z | Do | Wartość podstawowa | Zakres |
| Przewlekłe wzw C | Wyrównana marskość wątroby | 0,073 | 0,027- 0,232 | 23 |
| Wyrównana marskość wątroby | Niewyrównana marskość wątroby | 0,039 | 0,02 - 0,083 | 24, 30 |
| Rak wątroby | 0,014 | 0,01 - 0,044 | 24, 31, 32 |
| Niewyrównana marskość wątroby | Rak wątroby | 0,014 | 0,01 - 0,044 | 24, 31, 32 |
| Przeszczep wątroby | 0,031 | 0,01 - 0,062 | 25 |
| Zgon | 0,129 | 0,065- 0,193 | 24 |
| Rak wątroby | Zgon | 0,427 | 0,33 - 0,86 | 24 |
| Przeszczep wątroby | Zgon (pierwszy rok) | 0,21 | 0,06 - 0,42 | 25-29 |
| Zgon (następne lata) | 0,057 | 0,057 - 0,11 | 25-29 |
– u chorych z niewyrównaną marskością wątroby – 12,9% [24],
– u chorych z rakiem wątroby – 42,7% [24],
– u chorych po przeszczepieniu wątroby – w pierwszym roku 21%, a w następnych 5,7% [26-28].
Wszystkie prawdopodobieństwa przejść użyte w analizie wyjściowej i analizie wrażliwości przedstawia tab. 3.
Użyteczność stanów zdrowia
Użyteczność poszczególnych stanów zdrowia, występujących w modelu Markowa, została oszacowana na podstawie opublikowanych danych literaturowych (tab. 4). Do analizy wyjściowej użyto wartości pochodzących z badania Kima i wsp. [29], w którym użyteczność stanów zdrowia oceniano bezpośrednio za pomocą HUI (wersja III) u chorych w różnych stadiach choroby wątroby. W analizie wrażliwości wykorzystano wyniki opublikowane w pracach Dusheiko i Robertsa [34], Benetta i wsp. [25] oraz Wonga i wsp. [35].
Tabela 4. Użyteczność stanów zdrowia występujących w modelu Markowa.
| Stan zdrowia | Kim i wsp. [25] | Dusheiko i Roberts [34] | Benett i wsp. [25] | Wong i wsp. [35] |
| Przewlekłe zapalenie wątroby | 0,83 | 0,8 | | 0,94 |
| Wyrównana marskość wątroby | 0,78 | 0,5 | 0,7 | 0,92 |
Niewyrównana marskość wątroby
wodobrzusze
krwawienie z żylaków przełyku
encefalopatia wątrobowa | 0,65 | 0,2 |
0,35
0,28
0,3 | 0,54 |
| Rak wątroby | 0,25 | 0,2 | 0,1 | 0,49 |
| Przeszczep wątroby (1. rok) | 0,5 | | | |
| Przeszczep wątroby (następne lata) | 0,7 | | | |
KOSZTY
W analizie uwzględniono bezpośrednie koszty medyczne związane z leczeniem przeciwwirusowym oraz leczeniem następstw wzw C. Obejmują one koszty diagnostyki, leczenia farmakologicznego, konsultacji lekarskich i hospitalizacji. Roczny koszt wzw C oszacowano na podstawie ankiet przeprowadzonych w 5 ośrodkach specjalistycznych (Katedra i Klinika Chorób Zakaźnych AM we Wrocławiu, Katedra i Klinika Chorób Zakaźnych AM w Poznaniu, Klinika Chorób Zakaźnych AM w Bydgoszczy, Klinika Chorób Wewnętrznych Śląskiej AM w Sosnowcu, Wojewódzki Szpital Zakaźny w Warszawie). Roczny koszt wyrównanej marskości wątroby oszacowano na podstawie retrospektywnej analizy historii chorób 23 chorych z 1 ośrodka (Wojewódzki Szpital Zakaźny w Warszawie). Roczny koszt niewyrównanej marskości wątroby oszacowano na podstawie retrospektywnej analizy danych dotyczących leczenia 117 chorych z 2 ośrodków (Wojewódzki Szpital Zakaźny w Warszawie oraz Klinika Hepatologii i Nabytych Niedoborów Odporności AM w Warszawie).
Roczny koszt prowadzenia chorego po przeszczepieniu wątroby i leczenia raka wątroby oszacowano na podstawie opinii ekspertów z Instytutu Transplantologii Akademii Medycznej w Warszawie oraz Instytutu Onkologii w Warszawie. Ceny jednostkowe leków pochodzą z cennika hurtowni farmaceutycznej CEFARM (maj, 2003) [45] i hurtowni Roche [46]. Ceny jednostkowe świadczeń medycznych pochodzą z listy standardowych kosztów oraz lokalnych taryfikatorów płatnika świadczeń zdrowotnych [47-49].
Wartości kosztów uwzględnionych w modelu przedstawia tabela 5.
Tabela 5. Koszty uwzględnione w modelu
| Kategoria kosztów | Koszt całkowity | Zródło danych |
| Leczenie przeciwwirusowe (zł/tydz.)
Peg-IFN a2a z rybawiryną
IFN a2b z rybawiryną
|
1041,545a1 ; 1022,93a21698,13b2. w analizie podstawowej: 1386* 960 a1 .974,4b1 ; 1272 b2
w analizie podstawowej: 1277 * | Cennik hurtowni farmaceutycznej CEFARM i hurtowni Roche (maj, 2003) |
| Przewlekłe wirusowe zapalenie wątroby zł/rok | 4153 | Ankieta przeprowadzona
w 5 ośrodkach specjalistycznych |
| Wyrównana marskość wątroby zł/rok | 1919 | Retrospektywna analiza bazy danych:
23 chorych z 1 ośrodka |
| Niewyrównana marskość wątroby zł/rok | 38 213 | Retrospektywna analiza bazy danych:
117 chorych z 2 ośrodków |
| Transplantacja wątroby (1. rok) zł/rok | 200 800 | Opinia ekspertów |
| Transplantacja wątroby (kolejne lata) zł/rok | 33 600 | Opinia ekspertów |
| Rak wątroby zł/rok | 39 518 | Opinia ekspertów |
a – kalkulacja kosztu kuracji tygodniowej przy założeniu, że stosowany jest preparat złożony IFN +rybawiryna
a1koszt rybawiryny kalkulowany przy założeniu, że wykorzystane jest całe opakowanie preparatu złożonego (168 tbl)
a2koszt rybawiryny kalkulowany przy założeniu, że wykorzystana jest tylko część opakowania, zgodnie z dawkowaniem wg protokołu
b – kalkulacja kosztu kuracji tygodniowej przy założeniu, że stosowany jest preparat IFN oraz preparat rybawiryny
b1 koszt rybawiryny kalkulowany na podst. ceny preparatu złożonego IFN+rybawiryna, po odjęciu ceny IFN
b2 koszt rybawiryny kalkulowany na podst. ceny preparatu rybawiryny
* cena brutto: 1,33 x cena hurtowa
CENY LEKÓW
Pegasys 180 (PegIFN a2a) 4 ampułkostrzykawki po 180 mcg + rybawiryna: 1 opakowanie tbl. 200 mg/ 168 - łączna cena 4166,18 zł
Pegasys I amp. 180 mcg - 930,13 zł;
Copegus: 168 tbl. po 200 mg – 4388,58 zł
Rebetol 168 tbl po 200 mg – 4953,27 zł
Rebetron 3/168: IFN a2b 12 amp. po 3 mln j.m. + 168 tbl. rybawiryny po 200 mg - 3841,68 zł
Intron A 1 amp. 3 mln – 80 zł
rybawiryna (z prepartu Rebetron 3 /168, po odjęciu kosztu IFN a2b a2b) 168 tbl po 200 mg – 2881,68 zł
ANALIZA WRAŻLIWOŚCI
Przeprowadzono jednokierunkowe analizy wrażliwości, w których uwzględniono zmienność wartości następujących kluczowych parametrów:
1) prawdopodobieństwo uzyskania trwałej odpowiedzi wirusologicznej (w zakresie 95% przedziału ufności dla wartości pochodzących z randomizowanych, kontrolowanych badań klinicznych)
2) czas wykonywania testu predykcyjnego u chorych zakażonych genotypem 1 HCV (12, 24 tygodni oraz sytuacja, w której test predykcyjny nie jest wykonywany i leczenie u wszystkich chorych trwa 48 tygodni)
3) prawdopodobieństwa przejść (wartości graniczne pochodzące z publikowanych badań klinicznych i epidemiologicznych)
4) ceny IFN a2b z rybawiryną oraz Peg IFN a2a z rybawiryną (wartości minimalne i maksymalne)
5) koszty stanów zdrowia (w zakresie +/- 50% wartości wyjściowej).
Dla zmiennych, których wartość może mieć wpływ na wniosek końcowy analizy, obliczono wartości graniczne. Przeprowadzono również analizę scenariuszy, biorąc pod uwagę wartości użyteczności stanów zdrowia pochodzące z alternatywnych źródeł danych (tab. 4).
WYNIKI
Peg-IFN a2a z rybawiryną vs IFN a2b z rybawiryną w populacji zakażonej genotypem HCV-1
W populacji chorych zakażonych genotypem HCV-1 całkowity koszt w przeliczeniu na 1 chorego w grupie leczonych Peg-IFN a2a z rybawiryną jest o 2 198 zł wyższy niż w grupie leczonych IFN a2b z rybawiryną (101 908 zł vs 99 710 zł). Koszt Peg-IFN a2a z rybawiryną jest w przeliczeniu na 1 chorego o 10 691 zł wyższy niż koszt IFN a2b z rybawiryną, ale jednocześnie pozostałe koszty leczenia są w grupie otrzymujących Peg-IFN a2a z rybawiryną niższe o 8 492 zł niż w grupie leczonych IFN a2b z rybawiryną (tab. 6). Gdyby założyć, że w czasie leczenia nie wykonywano testu predykcyjnego i wszyscy chorzy w obu grupach otrzymywaliby lek przez 48 tygodni, koszt leku wynosiłby 66 528 zł w grupie Peg-IFN a2a z rybawiryną i 61 296 zł w grupie IFN a2b z rybawiryną, a więc różnica w kosztach pomiędzy grupami wynosiłaby 5 232 zł.
Tabela 6. Analiza efektywności kosztów: Peg-IFN a2a z rybawiryną vs IFN a2b z rybawiryną w populacji chorych zakażonych genotypem HCV-1
| Peg-IFN a2a z rybawiryną | IFN a2b z rybawiryną | Różnica |
Koszty
Koszt leku
Koszt postępowania med.
Koszt całkowity |
56 050 zł
45 858 zł
101 908 zł |
45 350 zł
54 351 zł
99 710 zł |
10 691 zł
- 8 492 zł
2 198 zł |
| Wyniki
Lata życia
QALY (dyskontowane) |
29,52
12, 87 |
28,75
12,41 |
0,78
0,46 |
Koszt uzyskania dodatkowej jednostki wyniku: Peg-IFN a2a z rybawiryną vs IFN a2b z rybawiryną
Koszt/zyskany rok życia 2826 zł (Peg-IFN a2a z rybawiryną jest terapią opłacalną)
Koszt/zyskany QALY 4793 zł (Peg-IFN a2a z rybawiryną jest terapią opłacalną) |
Dzięki stosowaniu Peg-IFN a2a z rybawiryną zamiast IFN a2b z rybawiryną można uzyskać dodatkowe 0,78 roku życia lub dodatkowe 0,46 QALY (tab. 6). Ponieważ koszt uzyskania dodatkowego wyniku przy zastąpieniu standardowej terapii skojarzonej (IFN a2b z rybawiryną) terapią skojarzoną Peg-IFN a2a z rybawiryną wynosi 2 826 zł/zyskany rok życia lub 7 920 zł/zyskany QALY, a więc jest niższy od hipotetycznej granicy opłacalności leczenia (w Polsce około 60 000 PLN/rok życia), terapię Peg-IFN a2a z rybawiryną można uznać za wysoce opłacalną alternatywę dla standardowej terapii skojarzonej.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Wong JB., Davis GL., Pauker SG.: Cost-effectiveness of Ribavirin/Interferon Alfa-2b after Interferon Relapse in Chronic Hepatitis C. Am.J.Med. 2000; 108(5): 366-373
2. Wong JB., Bennett WG., Koff RS., Pauker SG.: Pretreatment Evaluation of Chronic Hepatitis C: Risks, Benefits, and Costs JAMA. 1998; 280: 2088-2093.
3. Fried MW, Schiffman ML, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347: 975-982.
4. Siebert U., Sroczynski G, Rossol S., Wasem J., Ravens-Sieberer U., Kurth B., Manns MP., McHutchison JG., Wong JB.: Cost effectiveness of peginterferon [alpha]-2b plus ribavirin versus interferon [alpha]-2b plus ribavirin for initial treatment of chronic hepatitis C. Gut 2003; 52(3): 425-432.
5. Manns MP., McHutchison JG., Gordon SC., et al.: Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomized trial. Lancet 2001; 358: 958-965.
6. Seeff LB.: Natural history of hepatitis C. Am J Med. 1999; 107: 10S-15S.
7. Dore GJ, Freeman AJ, Law M, Kaldor JM. Is severe liver disease a common outcome for people with chronic hepatitis C? J Gastroenterol.Hepatol. 2002; 17: 423-430.
8. Alter HJ, Seeff LB. Recovery, persistence, and sequelae in hepatitis C virus infection. Semin. Liver Dis. 2000; 20: 17-35.
9. McHutchison JG, Gordon SC, Schiff ER, et al.: Interferon alfa-2b alone or in combination with ribavirin as initial treatment for chronic hepatitis C. N.Engl.J.Med. 1998;.339:.1485-1492.
10. Dusheiko G. Side effects of alpha interferon in chronic hepatitis C. Hepatology. 1997;.26(3 suppl.1):.112S-121S.
11. Fattovich G, Giustina G, Favarato S, Ruol A. A survey of adverse events in 11,241 patients with chronic viral hepatitis treated with alfa interferon. J Hepatol. 1996; 24: 38-47.
12. Salomon JA., Weinstein MC., Hammitt JK., Goldie SJ.: Cost-effectiveness of Treatment for Chronic Hepatitis C Infection in an Evolving Patient Population. JAMA 2003; 290(2): 228-237
13. National Institutes of Health Consensus Development Conference Statement: management of hepatitis C: June 10-12, 2002. Hepatology 2002, 36(5). http://hepatology2.aasldjournals.org 14.06 2003.
14. Salomon JA, Weinstein MC, Hammitt JK, Goldie SJ.: Empirically-calibrated model of hepatitis C virus infection in the United States. Am.J.Epidemiol. 2002; 156: 761-773.
15. Standardy terapii przewlekłego zapalenia wątroby typu C w Polsce. Stanowisko Grupy Ekspertów, Warszawa, luty 2003.
16. Langley-Hawthorne C. Modelling the lifetime costs of treating schizophrenia in Australia. Clin. Ther., 1997; 19(6): 1470-95.
17. Weinstein M, Fineberg H. Clinical Decision Analysis. London: Saunders, 1980.
18. Holloway CA. Decision Making under Uncertainty Models and Choices. Englewood Cliffs (NJ): Prentice Hall, 1979.
19. Orlewska E. Analiza decyzyjna. w: Podstawy farmakoekonomiki, Unimed, Warszawa, 1999.
20. Reddy KR, Wright TL, Pockros PJ, Shiffman M, Everson G, Reindollar R et al. Efficacy and safety of pegylated (40-kd) interferon < alpha >-2a compared with interferon < alpha >-2a in noncirrhotic patients with chronic hepatitis C. Hepatoly 2001;33:433-8.
21. Zeuzem S, Feinman SV, Rasenack J, Heathcote EJ, Lai MY, Gane E et al. Peginterferon alfa-2a in patients with chronic hepatitis C. N.Engl.J Med. 2000;343:1666-72.
22. Hadziyannis SJ, Cheinquer H, Morgan T, Diago M, Jensen DM, Sette H et al. Peginterferon alfa-2a (40KD) (pegasys) in combination with ribavirin (RBV): Efficacy and safety results from a phase III randomized, double-blind, multicentre study examining effect of duration of treatment and RBV dose. Journal of Hepatology 2002;36:1.
23. Yano M, Kumada H, Kage M, et al. The long-term pathological evolution of chronic hepatitis C. Hepatology 1996; 23: 1334-1340
24. Fattovich G, Guistina G, Degas F. Morbidity and mortality in compensated cirrhosis type C: a retrospective follow-up study of 384 patients. Gastroenterology 1997; 112: 463-472.
25. Bennett WG, Inoue Y, Beck JR, Wong JB, Pauker SG, Davis GL. Estimates of the cost-effectiveness of a single course of interferon-alpha2b in patients with histologically mild chronic hepatitis C. Ann Intern Med 1997; 127: 855-865.
26. Ascher NL, Lake JR, Emond J, Roberts J. Liver transplantation for hepatitis C virus-related cirrhosis. Hepatology 1994; 20: 245-275.
27. Detre KM, Belle SH, Lomarddero M. Liver transplantation for chronic viral hepatitis. Viral Hepatitis Rev 1996; 2: 219-228.
28. Kilpe VE, Krakauer H, Wren RE. An analysis of liver transplant experience from 37 transplant centers as reported to Medicare. Transplantation 1993; 56: 554-561.
29. Kim WR, Poterucha JJ, Hermans JE, Therneau TM, Dickson ER, Evans RW, Gross JB. Cost-effectiveness of 6 and 48 weeks of interferon-alpha therapy for chronic hepatitis C. Ann Intern Med 1997; 127: 866-874.
30. Gines P, Quintero E, et al. Compensated cirrhosis: natural history and prognostic factors. Hepatology 1987; 7: 122-128.
31. Tsukuma H, Hiyama T, et al. Risk factors for hepatocellular carcinoma among patients with chronic liver disease. N Engl J Med 1993; 328: 1797-1801.
32. Colombo M, de Franchis R, et al. Hepatocellular carcinoma in Italian patients with cirrhosis. N Engl J Med 1991; 325: 675-680.
33. Tabele przeżycia. Główny Urząd Statystyczny. www.stat.gov.pl/serwis/nieregularne/trwanie_tbal.xls. dostęp 16.06.2003.
34. Dusheiko GM, Roberts JA. Treatment of chronic type B and C hepatitis with interferon alpha: an economic appraisal. Hepatology 1995; 22: 1863-73.
35. Wong JB, Koff RS, Tine F, et al. Cost-effectiveness of interferon-alpha 2b treatment for hepatitis B e antigen-positive chronic hepatitis B. Ann Inter Med 1995; 122: 664-75.
36. Nuijten MJC. Data management in modeling studies: the selection of data sources. Pharmacoeconomics 1998; 3: 305-16.
37. Orlewska E., Mierzejewski P. Polskie wytyczne przeprowadzania badań farmakoekonomicznych (projekt). Farmakoeonomika 2000, Suplement 1:3-11.
38. Lee S. Heathcote EJ, et al. Prognostic factors and early predictability of sustained viral response with pegitnerferon alfa-2a (40 KD). J Hepatol 2002; 37: 500-506
39. Ferenci P. Early prediction of response to Peginterferon alfa-1a (40 kD) [Pegasys(r)] plus ribavirin in patients with chronic hepatitis C. Hepatology 2001, 34 Pt.2: 351A.
40. Pegasys - Charakterystyka środka farmaceutycznego. Physicians´ Desk Reference 2003.
41. Davis GL, Esteban MR, Rustgi V, Hoefs J, Gordon SC, Trepo C et al. Interferon alfa-2b alone or in combination with ribavirin for the treatment of relapse of chronic hepatitis C. International Hepatitis Interventional Therapy Group. N Eng J Med 1998; 339(21):1493-1499.
42. McHutchison JG, Poynard T. Combination therapy with interferon plus ribavirin for the initial treatment of chronic hepatitis C. Semin Liver Dis 1999; 19 Suppl 1:57-65.
43. Poynard T, Marcellin P, Lee SS, Niederau C, Minuk GS, Ideo G et al. Randomised trial of interferon alpha2b plus ribavirin for 48 weeks or for 24 weeks versus interferon alpha2b plus placebo for 48 weeks for treatment of chronic infection with hepatitis C virus. International Hepatitis Interventional Therapy Group (IHIT). Lancet 1998; 352(9138):1426-1432.
44. Poynard T, McHutchison J, Goodman Z, Ling MH, Albrecht J. Is an "a la carte"combination interferon alfa-2b plus ribavirin regimen possible for the first line treatment in patients with chronic hepatitis C? The ALGOVIRC Project Group. Hepatology 2000; 31(1):211-218.
45. Cennik hurtowni farmaceutycznej CEFARM Warszawa, maj 2003.
46. Cennik hurtowni ROCHE, maj 2003.
47. Lista standardowych kosztów świadczeń udzielanych w zakresie ambulatoryjnego lecznictwa specjalistycznego, opieki długoterminowej i rehabilitacji leczniczej. Farmakoekonomika 2003, 1:11-24
48. Lista Standardowych kosztów świadczeń udzielanych w zakresie lecznictwa zamkniętego . Farmakoekonomika 2003, 2:1-19.
49. Taryfikator Usług Medycznych. www.kasa-chorych.lodz.pl/Konkurs2002/cennik.html. dostęp: 22.02.2002.
50. Younossi ZM, Singer ME, et al. Cost effectiveness of interferon alfa2b combined with ribavirin for the treatment of chronic hepatitis C. Hepatology 1999; 30(5): 1318-1324.
51. Jensen D, Bernstein D, et al. Modelling the impact of peginterfreon alfa-2a (40 KD) (Pegasys(r)) plus ribavirin therapy on life expectancy and medical care costs in chronic hepatitis C (abstract). American Association for the Study of Liver Diseases (AASLD) Listopad 2-5, 2002, Boston, MA
52. Sullivan SD, Green J, et al. Comparison of the cost-effectiveness of Peginterfreon alfa-2a (40 KD) (Pegasys(r)) plus ribavirin (Copegus(r)) versus interferon alfa-2b plus ribavirin in chronic hepatitis C (abstract). Value in Health 2003; 3(6): Praca prezentowana na 8 Międzynarodowej Konferencji ISPOR, 18-21 maja 2003, Arlington VA, USA.
Pozostałe artykuły z numeru 4/2003:

