© Borgis - Nowa Medycyna 3/2013, s. 124-129
*Paweł Kowalczyk1, Urszula Jankiewicz2
Metody przenoszenia informacji genetycznej i ich wpływ na zdrowie człowieka
Methods of transfer of genetic information and its impact on human health
1Samodzielny Zakład Biologii Mikroorganizmów, Wydział Rolnictwa i Biologii, Szkoła Główna Gospodarstwa Wiejskiego, Warszawa
P.o. Kierownika Zakładu: dr hab. Barbara Łotocka
2Katedra Biochemii, Wydział Rolnictwa i Biologii, Szkoła Główna Gospodarstwa Wiejskiego, Warszawa
Summary
HGT (called Horizontal Gene Transfer) consists of the transfer of genetic material from one cell to another of the same type (common in prokaryotic between different bacterial species), between cells or between other unrelated organisms (found in eukaryotes). In 1984, then called HGT concepts as interspecies gene flow introduced Michael Syvanen and it gradually developed. This type of transfer is inseparably connected with the concept of a broad host range (between prokaryotic and eukaryotic) when the body can transfer genes of representatives of different species and even generations. The adsorption of the bacteriophage to the cellular surface of its host unleashes a cascade of reaction, the final product being the formation of new virions and infection of new cells. Most important aspects of the bacteriophage development cycle concern the conditions in which the metabolic apparatus of the host is being taken over by the virus and the assembly and formation of new bacteriophages. Head maturation is a complex process which requires many different structural proteins and enzymes to interact together. Proteases responsible for the proteolytic cleavage of structural and scaffolding are poorly described and still require research. Despite intensified studies there is still little information about substrate specificity, optimal conditions for enzyme activity or the regulation of activity in vivo.

WSTĘP
Horyzontalny transfer genów (ang. HGT, Horizontal Gene Transfer) zwany także poziomym transferem genów, polega na przeniesieniu materiału genetycznego z jednej komórki do drugiej tego samego typu (powszechnie występuje w organizmach prokariotycznych) między różnymi gatunkami bakterii poprzez procesy koniugacji, transdukcji oraz transformacji, pomiędzy innymi komórkami np. bakteriami a drożdżami lub m.in. niespokrewnionymi organizmami (również w komórkach eukariotycznych) np. bakteriami i owadami, grzybami a zwierzętami. W 1984 roku Michael Syvanen wprowadził koncepcje HGT jako międzygatunkowego przepływu genów i stopniowo ją rozwijał. Ten rodzaj transferu jest nierozerwalnie związany z pojęciem szerokiego zakresu gospodarza (między organizmami prokariotycznymi i eukariotycznymi), kiedy informacja genetyczna może być przenoszona przez przedstawicieli różnych gatunków, a nawet pokoleń. Na przykładzie adsorpcji bakteriofaga do komórkowej powierzchni gospodarza, wyzwalana jest kaskada reakcji, a w konsekwencji tworzenie nowych wirionów, które doprowadzają do zakażeń nowych komórek i tworzenia nowych bakteriofagów.
Rodzaje horyzontalnego transferu genów
Ten typ wymiany materiału genetycznego został dobrze i wcześnie poznany głównie wśród organizmów prokariotycznych dzięki mechanizmom: koniugacji, transdukcji i transformacji.
Koniugacja – w wieloetapowym procesie przekazywania genów przez bezpośredni fizyczny kontakt komórek dawcy i biorcy za pomocą pili ułatwiających zajście procesu. Gdy przez pile przechodzi DNA między bakteriami tego samego gatunku, określa się to jako transfer pionowy, gdy między różnymi gatunkami – jest to transfer poziomy. Proces koniugacji rozpoczyna się od kontaktu czubka pilusa z odpowiednim receptorem na powierzchni komórki innej bakterii. Następnie zostaje on unieruchomiony i ulega retrakcji, a później degradacji, doprowadzając do bezpośredniego kontaktu osłon komórkowych. Umożliwia to lokalne ścisłe zespolenie błon. Pary komórek, które połączyły się w ten sposób, są wystarczająco stabilne i gotowe do przekazania DNA (ryc. 1). W czasie przekazywania materiału genetycznego następuje już synteza nowych genów z materiałem genetycznym naturalnie występującym u danej bakterii Koniugacja najbardziej przypomina proces płciowy występujący u Eukaryota. Została opisana po raz pierwszy w 1964 roku przez amerykańskiego genetyka Joshuę Lederberga (1) u wielu gatunków bakterii, w tym u sinic. Prawdopodobnie dzięki koniugacji powstały w krótkim czasie lekooporne bakterie, takie jak Shigella oporna na różne antybiotyki lub gronkowiec złocisty (Straphylococus aureus) oporny na penicylinę.
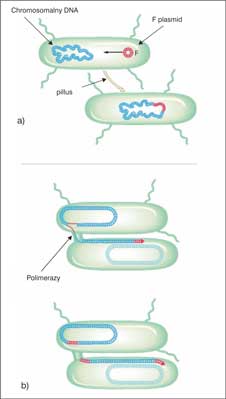
Ryc. 1. Mechanizm zachodzenia koniugacji u bakterii: a) przenoszenie plazmidów między różnymi komórkami danej populacji poprzez mostek koniugacyjny za pomocą pili, przez który przechodzą specjalne nośniki DNA, tj. plazmidy (koniugacyjne – które tworzą połączenia w postaci mostków koniugacyjnych; mobilizowane – mające zdolności do samoistnego przenoszenia informacji, nie tworzą mostków koniugacyjnych) oraz transpozony koniugacyjne poprzez jednoniciowe nacięcie w odpowiednim miejscu plazmidu przez określone białko. Po przekazaniu plazmidu jego liniowa forma ulega cyrkularyzacji;
b) synteza nici komplementarnych w komórce dawcy przebiega w sposób ciągły, a w komórce biorcy poprzez fragmenty Okazaki udziałem polimeraz bakteryjnych.
Transdukcja – jest jednym z najwydajniejszych procesów przekazywania genów przez bakteriofagi (wirusy bakteryjne) jako do komórki bakterii z zastosowaniem różnych metod i technik stosowanych w biologii molekularnej w oparciu o wektory będące pochodnymi faga lambda, retrowirusów, lentiwirusów oraz adenowirusów. W chwili obecnej znalazła szerokie zastosowanie w terapiach przeciwnowotworowych oraz w terapii genowej, w której to indukuje się komórki produkcji określonych białek występujące w niedomiarze lub jest ich brak w organizmie podczas procesów metabolicznych, np. hemofilii. W terapii genowej z udziałem transdukcji stosuje się metodę ex vivo. Metoda ex vivo polega na wyizolowaniu komórek z organizmu pacjenta, wprowadzeniu do nich terapeutycznego DNA lub RNA i ponownym podaniu ich pacjentowi. Dobrym przykładem jest leczenie dzieci cierpiących na X- i ADA-SCID (ciężki złożony niedobór immunologiczny spowodowany mutacją genu deaminazy adenozynowej – ADA). Jest to choroba genetyczna dziedziczona autosomalnie (recesywnie). Ogólny schemat procesu przedstawia rycina 2. Do receptorów obecnych na powierzchni komórki bakteryjnej przyczepia się fag, który może doprowadzić do infekcji litycznej bądź lizogenii. Zjawisko zostało odkryte już w roku 1952 przez Lederberga i Zindera w procesie infekcji komórek bakteryjnych bakteriofagami (2).
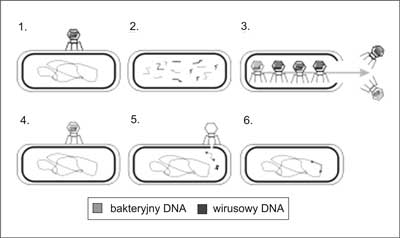
Ryc. 2. Przebieg transdukcji bakteriofagiem na przykładzie cyklu litycznego.
W I etapie bakteriofag zakaża komórkę bakteryjną własnym swoistym DNA, łącząc się z białkami receptorowymi na błonie bakterii. Następnie w II etapie bakteryjne i bakteriofagowe kwasy nukleinowe zostają pocięte przez enzymy wirusowe na mniejsze fragmenty, tzw. infekcja lityczna, po czym następuje replikacja DNA fagowego (która doprowadza do śmierci komórki). Kolejno w III etapie następuje szybkie pakowanie DNA fagowego do kaspydu (główki faga) i powstają kompletne wiriony, które opuszczają komórkę bakteryjną; kapsydy, w których nastąpiło błędne upakowanie DNA bakteryjnym zaznaczono kolorem szarym. W następnym etapie (IV) bakteriofag niosący bakteryjny DNA zakaża kolejną bakterię z uśmierconej komórki (etap V). Bakteryjne DNA komórki dawcy zostaje wstrzyknięte do komórki biorcy (etap VI). DNA z komórki dawcy zastąpiło fragment DNA biorcy.
Transformacja – jest to proces polegający na wprowadzeniu do komórki obcego materiału genetycznego (DNA), zwłaszcza niewielkiej jego porcji, obejmującej jeden do kilku genów. Zmodyfikowana w ten sposób komórka oraz – w przypadku organizmów wielokomórkowych – zregenerowany z niej organizm noszą nazwę transformanta. W zależności od rodzaju zastosowanego wektora lub jego braku transformacje dzieli się zwykle na bezwektorową (transformacja bezpośrednia) i wektorową (transformacja pośrednia). Transformacja bezpośrednia (bezwektorowa) komórek eukariotycznych bywa czasem nazywana transfekcją. Metoda ta wykorzystywana jest w laboratoriach, służy m.in. do klonowania genów. Polega ona na wystawianiu błony komórkowej bakterii na szok osmotyczny, cieplny lub na działanie pola elektrycznego o dużym napięciu, co zmusza komórkę do pobrania DNA z otoczenia. Ten rodzaj transformacji, odmiennie od naturalnej, wprowadza do komórki nienaruszony, dwuniciowy DNA w postaci plazmidu lub liniowego odcinka (ryc. 3).
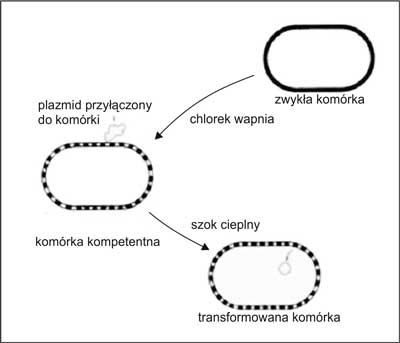
Ryc. 3. Ogólny schemat transformacji bezwektorowej (transfekcji).
W metodach wektorowych wykorzystuje się określony organizm pośredniczący, przenoszący transgen do komórki-biorcy (wektor do transformacji). W metodach bezpośredniej transformacji stosuje się różne sposoby ułatwienia transgenom pokonywania bariery błonowej komórki-biorcy:
– za pomocą środków chemicznych zwiększających przepuszczalność błony, stosowane w roztworze wraz z DNA (glikol polietylenowy do roślinnych izolowanych protoplastów, chlorek rubidu, chlorek wapnia do chemicznej transformacji bakterii). Przykładem jest przeniesienie DNA z komórek bakterii rodzaju Agrobacterium do komórki roślinnej. Nieliczne doniesienia dowodzą także transfer genów między bakterią Escherichia coli a komórką drożdży Saccharomyces cerevisiae (3),
– wstrzeliwanie cząsteczek DNA przy pomocy armatki genowej (metoda biolistyczna – do transformowania komórek zwierząt, grzybów i roślin, zarówno dwu-, jak i jednoliściennych; najczęściej wykorzystywana metoda bezpośredniej transformacji roślin),
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Warwick K: The Joshua Lederberg Papers: Profiles in Science, National Library of Medicine. Biography 2001; 24(4): 978-982. 2. Clewell DB (ed.): Bacterial Conjugation. Plenum Press, New York 1993. 3. Lorentz MG, Wackernagel W: Bacterial gene transfer by natural genetic transformation in the environment. Microbial Reviews 1994; 58: 563-602. 4. Gelvin SB: Agrobacterium and plant genes involved in T-DNA transfer and integration. Ann Rev Plant Physiol Plant Mol Biol 2000; 51: 223-256. 5. Heinemann JA, Sprague GF: Bacterial conjugative plasmids mobilize DNA transfer between bacteria and yeast. Nature 1989; 340: 205-209. 6. Bergh O, Børsheim KY, Bratbak G, Heldal M: High abundance of viruses found in aquatic environments. Nature 1989; 340: 467-468. 7. Mary ET, Richard EI: Microbial food safety in animal agriculture: current topic. Iowa State Press 2003: 155. 8. Syvanen M, Kado C (eds.): Horizontal Gene Transfer. Academic Press, 2nd edition, New York-London 2002: 445. 9. Syvanen, M: Temporal patterns of eukaryotic evolution suggest extensive polyphly. [In:] Syvanen M, Kado C (eds.): Horizontal Gene Transfer. Academic Press, 2nd edition, New York-London 2002: 383-395. 10. Institute of Medicine (U.S.): Committee on the Review of the USDA E. coli O157:H7 Farm-to-Table Process Risk Assessment: Escherichia coli O157:H7 in ground beef: review of a draft risk assessmen. D.C.: National Academies Press, Washington 2002. 11. Friedmann T, Roblin R: Gene Therapy for Human Genetic Disease? Science 1972; 175(4025): 949-955. 12. Sheridan C: Gene therapy finds its niche. Nature Biotechnology 2011; 29(2): 121-128. 13. Cideciyan AV, Hauswirth WW, Aleman TS et al.: Vision 1 Year after Gene Therapy for Leber’s Congenital Amaurosis. New England Journal of Medicine 2009; 361(7): 725. 14. Fischer A, Hacein-Bey-Abina S, Cavazzana-Calvo M: 20 years of gene therapy for SCID. Nature Immunology 2010; 11(6): 457-460. 15. Ferrua F, Brigida I, Aiuti A: Update on gene therapy for adenosine deaminase-deficient severe combined immunodeficiency. Current Opinion in Allergy and Clinical Immunology 2010; 10(6): 551-556. 16. Cartier N, Aubourg P: Hematopoietic Stem Cell Transplantation and Hematopoietic Stem Cell Gene Therapy in X-Linked Adrenoleukodystrophy. Brain Pathology 2009; 20(4): 857-862. 17. Yang ZJ, Zhang YR, Chen B et al.: Phase I clinical trial on intracoronary administration of Ad-hHGF treating severe coronary artery disease. Molecular Biology Reports 2008; 36(6): 1323-1329. 18. Callejas D, Mann CJ, Ayuso E et al.: Treatment of Diabetes and Long-term Survival Following Insulin and Glucokinase Gene Therapy. Diabetes 2013 May; 62(5): 1718-1729. 19. Woods NB, Bottero V, Schmidt M et al.: Gene therapy: Therapeutic gene causing lymphoma. Nature 2006; 440(7088): 11. 20. Thrasher AJ, Gaspar HB, Baum C et al.: Gene therapy: X-SCID transgene leukaemogenicity. Nature 2006; 443(7109): E5-E6; discussion E6-7. 21. Frank KM, Hogarth DK, MillerJL et al.: Investigation of the Cause of Death in a Gene-Therapy Trial. New England Journal of Medicine 2009; 361(2): 161-169. 22. Cepko CL: Emerging Gene Therapies for Retinal Degenerations. Journal of Neuroscience 2012; 32(19): 6415-6420. 23. Syvanen M, Zhou Z, Wharton J et al.: Heterogeneity of the glutathione transferase genes encoding enzymes responsible for insecticide degradation in the housefly. J Molec Evol 1996; 43: 236-240.




