© Borgis - Nowa Pediatria 4/2015, s. 132-139
Małgorzata Gołąbek-Dylewska, Tomasz Książczyk, *Bożena Werner
Zapalenie osierdzia u dzieci – obserwacje własne
Pericarditis in children – single-institution experience
Klinika Kardiologii Wieku Dziecięcego i Pediatrii Ogólnej, Warszawski Uniwersytet Medyczny
Kierownik Kliniki: prof. dr hab. n. med. Bożena Werner
Summary
Introduction. Pericarditis is a rare disorder in children, usually accompanying other inflammatory diseases.
Aim. The aim of the study was to analyze a clinical presentation and etiology of the pericarditis in children.
Material and methods. 40 patients, aged 2 months to 17 years old were included into the study. In all patients ECG, X-ray, echocardiography and basic blood tests were performed. When suitable additional tests were done: antinuclear and anticardiolipin antibodies, RF, ASO, troponin, CK and CK-MB, LDH, thyroid hormones, blood cultures, tests for viral infections and pericardial fluid analysis.
Results. 19 patients were in good general condition, 10 in moderate and 11 in severe state. 35 children had signs of infection, of those 13 had pneumonia. The leading symptoms were: fever, chest pain, fatigue, cough, dyspnoea, tachycardia. In 25 patients the heart was enlarged in a chest X-ray, in 27 ECG abnormalities were found. Viral etiology was confirmed in 10 patients, bacterial in 3 and auto-immunological in 4 cases. In single patients pericarditis was caused by trauma, hypothyroidism and uremia. In 20 cases (50%) etiology was not established. Recurrence occurred in 4 patients. 13 patients due to risk of tamponade required pericardial drainage. 27 patients were treated conservatively.
Conclusions. Clinical presentation of pericarditis is usually benign, but in about 30% of patients, especially infants and young children, might be severe with threatening cardiac tamponade. Leading symptoms are: chest pain, tachycardia, dyspnoea, fever. The most common is viral etiology although in 50% of patients the etiology was not determined.

Wstęp
W krajach wysokorozwiniętych zapalenie osierdzia (ZO) występuje stosunkowo rzadko, jego częstość ocenia się obecnie na około 1/1000-1/800 pacjentów hospitalizowanych (1). W materiałach sekcyjnych ZO stwierdza się jednak znacznie częściej, w około 2-6% przypadków, co może świadczyć o często skąpoobjawowym przebiegu schorzenia (1, 2).
ZO u dzieci jest najczęściej wtórne, tylko w około 10% przypadków pierwotne (2, 3). Wśród przyczyn ZO wymienia się: zakażenie (wirusowe, bakteryjne, grzybicze i pasożytnicze), choroby o podłożu immunologicznym (choroby tkanki łącznej, gorączka reumatyczna, choroba Kawasaki, choroba posurowicza, reakcje polekowe, sarkoidoza), zaburzenia metaboliczne (mocznica, skrobiawica, niedoczynność tarczycy), choroby nowotworowe (białaczki, chłoniaki, przerzuty nowotworowe, rzadko nowotwór pierwotny osierdzia), radioterapię, zabiegi kardiochirurgiczne i kardiologii interwencyjnej, uraz klatki piersiowej.
W ostatnich dziesięcioleciach, ze względu na stosowaną antybiotykoterapię i poprawę warunków bytowych, uległa zmianie zarówno częstość występowania ZO, jak i jego etiologia. Wyraźnie zmniejszyła się liczba przypadków bakteryjnego, a zwłaszcza gruźliczego ZO, natomiast relatywnie zwiększyła się częstość występowania ZO o etiologii wirusowej, immunologicznej i nowotworowej (3, 4).
Cel pracy
Celem pracy jest analiza obrazu klinicznego i etiologii ZO u pacjentów hospitalizowanych w Klinice Kardiologii w latach 1997-2015.
Materiał i metody
Badaniami objęto 40 dzieci, w tym 26 dziewcząt i 14 chłopców w wieku od 2. m.ż. do 17. r.ż. (średnia: 12 lat). W badanej grupie było 7 niemowląt, 5 dzieci od 1. do 3. r.ż., 4 w wieku przedszkolnym i 24 w wieku szkolnym. W latach 1997-1999 hospitalizowano 14 dzieci z rozpoznaniem ZO, średnio 4,7 pacjenta/rok, natomiast od 2000 roku – 26 pacjentów, czyli średnio 1,73 pacjenta/rok. Do badania nie włączono pacjentów z zespołem poperikardiotomijnym po operacjach kardiochirurgicznych.
Rozpoznanie ustalono na podstawie zebranych wywiadów, badania przedmiotowego oraz wyników badań dodatkowych. U wszystkich pacjentów wykonano następujące badania laboratoryjne: morfologię krwi ze wzorem odsetkowym krwinek białych, OB, CRP, proteinogram, jonogram, oznaczono stężenie mocznika, kreatyniny i troponiny I oraz aktywność enzymów: transaminaz, dehydrogenazy kwasu mlekowego (LDH), kinazy kreatynowej (CK i frakcji sercowej CK-MB) w surowicy krwi, TSH i hormony tarczycy, ASO, czynnik reumatoidalny, komórki LE i przeciwciała przeciw komórkom mięśnia sercowego (antykardiolipinowe), w niektórych przypadkach (u wszystkich pacjentów od 2008 r.) przeciwciała przeciwjądrowe ANA i przeciw leukocytom obojętnochłonnym ANCA. U większości pacjentów wykonano badania serologiczne w kierunku zakażeń wirusowych oraz posiewy krwi. W uzasadnionych przypadkach (wywiad rodzinny i środowiskowy, inne objawy kliniczne) wykonywano badania w kierunku zakażenia prątkiem gruźlicy (próba tuberkulinowa, Quantiferon). U 13 dzieci poddano analizie mikrobiologicznej, biochemicznej i histochemicznej płyn z worka osierdziowego. Rutynowo wykonywano zdjęcie radiologiczne klatki piersiowej (rtg), badanie elektrokardiograficzne (EKG) i badanie echokardiograficzne (Echo-2D). EKG i Echo-2D serca powtarzano kilkakrotnie podczas leczenia, w zależności od wskazań klinicznych i w celu monitorowania przebiegu choroby.
Wyniki
Przy przyjęciu do Kliniki spośród 40 dzieci stan ogólny 19 pacjentów był dobry, 10 średni, a 11 pacjentów przyjęto w stanie ciężkim, z objawami niewydolności serca. Wśród pacjentów w stanie dobrym i średnim przeważały dzieci w wieku szkolnym (powyżej 6. r.ż.) – 28 pacjentów. Natomiast wśród 11 pacjentów w stanie ciężkim było 2 niemowląt, 3 dzieci do 3. r.ż., 3 w wieku przedszkolnym oraz 3 dzieci starszych.
U 35 dzieci przed hospitalizacją stwierdzono objawy infekcji: u 19 objawy zakażenia górnych dróg oddechowych z gorączką do 39?C i kaszlem, a u 2 dzieci również z opryszczką wargową. U 2 dzieci stwierdzono ropne zapalenie ucha środkowego. Jeden z pacjentów kilka dni przed hospitalizacją przebył płonicę. U 13 pacjentów z ZO współistniało zapalenie płuc, w tym u 2 występowały cechy zakażenia uogólnionego. Jedno z dzieci kilka dni wcześniej doznało silnego urazu klatki piersiowej i nadbrzusza. Inne dziecko z biegunką i wymiotami w wywiadzie zostało przyjęte z objawami niewydolności nerek. U jednego pacjenta rozpoznano niedoczynność tarczycy.
Dominującymi objawami podmiotowymi były: gorączka, duszność, uczucie szybkiego bicia serca (tachykardia), zmniejszona tolerancja wysiłku i uczucie ogólnego osłabienia, suchy kaszel oraz ból w klatce piersiowej zlokalizowany w okolicy przedsercowej. Natomiast w badaniu przedmiotowym najczęściej stwierdzano: tachykardię, ciche i głuche tony serca, poszerzenie granic stłumienia serca oraz powiększenie wątroby i śledziony. Szmer tarcia osierdzia wysłuchiwano jedynie u 16 (40%), a tętno paradoksalne występowało u 10 (25%) pacjentów. Dokładne dane na temat objawów klinicznych zestawiono w tabeli 1.
Tabela 1. Objawy kliniczne w zaawansowanym okresie choroby.
| Objawy | Liczba dzieci |
| Podmiotowe |
| gorączka | 36 |
| zmniejszona tolerancja wysiłku | 26 |
| ból w klatce piersiowej | 20 |
| duszność | 18 |
| suchy kaszel | 13 |
| Przedmiotowe |
| tachykardia | 21 |
| ciche/głuche tony serca | 20 |
| poszerzenie granic serca | 19 |
| powiększenie wątroby i śledziony | 17 |
| szmer tarcia osierdzia | 16 |
| obrzęki kończyn dolnych | 14 |
| hipotonia | 13 |
| przepełnienie żył szyjnych | 12 |
| tętno paradoksalne | 10 |
W zakresie podstawowych badań laboratoryjnych dodatnie wskaźniki stanu zapalnego w postaci podwyższonych wartości OB (11-120 mm/h) i CRP (1-48 mg%) stwierdzono u 36 spośród 40 pacjentów, a zwiększoną ponad normę dla wieku liczbę krwinek białych z nieprawidłowym wzorem odsetkowym u 22 badanych. U 10 z nich stwierdzono zwiększoną liczbę limfocytów, a u 12 granulocytów. U 12 dzieci występowała także niedokrwistość niedobarwliwa mikrocytarna. U pacjenta z płonicą w wywiadzie miano ASO było podwyższone do 680 IU.
U pacjenta przyjętego z objawami odwodnienia i niewydolności nerek stężenie mocznika było podwyższone do 195 mg%, kreatyniny do 3,5 mg%, a stężenie potasu do 6 mEq/l.
Aktywność LDH w surowicy krwi była zwiększona u 5 dzieci, a u 2 z nich występował również wzrost aktywności troponiny I, CK i CK-MB. U 3 dzieci, w tym u 2 z podwyższoną aktywnością enzymów sercowych, stwierdzono obecność przeciwciał antykardiolipinowych przeciw komórkom mięśnia sercowego.
U jednego dziecka z towarzyszącą kardiomiopatią rozstrzeniową, niewydolnością serca, zaburzeniami krzepnięcia, u którego doszło do powikłań zakrzepowych (zakrzep tętnicy podkolanowej i wątrobowej), obserwowano okresowo znaczne podwyższenie aktywności transaminaz (GOT maks. 2497 U/l, GPT maks. 1608 U/l) i LDH (maks. 5045 U/l), przy prawidłowych wartościach CK i CK-MB.
U 4 pacjentów stwierdzono w surowicy krwi przeciwciała przeciwjądrowe ANA (w tym u pacjenta z przebytą płonicą), a u 2 z nich dodatni czynnik reumatoidalny.
W posiewach krwi jedynie u jednej pacjentki (dwuletnia dziewczynka ze współistniejącym zapaleniem wsierdzia) uzyskano wzrost szczepu gronkowca złocistego (Staphylococcus aureus). U pozostałych dzieci wyniki posiewów krwi i moczu oraz pobranego u niektórych pacjentów płynu z worka osierdziowego były ujemne.
W badaniach serologicznych u jednej pacjentki stwierdzono podwyższone miano przeciwciał w klasie IgM dla Mycoplasma pneumoniae. U 10 pacjentów stwierdzono dodatnie wyniki badań serologicznych w kierunku zakażeń wirusami. U 5 dzieci w odczynie ELISA miano przeciwciał dla wirusów paragrypy typów 2 i 3 było znamiennie podwyższone, a u 2 innych pacjentów obserwowano wysokie miano i znaczący wzrost po 2 tygodniach miana przeciwciał dla wirusów Coxsackie B4, a u 1 dla wirusów Coxsackie B3 i HCV. Ponadto u 2 dzieci (z opryszczką wargową w wywiadzie) stwierdzono istotny wzrost miana przeciwciał przeciw wirusom Herpes simplex, przy czym u jednego z tych pacjentów wystąpił jednocześnie czterokrotny wzrost miana przeciwciał dla wirusów paragrypy typu 3.
Powiększoną sylwetkę serca w badaniu radiologicznym stwierdzono u 25 dzieci, w tym u 13 była ona znacznie powiększona ze wskaźnikiem sercowo-płucnym 0,58-0,68 (ryc. 1). Zmiany miąższowe i śródmiąższowe o charakterze zapalnym w płucach występowały u 13 pacjentów, a u 7 – cechy zastoju w krążeniu płucnym. Ponadto u 12 dzieci obecny był płyn w opłucnej, który u 4 wymagał ewakuacji ze względu na jego dużą ilość.
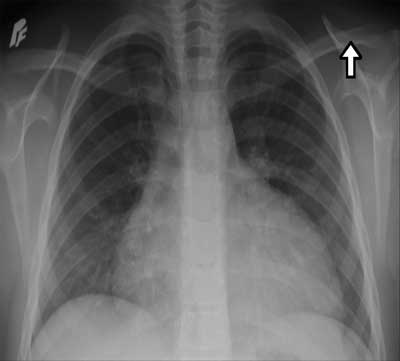
Ryc. 1. Obraz radiologiczny klatki piersiowej u pacjenta z wysiękowym zapaleniem osierdzia: znacznie powiększona sylwetka serca z powodu nagromadzenia płynu w osierdziu; typowy kształt serca przypominający karafkę.
Zmiany w zapisie EKG stwierdzono u 27 pacjentów, przy czym typowe dla ZO uniesienie odcinka ST-T w większości odprowadzeń występowało u 13 dzieci (ryc. 2). Inne nieprawidłowości w zapisie EKG to: tachykardia zatokowa u 21 badanych, niski woltaż zespołów QRS u 12, zaburzenia okresu repolaryzacji pod postacią płaskich lub dodatnio ujemnych załamków T u 23 pacjentów. U 3 dzieci stwierdzono ponadto cechy przerostu i przeciążenia lewej komory (LV). U wszystkich pacjentów obserwowano ewolucję zapisu EKG polegającą na wzroście amplitudy zespołów QRS i stopniowej normalizacji odcinka ST i załamka T w okresie 2-6 tygodni od rozpoczęcia leczenia, w miarę poprawy stanu pacjentów i zmniejszenia się ilości płynu w osierdziu. Należy jednak zauważyć, że u 13 (32%) pacjentów zapis EKG nie wykazywał nieprawidłowości.
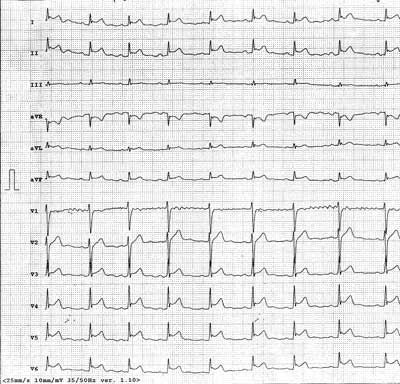
Ryc. 2. Zapis elektrokardiograficzny u pacjenta z ostrym zapaleniem osierdzia, widoczne uniesienie odcinka ST-T w większości odprowadzeń.
Badanie echokardiograficzne wykonane po przyjęciu do Kliniki wykazało u wszystkich pacjentów obecność płynu w worku osierdziowym o grubości warstwy od 3 do 50 mm, w tym u 13 powyżej 20 mm (ryc. 3A, B). Płyn był zlokalizowany głównie przy prawej komorze i prawym przedsionku, zwykle w mniejszych ilościach przy komorze lewej. U 16 pacjentów w płynie uwidaczniano liczne nitki włóknika, w tym u 2 jego znaczną ilość wypełniającą dużą część worka osierdziowego. Echokardiograficzne cechy tamponady serca pod postacią zapadania się ściany prawego przedsionka i prawej komory, „swinging heart” i zaburzenia czynności rozkurczowej serca stwierdzono u 13 dzieci.
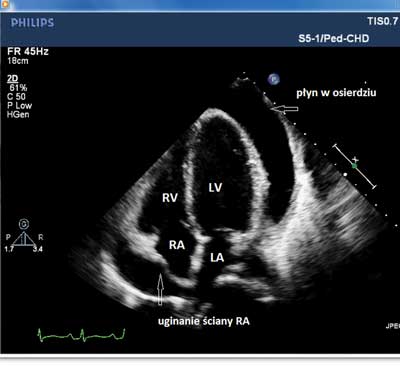
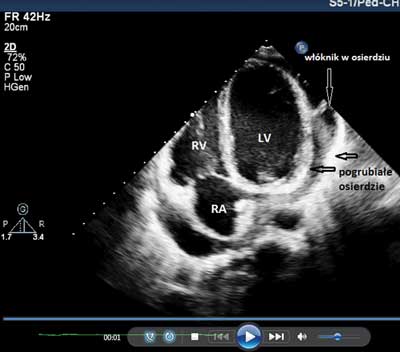
Ryc. 3. Obraz echokardiograficzny wysiękowego zapalenia osierdzia. A. Widoczna duża ilość płynu w worku osierdziowym i uginanie się ściany prawego przedsionka i w mniejszym stopniu prawej komory z powodu podwyższonego ciśnienia w osierdziu. B. Płyn z włóknikiem w osierdziu, pogrubiałe, hiperechogenne blaszki osierdzia (czarne strzałki).
RA – prawy przedsionek, RV – prawa komora, LA – lewy przedsionek, LV – lewa komora
Czynność skurczowa lewej komory u większości dzieci była prawidłowa, jedynie u 8 stwierdzono nieznaczne obniżenie frakcji wyrzutowej (EF 40-55%) i frakcji skracania włókien okrężnych (SF 20-25%). W grupie bez zaburzeń czynności skurczowej EF i SF wynosiły odpowiednio 55-85% i 28-50%. U 3 pacjentów z upośledzoną czynnością skurczową obraz echokardiograficzny wskazywał na kardiomiopatię rozstrzeniową lewej komory.
Ponadto u 2 dzieci w wieku 2 lat i 2 miesięcy stwierdzono wegetacje na zastawce aortalnej i mitralnej, co było podstawą do rozpoznania zapalenia wsierdzia. U jednego z tych dzieci doszło w trakcie hospitalizacji do powstania ropnia pierścienia aortalnego.
Etiologię ZO na podstawie obrazu klinicznego i wyników badań dodatkowych ustalono u 20 pacjentów. U 10 dzieci stwierdzono etiologię wirusową ZO (w tym u 2 współistniejące zapalenie mięśnia sercowego), u 3 bakteryjną, u 4 ZO o podłożu immunologicznym, w tym u 2 w przebiegu tocznia układowego, u jednego dziecka pourazowe ZO. U jednego pacjenta przyczyną była mocznica w przebiegu niewydolności nerek, a u innego niedoczynność tarczycy.
U 20 pacjentów (50%) nie ustalono etiologii i rozpoznano idiopatyczne ZO. Na podstawie wywiadów (przebyta infekcja dróg oddechowych o prawdopodobnej etiologii wirusowej) oraz łagodnego przebiegu schorzenia podejrzewano u tych pacjentów ostre wysiękowe wirusowe ZO.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Imazio M, Gaita F: Diagnosis and treatment of pericarditis. Heart 2015; 101: 1159-1168. 2. Little WC, Freeman GL: Pericardial disease. Circulation 2006; 113: 1622-1632. 3. Troughton RW, Aster CR, Klein AL: Pericarditis. Lancet 2004; 363: 717-727. 4. Ziółkowska L, Tężyńska I, Kawalec W, Turska-Kmieć A: Standardy postępowania diagnostycznego w wysiękowym zapaleniu osierdzia u dzieci. Stand Med 2008; 5: 2-4. 5. Adler Y, Charron P, Imazio M et al.: 2015 ESC Guidelines for the diagnosis and management of pericardial diseases: The Task Force for the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology (ESC). Endorsed by: The European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2015; 36(42): 2921-2964. 6. Shakti D, Hehn R, Gauvreau K et al.: Idiopathic pericarditis and pericardial effusion in children: contemporary epidemiology and management. J Am Heart Assoc 2014; 3(6): e0011483. 7. Gaspari S, Marsili M, Imazio M, Brucato A: New insights in the pathogenesis and therapy of idiopathic recurrent pericarditis in children. Clin Exp Rheumatol 2013; 31: 788-794. 8. Imazio M: Contemporary management of pericardial diseases. Curr Opin Cardiol 2012; 27: 308-317. 9. Imazio M, Brucato A, Cemin R et al.: A randomized trial of colchicine for acute pericarditis. N Eng J Med 2013; 369: 1522-1528. 10. Augustn P, Desmard M, Mordant P et al.: Clinical reviev: Intrapericardial fibrinolysis in management of purulent pericarditis. Critical Care 2011; 15: 220.




