*Tomasz Songin
Endometrioza głęboko naciekająca przegrody odbytniczo-pochwowej – problem interdyscyplinarny
Deep infiltrating endometriosis of the rectovaginal septum ? an interdisciplinary problem
Miracolo Clinic ? Endometriosis Treatment Centre, Warsaw
Streszczenie
Endometrioza polega na ektopowym występowaniu nabłonka gruczołowego jamy macicy, który może naciekać wszystkie narządy jamy otrzewnowej oraz w rzadszych przypadkach odleglejsze lokalizacje. Jedną z jej najcięższych postaci jest endometrioza głęboko naciekająca przegrody odbytniczo-pochwowej. W tym przypadku naciek może obejmować pochwę, macicę, odbytnicę, a także okolicę zwieraczy odbytu i mięśni dna miednicy. Taki stan będzie powodował liczne dolegliwości bólowe, w tym dyspareunie, dyschezje oraz inne objawy jelitowe, znacząco obniżając komfort życia kobiety. W diagnostyce ważną rolę pełni badanie zestawione przezpochwowe i przezodbytnicze, poprzedzone wnikliwym wywiadem. Wśród badań dodatkowych zaleca się wykonanie USG przezpochwowego, przezodbytniczego oraz MRI, których czułość i specyficzność wynosić może nawet odpowiednio 91 i 98%. Połączenie tych metod w sposób istotny zwiększa odsetek rozpoznań, skracając czas do rozpoczęcia leczenia, który obecnie wynosi średnio 7 lat. Wśród głównych metod leczniczych możemy wymienić farmakoterapię oraz leczenie operacyjne wspomagane odpowiednią dietą, fizjoterapią i psychoterapią. Włączenie leczenia hormonalnego znacząco redukuje ból, przyczyniając się do poprawy komfortu życia, przy jednoczesnych niewielkich zmianach wielkości ognisk, co wiąże się z nawrotem dolegliwości po odstawieniu leków. Metody operacyjne umożliwiają radykalną resekcję zmian, lecz mogą powodować istotne powikłania, wpływając na funkcję jelita, pęcherza moczowego, zwieraczy odbytu oraz innych narządów. W każdym przypadku wybór optymalnej metody leczenia powinien być podejmowany indywidualnie w oparciu o doświadczenie zespołu wielospecjalistycznego.
Summary
Endometriosis refers to the ectopic localization of the uterine glandular epithelium, which can infiltrate all peritoneal cavity organs as well as, though less commonly, distant locations. One of its most severe forms is deep infiltrating endometriosis (DIE) of the rectovaginal septum. In cases of DIE, the infiltration may involve the vagina, uterus, rectum, and the area of anal sphincters and pelvic floor muscles. The condition causes a variety of pain symptoms, including dyspareunia and dyschezia, and other intestinal complaints, significantly impairing the quality of a woman’s life. Important elements of the diagnostic work-up include obtaining the patient’s detailed history followed by transvaginal and transrectal examinations. Additional examinations recommended in patient assessment are transvaginal and transrectal ultrasonography, and MRI. The sensitivity and specificity of the methods may reach 91 and 98%, respectively. The combination of these diagnostic modalities significantly increases the rate of diagnosis, reducing the time to the start of treatment which, at present, is on average 7 years. The main management methods for DIE include pharmacotherapy and surgical treatment complemented by an appropriate diet, physiotherapy and psychotherapy. Hormone treatment markedly reduces pain, contributing to an improvement in the quality of life, and causes slight changes in the size of endometriotic lesions, which is associated with the relapse of symptoms after the discontinuation of medication. Surgical methods allow radical removal of lesions, but may cause significant complications, adversely affecting the function of the intestine, bladder, anal sphincters, and other body organs. In each case, the choice of optimum treatment should be adjusted individually to the patient based on the experience of the multidisciplinary team.

Endometrioza to przewlekły, nieuleczalny, ektopowy rozrost tkanki gruczołowej błony śluzowej jamy macicy. Do chwili obecnej nie wyjaśniono ostatecznie etiopatogenezy tej choroby, a teorie jej powstawania skupiają się na procesie metaplazji oraz wszczepiania migrujących komórek endometrium przy towarzyszącej dysfunkcji układu immunologicznego. W zdecydowanej większości problem dotyczy głównie narządu rodnego, jednak bezpośrednia bliskość istotnych narządów w miednicy mniejszej oraz charakter jej rozprzestrzeniania się powodują, że staje się ona problemem nie tylko ginekologa, ale także chirurga, proktologa i urologa. Częstość występowania endometriozy wśród kobiet w wieku rozrodczym szacowana jest na około 10%, co sprawia, że będą one stanowić dużą część pacjentów zarówno ambulatoryjnych, jak i szpitalnych tych specjalistów. Jednak ze względu na niejednoznaczne objawy oraz trudności w diagnostyce obrazowej, niejednokrotnie stawiane jest złe rozpoznanie, a pacjentki są odsyłane między specjalistami, co wydłuża nawet do 7 lat czas rozpoczęcia odpowiedniego leczenia. Jedną z najcięższych form endometriozy jest jej postać głęboko naciekająca, zajmująca przegrodę odbytniczo-pochwową, co jest tematem niniejszego opracowania.
Definicja endometriozy głęboko naciekającej mówi o 5-mm nacieku tkanki endometrialnej pod otrzewną. Ze względu na różnice w budowie, formie, a także aktywności, w latach 90. ogniska endometriozy miednicy mniejszej zostały podzielone na trzy grupy: postać otrzewnową, jajnikową i głęboko naciekającą ? w tym przypadku odbytniczo-pochwową, która może wnikać w przegrodę o tej samej nazwie (ang. rectovaginal septum ? RVS) (1, 2). Obraz histopatologiczny endometriozy odbytniczo-pochwowej, będący m.in. podstawą powyższego podziału, składa się głównie z tkanki mięśni gładkich oraz tkanki włóknistej, a w mniejszym stopniu tkanki gruczołowej (3). Taki skład tkankowy jest powodem formowania się twardych, wyczuwalnych palcem guzków tej okolicy. Różnice są widoczne także w aktywności wydzielniczej nabłonka gruczołowego, który w tej lokalizacji nie wykazuje typowych zmian w II fazie cyklu lub przebiegają one niekompletnie. Powyższe obserwacje były powodem nazwania tych guzków adenomiozą przegrody odbytniczo-pochwowej (2, 4). I choć nadal trwa dyskusja na temat pochodzenia i mechanizmów formowania się tych zmian, wszyscy są zgodni co do odmienności endometriozy tej okolicy w stosunku do ognisk otrzewnowych i jajnikowych. Współistnienie tych ognisk nie jest konieczne, dlatego obraz kliniczny endometriozy w miednicy mniejszej może być bardzo zróżnicowany. Obecność ognisk głęboko naciekających szacuje się na około 1-2% (5). Wartość ta może być jednak niedoszacowana, ze względu na pozornie niegroźny obraz makroskopowy niektórych ognisk (objaw „góry lodowej” ? widzimy tylko czubek) (ryc. 1) i często towarzyszący im rozległy proces zrostowy (ryc. 2), co powoduje niejednokrotnie „pomijanie” ich w trakcie inspekcji jamy otrzewnowej.
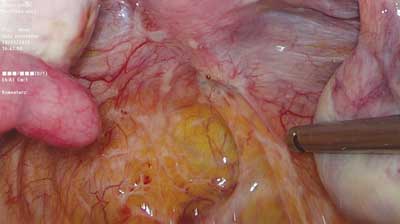
Ryc. 1. Niewinnie wyglądające ognisko endometriozy głęboko naciekające prawe więzadło krzyżowo-maciczne oraz wnikające do RVS i pochwy (fot. Miracolo Clinic)
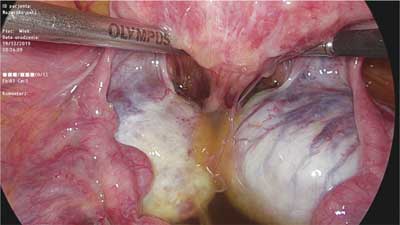
Ryc. 2. Zaawansowany proces zrostowy obejmujący tylną ścianę macicy, jajniki i odbytnicę, zamykający dostęp do zatoki Douglasa (fot. Miracolo Clinic)
Przestrzeń odbytniczo-pochwowa rozciąga się od dna zagłębienia odbytniczo-macicznego (inaczej zatoki Douglasa) i sięga do środka ścięgnistego krocza, przebiegając między tylną ścianą pochwy a przednią ścianą odbytnicy. W płaszczyźnie strzałkowej można ją podzielić na mniej więcej trzy równe części, różniące się od siebie obecnością przebiegających w nich struktur, takich jak: tkanka łączna, nerwy i naczynia. Według wielu autorów, w analogi do podobnej tkanki obecnej u mężczyzn, w przestrzeni tej przebiega niezależna struktura łącznotkankowa o nazwie przegrody odbytniczo-pochwowej (RVS). Druga grupa autorów podważa jej istnienie, interpretując obecność tkanki łącznej w tej okolicy jako fragmentu struktur ją otaczających, czyli odbytnicy i pochwy, czasami uzasadniając jej powstanie w odpowiedzi na otaczające napięcie (6). Przegroda składa się z dwóch blaszek, których górna 1/3 długości, rozpoczynająca się w okolicy otrzewnej zatoki Douglasa, stanowi najcieńszy jej fragment, predysponując do powstawania enterocoele. Przechodząc ku dołowi, w swej 1/3 środkowej części staje się najgrubsza, a następnie ścieńcza się ponownie, kończąc się w tkance środka ścięgnistego. Przegroda nie posiada żadnych bocznych granic, przechodząc na boczną ścianę pochwy w swej przedniej części oraz na odbytnicę w części tylnej. Jej znaczenie i funkcja również pozostają niejednoznaczne. Stosunkowo słaba struktura, szczególnie poza częścią centralną, powoduje, że funkcja utrzymująca statykę pochwy i odbytu jest kwestionowana, sprowadzając ją do roli podtrzymującej naczyń i nerwów zaopatrujących okoliczne struktury. Kolejnym ważnym, z punktu widzenia rozwoju endometriozy, elementem jest obecność tkanki mięśni gładkich w obrębie przegrody. W wyniku badań immunohistochemicznych obecność tych włókien została potwierdzona, choć istnieją doniesienia negujące ten stan (3, 7).
Rozwój endometriozy w przegrodzie odbytniczo-pochwowej (RVS) może przebiegać na jednym z jej końców. Izolowany naciek na przegrodę jest rzadki i najczęściej zajęte są też sąsiadujące z nią struktury, czyli szyjka macicy, pochwa, odbytnica, a także więzadła krzyżowo-maciczne i szerokie macicy. Do inwazji w dolną partię przegrody dochodzi poprzez uszkodzone tkanki krocza i pochwy. Choć najczęściej przyczynia się do tego uraz okołoporodowy, w literaturze opisywane są przypadki wszczepów niezwiązanych z porodem (8). W tej okolicy, poza zajęciem pochwy lub odbytnicy, dojść może do nacieku na mięsień zwieracz odbytu, a także na sąsiadujące mięśnie przepony dna miednicy.
Objawy
Obecność i nasilenie objawów związanych z endometriozą przegrody odbytniczo-pochwowej w dużej mierze zależy od lokalizacji, wielkości i głębokości naciekania jej ognisk. Czasami ogniska zlokalizowane w tym samym miejscu mogą dawać objawy u niektórych pacjentek, podczas gdy część z nich może nie odczuwać żadnych dolegliwości. Współistnienie adenomiozy, endometriozy otrzewnowej, a także głęboko naciekającej o innej lokalizacji (pęcherza, bocznej ściany miednicy mniejszej, jelita) będzie nasilało dolegliwości bólowe. Na potrzeby tej publikacji można je podzielić na dwie części ? dolną i górną. Endometrioza dolnego odcinka przegrody w okolicy zwieraczy odbytu i wejścia do pochwy będzie głównie objawiać się bólem krocza w rzucie blizny po episiotomii, bólem przy defekacji, podczas stosunku (dyspareunia płytka) oraz obecnością tkliwego palpacyjnie guzka okolicy rany po episiotomii, który może się pojawiać i znikać w zależności od fazy cyklu. Poza bólem, wśród objawów wymienić możemy: cykliczne krwawienia, dysfunkcje zwieraczy i zmiany charakteru stolca. W przypadku lokalizacji w górnej części przegrody głównymi objawami będą: dyspareunia głęboka, dyschezja oraz obecność tkliwych palpacyjnie guzków tylnego sklepienia pochwy, które mogą zajmować całą jej szerokość, naciekać na szyjkę macicy oraz na odbytnicę. W zależności od stopnia naciekania na jelito mogą pojawić się objawy niedrożności oraz krwawienia z przewodu pokarmowego. Często obecne są także uogólnione objawy jelita drażliwego. W każdym z powyższych przypadków tym specyficznym objawom mogą towarzyszyć inne dolegliwości. Najczęstszym objawem jest ból, który głównie pojawia się podczas miesiączki, ale także niejednokrotnie dotyczy całego cyklu lub wręcz może nasilać się podczas owulacji. Kolejnymi ważnymi objawami są obfite krwawienia miesiączkowe, niepłodność oraz współistniejące torbiele jajników. Gdy nacieki obejmują pęcherz moczowy, mogą spowodować dysurię, hematurię lub objawy pęcherza nadreaktywnego. Czasami symptomy endometriozy miednicy mniejszej mogą rzutować na sąsiadujące struktury, symulując dysfunkcje innych narządów, jak np. w przypadku bólu stawu biodrowego lub okolicy krzyżowo-lędźwiowej. Cykliczny ból w klatce piersiowej i szczytach płuc może również oznaczać obecność endometriozy w opłucnej lub na przeponie. Pozostaje również duże spektrum dolegliwości bólowych niewywołanych bezpośrednią obecnością ognisk na danym narządzie, a spowodowanych krążącymi w krwiobiegu mediatorami stanu zapalnego i bólu lub naciekaniem dróg przewodzenia nerwowego.
Diagnostyka
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Nisolle M, Donnez J: Peritoneal endometriosis, ovarian endometriosis, and adenomyotic nodules of the rectovaginal septum are three different entities. Fertil Steril 1997; 68: 585-596.
2. Koninckx PR, Martin D: Deep endometriosis: a consequence of infiltration or retraction or possibly adenomyosis externa? Fertil Steril 1992; 58: 924-928.
3. Itoga T, Matsumoto T, Takeuchi H et al.: Fibrosis and smooth muscle metaplasia in rectovaginal endometriosis. Pathol Int 2003; 53(6): 371-375.
4. Gordts S, Koninckx P, Brosens I: Pathogenesis of deep endometriosis. Fertil Steril 2017; 108(6): 872-885.
5. Koninckx PR, Ussia A, Adamyan L et al.: Deep endometriosis: definition, diagnosis, and treatment. Fertil Steril 2012; 98(3): 564-571.
6. Dariane C, Moszkowicz D, Peschaud F: Concepts of the rectovaginal septum: implications for function and surgery. Int Urogynecol J 2016; 27(6): 839-848.
7. Nagata I, Murakami G, Suzuki D et al.: Histological features of the rectovaginal septum in elderly women and a proposal for posterior vaginal defect repair. Int Urogynecol J Pelvic Floor Dysfunct 2007; 18(8): 863-868.
8. Nasu K, Okamoto M, Nishida M, Narahara H: Endometriosis of the perineum. J Obstet Gynaecol Res 2013; 39(5): 1095-1097.
9. Nnoaham KE, Hummelshoj L, Webster P et al.: Impact of endometriosis on quality of life and work productivity: a multicenter study across ten countries. Fertil Steril 2011; 96: 366-373.
10. Shigesi N, Kvaskoff M, Kirtley S et al.: The association between endometriosis and autoimmune diseases: a systematic review and meta-analysis. Hum Reprod Update 2019; 25(4): 486-503.
11. Khizroeva J, Nalli C, Bitsadze V et al.: Infertility in women with systemic autoimmune diseases. Best Pract Res Clin Endocrinol Metab 2019: 101369.
12. Moen MH, Magnus P: The familial risk of endometriosis. Acta Obstet Gynecol Scand 1993; 72(7): 560-564.
13. Ballard KD, Seaman HE, De Vries CS, Wright JT: Can symptomatology help in the diagnosis of endometriosis? Findings from a national case-control study ? part 1. Br J Obstet Gynecol 2008; 115: 1382-1391.
14. Nnoaham KE, Hummelshoj L, Kennedy SH et al.; World Endometriosis Research Foundation Women’s Health Symptom Survey Consortium: Developing symptom-based predictive models of endometriosis as a clinical screening tool: results from a multicenter study. Fertil Steril 2012; 98: 692-701.
15. Hudelist G, Ballard K, English J et al.: Transvaginal sonography vs. clinical examination in the preoperative diagnosis of deep infiltrating endometriosis. Ultrasound Obstet Gynecol 2011; 37(4): 480-487.
16. Zhu L, Lang J, Wang H et al.: Presentation and management of perineal endometriosis. Int J Gynaecol Obstet 2009; 105: 230-232.
17. Guerriero S, Ajossa S, Orozco R et al.: Accuracy of transvaginal ultrasound for diagnosis of deep endometriosis in the rectosigmoid: systematic review and meta-analysis. Ultrasound Obstet Gynecol 2016; 47: 281.
18. Hudelist G, English J, Thomas AE et al.: Diagnostic accuracy of transvaginal ultrasound for noninvasive diagnosis of bowel endometriosis: systematic review and meta-analysis. Ultrasound Obstet Gynecol 2011; 37: 257.
19. Tammaa A, Fritzer N, Strunk G et al.: Learning curve for the detection of pouch of Douglas obliteration and deep infiltrating endometriosis of the rectum. Hum Reprod 2014; 29(6): 1199-1204.
20. Guerriero S, Condous G, van den Bosch T et al.: Systematic approach to sonographic evaluation of the pelvis in women with suspected endometriosis, including terms, definitions and measurements: a consensus opinion from the International Deep Endometriosis Analysis (IDEA) group. Ultrasound Obstet Gynecol 2016; 48(3): 318-332.
21. Bazot M, Bharwani N, Huchon C et al.: European society of urogenital radiology (ESUR) guidelines: MR imaging of pelvic endometriosis. Eur Radiol 2017; 27: 2765-2775.
22. Fernando S, Soh PQ, Cooper M et al.: Reliability of visual diagnosis of endometriosis. J Minim Invasive Gynecol 2013; 20: 783-789.
23. Menakaya UA, Rombauts L, Johnson NP: Diagnostic laparoscopy in pre-surgical planning for higher stage endometriosis: Is it still relevant? Aust N Z J Obstet Gynaecol 2016; 56(5): 518-522.
24. Okaro E, Condous G, Khalid A et al.: The use of ultrasound based “soft markers” for the prediction of pelvic pathology in women with chronic pelvic pain ? can we reduce the need for laparoscopy? BJOG 2006; 113: 251-256.
25. Menakaya UA, Reid S, Lu C et al.: Performance of an ultrasound based endometriosis staging system (UBESS) for predicting the level of complexity of laparoscopic surgery for endometriosis. Ultrasound Obstet Gynecol 2016; 48(6): 786-795.
26. Catania G, Puleo C, Card? F et al.: Malignant schwannoma of the rectum: a clinical and pathological contribution. Chir Ital 2001; 53(6): 873-877.
27. Bohlok A, El Khoury M, Bormans A et al.: Schwannoma of the colon and rectum: a systematic literature review. World J Surg Oncol 2018; 16(1): 125.
28. Rodrigues BD, Alves MC, da Silva AL, Reis IG: Perianal endometriosis mimicking recurrent perianal abscess: case report and literature review. Int J Colorectal Dis 2016; 31(7): 1385-1386.
29. Miettinen M, Furlong M, Sarlomo-Rikala M et al.: Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the rectum and anus: a clinicopathologic, immunohistochemical, and molecular genetic study of 144 cases. Am J Surg Pathol 2001; 25(9): 1121-1133.
30. Farley J, O’Boyle JD, Heaton J, Remmenga S: Extraosseous Ewing sarcoma of the vagina. Obstet Gynecol 2000; 96(5 Pt 2): 832-834.
31. Lam MM, Corless CL, Goldblum JR et al.: Extragastrointestinal stromal tumors presenting as vulvovaginal/rectovaginal septal masses: a diagnostic pitfall. Int J Gynecol Pathol 2006; 25(3): 288-292.
32. Yazbeck C, Poncelet C, Chosidow D, Madelenat P: Primary adenocarcinoma arising from endometriosis of the rectovaginal septum: a case report. Int J Gynecol Cancer 2005; 15(6): 1203-1205.
33. Ulrich U, Rhiem K, Kaminski M et al.: Parametrial and rectovaginal adenocarcinoma arising from endometriosis. Int J Gynecol Cancer 2005; 15(6): 1206-1209.
34. Fujimoto T, Tanuma F, Otsuka N, Kataoka S: Laparoscopic posterior pelvic exenteration for primary adenocarcinoma of the rectovaginal septum without associated endometriosis: A case report. Mol Clin Oncol 2019; 10(1): 92-96.
35. Dunselman GA, Vermeulen N, Becker C et al.: ESHRE guideline: management of women with endometriosis. European Society of Human Reproduction and Embryology. Hum Reprod 2014; 29(3): 400-412.
36. Diagnosis and management of endometriosis: summary of NICE guidance. BMJ 2017; 358: j4227
37. Barra F, Scala C, Maggiore ULR, Ferrero S: Long-Term Administration of Dienogest for the Treatment of Pain and Intestinal Symptoms in Patients with Rectosigmoid Endometriosis. J Clin Med 2020; 9(1).
38. Morotti M, Venturini PL, Biscaldi E et al.: Efficacy and acceptability of long?term norethindrone acetate for the treatment of rectovaginal endometriosis. Eur J Obstet Gynecol Reprod Biol 2017; 213: 4-10.
39. Remorgida V, Ferrero S, Fulcheri E et al.: Bowel endometriosis: presentation, diagnosis and treatment. Obstet Gynecol Surv 2007; 62: 461-470.
40. Roman H, Rozsnayi F, Puscasiu L et al.: Complications associated with two laparoscopic procedures used in the management of rectal endometriosis. JSLS 2010; 14(2): 169-77.
41. Darwish B, Roman H: Surgical treatment of deep infiltrating rectal endometriosis: in favor of less aggressive surgery. Am J Obstet Gynecol 2016; 215(2): 195-200.
42. Redwine DB, Koning M, Sharpe DR: Laparoscopically assisted transvaginal segmental resection of the rectosigmoid colon for endometriosis. Fertil Steril 1996; 65(1): 193-197.
43. Chapron C, Jacob S, Dubuisson JB et al.: Laparoscopically assisted vaginal management of deep endometriosis infiltrating the rectovaginal septum. Acta Obstet Gynecol Scand 2001; 80(4): 349-354.
44. Chen N, Zhu L, Lang J et al.: The clinical features and management of perineal endometriosis with anal sphincter involvement: a clinical analysis of 31 cases. Hum Reprod 2012; 27(6): 1624-1627.



