*Halina Ekiert, Agnieszka Kulig, Marta Klimek-Szczykutowicz, Agnieszka Szopa
Nowe surowce roślinne w Farmakopei Europejskiej. Cz. 8. Camellia sinensis (L.) Kuntze (Herbata chińska) – źródło surowca katechinowo-alkaloidowego
The new plant raw materials in the European Pharmacopoeia. Part 8. Camellia sinensis (L.) Kuntze (Chinese tea) – the source of catechin – alkaloid raw material
Katedra i Zakład Botaniki Farmaceutycznej, Wydział Farmaceutyczny, Uniwersytet Jagielloński – Collegium Medicum, Kraków
Kierownik Katedry i Zakładu: prof. dr hab. n. farm. Halina Ekiert
Streszczenie
W Suplemencie 9.4 do Farmakopei Europejskiej, jednym z najnowszych dokumentów farmakopealnych, figuruje 8 nowych monografii surowców pochodzenia roślinnego. Są to surowce pozyskiwane zarówno z gatunków roślin wschodnio-azjatyckich, jak i południowoamerykańskich. Dwie pierwsze części serii artykułów poświęcono charakterystyce roślin będących źródłem surowców saponinowych – Bupleurum sp. i Platycodon grandiflorus. W częściach 3-5 opisano wschodnio-azjatyckie gatunki – Ligusticum huanxiong, Houttuynia cordata i Paeonia x suffruticosa, dostarczające odpowiednio surowca olejkowego, flawonoidowego i terpenoidowo-fenolowego. W częściach 6 i 7 przedstawiono dwa południowo-amerykańskie gatunki alkaloidowe – Paullinia cupana i Ilex paraguariensis.
W części 8 zaplanowano przedstawienie Camellia sinensis, jako źródła Camelliae sinensis non fermentata folia. Surowiec ten jest bogatym źródłem polifenoli – katechin (m.in. galusanów epigallokatechiny, gallokatechiny i epikatechiny), alkaloidów purynowych (głównie kofeiny) oraz unikalnego nieproteinogennego aminokwasu – teaniny. Udowodniono, że surowiec wykazuje m.in. właściwości antyoksydacyjne, przeciwnowotworowe, przeciwdrobnoustrojowe, hipolipemiczne i hipocholesterolemiczne, hepatoprotekcyjne i przeciwcukrzycowe. Celem artykułu jest zwrócenie uwagi środowiska farmaceutyczno-medycznego na liczne walory terapeutyczne, prozdrowotne i kosmetyczne surowca, udowodnione profesjonalnymi badaniami naukowymi.
Summary
In Supplement 9.4 to the European Pharmacopoeia, one of the newest pharmacopoeial documents, there are eight new monographs raw materials of plant origin. They are derived from both East Asian and South American species.
The first two parts of the series of articles are devoted to the characteristics of plants, which are a source of saponin raw materials: Bupleurum sp. and Platycodon grandiflorus. The next parts: 3, 4 and 5 describe the East Asian species: Ligusticum huanxiong, Houttuynia cordata and Paeonia x suffruticosa, which provide raw materials rich in volatile oil, flavonoids and terpenoid-phenolic compounds, respectively. Two South American alkaloid-rich species: Paullinia cupana and Ilex paraguariensis are presented in parts 6 and 7. Part 8 characterizes Camellia sinensis, as a source of Camelliae sinensis non fermentata folia. This raw material is a rich source of polyphenols: catechins (e.g. epigallocatechin, gallocatechin and epicatechin gallates), purine alkaloids (mostly caffeine) and a unique non-protein amino acid, theanine. It has been proven that the raw material possesses among others a number of medicinal properties, including antioxidant, anticancer, antimicrobial, hypolipemic, hypocholesterolemic, hepatoprotective and antidiabetic properties. The aim of the present article is to draw attention of pharmaceutical and medical community to the numerous therapeutic, health-promoting and cosmetic values of this raw material proven by professional scientific studies.

Wstęp
W Suplemencie 9.4 do Farmakopei Europejskiej (1) – jednym z najnowszych dokumentów farmakopealnych oraz w jego tłumaczeniu na język polski wraz z Suplementami 9.3 i 9.5 – w Suplemencie 2018 do XI wydania Farmakopei Polskiej (2) figuruje 8 nowych monografii surowców pochodzenia roślinnego. Są to surowce pozyskiwane zarówno z gatunków roślin wschodnio-azjatyckich, jak i południowo-amerykańskich.
Dwie pierwsze części serii artykułów (3, 4) poświęcono charakterystyce roślin będących źródłem surowców saponinowych – Bupleurum sp. (Przewiercień) i Platycodon grandiflorus (Rozwar wielkokwiatowy). W częściach 3-5 (5-7) przedstawiono charakterystykę Ligusticum chuanxiong (Podagrycznika chińskiego), Houttuynia cordata (Pstrolistki sercowatej) i hybrydy – Paeonia × suffruticosa (Piwonii (Peonii) drzewiastej), roślin dostarczających odpowiednio surowca olejkowego, flawonoidowego i terpenoidowo-fenolowego. Wymienione gatunki roślin od dawna są znane i wykorzystywane w tradycyjnej medycynie chińskiej (TCM).
Kolejne gatunki roślin farmakopealnych scharakteryzowane w częściach 6 i 7 serii artykułów (8, 9) to rośliny powszechnie znane w ogólnoświatowym lecznictwie – dwa gatunki południowo-amerykańskie – Paullinia cupana (P. guarana) i Ilex paraguariensis, będące źródłem surowców alkaloidowych.
W części 8 zdecydowano zaprezentować Camellia sinensis (herbatę chińską), jako źródło surowca katechinowo-alkaloidowego – niefermentowanego liścia zielonej herbaty. W artykule przedstawiono właściwości lecznicze i prozdrowotne tego surowca, udowodnione badaniami naukowymi.
Celem artykułu jest zwrócenie uwagi środowiska farmaceutyczno-medycznego na liczne, nie do końca znane, walory lecznicze, prozdrowotne i kosmetyczne tego surowca.
Camellia sinensis – informacje ogólne
Camellia sinensis (L.) Kuntze należy do rodziny Theaceae (Herbatowate) i występuje pod wieloma łacińskimi nazwami synonimowymi, m.in.: C. arborescens Hung T. Chang & F.L. Yu, C. chinensis (Sims) Kuntze, C. thea Link, C. viridis Sweet, Thea bohea L., T. chinensis Sims czy też Theaphylla cantonensis (Lour.) Raf. (10). W Polsce gatunek nazywany jest herbatą chińską lub kamelią chińską, w innych krajach jest znany jako: green tea (ang.), Cha (chin., hind.), thè vert (fr.), Grüner Tee (niem.) (11, 12).
Pomysł użycia herbaty został po raz pierwszy zaproponowany przez chińskiego cesarza Shen Nunga w 2737 r. p.n.e., kiedy przez przypadek liście krzewu herbacianego zagotowano w wodzie, a uzyskany napój miał przyjemny zapach i smak (13). Później napar z liści herbacianych stał się popularnym napojem na całym świecie, wzrosło także zainteresowanie jego właściwościami leczniczymi (14).
Obecnie herbata jest jednym z najczęściej spożywanych napojów na świecie (15). Wyróżnia się kilka rodzajów herbaty, pochodzących z tego samego gatunku – C. sinensis: herbatę zieloną, białą, czarną, czerwoną i oolong. Różnią się one sposobem fermentacji surowca, a co za tym idzie stopniem utlenienia składników chemicznych, wyglądem, smakiem oraz aromatem. W przypadku białej herbaty, pąki liściowe i młode liście zbiera się na krótko przed pełnym otwarciem pąków, następnie pąki i liście są parzone i suszone przy minimalnej ilości przetwarzania. Z tego powodu biała herbata, w porównaniu z pozostałymi rodzajami herbat, posiada najwyższą zawartość polifenoli i najniższy poziom kofeiny. Zielona herbata jest wytwarzana przez suszenie i parowanie liści C. sinensis, aby zapobiec fermentacji, podczas gdy liście herbaty czarnej, czerwonej i oolong są całkowicie lub częściowo fermentowane (16, 17). Im wyższy stopień fermentacji, tym niższa zawartość polifenoli i wyższa zawartość kofeiny. W badaniach porównywano zawartości kofeiny i katechin (polifenoli) w herbatach z liści tej samej rośliny C. sinensis, lecz wyprodukowanych z zastosowaniem różnych procesów fermentacji. Stwierdzono, że zawartość kofeiny była największa w czarnej herbacie, natomiast poziom galusanu epigallokatechiny i sumy pozostałych badanych katechin był największy w zielonej herbacie (16, 17).
Herbata zielona i oolong są powszechnie spożywane w krajach azjatyckich, takich jak Indie, Chiny, Japonia i Tajlandia, natomiast czarna jest najbardziej popularna w krajach Europy Zachodniej (15). Obecnie C. sinensis sprzedaje się w formie suszu, pakowanego w pojedyncze torebki bądź jako herbatę sypką; z liści herbaty przygotowywane są także gotowe napoje.
Status w tradycyjnym i oficjalnym lecznictwie
C. sinensis od dawna stosowana jest w tradycyjnej medycynie chińskiej i w medycynie ajurwedyjskiej, głównie jako środek pobudzający, moczopędny, ściągający, wzmacniający pracę serca, przy wzdęciach, w celu regulacji temperatury ciała i poziomu cukru we krwi oraz dla poprawy trawienia i funkcji umysłowych (18).
W Indiach odwar z suszonych lub świeżych pąków liściowych i liści stosowano wewnętrznie w bólach głowy i gorączce oraz miejscowo, w celu zapobiegania próchnicy zębów. Natomiast świeży sok z liści wykorzystywano jako środek o działaniu poronnym, antykoncepcyjnym i hemostatycznym. W Meksyku herbata była spożywana ze względu na efekt mlekopędny, a w Tajlandii – kardio- i neurotonizujący. Z kolei w Gwatemali i Kenii używano jej miejscowo do przemywania oczu w stanach zapalnych (18).
Monografia „Camelliae sinensis non fermentata folia” (ang. green tea) po raz pierwszy pojawia się w Suplemencie 9.4 do European Pharmacopoeia 9th (1). Suplement dopuszcza do stosowania młode, niefermentowane liście C. sinensis (L.) Kuntze szybko/gwałtowanie stabilizowane przez krótkotrwałe ogrzewanie, a następnie wysuszone. Surowcem są szaro-zielone liście z usuniętym ogonkiem liściowym, zwinięte, składane lub skręcane, całe lub cięte przed zwinięciem. Surowiec powinien zawierać min. 1,5% kofeiny i min. 8,0% sumy katechin w przeliczeniu na (-)-galusan epigallokatechiny (1).
C. sinensis jako roślina lecznicza posiada monografie Europejskiej Agencji Leków (European Medicines Agency – EMA) (19). Europejski Urząd ds. Bezpieczeństwa Żywności (European Food Safety Authority – EFSA) wydał pozytywną opinię dotyczącą bezpieczeństwa stosowania herbat i suplementów diety z C. sinensis, jednak informuje też, że duże ilości konsumowanej herbaty (gdy zawartość galusanu epigallokatechiny [EGCG] przekracza 800 mg/dzień) mogą działać szkodliwie na wątrobę (zwiększenie aktywności aminotransferaz) (20). Organizacja Narodów Zjednoczonych do spraw Wyżywienia i Rolnictwa (Food and Agriculture Organization of the United Nations – FAO) również wydała pozytywną opinię dotyczącą stosowania herbaty, lecz określiła maksymalne limity zawartości pozostałości pestycydów w suszonych i fermentowanych liściach i szypułkach C. sinensis (21).
Charakterystyka botaniczno-ekologiczna
C. sinensis to wiecznie zielony krzew lub drzewo, osiągające wysokość od 1 do 5 m. Roślina posiada silny korzeń pierwotny. Liście są skórzaste, eliptyczne, odwrotnie jajowate lub eliptyczno-odwrotnie jajowate, o wymiarach 5-14 × 2-7,5 cm. Ogonek liściowy ma długość od 4 do 7 mm. Roślina posiada kwiaty męskie i żeńskie, o średnicy 2,5-4 cm, osadzone pachwinowo, pojedynczo lub do trzech w skupisku. Płatki korony kwiatów są białe, szeroko jajowate, w liczbie 6-8. Działek kielicha jest 5, pręciki są liczne. Zalążnia jest kulista, trójkomorowa. Nasiona mają kolor brązowy, a ich średnica wynosi 1-1,4 cm (16, 17, 22).
C. sinensis pochodzi z Chin, później prawdopodobnie rozprzestrzeniła się do innych krajów, tj. Indii, Korei, Japonii, Tajlandii, Wietnamu, Laosu i Birmy. Gatunek ten naturalnie rośnie w wiecznie zielonych lasach liściastych i zaroślach (16, 17, 22).
Obecnie C. sinensis uprawiana jest w ponad 30 krajach. W Polsce można ją nabyć jako roślinę doniczkową. Największymi producentami herbaty są Chiny i Indie. Jej uprawa ma jednak dość specyficzne wymagania agroklimatyczne, które są spełnione w klimatach tropikalnym i subtropikalnym, choć niektóre odmiany mogą tolerować nadmorski klimat Wielkiej Brytanii, czy obszaru Waszyngtonu w Stanach Zjednoczonych. Roślina wymaga temp. w zakresie 10-30°C, minimalnych rocznych opadów wynoszących 1250 mm, najlepiej kwaśnej gleby i nachylenia zbocza 0,5-10°. Gatunek rośnie na wysokości do 2000 m n.p.m. Jest bardzo wrażliwy na zmiany warunków wzrostu, dlatego uprawy herbaty są geograficznie ograniczone do kilku obszarów na świecie (23).
Charakterystyka fitochemiczna
Najważniejszymi aktywnymi biologicznie związkami chemicznymi C. sinensis są polifenole z grupy katechin. Głównymi związkami są: katechina (C), epikatechina (EC), gallokatechina (GC), epigallokatechina (EGC), galusan katechiny (CG), galusan epikatechiny (ECG), galusan epigallokatechiny (EGCG), galusan gallokatechiny (GCG) (ryc. 1). Ważnymi antyoksydantami z grupy flawonoidów są flawonole: kemferol, kwercetyna i mirycetyna, oraz z grupy kwasów fenolowych: kwas elagowy i kwas galusowy. W liściach C. sinensis występują też alkaloidy purynowe: kofeina, teofilina i teobromina (ryc. 2), olejek eteryczny oraz witaminy, węglowodany, lipidy, aminokwasy i biopierwiastki (tab. 1) (16, 24-26).
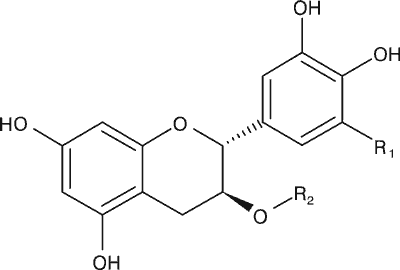
| Katechina i jej pochodne | R1 | R2 |
| (-)-katechina (C) | H | H |
| (-)-gallokatechina (GC) | OH | H |
| (-)-galusan katechiny (CG) | H | 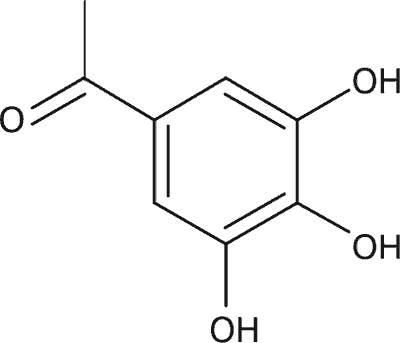 |
| (-)-galusan gallokatechiny (GCG) | OH |  |
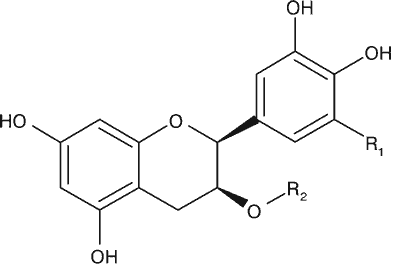
| Epikatechina i jej pochodne | R1 | R2 |
| (-)-epikatechina (EC) | H | H |
| (-)-epigallokatechina (EGC) | OH | H |
| (-)-galusan epikatechiny (ECG) | H |  |
| (-)-galusan epigallokatechiny (EGCG) | OH |  |
Ryc. 1. Struktura chemiczna katechin występujących w Camellia sinensis – katechina i jej pochodne oraz epikatechina i jej pochodne
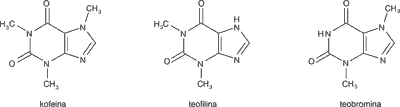
Ryc. 2. Struktura chemiczna alkaloidów purynowych występujących w Camellia sinensis
Tab. 1. Główne grupy związków chemicznych występujących w Camellia sinensis
| Grupa związków | Metabolity | Piśmiennictwo |
| Katechiny | katechina (C), epikatechina (EC), epigallokatechina (EGC), gallokatechina (GC), galusan katechiny (CG), galusan epikatechiny (ECG), galusan epigallokatechiny (EGCG), galusan gallokatechiny (GCG) | (25-27) |
| Alkaloidy purynowe | kofeina, teofilina, teobromina | (28, 29) |
| Flawonoidy (flawonole) | kemferol, kwercetyna, mirycetyna | (26, 27) |
| Kwasy fenolowe | kwas elagowy, kwas galusowy | (26, 27) |
| Aminokwasy | aminokwasy proteinogenne: arginina, glicyna, kwas asparaginowy, kwas glutaminowy, leucyna, lizyna, seryna, tryptofan, tyrozyna, walina
aminokwasy nieproteinogenne: teanina | (25, 27) |
| Węglowodany | glukoza, sacharoza, celuloza | (25) |
| Kwasy tłuszczowe | kwas linolowy, kwas α-linolenowy | (25) |
| Inne | witaminy: A, B2, B3, C, E, K
biopierwiastki: chrom (Cr), cynk (Zn), magnez (Mg), mangan (Mn), miedź (Cu), nikiel (Ni), selen (Se), wapń (Ca) |
(24, 25) |
Właściwości przeciwutleniające katechin są związane głównie z liczbą i usytuowaniem grup hydroksylowych w cząsteczkach, a w konsekwencji z wiązaniem i neutralizacją wolnych rodników przez te grupy. Badania aktywności przeciwutleniającej poszczególnych katechin wykazały różnice w sile ich działania. Związki o najwyższej i najniższej sile działania ukazuje następujący szereg: EGCG ≥ GCG ≥ ECG > EGC ≥ GC ≥ EC ≥ C. Ponadto, za kluczowy czynnik wpływający na aktywność przeciwutleniającą C. sinensis uznano zawartość cis-katechin (27).
Alkaloidy purynowe odpowiadają za działanie przeciwutleniające i psychostymulujące surowca. Ich siła działania maleje w szeregu: kofeina ≥ teofilina ≥ teobromina (28).
Wśród aminokwasów w C. sinensis głównym związkiem jest L-teanina (ryc. 3), która została odkryta w 1949 roku w liściach. L-teanina jest niebiałkowym aminokwasem, będącym unikalnym związkiem herbaty. Odpowiada za karmelowy posmak i atrakcyjny aromat, który pomaga złagodzić ściągający smak polifenoli i gorycz kofeiny. L-teanina związana jest także ze smakiem umami (często charakteryzowany jako „rosołowy”, „mięsny”, „słony, ale inny”). Efekty farmakologiczne tego związku obejmują: wpływ na komórki nowotworowe, choroby sercowo-naczyniowe, przeziębienie, otyłość, poprawę sprawności poznawczej, stanu emocjonalnego, relaksację i jakość snu (29, 30).
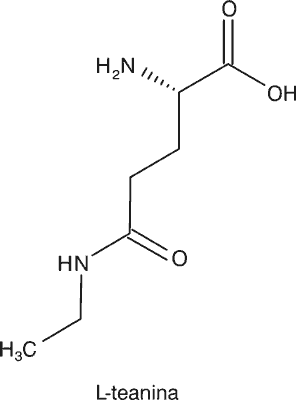
Ryc. 3. Struktura chemiczna L-teaniny, specyficznego aminokwasu nieproteinogennego, występującego w Camellia sinensis
Biosynteza teaniny odbywa się w korzeniach, liścieniach i kiełkach, skąd jest następnie transportowana do liści. Substratami wykorzystywanymi w syntezie są kwas glutaminowy i etyloamina. Po ekspozycji na światło i temperaturę teanina ulega hydrolizie. Etyloamina, która powstaje w wyniku wspomnianej reakcji, jest prekursorem katechin. W konsekwencji, herbata uprawiana w warunkach o niskim nasłonecznieniu ma wysokie stężenie teaniny, a co za tym idzie niskie stężenie katechin (29).
Zawartość L-teaniny w wysuszonej herbacie waha się od 1 do 3% i zależy od wielu czynników, m.in. strefy geograficznej, w której roślina rośnie, sposobu produkcji, czasu i techniki zbioru oraz klasy i rodzaju herbaty. C. sinensis var. sinensis ma większą zawartość tego związku w porównaniu z var. assamica. Dodatkowo, herbata zebrana na początku lata ma przypuszczalnie więcej teaniny w porównaniu z herbatą zebraną pod koniec lata (29, 30).
Aktywność biologiczna potwierdzona badaniami naukowymi
Działanie przeciwutleniające
Za działanie przeciwutleniające C. sinensis odpowiadają głównie katechiny i inne polifenole, które są dobrymi donorami elektronów i usuwają wolne rodniki (31). Ponadto mają zdolność do hamowania enzymów proutleniających i promowania przeciwutleniających (32). Aktywność przeciwutleniającą flawonoli C. sinensis zbadano z użyciem metody FRAP (ang. ferric reducing ability of plasma) (33) oraz analizą wychwytu DPPH (2,2-difenylo-1-pikrylohydrazylu) (34). Stwierdzono, że wśród pochodnych katechinowych, grupa orto-trihydroksylowa w pierścieniu B i reszta galloilowa w pozycji 3 szkieletu flawan-3-olu są najważniejszymi cechami strukturalnymi, warunkującymi zdolność do zmiatania rodnika DPPH (34). Badania wykazały, że jedna cząsteczka (+)-katechiny może wychwycić 4 cząsteczki wolnych rodników lipidowych (35), a epikatechina usuwa rodniki hydroksylowe, peroksylowe, ponadtlenkowe i rodniki DPPH (36).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. European Pharmacopoeia. 9th ed., Suplement 9.4. Council of Europe. Strasbourg 2017.
2. Farmakopea Polska. Wyd. XI. Supplement 2018. Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Warszawa 2018.
3. Ekiert H, Sondej A, Klimek-Szczykutowicz M i wsp. Nowe surowce roślinne w Farmakopei Europejskiej. Cz. 1. Gatunki rodzaju Bupleurum (Przewiercień) – źródło nowego surowca saponinowego. Post Fitoter 2018; 19(4):248-56.
4. Ekiert H, Sondej A, Klimek-Szczykutowicz M i wsp. Nowe surowce roślinne w Farmakopei Europejskiej. Cz. 2. Rozwar wielkokwiatowy (Platycodon grandiflorus) – źródło nowego surowca saponinowego. Post Fitoter 2019; 20(1):41-8.
5. Ekiert H, Sondej A, Jafernik K i wsp. Nowe surowce roślinne w Farmakopei Europejskiej. Cz. 3. Ligusticum chuanxiong (Podagrycznik chiński) – źródło nowego surowca olejkowego. Post Fitoter 2019; (2):102-10.
6. Kwiecień I, Kulig A, Szopa A i wsp. Nowe surowce roślinne w Farmakopei Europejskiej. Cz. 4. Houttuynia cordata Thunb. (Pstrolistka sercowata) – źródło nowego surowca flawonoidowego. Post Fitoter 2019; (3):186-93.
7. Ekiert H, Sondej A, Klimek-Szczykutowicz M i wsp. Nowe surowce roślinne w Farmakopei Europejskiej. Cz. 5. Paeonia × suffruticosa (Piwonia drzewiasta) – źródło nowego surowca terpenoidowo-fenolowego. Post Fitoter 2019; (4):21-31.
8. Kubica P, Kulig A, Szopa A i wsp. Nowe surowce roślinne w Farmakopei Europejskiej. Cz. 6. Paullinia cupana (P. guarana) – źródło nowego surowca alkaloidowego. Post Fitoter 2020; (1):19-27.
9. Ekiert H, Kulig A, Ekiert RJ i wsp. Nowe surowce roślinne w Farmakopei Europejskiej. Cz. 7. Ilex paraguariensis A. St.-Hil. (Ostrokrzew paragwajski) – źródło nowego surowca alkaloidowego. Post Fitoter 2020; (2):83-92.
10. The Plant List. Camellia sinensis (Online); http://www.theplantlist.org/tpl1.1/record/kew-2694880.
11. Wichtl M, Brinckmann JA, Lindenmaier MP. Green tea leaf. W: Herbal Drugs and Phytopharmaceuticals. Medpharm 2004; 605-6.
12. van Wyk BE, Wink M. Camellia sinensis. W: Rośliny lecznicze świata. MedPharm 2008; 75.
13. Taylor PW, Hamilton-Miller JMT, Stapleton PD. Antimicrobial properties of green tea catechins. Food Sci Technol Bull 2005; 2:71-81.
14. Rahman SU, Huang Y, Zhu L i wsp. Therapeutic role of green tea polyphenols in improving fertility: a review. Nutrients 2018; 10:834.
15. Shirakami Y, Shimizu M. Possible mechanisms of green tea and its constituents against cancer. Molecules 2018; 23:2284.
16. Sharangi AB. Medicinal and therapeutic potentialities of tea (Camellia sinensis L.) – a review. Food Res Int 2009; 42:529-35.
17. Namita P, Mukesh R, Vijay KJ. Camellia Sinensis (Green Tea): A Review. GJP 2012; 6:52-9.
18. Ogle N. Green tea Camellia sinensis. AJHM 2009; 21.
19. European Medicines Agency Science Medicine Health (Online); https://www.ema.europa.eu/en.
20. European Food Safety Authority (Online); http://www.efsa.europa.eu/.
21. Food and Agriculture Organization of the United Nations (Online); http://www.fao.org/home/en/.
22. Min T, Bartholomew B. Hippocastanaceae through Theaceae. Flora of China 2007; 12:376.
23. World tea production and trade. Current and future development. Rome: FAO 2015.
24. Karori SM, Wachira FN, Wanyoko JK i wsp. Antioxidant capacity of different types of tea products. Afr J Biotechnol 2007; 6:2287-96.
25. Musial C, Kuban-Jankowska A, Gorska-Ponikowska M. Beneficial properties of green tea catechins. Int J Mol Sci 2020; 21:1744.
26. Tang G-Y, Meng X, Gan R-Y i wsp. Health functions and related molecular mechanism of tea components: an update review. Int J Mol Sci 2019; 20:6196.
27. Lee LS, Kim SH, Kim YB i wsp. Quantitative analysis of major constituents in green tea with different plucking periods and their antioxidant activity. Molecules 2014; 19:9173-86.
28. Ashihara H. Metabolism of alkaloids in coffee plants. Braz J Plant Physiol 2006; 18(1):1-8.
29. Saeed M, El-Hack MEA, Alagawany M i wsp. Phytochemistry, modes of action and beneficial health applications of green tea (Camellia sinensis) in humans and animals. Int J Pharmacol 2017; 13:698-708.
30. Türközü D, Şanlier N. L-theanine, unique amino acid of tea, and its metabolism, health effects, and safety. Crit Rev Food Sci Nutr 2017; 57:1681-7.
31. Nanjo F, Honda M, Okushio K i wsp. Effects of dietary tea catechins on alpha-tocopherol levels lipid peroxidation, and erythrocyte deformability in rats fed on high palm oil and perilla oil diets. Biol Pharm Bull 1993; 16:1156-9.
32. Velayutham P, Babu A, Liu D. Green tea catechins and cardiovascular health: an update. Curr Med Chem 2008; 15:1840-50.
33. Langley-Evans SC. Antioxidant potential of green and black tea determined using the ferric reducing power (FRAP) assay. Int J Food Sci Nutr 2000; 51:181-8.
34. Nanjo F, Goto K, Seto R i wsp. Scavenging effects of tea catechins and their derivatives on 1,1-diphenyl-2-picrylhydrazyl radical. Free Radic Biol Med 1996; 21:895-902.
35. Koketsu M. Antioxidative effects of tea polyphenols. CRC Press, Boca Raton 1997; 37-50.
36. Yilmaz Y. Novel uses of catechins in foods. Trend Food Sci Technol 2006; 17:64-71.
37. Yokozawa T, Nakagawa T, Lee KI i wsp. Effects of green tea tannin on cisplatin-induced nephropathy in LLC-PK1 cells and rats. J Pharm Pharmacol 1999; 51:1325-31.
38. Bartikova H, Skalova L, Valentova K i wsp. Effect of oral administration of green tea extract in various dosage scheme on oxidative stress status of mice in vivo. Acta Pharm 2015; 65:65-73.
39. Yang CS, Wang X, Lu G i wsp. Cancer prevention by tea: animal studies: molecular mechanisms and human relevance. Nat Rev Cancer 2009; 9:429-39.
40. Kavanagh KT, Hafer LJ, Kim DW i wsp. Green tea extracts decrease carcinogen-induced mammary tumor burden in rats and rate of breast cancer cell proliferation in culture. J Cell Biochem 2001; 82:387-98.
41. Sadava D, Whitlock E, Kane SE. The green tea polyphenol: epigallocatechin-3-gallate inhibits telomerase and induces apoptosis in drug-resistant lung cancer cells. Biochem Biophys Res Commun 2007; 360:233-7.
42. Zhen M, Huang X, Wang Q i wsp. Green tea polyphenol epigallocatechin-3-gallate suppresses rat hepatic stellate cell invasion by inhibition of MMP-2 expression and its activation. Acta Pharmacol Sin 2006; 27:1600-7.
43. Baliga MS, Meleth S, Katiyar SK. Growth inhibitory and antimetastatic effect of green tea polyphenols on metastasis specific mouse mammary carcinoma 4T1 cells in vitro and in vivo systems. Clin Cancer Res 2005; 11:1918-27.
44. Liu S, Wang XJ, Liu Y i wsp. PI3K/AKT/mTOR signaling is involved in ([ndash])-epigallocatechin-3-gallate-induced apoptosis of human pancreatic carcinoma cells. Am J Chin Med 2013; 41:629-42.
45. Jankun J, Selman SH, Swiercz R i wsp. Why drinking green tea could prevent cancer. Nature 1997; 387:561.
46. Al-Hazzani AA, Alshatwi AA. Catechin hydrate inhibits proliferation and mediates apoptosis of SiHa human cervical cancer cells. Food Chem Toxicol 2011; 49:3281-6.
47. Leong H, Mathur PS, Greene GL. Green tea catechins inhibit angiogenesis through suppression of STAT3 activation. Breast Cancer Res Treat 2009; 117:505-15.
48. Li X, Feng Y, Liu J i wsp. Epigallocatechin-3 gallate inhibits IGF-I-stimulated lung cancer angiogenesis through downregulation of HIF-1 and VEGF expression. J Nutr Nutr 2013; 6(3):169-78.
49. Shirakami Y, Shimizu M, Adachi S i wsp. ([ndash])-Epigallocatechin gallate suppresses the growth of human hepatocellular carcinoma cells by inhibiting activation of the vascular endothelial growth factor-vascular endothelial growth factor receptor axis. Cancer Sci 2009; 100:1957-62.
50. Tang FY, Chiang EPI, Shih CJ. Green tea catechin inhibits ephrin-A1-mediated cell migration and angiogenesis of human umbilical vein endothelial cells. J Nutr Biochem 2007; 18:391-9.
51. Xiong LG, Chen YJ, Tong JW i wsp. Tea polyphenol epigallocatechin gallate inhibits Escherichia coli by increasing endogenous oxidative stress. Food Chem 2017; 217:196-204.
52. Yoda Y, Hu ZQ, Zhao WH i wsp. Different susceptibilities of Staphylococcus and Gram-negative rods to epigallocatechin gallate. J Infect Chemother 2004; 10:55-8.
53. Hara-Kudo Y, Yamasaki A, Sasaki M i wsp. Antibacterial action on pathogenic bacterial spore by green tea catechins. J Sci Food Agric 2005; 85:2354-61.
54. Ahn YJ, Sakanaka S, Kim MJ i wsp. Effect of green tea extract on growth of intestinal bacteria. Microb Ecol Health Dis 1990; 3:335-8.
55. Mabe K, Yamada M, Oguni I i wsp. In vitro and in vivo activities of tea catechins against Helicobacter pylori. Antimicrob Agent Chemother 1999; 43:1788-91.
56. Noormandi A, Dabaghzadeh F. Effects of green tea on Escherichia coli as auropathogen. J Tradit Complement Med 2015; 5:15-20.
57. Yasuda H, Arakawa T. Deodorizing mechanism of (–)-epigallocatechin gallate against methyl mercaptan. Biosci Biotechnol Biochem 1995; 59:1232-6.
58. Hirasawa M, Takada K, Makimura M i wsp. Improvement of periodontal status by green tea catechin using a local delivery system: a clinical pilot study. J Periodontal Res 2002; 37:433-8.
59. Otake S, Makimura M, Kuroki T i wsp. Anticaries effects of polyphenolic compounds from Japanese green tea. Caries Res 1991; 25:438-43.
60. Yamaguchi K, Honda M, Ikigai H i wsp. Inhibitory effects of ([ndash])-epigallocatechin gallate on the life cycle of human immunodeficiency virus type 1 (HIV-1). Antiviral Res 2002; 53:19-34.
61. Li S, Hattori T, Kodama EN. Epigallocatechin gallate inhibits the HIV reverse transcription step. Antiviral Chem Chemother 2011; 21:239-43.
62. Song JM, Lee KH, Seong BL. Antiviral effect of catechins in green tea on influenza virus. Antiviral Res 2005; 68:66-74.
63. Song JM, Par KD, Lee KH i wsp. Biological evaluation of anti-influenza viral activity of semi-synthetic catechin derivatives. Antiviral Res 2007; 76:178-85.
64. Pang JY, Zhao KJ, Wang JB i wsp. Green tea polyphenol, epigallocatechin-3-gallate, possesses the antiviral activity necessary to fight against the hepatitis B virus replication in vitro. J Zhejiang Univ Sci B 2014; 15:533-9.
65. Ho HY, Cheng ML, Weng SF i wsp. Antiviral effect of epigallocatechin gallate on enterovirus 71. J Agric Food Chem 2009; 57:6140-7.
66. Isaacs CE, Xu W, Merz G i wsp. Digallate dimers of ([ndash])-epigallocatechin gallate inactivate Herpes simplex virus. Antimicrob Agent Chemother 2011; 55: 5646-53.
67. Aladag H, Ercisli S, Yesil DZ i wsp. Antifungal activity of green tea leaves (Camellia sinensis L.) sampled in different harvest time. Pharmacogn Mag 2009; 5:437-40.
68. Hirasawa M, Takada K. Multiple effects of green tea catechin on the antifungal activity of antimycotics against Candida albicans. J Antimicrob Chemother 2004; 53:225-9.
69. Han Y. Synergic anticandidal effect of epigallocatechin-O-gallate combined with amphotericin B in a murine model of disseminated candidiasis and its anticandidal mechanism. Biol Pharm Bull 2007; 30:1693-6.
70. Park BJ, Taguchi H, Kamei K i wsp. In vitro antifungal activity of epigallocatechin 3-O-gallate against clinical isolates of dermatophytes. Yonsei Med J 2011; 52:535-8.
71. Paveto C, Güida MC, Esteva MI i wsp. Anti-Trypanosoma cruzi activity of green tea (Camellia sinensis) catechins. Antimicrob Agent Chemother 2004; 48:69-74.
72. Inacio JD, Gervazoni L, Canto-Cavalheiro MM i wsp. The effect of ([ndash])-epigallocatechin 3-O-gallate in vitro and in vivo in Leishmania braziliensis: involvement of reactive oxygen species as a mechanism of action. PLoS Negl Trop Dis 2014; 8.
73. Aboulaila M, Yokoyama N, Igarashi I. Inhibitory effects of ([ndash])-epigallocatechin-3-gallate from green tea on the growth of Babesia parasites. Parasitol 2010; 137:785-91.
74. Siddique YS, Ali F. Protective effect of epigallocatechin gallate against N-nitrosodiethylamine (NDEA) induced toxicity in rats. Cogent Biol 2016; 2:1141451.
75. Darweish MM, Abbas A, Ebrahim MA i wsp. Chemopreventive and hepatoprotective effects of epigallocatechin-gallate against hepatocellular carcinoma: role of heparan sulfate proteoglycans pathway. J Pharm Pharmacol 2014; 66:1032-45.
76. Thitimuta S, Pithayanukul P, Nithitanakool S i wsp. Camellia sinensis L. extract and its potential beneficial effects in antioxidant, anti-inflammatory, anti-hepatotoxic, and anti-tyrosinase activities. Molecules 2017; 22(3):401.
77. Bursill CA, Abbey M, Roach PD. A green tea extract lowers plasma cholesterol by inhibiting cholesterol synthesis and upregulating the LDL receptor in the cholesterol-fed rabbit. Atheroscler 2007; 193:86-93.
78. Santana A, Santamarina A, Souza G i wsp. Decaffeinated green tea extract rich in epigallocatechin-3-gallate improves insulin resistance and metabolic profiles in normolipidic diet–but not high-fat diet-fed mice. J Nutr Biochem 2915; 26:893-902.
79. Santamarina AB, Oliveira JL, Silva FP i wsp. Green tea extract rich in epigallocatechin-3-gallate prevents fatty liver by AMPK activation via LKB1 in mice fed a high-fat diet. PLoS One 2015; 10.
80. Wu Q, Li JZ, Zhao TY i wsp. Epigallocatechin-3-gallate (EGCG) inhibits 3-hydroxy-3-methylglutaryl-CoA reductase in the presence of glycerol. Pak J Pharm Sci 2014; 27:1905-10.
81. Lee SJ, Jia Y. The effect of bioactive compounds in tea on lipid metabolism and obesity through regulation of peroxisome proliferator-activated receptors. Curr Opin Lipidol 2015; 26:3-9.
82. Roghani M, Baluchnejadmojarad T. Hypoglycemic and hypolipidemic effect and antioxidant activity of chronic epigallocatechin-gallate in streptozotocin-diabetic rats. Pathophysiol 2010; 17:55-9.
83. Fu QY, Li QS, Lin XM i wsp. Antidiabetic effects of tea. Molecules 2017; 22(5):849.
84. Waltner-Law ME, Wang XL, Law BK i wsp. Epigallocatechin gallate, a constituent of green tea, represses hepatic glucose production. J Biol Chem 2002; 277:34933-40.
85. Liu CY, Huang CJ, Huang LH i wsp. Effects of green tea extract on insulin resistance and glucagon-like peptide 1 in patients with type 2 diabetes and lipid abnormalities: a randomized, double-blinded, and placebo-controlled trial. PLoS One 2014; 9(3):e91163.
86. Shixian Q, VanCrey B, Shi J i wsp. Green tea extract thermogenesis-induced weight loss by epigallocatechin gallate inhibition of catechol-O-methyltransferase. J Med Food 2006; 9:451-8.
87. Shen CL, Yeh JK, Cao JJ i wsp. Green tea and bone health evidence from laboratory studies. Pharmacol Res 2011; 64:155-61.
88. Song D, Gan M, Zou J i wsp. Effect of ([ndash])-epigallocatechin-3-gallate in preventing bone loss in ovariectomized rats and possible mechanisms. Int J Clin Exp Med 2014; 7:4183-90.
89. Rodriguez R, Kondo H, Nyan M i wsp. Implantation of green tea catechin α-tricalcium phosphate combination enhances bone repair in rat skull defects. J Biomed Mater Res Part B: Appl Biomater 2011; 98:263-71.
90. Tominari T, Matsumoto C, Watanabe K i wsp. Epigallocatechin gallate (EGCG) suppresses lipopolysaccharide-induced inflammatory bone resorption, and protects against alveolar bone loss in mice. FEBS Open Bio 2015; 5:522-7.
91. Ito Y, Ohnishi S, Fujie K. Chromosome aberrations induced by aflatoxin B1 in rat bone marrow cells in vivo and their suppression by green tea. Mutat Res 1989; 222:253-61.
92. Hsu S, Dickinson D, Borke J i wsp. Green tea polyphenol induces caspase 14 in epidermal keratinocytes via MAPK pathways and reduces psoriasiform lesions in the flaky skin mouse model. Exp Dermatol 2007; 16:678-84.
93. Dias TR, Alves MG, Casal S i wsp. The single and synergistic effects of the major tea components caffeine, epigallocatechin-3-gallate and L-theanine on rat sperm viability. Food Funct 2016; 7:1301-5.
94. Vallorani C, Spinaci M, Bucci D i wsp. Effects of antioxidants on boar spermatozoa during sorting and storage. Anim Reprod Sci 2010; 122:58-65.
95. Kaedei Y, Naito M, Naoi H i wsp. Effects of ([ndash])-epigallocatechin gallate on the motility and penetrability of frozen-thawed boar spermatozoa incubated in the fertilization medium. Reprod Domest Anim 2012; 47:880-6.
96. Lee IP, Kim YH, Kang MH i wsp. Chemopreventive effect of green tea (Camellia sinensis) against cigarette smoke-induced mutations (SCE) in humans. J Cell Biochem Supp 1997; 27:68-75.
97. Fahmy MA, Diab KAE, Hassan NH i wsp. Modulatory effect of green tea against genotoxicity induced by hydrocortisonein mice. Comunic Scient 2014; 5:213-21.
98. Khan SH. The use of green tea (Camellia sinensis) as a phytogenic substance in poultry diets’. Onderstepoort J Vet Res 2014; 81(1):1-8.
99. Farahat M, Abdallah F, Abdel-Hamid T i wsp. Effect of supplementing broiler chicken diets with green tea extract on the growth performance, lipid profile, antioxidant status and immune response. Br Poult Sci 2016; 57:714-22.
100. Sarker MSK, Kim GM, Yang CJ. Effect of green tea and biotite on performance, meat quality and organ development in Ross broiler. Egypt Poult Sci J 2010; 30:77-88.
101. Koch W, Zagórska J, Marzec Z i wsp. Applications of tea (Camellia sinensis) and its active constituents in cosmetics. Molecules 2019; 24:4277.
102. Saric S, Notay M, Sivamani RK. Green tea and other tea polyphenols: effects on sebum production and acne vulgaris. Antioxidants (Basel) 2016; 6(1):2.
103. Fathima NN, Ansari T, Rao JR i wsp. Role of green tea polyphenol crosslinking in alleviating ultraviolet-radiation effects on collagen. J Appl Poult Sci 2007; 106:3382-6.
104. Tobi SE, Gilbert M, Paul N i wsp. The green tea polyphenol, epigallocatechin-3-gallate, protects against the oxidative cellular and genotoxic damage of UVA radiation. Int J Cancer 2002; 102:439-44.
105. Hong YH, Jung EY, Noh DO i wsp. Physiological effects of formulation containing tannase-converted green tea extract on skin care: physical stability, collagenase, elastase, and tyrosinase activities. Integr Med Res 2014; 3:25-33.
106. Cosmetic Ingredients Database (Online); https://ec.europa.eu/growth/sectors/cosmetics/cosing_en.








