© Borgis - Medycyna Rodzinna 3/2008, s. 66-68
1Joanna Wróblewska*, 1Eugenia Gospodarek, 1Małgorzata Bredow, 2Alina Grzanka, 2Alicja Niewińska
L-form Staphylococcus hominis wywołane pod wpływem ampicyliny i cefazoliny
L-form of Staphylococcus hominis induced by ampicilin and cefazolin
1Katedra i Zakład Mikrobiologii Collegium Medicum im. Ludwika Rydygiera w Bydgoszczy
Uniwersytetu Mikołaja Kopernika w Toruniu
Kierownik Katedry i Zakładu: prof. UMK dr hab. n. med. Eugenia Gospodarek
2Katedra i Zakład Histologii i Embriologii Collegium Medicum im. Ludwika Rydygiera w Bydgoszczy
Uniwersytetu Mikołaja Kopernika w Toruniu
Kierownik Katedy i Zakładu: prof. UMK dr hab. Alina Grzanka
Summary
S. hominis L-forms have not been studied carefully yet. They do not grow on routinely used microbiological media but they can be cultured on special hypertonic medium. No information on in vitro induction and evaluation of S. hominis L-forms on solid media can be found in literature.
Material and methods. 36 S. hominis strains isolated from patients of dr. A. Jurasz University Hospital in Bydgoszcz were analysed. These strains were identified with the API Staph (bioMérieux) and tested for L-forms induction with method described by Owens (1988).
Results. The studies indicated that 13.9% and 13.9% strains of S. hominis respectively changed into revert L-forms by ampicilin and cefazolin. It was observed that after 10 minutes and 24 hours incubation in BHI containing ampicilin 11.1% and 13.9% strains of S. hominis changed into revert L-forms respectively. Whereas the cefazolin was used 13.9%, 8.3% of strains of S. hominis changed into revert L-forms during 10 minutes and 24 hours of incubation in BHI respectively.
Conclusion. Ampicilin and cefazolin are effective antibiotics which induce L-forms of S. hominis strains. This study suggest that the time of S. hominis strains incubation in BHI with antibiotics did not play a significant role in changing these bacteria into L-forms.

Wstęp
Szczepy Staphylococcus hominis izolowane są tylko od ludzi i wchodzą w skład naturalnej mikroflory skóry i błon śluzowych. Dominują na opuszkach palców, a występują w największej liczbie w pobliżu gruczołów potowych (1). S. hominis po Staphylococcus epidermidis jest drugim gatunkiem wśród gronkowców, który występuje na suchej pozbawionej włosów skórze ramion, tułowia, kończyn dolnych (3). Trudno zinterpretować jego chorobotwórczą rolę. Może być czynnikiem etiologicznym zapalenia wsierdzia (2, 4, 5), zakażenia skóry oraz tkanek miękkich, w tym zakażeń ran chirurgicznych (6). Sporadycznie może być odpowiedzialny za wystąpienie zakażenia krwi powiązanego z wcześniejszym wszczepieniem protez i implantów (3), czy też bakteriemii u noworodków i u dzieci z niewykształconym układem odpornościowym (7, 8). Jako następstwo bakteriemii może rozwinąć się z jego udziałem zapalenie kości i szpiku kostnego (2). S. hominis może być czynnikiem etiologicznym zakażenia układu moczowego (9), a także zapalenia rogówki i wnętrznej gałki ocznej (10-12).
L-formy bakterii posiadają częściową ścianę komórkową lub są całkowicie jej pozbawione oraz mają błonę otaczającą bezpośrednio cytoplazmę. Bakteryjne L-formy mogą odgrywać rolę w utrzymujących się, przewlekłych lub nawracających zakażeniach (13). Najprawdopodobniej nie są rozpoznawane przez układ obronny człowieka i może dlatego bakterie posiadające zdolność nie wykształcania ściany komórkowej w obecności antybiotyku, którego mechanizm działania związany jest z blokowaniem syntezy ściany komórkowej, mogą wywoływać długo utrzymujące się zakażenia (13, wg 14).
Celem niniejszej pracy była ocena wytwarzania in vitro L-form przez szczepy S. hominis pod wpływem ampicyliny i cefazoliny, oraz zbadanie, czy czas działania antybiotyków ma wpływ na wytwarzanie L-form.
Materiał i metody
Badaniem objęto 36 szczepów S. hominis izolowanych od chorych Szpitala Uniwersyteckiego im. A. Jurasza w Bydgoszczy. Szczepy identyfikowano stosując testy API Staph (bioMérieux). Hodowlę prowadzono w warunkach tlenowych, w temperaturze 35°C. W celu zbadania wytwarzania L-form szczepy posiewano na podłoże tryptozowo-sojowe z dodatkiem 5% krwi baraniej (Trypticase Soy Agar, TSA) (BBL). Uzyskane hodowle zawieszano w TSB (do otrzymania 0,5 według skali McFarlanda) i inkubowano przez dwie godziny. W celu uzyskania L-form, 0,05 ml płynnej hodowli w objętości przenoszono do 4,95 ml wyciągu mózgowo-sercowego (Brain Heart Infusion, BHI) (Difco), wzbogaconego 5% NaCl, 5% sacharozą (Polskie Odczynniki Chemiczne Gliwice), 0,5% ekstraktem drożdżowym (Difco), 10% surowicą końską, zawierającego 100,0 ?g ampicyliny (Polfa Tarchomin S.A.) lub 100,0 ?g cefazoliny (Polfa Tarchomin S.A.). Hodowle w bulionie podzielono na dwie części, z których jedną inkubowano przez 10 minut, a drugą przez 24 godziny. Po inkubacji 0,1 ml hodowli posiewano na agar BHI (Difco) wzbogacony 5% NaCl, 5% sacharozą, 0,5% ekstraktem drożdżowym, 10% surowicą końską i zawierającym 100,0 ?g ampicyliny (Polfa Tarchomin S.A.) lub 100,0 ?g cefazoliny (Polfa Tarchomin S.A.). Wszystkie hodowle inkubowano w temperaturze 35°C. Przez 8 kolejnych dni obserwowano wzrost kolonii wyrosłych z badanych szczepów. Za wynik dodatni przyjmowano jednolity wzrost kolonii kształtu „sadzonego jaja” z centralnie położonym rdzeniem wystającym ponad powierzchnię kolonii, które w piśmiennictwie przez badaczy noszą nazwę L-form pośrednich (15, 16). Za wynik dodatni przyjmowano tylko te hodowle, które wzrastały przynajmniej po trzech dobach inkubacji na agarze z ampicyliną lub cefazoliną w postaci kolonii kształtu „sadzonego jaja”, zagłębiające się w powierzchnię podłoża. Kolonie wyrosłych bakterii traktowano 3,6% aldehydem glutarowym (Merck), płukano w 0,1 molowym kakodylanie sodu (FLUKA) o pH 7,4, wybarwiano octanem uranylu (Chemapol) i cytrynianem ołowiu (Polskie Odczynniki Chemiczne S.A. Gliwice). Wykonano zdjęcia komórek L-form S. hominis przy użyciu mikroskopu elektronowego JEOL JEM 100 CX.
Do obliczeń statystycznych zastosowano test dwóch frakcji, w modyfikacji uwzględniającej próbki o małej liczebności. W celu weryfikacji hipotezy o równości frakcji obliczano wartość statystyki U opartej na przekształceniu arcus sinus. Frakcja arc sin x jest wyrażona w stopniach (17).
Wyniki
Przyjęte założenia umożliwiły uzyskanie na agarze z ampicyliną lub cefazoliną tylko form bakteryjnych pozbawionych ściany komórkowej. Potwierdzono je wykonując fotografie komórek gronkowców L-form przy użyciu mikroskopu elektronowego (fot. 1).
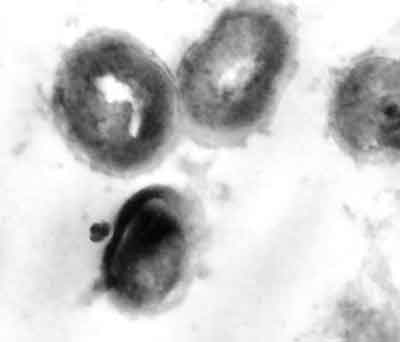
Fot. 1. Komórki L-form S. hominis otrzymane pod wpływem cefazoliny. Powiększenie, 10 000 x
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Crossley KB, Archer GL: The staphylococci in human disease. Churchill Livingstone Inc. New York: 1997. p. 119-22. 2. Huebner J, Goldmann DA: Coagulase-negative staphylococci: role as pathogen. Annu Rev Med 1999; 50: 223-36. 3. Etienne J, Eykyn SJ: Increase in native valve endocarditis caused by coagulase-negative staphylococci: an anglo-french clinical and microbiological study. Br Heart J 1990; 64: 381-4. 4. Sunbul M, Demirag MK, Yilmaz O, Yilmaz H, Ozturk R, Leblebicioglu H: Pacemaker lead endocarditis caused by Staphylococcus hominis.PACE 2006; 29: 543-5. 5. von Eiff C, Proctor RA, Peteres G: Coagulase-negative staphylococci. Postgrad Med 2001; 110: 63-6. 6. Calnen G, Campognone P, Peter G: Coagulase-negative staphylococcal bacteremia in new-borns. Clin Pediatr 1984; 23: 542-4. 7. Khadilkar V, Tudenhop D, Fraser S: A prospective study of nosocomial infections in a neonatal intensive care unit. J Pediatr Child Health 1995; 31: 387-91. 8. Giurguitzowa B, Chankova D, Zozikov B: The Staphylococci as uropathogens, frequency of isolation in hospitalized patients and susceptibility to antimicrobial agents. Ann Urol 2002; 36: 341-7. 9. Bannerman TL, RhodenDL, McAllister SK, Miller JM, Wilson LA: The source of coagulase-negative staphylococci in the endophthalmitis vitrectomy study. Arch Ophthalmol 1997; 115: 357-61. 10. Iyer MN, Wirostko WJ, Kim SH, Simons KB: Staphylococcus hominis endophthalmitis associated with capsular hypopyon. Am J Ophthalmol 2005; 139: 930-2. 11. Manikandan P, Bhaskar M, Revathy R, John RK, Narendran K, Narendran V: Speciation of coagulase negative staphylococcus causing bacterial keratitis. Indian J Ophthalmol 2005; 53: 59-60. 12. Cantwell AR. Cell-wall-deficient bacteria as a possible cause of basal cell carcinoma. JOIMR 2003; 1: 1. 13. Onwuamaegbu ME, Belcher RA, Soare C: Cell wall-deficient bacteria as a causa of infections: a review of the clinical significance. J Int Med Rse 2005; 33: 1-20. 14. Jakubczak A, Sachanowicz J, Kleczkowski M, Bukowski K: Wpływ wybranych antybiotyków na wytwarzanie from L szczepów Staphylococcus aureus. Medycyna Wet 2002; 58: 807-9. 15. Owens WE. Evaluation of various antibiotics for induction of L-form Staphylococcus aureus strains isolated from bovine mastitis. J Clin Microbiol 1988; 26: 2187-90. 16. Sachs L. Applied Statistics. Springer-Verlg. Berlin-Heidelberg. 1984. 17. Dominugue GJ, Thomas R, Walters F, Serrano A, Heidgerd PM: Cell wall deficient bacteria as a cause of idiopathic hematuria. J Urol 1993; 150: 483-5. 18. Dominigue GJ, Hellstrom WJG: Prostatis. Clin Microbiol Rev 1998; 11: 604-13. 19. Göksu N, Ataođlu H, Kemalođlu YK, Ataođlu O, Ozsökmen D, Akyildiz N: Experimental otitis media induced by coagulase negative staphylococcus and its L-forms. Int J Pediatr Otorhinolaryngol 1996; 37: 201-16. 20. Dominigue GJ, Woody HB: Bacterial persistence and expression of disease. Clin Microbiol Rev 1997; 10: 320-44. 21. Vuurde JWL, van Elvira-Recuenco M: Efficiency of procedures for induction and cultivation of Pseudomonas syringae pv. pisi L-form. Microbiol Res 2003; 158: 271-9.

