© Borgis - Nowa Medycyna 3/1999, s. 23-29
Piotr Chłosta1, Artur A. Antoniewicz2, Andrzej Borówka2
Leczenie farmakologiczne łagodnego rozrostu stercza – podstawy naukowe, przesłanki kliniczne i uwagi praktyczne
Medical therapy of BPH – scientific background, clinical guidelines and practical remarks
1 z Oddziału Urologii Okręgowego Szpitala Kolejowego we Wrocławiu
Ordynator Oddziału: dr n. med. Edward Pinkas
2 z Oddziału Urologii Centralnego Szpitala Kolejowego w Warszawie-Międzylesiu
Ordynator Oddziału: prof. dr hab. n. med. Andrzej Borówka

Gruczoł krokowy (stercz, łac. – prostata) należy do układu męskich narządów płciowych. Znajduje się w bezpośrednim sąsiedztwie dna pęcherza moczowego i przepony moczowo-płciowej, otaczając tylny odcinek cewki moczowej. Dlatego zmiany w obrębie stercza wywierają wpływ na stan dróg moczowych i często bywają powodem zaburzeń w oddawaniu moczu (7).
Miąższ stercza jest utworzony przez elementy gruczołowe oraz zrąb zbudowany z tkanki łącznej i włókien mięśni gładkich. Struktura gruczołu krokowego nie jest jednorodna. Według Mc Neala, tworzą ją cztery strefy różniące się od siebie cechami morfologicznymi i czynnościowymi oraz podlegające różnym procesom patologicznym (25):
– strefa obwodowa (peripherial zone),
– strefa przejściowa (transition zone),
– strefa środkowa (central zone),
– część przednia, zwana spoidłem lub przegrodą przednią (anterior septum).
Strefa obwodowa jest pierwotnym miejscem rozwoju raka. Łagodny rozrost (BPH – ang. benign prostatic hyperplasia) polegający na zwiększeniu liczby komórek zrębu i frakcji gruczołowej dotyczy strefy przejściowej stercza. Rozrost w tym obszarze prowadzi do powstania struktury określanej mianem gruczolaka (adenoma prostatae) (7, 28). Gruczolak jest objęty przez tzw. torebkę chirurgiczną, którą tworzy tkanka zepchniętej na zewnątrz strefy obwodowej i tkanka spoidła przedniego. Ilościowy udział zrębu włóknisto-mięśniowego oraz elementów gruczołowych w rozroście gruczołu krokowego jest osobniczo różny i stanowi podstawę do wyodrębnienia odmiennych typów histopatologicznych BPH – od typu z dużą przewagą utkania zrębowego po typ z dominacją tkanki gruczołowej, przy czym najczęściej występuje rozrost o charakterze włóknisto-mięśniowo-gruczolakowatym (ryc. 1).
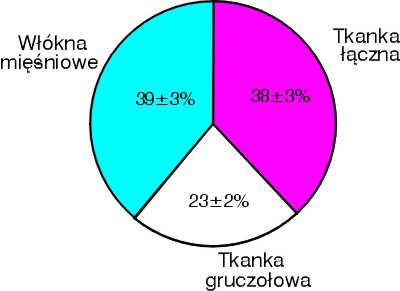
Ryc. 1. Udział frakcji gruczołowej i elementów zrębu (tkanka łączna, włókna mięśni gładkich) w sterczu dotkniętym rozrostem łagodnym.
Pomimo intensywnie prowadzonych badań nad etiologią BPH, nie jest ona jeszcze definitywnie poznana (26). Stercz jest narządem hormonozależnym i podlega wpływowi hormonów płciowych – rozwój i rozrost frakcji gruczołowej stymulują androgeny, estrogeny wywierają wpływ na zrąb stercza (4, 10, 26, 16, 27). Rozrost zrębu oddziaływuje również na komórki gruczołowe pobudzając je także do rozrostu (10, 27). Istnieją przesłanki sugerujące, że do BPH dochodzi w wyniku działania czynników wzrostowych (ang. growth factors) na zrąb gruczołu krokowego i część gruczołową jego strefy przejściowej (10, 22). Według innej hipotezy rozrost stercza powstaje w wyniku zaburzenia równowagi ilościowej pomiędzy liczbą komórek obumierających w następstwie apoptozy a liczbą komórek nowopowstających. Wiarygodną wydaje się również hipoteza, że rozwój BPH jest następstwem kilku różnych, jednak łącznie działających procesów patologicznych. Pomimo niedostatku danych oraz wielu wątpliwości dotyczących etiologii łagodnego rozrostu stercza, wiadomo z całą pewnością, że czynnikami niezbędnymi dla powstania tej choroby są czynność hormonalna jąder (BPH nie występuje u mężczyzn pozbawionych jąder przed okresem dojrzałości płciowej) oraz proces starzenia się (BPH występuje na ogół u mężczyzn ponad 60 letnich) (2, 5, 10, 15, 26, 28).
BPH stanowi niejednorodny zespół zmian patofizjologicznych oraz objawów i dolegliwości, których nasilenie i wzajemny udział u różnych chorych nie jest jednakowy. Elementami tego zespołu są:
– powiększenie gruczołu krokowego (BPE – ang. benign prostatic enlargement),
– przeszkoda podpęcherzowa (BPO – ang. benign prostatic obstruction),
– objawy ze strony dolnych dróg moczowych (LUTS – ang. lower urinary tract symptoms), na które składają się objawy przeszkody podpęcherzowej i objawy podrażnienia pęcherza moczowego (1, 5, 6, 7, 31).
Różne możliwości udziału tych elementów ilustruje rycina 2. Schemat przedstawiony na niej unaocznia, że nie ma bezpośredniego związku między stopniem powiększenia stercza i nasileniem dolegliwości związanych z oddawaniem moczu oraz nasileniem przeszkody podpęcherzowej (5, 6, 7, 8, 26, 29, 31). U niektórych chorych dominuje powiększenie stercza ze znikomymi objawami przeszkody podpęcherzowej i niewielkimi dolegliwościami. U innych zaś stercz jest nieznacznie powiększony, jednak dolegliwości są duże, a przeszkoda podpęcherzowa niewielka. U jeszcze innych chorych występuje istotne utrudnienie odpływu moczu z pęcherza, a stercz jest mały i dolegliwości znikome (1, 5, 6, 8, 26).
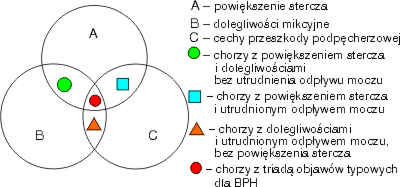
Ryc. 2. Wzajemne zależności grup objawów klinicznych BPH.
Powiększenie gruczołu krokowego rozpoznaje się na podstawie badania palpacyjnego stercza przez odbytnicę (DRE – digital rectal examination) oraz na podstawie ultrasonografii przezpowłokowej (TAUS – transabdominal ultrasound). Dokładne określenie objętości całego gruczołu krokowego i gruczolaka umożliwia ultrasonografia przezodbytnicza (TRUS – transrectal ultrasound).
Przeszkoda podpęcherzowa (BPO) u chorych na BPH jest spowodowana przez dwa czynniki:
– mechaniczny, polegający na uciśnięciu cewki moczowej przez powiększony gruczoł krokowy,
– dynamiczny, spowodowany przez skurcz włókien mięśniowych gładkich zrębu stercza, sterczowego odcinka cewki i okolicy ujścia wewnętrznego cewki.
Element dynamiczny BPO stanowi u wielu chorych niemal 50% globalnego oporu cewkowego.
Zasadniczą metodą oceny stopnia zasilenia BPO jest pomiar tempa przepływu moczu przez cewkę w czasie naturalnej mikcji (uroflowmetria). Wynik badania jest miarodajny, jeśli objętość mikcji nie jest mniejsza od 150 ml. Uroflowmetria umożliwia określenie szeregu mierników obiektywnych mikcji. Najważniejszym spośród nich jest maksymalny przepływ cewkowy (Qmax) – w warunkach prawidłowych u mężczyzn przewyższa on 15 ml/s. Pośrednią miara przeszkody podpęcherzowej i sprawności mięśnia wypieracza jest zaleganie moczu w pecherzu po mikcji (Rv). Określa się je metodą TAUS.
Najczęstszymi objawami BPH są częstomocz, konieczność oddawania moczu w nocy, zwężenie strumienia moczu, częste gwałtowne parcie na mocz i wydłużenie czasu mikcji. Objawy i dolegliwości ze strony dolnych dróg moczowych (LUTS) towarzyszące BPH można podzielić na dwie grupy – objawy podrażnienia i objawy świadczące o przeszkodzie podpęcherzowej (tab. 1). Przeszkoda podpęcherzowa utrzymująca się długo prowadzi do rozstrzeni pęcherza. Jej przejawem jest stałe, bezwiedne wyciekanie moczu z pęcherza przez cewkę (ischuria paradoxa). Krwiomocz w przebiegu BPH zdarza się stosukowo rzadko. Jego wystąpienie zawsze wymaga przeprowadzenia badań mających na celu wykrycie lub wyłączenie nowotworu narządów układu moczowego (4, 5, 6, 7, 8).
Tabela 1. Najczęściej występujące objawy i dolegliwości towarzyszące łagodnemu rozrostowi stercza.
| Objawy podrażnienia pęcherza | Objawy przeszkody podpęcherzowej |
| częstomocz | wyczekiwanie na mikcję |
| oddawanie moczu w nocy | zwężenie strumienia moczu |
| gwałtowne parcie na mocz | wydłużenie czasu mikcji |
| brak możliwości powstrzymania mikcji | przerywany strumień moczu |
| ból w czasie mikcji | wykapywanie moczu z cewki po mikcji, uczucie niecałkowitego opróżnienia pęcherza |
W celu zobiektywizowania oceny nasilenia dolegliwości mikcyjnych opracowano kilka metod umożliwiających określenie ilościowe LUTS, w których wykorzystuje się kwestionariusze (np. I-PSS – International Prostate Symptom Score, AUA-SS – American Urological Association Symptom Score, Boyarsky Score) zawierające pytania na temat poszczególnych dolegliwości. Odpowiedzi na pytania udziela chory. Każdej z nich jest przypisana odpowiednia liczba punktów. Kwestionariuszem rozpowszechnionym w Polsce i w innych krajach europejskich jest I-PSS. Pozwala on określić nasilenie LUTS na podstawie sumy punktów wynikającej z wybranych przez chorego odpowiedzi na 7 pytań:
– dolegliwości nie występują lub są znikome – 0-7 punktów,
– dolegliwości umiarkowanie – 8-19 punktów,
– dolegliwości znaczne – 20-35 punktów.
Integralną częścią I-PSS jest pytanie o jakość życia (QoL – Quality of Life) zależną od LUTS. QoL określa się w skali od 0 do 6 punktów.
BPH jest chorobą rozwijającą się powoli. Względne ryzyko wystąpienia ostrego zatrzymania moczu lub wskazań do leczenia chirurgicznego u chorych z BPE i BPO obserwowanych przez 10 lat ocenia się na
około 10%. BPH u większości chorych nie powoduje niekorzystnych następstw (rozstrzeń pęcherza, poszerzenie górnych dróg moczowych, wodonercze), ani powikłań (zakażenie dróg moczowych, kamica moczowa, niewydolność nerek) stanowiących bezwzględne wskazania do leczenia chirurgicznego – złotym standardem w tym względzie jest elektroresekcja przezcewkowa stercza (TURP – Transurethral Resection of the Prostate), metoda charakteryzująca się dużą skutecznością i znacznie mniejszą inwazyjnością od operacyjnego wyłuszczenia gruczolaka stercza (OPSU – Open Prostatic Surgery). Dominującą grupę chorych na BPH stanowią ci, których wystarczy objąć baczną obserwacją (Wa-Wa – Watchful Waiting) oraz u których występują wskazania do leczenia farmakologicznego, bądź u których można zastosować znikomo inwazyjne metody zabiegowe, np. termoterapię mikro- lub radiofalową (TUMT – Transurethral Microwave Thermotherapy), czy przezcewkową śródmiąższową koagulację laserową (ILCP – Interstitial Laser Coagulation of the Prostate).
Celem leczenia farmakologicznego chorych na BPH jest złagodzenie dolegliwości mikcyjnych, polepszenie jakości życia oraz spowodowanie poprawy warunków urodynamicznych mikcji. Leczenie farmakologiczne ma zastosowanie u chorych z umiarkowanymi lub znacznie nasilonymi dolegliwościami (IPSS > 7 punktów), u których nie występują bezwzględne wskazania do leczenia chirurgicznego oraz, którzy - mimo istnienia u nich wskazań do leczenia zabiegowego – nie wyrażają na nie zgody, a także u chorych, których z uwagi na duże ryzyko powikłań nie można poddać leczeniu chirurgicznemu.
Do leczenia farmakologicznego BPH stosuje się leki należące do następujących grup:
– leki blokujące receptory α-1 adrenergiczne,
– leki wpływające na środowisko hormonalne stercza,
– preparaty pochodzenia roślinnego.
Blokada receptorów α adrenergicznych
Zwiększenie objętości stercza w przebiegu BPH jest w dużej mierze następstwem rozrostu zrębu gruczołu krokowego, w tym włókien mięśni gładkich. Skurcz włókien mięśniowych zrębu stercza, sterczowego odcinka cewki i okolicy ujścia wewnętrznego cewki moczowej będący wynikiem pobudzenia receptorów α-1 adrenergicznych (a zwłaszcza receptorów podtypu α1A) przez noradrenalinę jest powodem komponenty dynamicznej przeszkody podpęcherzowej. Zablokowanie adrenoreceptorów α-1 prowadzi zatem do rozkurczu wymienionych struktur mięśniowych i może się tym samym przyczynić do zmniejszenia oporu w obrębie szyi pecherza i odcinka tylnego cewki. Działanie adrenolityczne na receptory α-2 nie powoduje takiego efektu. Oddziaływanie farmakologiczne na receptory b adrenergiczne pozostaje bez wpływu na napięcie frakcji mięśniowej zrębu stercza dotkniętego rozrostem łagodnym.
Rodzinę receptorów α-1 adrenergicznych (α-1 AR) tworzą dwie grupy: receptory wykazujące duże powinowactwo do prazosyny (α-1 H AR) oraz receptory o małym powinowactwie do prazosyny (α-1 L AR). Wśród α-1 H AR można na podstawie selekcji farmakologicznej odróżnić trzy podtypy: receptory α-1A, α-1B oraz α-1D. Podtypy te identyfikowane techniką klonowania określa się symbolami α-1a, α-1b i α-1d. Reprezentacja podtypów α-1 AR jest różna w różnych tkankach. W obrębie stercza dominuje podtyp α-1A, dlatego określa się go mianem receptora „prostatospecyficznego”. Gęstość receptorów α-1 B i α-1 D w sterczu jest znacznie mniejsza. Receptory te oraz receptory a-2 adrenergiczne występują m.in. w układzie sercowo-naczyniowym. Zablokowanie wszystkich trzech podtypów α-1 AR, a zwłaszcza adrenoreceptorów α-1 i α-2 prowadzi do wystąpienia pozasterczowych efektów adrenolizy, np. obniżenia ciśnienia tętniczego. Dlatego do leczenia BPH stosuje się adrenolityki działające wybiórczo na receptory α-1. Leki te różnią się głównie czasem półtrwania (tab. 2). Niektóre z nich wykazują szczególne powinowactwo do receptora α-1 A.
Tabela 2. Czas półtrwania i dawkowanie leków a-1 adrenolitycznych wykorzystywanych do leczenia chorych na BPH.
| Lek | Nazwa handlowa | Czas półtrwania | Dawkowanie |
| prazosyna | Polpressin/Minipress | 3 godz. | 1-2 mg
4 x dziennie |
| alfuzosyna | Dalfaz 2,5 mg
Dalfaz 5 mg | 5 godz. 10 godz. | 2,5 mg
3 x dziennie
5 mg
1 x dziennie |
| terazosyna | Hytrin | 8 godz. | 2 mg, 5 mg lub 10 mg
1 x dziennie |
| tamsulosyna | Omnic 0,4 mg | 10 godz. | 0,4-0,8 mg
1 x dziennie |
| doksazosyna | Cardura 2 mg
Cardura 4 mg | 22 godz.
22 godz. | 2-8 mg
1 x dziennie |
Podstawową cechą α-adrenolityków stosowanych współcześnie do leczenia BPH jest – jak wspomniano - ich selektywność w stosunku do receptora α-1. Tzw. „uroselektywność” tych leków można rozpatrywać w trzech kategoriach: farmakologicznej, fizjologicznej i klinicznej. Uroselektywność w znaczeniu farmakologicznym oznacza wybiórcze działanie leku w stosunku do receptora α-adrenergicznego, który występuje wyłącznie w obrębie stercza, szyi pęcherza moczowego i sterczowego odcinka cewki moczowej. Pomimo wykrycia kilku podtypów α-1 AR, nie udało się dotychczas wyodrębnić takiego podtypu, którego pobudzenie byłoby wyłącznie odpowiedzialne za skurcz mięśni gładkich stanowiący dynamiczny element przeszkody podpęcherzowej. Niemniej, z punktu widzenia teorii uroselektywności farmakologicznej, najbardziej charakterystycznym dla gruczołu krokowego, szyi pęcherza moczowego i sterczowego odcinka cewki jest adrenoreceptor α-1A. Uroselektywność adrenolityku w znaczeniu fizjologicznym (czynnościowym) oznacza efekt polegający na wybiórczym zniesieniu napięcia mięśni gładkich, których skurcz warunkuje istnienie elementu dynamicznego przeszkody podpęcherzowej w przebiegu BPH. Uroselektywność kliniczną α-1 adrenolityku wyraża wskaźnik kliniczno-terapeutyczny, obliczony jako stosunek dawki leku, po której występuje efekt niepożądany do dawki skutecznej terapeutycznie. Dotychczas nie jest znany prawdziwie uroselektywny lek adrenolityczny. Tamsulosyna, doksazosyna, terazosyna i afluzosyna różnią się głównie profilem farmakokinetycznym, przy czym tamsulosyna charakteryzuje się najkorzystniejszym wskaźnikiem terapeutyczno-klinicznym (31).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Abrams P.: The urodynamic assessement of lower urinary tract symptoms. The 4th International Consultation on Benign Prostatic Hyperplasia. Proceedings. Committee 7: 325-337. Health Publication Ltd, 1997. 2. Berry S.J. et al.: The development of human benign prostatic hyperplasia with age. J. Urol. 1984, 132:474-479. 3. Antoniewicz A.A.: III Międzynarodowa Konsultacja na temat łagodnego rozrostu stercza. Warsztaty urologiczne. Terapia, 1995, 9, 26:26. 4. Ball A.J.:Natural history of benign prostatic hyperplasia. Prospectives, 1993, 3, 2:1. 5. Borówka A.: Łagodny rozrost stercza – uwagi na temat patomorfologii, etiologii, następstw klinicznych i epidemiologii. Nowa Med., 1996, 2, 3-6. 6. Borówka A.: Łagodny rozrost stercza – uwarunkowania embriogenetyczne, aspekt strukturalny i etiologia choroby. Medycyna 2000, 1993, 41/42:4. 7. Borówka A.: Łagodny rozrost stercza. Postępy Medycyny. Farm. Pol. 1996, t. 52, 12, 531-546. 8. Borówka A.: Zapalenie gruczołu krokowego. Klinika. Nefrologia i urologia 4 (7): 361-364 (CaineM., Pfau A., Perlberg S (1976) Br. J. Urol. 48, 225. 9. Chung L. et al.: Etiology of Benign Prostatic Hyperplasia. Lepor H.: Advances in Benign prostatic hyperplasia Urol. Clin North. Am., 1995, 22 (2): 237-246. 10. Chute C.G. et al.: The prevalence of prostatism: a population - based survey of urinary symptoms. J. Urol., 1993, 150:85. 11. Denis L.J., et al.: (1996). Eur. Urol.30 (Suppl 2), 238. 12. Djavan B., McConnell J.(1996) Wien. Med. Wochenschr. 8, 165. 13. Franks L.M.: Benign prostatic hypertrophy : gross and microscopic anatomy. US D ept. of Health Education and Welfare. NIH Publications 1996, 63:76. 14. Garraway W.M. et al.: Impact of previously unrecognised benign prostatic hyperplasia on the daily activities of middle aged and elderly men. Brit.J. Gen. Pract.: 1993, 43:58. 15. Griffith K. et al.: Endocrine factors in prostatic disease (part 2). Prospectives, 1990, 1, 1:2. 16. Griffiths K. et al.: The regulation of pprostatic growth. In: The 3th International Consultation on Benign Prostatic Hyperplasia. Proceedings. Monaco, (1995), 75-115. 17. Hald T. et al.: Clinical urodynamics in benign prostatic hyperplasia. Eur. Urol. Update Series, 1993, 2:74. 18. Kazoń M.: Łagodny rozrost stercza. Terapia, 1995, 9, 26 :12. 19. Kozak J. et al.: Nuclei of stroma. Ste of highest estrogen concentration in human prostatic hyperplasia. The Prostate 1982, 3:433-438. 20. Krieg M. et al.: Effect of aging on endogenous level of 5 a dihydrotestosterone, testosterone, estradiol, and estron in epithelium and stroma of normal and hyperplastic human prostate. J. Clin. Endocrinol & Metabolism. 1993, 77:375-381. 21. Lawson R.: Prostate growth factor and benign prostate hyperplasia. Problems in Urology, 1991, 5:449. 22. Lepor H. et al.: N. Engl. Med. J. 1996, 335, 533. 23. Mc Connell J.D. et al.: The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among man with benign prostatic hyperplasia, N. Engl. Med. J. 1998, 338:557-563. 24. Mc Neal J.E.: Pathology of benign prostate hyperplasia: insight into etiology. Urol. Clin. North Am. 1990, 17:447. 25. Mieszkalski G.B. et al.: The Natural History of Benign Postatic Hyperplasia. Petrovich Z., Baert L.: Benign Prostatic Hyperplasia.Innovations in Management. Springer Verlag 1994, 39. 26. Oesterling J.E., Lewis R.W.: Benign prostatic hyperplasia: estrogens and the stromal component. Eur. Urol. Update Series, 1992, 1:178. 27. Pike M.C., Ursin G.: Etiology of Benign Prostatic Hyperplasia. Can this disease be prevented? Petrovich Z., Baert L.: Benign Prostatic Hyperplasia.Innovations in Management. Springer Verlag 1994, 1-16. 28. Rosier P.F.W.M., De la Rosette J.J.M.C.H.: Is there a correlation between prostate size and bladder – outlet obstruction? World. J. Urol., 1995, 13:9.29. Shapiro E. et al.: Prostate 20, 1992, 259. 30. Shapiro E., Lepor H.: Pathophisiology of clinical benign prostatic hyperplasia. Lepor H.: Advances in Benign prostatic hyperplasia Urol. Clin North. Am., 1995, 22 (2): 285-290. 31. The 4th International Consultation on Benign Prostatic Hyperplasia. Recommendations of the International Consensus Committee: The Evaluation and Treatment of Lower Urinary Tract Symptoms suggestive of Benign Prostatic Obstruction. Health Publication Ltd, 1997. 32. Pressler L.B. et al.: The incidence of hypertension in a population of men with benign prostatic hyperplasia. J. Urol., 1997, 157, 371.


