© Borgis - Nowa Stomatologia 2/2005, s. 94-97
Ewa Jankowska-Antczak, Andrzej Wojtowicz
Aktualne poglądy na temat patogenezy zapalenia tkanek okołowierzchołkowych
The current opinions on a pathogenesis of periapical inflamation
z Zakładu Chirurgii Stomatologicznej Instytutu Stomatologii Akademii Medycznej w Warszawie
Kierownik Zakładu: dr hab. Andrzej Wojtowicz

WSTĘP
Ostre lub przewlekłe zapalenie tkanek okołowierzchołkowych jest częstym problemem klinicznym. Istnieje wiele doniesień na temat udziału mikroorganizmów w rozwoju próchnicy zębów i jej powikłań. Dobrze udokumentowany jest też destrukcyjny wpływ bakterii i toksyn bakteryjnych obecnych w kanale korzeniowym na tkanki okołowierzchołkowe oraz ich rola w powstawaniu zmian zapalnych zwanych ziarniniakami okołowierzchołkowymi (1, 2). Wielu badaczy podkreśla jednak, że ziarnina okołowierzchołkowa jest z reguły jałowa, a możliwość bezpośredniego niszczenia tkanek przez bakterie i ich enzymy nie odpowiada rozmiarom procesu degradacji tkanek (3). W rozwój i podtrzymanie procesu zapalnego zaangażowane są więc niewątpliwie różne komponenty układu immunologicznego gospodarza. Mechanizmy obronne indukowane przez antygeny bakteryjne mają zmierzać do ograniczenia rozprzestrzeniania się zakażenia i eliminacji czynnika zakaźnego. Z drugiej jednak strony mogą powodować niszczenie zdrowych tkanek w tym resorpcję okolicznej kości (4, 5).
BUDOWA ZIARNINIAKA OKOŁOWIERZCHOŁKOWEGO
Ziarniniak okołowierzchołkowy w obrazie mikroskopowym jest bogato unaczynioną tkanką łączną, w różnym stopniu nacieczoną komórkami nacieku zapalnego, z towarzyszącym obrazem resorpcji tkanki kostnej. Tkanka ziarninowa nie jest zmianą jednorodną. Odzwierciedla ona wszystkie etapy okołowierzchołkowego procesu zapalnego od ostrej odpowiedzi zapalnej do obszaru całkowitej martwicy. Bergenholz (6) wyróżnia w obrębie ziarniniaka następujące strefy:
1. strefa martwicy,
2. strefa wysięku,
3. strefa ziarniny,
4. strefa włóknista.
Schemat budowy histologicznej ziarniniaka przedstawia rycina 1.
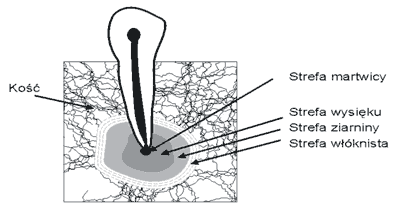
Ryc. 1. Schemat budowy histologicznej ziarniniaka okołowierzchołkowego.
W strefie martwicy i strefie wysiękowej zapalenia okołowierzchołkowego obecne są liczne neutrofile (granulocyty obojętnochłonne, mikrofagi) stanowiące pierwszą linię obrony przed inwazją bakterii z kanału korzeniowego. Ich zdolność do fagocytozy prowadzi do zniszczenia i eliminacji większości patogennych mikroorganizmów, zapobiegając ich dalszemu rozprzestrzenianiu (7). W strefie ziarniny dominują limfocyty, komórki plazmatyczne, makrofagi i eozynofile. Nadal stwierdza się obecność neutrofili, ale w mniejszym nasileniu niż w strefie wysięku, w której pomiędzy komórkami nacieku zapalnego obecne są pasma tkanki łącznej. W strefie włóknistej dominują natomiast elementy tkanki łącznej: fibroblasty, naczynia i włókna kolagenowe (5).
DYSFUNKCJA NEUTROFILI
Neutrofile w zmianach ziarninowych stanowią znaczący odsetek komórek odczynu zapalnego, biorą one udział w obronie organizmu przed zakażeniem, ale mogą również być istotnym czynnikiem degradującym okoliczne tkanki. Wielu badaczy donosi o zaburzeniach funkcji neutrofili towarzyszących takim zmianom patologicznym, jak: złe gojenie, owrzodzenie błony śluzowej jamy ustnej, zapalenie dziąseł i nawracające zapalenie jamy ustnej (8). Najnowsze badania przekonują, że procesowi zapalnemu sprzyja nie niedobór neutrofili, ale ich nadmiar i nadaktywność (9). Pobudzone neutrofile uwalniają rodniki tlenowe i enzymy proteolityczne bezpośrednio niszczące otaczające tkanki. Mogą też zaczopowywać drobne naczynia i mechanicznie blokować przepływ oraz uwalniać prozapalne czynniki: PAF – czynnik aktywujący płytki, tomboksany, leukotrieny. Wiedza ta zapoczątkowała badania nad możliwością wykorzystania lipoksyn, również pochodnych kwasu arachidonowego, do hamowania objawów zapalenia prowokowanego przez neutrofile (8). Na rycinie 2 przedstawiono schemat udziału pochodnych kwasu arachidonowego w indukowaniu objawów zapalenia i aktywowaniu komórek odczynu zapalnego. Linią przerywaną oznaczono działanie hamujące proces pobudzenia zapalenia.
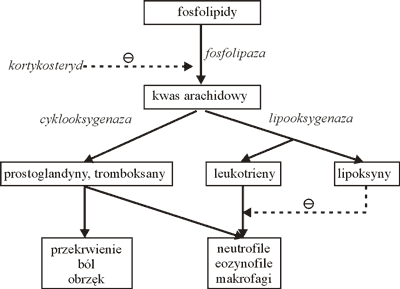
Ryc. 2. Schemat udziału pochodnych kwasu arachidonowego w procesie zapalnym (opis w tekście).
MECHANIZMY DEGRADACJI TKANKI KOSTNEJ
W prawidłowych warunkach najważniejszymi komórkami, odpowiedzialnymi za kontrolowaną resorpcję i przebudowę tkanki kostnej są osteoklasty. Aktywność osteolityczna osteoklastów jest uzależniona od udziału w tym procesie osteoblastów (10). Istniejącą równowagę oraz nasilenie procesu destrukcji zakłócającą czynniki wzmagające czynność osteoklastów. Czynnikami tymi mogą być antygeny bakteryjne lub czynniki wewnątrzpochodne gospodarza np.: IL-1 ab, TNF a (11).
Lipopolisacharyd bakteryjny (LPS), składnik bakteryjnej ściany komórkowej jest najbardziej znanym antygenem bakteryjnym. W stężeniu 10-3 g/l bezpośrednio stymuluje resorpcję kości. Natomiast milion razy niższe stężenie LPS (10-9 g/l) wystarczy, aby spowodować stymulację cytokin i prostaglandyn mających zdolność pobudzania osteoklastów (5). Udział wybranych czynników w niszczeniu tkanki kostnej ilustruje rycina 3.
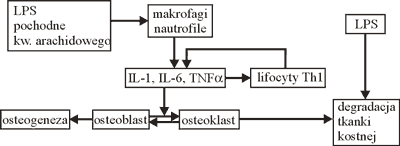
Ryc. 3. Czynniki pobudzające degradację tkanki kostnej.
LPS oraz inne mediatory zapalenia są czynnikiem chemotaktycznym przyciągającym komórki odczynu zapalnego: neutrofile i makrofagi. Badania wykazują, że komórki immunokompetentne nie namnażają się w obrębie zmian okołowierzchołkowych, lecz w okolicznych węzłach chłonnych i następnie migrują do ogniska chorobowego (chemotaksja) (12). Pobudzone komórki nacieku zapalnego uwalniają prozapalne cytokiny, przede wszystkim IL-1, IL-6 i TNFa, znane czynniki pobudzające aktywność osteolityczną osteoklastów.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Kakehashi S. et al.: The effects of surgical exposures of dental pulps in germ-free and conventional laboratory rats. Oral. Surg. 1965, 20:340-349. 2.Nair P.N.R.: Light and electron microscpic studies on root flora and periapical lesions. J. Endodont. 1987, 13:29-39. 3.Abou-Rass M., Bogen G.: Microorganisms in closed periapical lesions. Int. Endod. J. 1998, 31:33-42. 4.Stashenko P.: The role of immune cytokines in pathogenesis of periapical lesions. Endod. Dent. Traumatol. 1990, 6:89-96. 5.Marton I.J., Kiss C.: Protective and destructive immune reactions in apical periodontitis. Oral. Microbiol. Immunol. 2000, 15:139-150. 6.Bergenholtz G. et al.: Morphometric analysis of chronic inflammatory periapical lesions in root-filled teeth Oral. Surg. 1983, 55:259-301. 7.Babior B.M.: Oxidants from phogocytes: agents of defense and destruction. Blood 1984, 64:959-966. 8.Van Dyke T.E., Serhan C.N.: Resolution of inflamation: a new paradigm for the pathogenesis of periodontal diseases. J. Dent. Res. 2003, 82(2):82-90. 9.Lakshman R., Finn A.: Neutrofil disorders and their management. J. Clin. Pathol. 2001, 54:7-19. 10.Thomson B.M. et al.: Osteoblasts mediate interleukin 1 stimulation of bone resorption to rat osteoclasts. J. Exp. Med. 1986, 164:104-112. 11.Vaes G.: Cellular biology and biochemical mechanism of bone resorption. Clin. Orthop. 1988, 231:239-27. 12.Danin J. et al.: Tumor necrosis factor-alpha and transforming growth factor-beta in chronic periapical lesions. Oral. Surg. 2000, 90 (4):514-7. 13.Birkedal-Hansen H.: Role of cytokines and inflammatory mediators in tissue destruction. J. Periodont. Res. 1993, 28:500-510. 14.Birkedal-Hansen H. et al.: Matrix metalloproteinases: a review. Crit. Rev. Oral. Biol. Med., 1993, 4:197-250. 15.Birkedal-Hansen H.: Role of matix metalloproteinases in human periodontal diseases. J. Periodontol. 1993, 64:474-484. 16.Wahlgren J. et al.: Matrix metalloprteinase-8 (MMP-8) in pulpal and periapical inflammation and periapical root-canal exudates. Int. Endod. J. 2002, 35 (11):897-904. 17.Shin S. et al.: Tissue levels of matrix metalloproteinases in pulps and periapical lesions J. Endod. 2002, 28:313-315. 18.Mundy G.R.: Role of cytokines in bone resorption. J. Cell. Biochem. 1993, 53:296-300. 19.Jankowska-Antczak E., Wojtowicz A.: Ekspresja metaloproteinaz (MMP-1, -2,-3) i ich tkankowego inhibitora (TIMP-1) w ziarniniakach okołowierzchołkowych. Czas Stom. 2003, LVI (6):393-398. 20.Liapatas S. et al.: Inflammatory infiltrate of chronic periradicular lesions: an immunohistochemical study. Int. Endod. J. 2003, 36(7):464-71. 21.Kabashima H. et al.: Presence of IFN-gamma and IL-4 in human periapical granulation tissues and regeneration tissues. Cytokine 2001, 14 (5):289-93. 22.Takahashi K. et al.: Cell synthesis, proliferation and apoptosis in human dental periapical lesions analysed by in situ hybrydisation and immunohistochenistry. Oral. Diseas 1999, 5 (4):313-20. 23. Kabashima H. et al.: Interferon-gamma-producing cells and inducible nitric oxide synthase-producing cells in periapical granulomas. J. Oral. Pathol. Med. 1998, 27 (3):95-100.




