© Borgis - Postępy Fitoterapii 1/2009, s. 39-44
*Bogdan Kędzia
Skład chemiczny propolisu polskiego. Cz. I. Początkowy okres badań
CHEMICAL COMPOSITION OF POLISH PROPOLIS. PART I. THE INITIAL PERIOD OF INVESTIGATIONS
Instytut Włókien Naturalnych i Roślin Zielarskich w Poznaniu Oddział Roślin Zielarskich w Poznaniu
Dyrektor Instytutu: prof. dr hab. Grzegorz Spychalski
Summary
The studies carried out by scientists showed in native propolis the mean of 11.3% water, 4% valatile oil and 1.6% ash. The dried ethanol extract (95% ethanol) from propolis (EEP) includes on average 63.9% of biological active substances and 36.1% of non-soluble residues. The studies showed that EEP obtained by 70% ethanol contents on average 5.0% of flavonoid compounds. To the most frequently and in the largest amounts occurring compounds belong such flavonoids as: tektochrisin, chrisin, pinostrobine and apigenine. The most frequently occuring aromatic acids are: cinnamic acid, isoferulic acid and caffeic acid and aromatic ester: benzoic acid ethyl ester. In volatile oil distilled from EEP were found mainly terpens (geraniol, nerol) and sesquiterpenes (farnesol, caryophyllene, bisabolene). From the group of steroids was found stigmasterol. In EEP of native origin are occurring 22 bioelements among other calcium, magnesium, zinc, chromium and selenium. The total amount of bioelements in EEP is on average 0.6%. The native EEP contents moreover enzymes: α- and β-amylases, maltase and esterases. The total contents of enzymatic protein in EEP is 2.8%. On the basis of above investigations (1978-2000) could be assumed that EEP of native origin is a rich source of biological active substances.

Badania ostatnich lat dowodzą, że propolis należy uważać za produkt roślinny, będący żywiczną wydzieliną pączków liściowych niektórych drzew lub substancją wytwarzaną przez rośliny po ich uszkodzeniu, do której dodawany jest przez pszczoły wosk oraz niewielka ilość wydzieliny gruczołowej tych owadów (1). W propolisie znajdują się zazwyczaj domieszki mechaniczne, takie jak: pyłek kwiatowy, pierzga, kurz, fragmenty padłych pszczół i konstrukcji ula.
Niniejsze opracowanie dotyczy pierwotnego okresu badań nad polskim propolisem i obejmuje lata 1978-2000. Jedne z pierwszych badań przeprowadzonych w Instytucie Roślin i Przetworów Zielarskich w Poznaniu (2) wykazały, że w surowym propolisie znajduje się 11,3% wody, 4,0% olejku eterycznego i 1,6% popiołu. Natomiast po ekstrakcji surowca 95% etanolem (1:20) uzyskuje się suchy ekstrakt w ilości 63,9% oraz nierozpuszczalną pozostałość w ilości 36,1% (tab. 1).
Tabela 1. Skład surowego propolisu pochodzenia krajowego (wg 2).
| Składniki surowego propolisu (n=12) | Średnia zawartość (%) |
Woda
Olejek eteryczny
Popiół
Suchy ekstrakt (95% etanol)
Nierozpuszczalna pozostałość | 11,3
4,0
1,6
63,9 (54,3-69,0)
36,1 (31,0-45,7) |
Obecnie surowy propolis używany jest bardzo rzadko. Dla celów leczniczych, dietetycznych i kosmetycznych używa się zagęszczonego ekstraktu etanolowego z propolisu (EEP), który otrzymuje się na drodze ekstrakcji surowego propolisu za pomocą 70% etanolu (ryc. 1). Metoda ekstrakcji surowego propolisu została opracowana w kilku ośrodkach krajowych. Jako warunki optymalne uznano ekstrakcję surowca w stosunku 1:10 za pomocą 70% etanolu przez 5 dni w temp. 25-30°C. W tych warunkach zawartość substancji biologicznie aktywnych w ekstrakcie kształtuje się w granicach 64,3-68,5% (2, 3, 4). Po odparowaniu rozpuszczalnika i standaryzacji mikrobiologicznej zagęszczony etanolowy ekstrakt z propolisu (EEP) staje się produktem, z którego wytwarza się preparaty farmaceutyczne, weterynaryjne, suplementy diety i kosmetyki (ryc. 1).

Ryc. 1. Otrzymywanie zagęszczonego ekstraktu etanolowego z propolisu (EEP) (wg 2 i 3).
Powyższe dane dotyczą propolisu krajowego i zagranicznego. Niezależnie od jego pochodzenia, zawartość wody, olejku eterycznego, popiołu, suchego ekstraktu etanolowego i nierozpuszczalnej pozostałości będą podobne. Różnice mogą dotyczyć natomiast składu chemicznego EEP. Z publikacji przeglądowej (5) wynika, że istnieją duże różnice w składzie chemicznym propolisu zbieranego przez pszczoły w określonych strefach geograficznych Europy i świata. Dla przykładu inne grupy związków chemicznych występowały w propolisie polskim, a inne w propolisie pochodzącym z rejonu Morza Śródziemnego, Azji i Ameryki Południowej (5).
W tym kontekście wydaje się celowe zebranie wyników badań przeprowadzonych z użyciem propolisu krajowego i określenie jego typowego składu chemicznego. Dotyczy to szczególnie związków flawonoidowych, ze względu na to, że ich zawartość wykorzystywana jest dla standaryzacji tego surowca. O ile bowiem propolis polski jest podobny pod tym względem do propolisu pochodzącego z krajów Europy Środkowej i Wschodniej, to propolis z Wysp Kanaryjskich i Chile nie zawiera ich wcale, a propolis chiński może zawierać w swoim składzie ponad 80% tych związków (5).
Warto zatem prześledzić, które grupy związków chemicznych występują w propolisie krajowym i jaka jest ich zawartość w poszczególnych próbkach. Jest to o tyle istotne, ponieważ większość propolisu polskiego zbierana jest przez pszczoły z pączków liściowych topoli czarnej ( Populus nigra). Świadczą o tym badania Maciejewicz i Markowskiego (6, 7). Jednak może on pochodzić także z innych roślin krajowych. Między innymi ważnym źródłem propolisu są pączki liściowe różnych gatunków brzozy ( Betula) i olchy ( Alnus) (8).
A zatem przegląd składu chemicznego polskiego propolisu wypada rozpocząć od grup związków chemicznych, które występują w największej ilości w EEP lub są dla tego produktu bardzo charakterystyczne. Należy do nich zaliczyć związki flawonoidowe (w tym chalkony), kwasy aromatyczne (w tym kwasy fenolowe) i estry kwasów aromatycznych.
Związki flawonoidowe
Badania wielu autorów wskazują, że w EEP występują wyłącznie aglikony flawonoidowe z grup flawonów, flawonoli i flawononów oraz chalkony (tab. 2). Najliczniej występują flawony – tektochryzyna i chryzyna oraz flawonony – pinostrobina i 4,7-dimetyloeter naryngeniny. Pozostałe flawonoidy, w liczbie 12, występują w EEP rzadziej (tab. 2). Zwykle w EEP występuje od 6 do 9 związków flawonoidowych (5, 6, 10, 11). Wzory chemiczne tektochryzyny, chryzyny i pinostrobiny przedstawiono na ryc. 2.
Tabela 2. Częstotliwość występowania związków flawonoidowych w EEP.
| Związki flawonoidowe | Piśmiennictwo |
Flawony
Tektochryzyna
Chryzyna
Apigenina
4´, 5,7,-Trihydroksy-3,3´-dimetoksyflawon
Genkwanina
3´,4´,5,7-Tetrahydroksy-3-metoksyflawon
Pilloina
Eukaliptyna
3,5-Dihydroksy-4´,7-dimetoksyflawon
Flawonole
3-Metyloeter kwercetyny
Galangina
Kemferol
Flawonony
Pinostrobina
4´,7-Dimetyloeter naryngeniny
5-Hydroksy-4´,-dimetoksyflawon
Pinocembryna
Chalkony
Chalkon pinostrobinowy |
2, 9, 10, 12, 13, 14, 16
9, 10, 12, 13, 14, 17
14, 18
13, 14
10
13
10
10
9
14, 18
10
10
12, 13, 14, 16
12, 13, 14
12, 13
10
9, 10 |
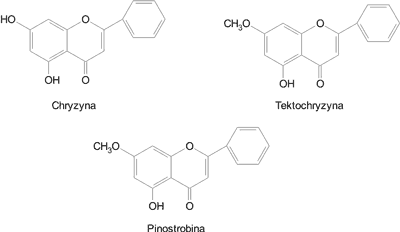
Ryc. 2. Budowa chemiczna flawonoidów najczęściej występujących w EEP.
Na podstawie danych zebranych w tabeli 3 można przyjąć, że zawartość związków flawonoidowych występujących w EEP mieści się w granicach 2,7-1,08%. Średnia zawartość wynosi 5,0% (tab. 3).
Tabela 3. Zawartość związków flawonoidowych w EEP.
| Zródło publikacyjne | Liczba prób | Zawartość flawonoidów (%) |
| zakres | średnia |
Ellnain-Wojtaszek i wsp. (15)
Kędzia i wsp. (19)
Kędzia i wsp. (20) | 7
3
10 | 4,37-10,81
3,92-6,00
2,72-5,21 | 6,18
4,90
3,96 |
| Łącznie | 20 | 2,72-10,81 | 5,0 |
Kwasy i estry aromatyczne
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Kędzia B. Pochodzenie propolisu w świetle teorii i badań naukowych. Herba Pol 2008, 54. 2. Lutomski J, Speichert H, Kędzia B i wsp. Ustalanie aktywnych biologicznie komponentów spożywczych i składu chemicznego propolisu w aspekcie preparatów spożywczych, ewentualnie parafarmaceutycznych. Dokumentacja tematu Nr 4/78. Inst Rośl Przetw Ziel, Poznań 1978. 3. Kownacka I. Oznaczanie zawartości propolisu w wodno-etanolowych wyciągach z tego surowca. Opracowanie Przeds. Pszczel-Farm. Apipol-Farma, Myślenice 2000. 4. Meresta T. Ekstrahowanie propolisu. Pszczelarstwo 1997; Nr 3:5-6. 5. Kędzia B. Skład chemiczny i aktywność biologiczna propolisu pochodzącego z różnych rejonów świata. Post Fitoter 2006; Nr 1:23-35. 6. Maciejewicz W. Oznaczanie metodą GC-MS składu chemicznego olejków wyodrębnionych z łusek pączków topoli Populus nigra i propolisu. IV Ogólnopolska Konf Nauk nt. Zastosowanie metod chromatograficznych w badaniach fitochemicznych i biomedycznych. Lublin 1995: P-65. 7. Maciejewicz W, Markowski W. Identification of flavonoids aglicones by GC-MS from propolis collected in Southern Poland. 2nd Int Symp on Chromatography of natural products. Lublin - Kazimierz Dolny 2000, P-34, 76. 8. Warakomska Z, Maciejewicz W. Microscopic analysis of propolis from Polish regions. Apidologie 1992; 23:227-83. 9. Maciejewicz W. Skład chemiczny propolisu: najnowsze badania oraz doświadczenia własne. V Miądzynar Symp Apiter, Zagadnienia wybrane. Wyd Pol Zw Pszczel Kraków-Kamianna 1986; 95-102. 10. Maciejewicz W. Izolacja i identyfikacja związków flawonoidowych z propolisu zebranego na terenie Polski. IV Ogólnopolska Konf Nauk nt. Zastosowanie metod chromatograficznych w badaniach fitochemicznych i biomedycznych. Lublin 1995, P-72. 11. Maciejewicz W, Markowski W. Identification of flavonoids aglicones by GC-MS method from propolis collected in Southern Poland. 2nd Intern Symp on Chromatography of natural products. Lublin-Kazimierz Dolny 2000, 76. 12. Ellnain-Wojtaszek M, Hładoń B, Bylka W i wsp. Wyodrębnianie i badanie aktywności cytostatycznej składników frakcji eterowej propolisu DEEP. Herba Pol 1982; 28:51-9. 13. Ellnain-Wojtaszek M, Bylka W, Skrzypczak L i wsp. Badania fitochemiczne i biologicznie czynnych frakcji propolisu. V Międzynar Symp Apiter, Streszcz Ref Kraków 1985; 28. 14. Kędzia B, Ellnain-Wojtaszek M, Bylka W i wsp. Aktywność mikrobiologiczna różnych frakcji propolisu. V Międzynar Symp Apiter, Streszcz Ref, Kraków 1985; 18. 15. Ellnain-Wojtaszek M, Marcinek A, Kowalewski Z i wsp. Standaryzacja wyciągów z propolisu za pomocą ilościowego oznaczania flawonoidów. Herba Pol 1990; 36:145-53. 16. Pniewska DŁ. Poszukiwanie składników propolisu o działaniu biologicznym. Praca magisterska. AM w Poznaniu, Poznań 1979. 17. Toboła E. Związki flawonoidowe propolisu. Praca magisterska. AM w Poznaniu, Poznań 1979. 18. Żelisławska R. Chemiczna analiza frakcji propolisu. Praca magisterska. AM w Poznaniu, Poznań 1984. 19. Kędzia B, Otta H, Hołderna-Kędzia E i wsp. Antybiotyczne działanie pyłku kwiatowego. XXXI Nauk Konf Pszczel Puławy 1994; 23-4. 20. Kędzia B, Jankowiak J, Mścisz A i wsp. Badania nad standaryzacją ekstraktów etanolowych z propolisu. XXXV Nauk Konf Pszczel Puławy 1998; 33-5. 21. Maciejewicz W. Oznaczanie metodą GC-MS składu chemicznego olejków wyodrębnionych z łusek pączków topoli Populus nigra i propolisu. IV Ogólnopolska Konf Nauk nt. Zastosowanie metod chromatograficznych w badaniach fitochemicznych i biomedycznych. Lublin 1995; P-65. 22. Maciejewicz W, Daniewski M, Mielniczuk Z. Gas chromatography-mass spectrometry investigation of propolis. Analysis of phenolic acids and sugars. Chem Anal 1984; 29: 421-7. 23. Maciejewicz W, Scheller S, Daniewski M. Gas chromatography - mass spectrometry investigation of propolis. Analysis of sesquiterpenes. Acta Polon Pharm 1983; 40:251-3. 24. Maciejewicz W, Daniewski M, Mielniczuk Z i wsp. Gas chromatography - mass spectrometry investigation of propolis. Analysis of β-steroids. Acta Polon Pharm 1982; 39:277-9. 25. Scheller S, Szaflarski J, Tustanowski J i wsp. Biological properties and clinical application of propolis. I. Some physico-chemical properties of propolis. Arzneim-Forsch 1977;27:889-90. 26. Scheller S, Stojko A, Tustanowski J i wsp. Regeneracyjne właściwości propolisu. Now Wet 1978; 8:175-80. 27. Bogdaszewska-Czabanowska J, Szwarc K i wsp. Badania alergologiczne nad właściwościami uczulającymi kitu pszczelego (propolis). Przegl Dermatol 1980; 67:747-52. 28. Kaczmarek F, Dębowski WJ. Występowanie α- i β-amylazy w propolisie. Acta Polon Pharm 1983; 40:121. 29. Kaczmarek F, Dębowski WJ. Występowanie amylaz i esteraz w propolisie. V Międzynar Sym Apiter Streszcz Ref, Kraków 1985; 31. 30. Kędzia B, Hołderna-Kędzia E. Miód. Skład i właściwości biologiczne. Przeds Wyd Rzeczposp SA, Warszawa 2008; 75-81.


