© Borgis - Postępy Fitoterapii 1/2009, s. 12-18
*Przemysław Dudko
Wpływ dowymieniowej infuzji ekstraktu z propolisu i wybranych mykostatyków na stan czynnościowy gruczołu mlekowego u krów
INFLUENCE OF COW´S UDDER INFUSION OF PROPOLIS AND ANTIMYCOTIC PREPARATIONS ON ACTIVITY OF MAMMARY GLAND IN COWS
Katedra Weterynarii Rolniczej Uniwersytetu Przyrodniczego w Poznaniu
Kierownik Katedry: prof. dr hab. Jędrzej Jaśkowski
Summary
A comparison of reaction in the cow´s udders on infusions of the ethanol extract of propolis (EEP) water emulsion, also two antimycotic preparations (Pimafucin and Pimavecort) containing the natamycin were the object of this work. The in offensiveness estimation of the tested drugs was made on 15 healthy ncb lactating cows of 450-550 kg of body weight. Intra-mammary introduction of EEP water emulsion causes changes in milk, but the latter recess after 1.5-2 days from the last application of the preparation. More intensive changes in milk after introduction of Pimafucin disappeared after three days. The serious milk changes and clinical stiffening of the udders after introduction of Pimavecort disappeared after eight days from the last infusion. In five other healthy cows there was stated the carency period of milk after triple infusions of EEP water emulsion. The yellow pigmentation in first streams of milk after the introduction of propolis may aid in maintaining the carency period for milk. After 72 and 120 hours from the last infusion of the propolis preparation no track values of this drug, typical of its biological activity, were stated in cow´s milk on the basis of laboratory tests.

Wstęp
Pozytywne wyniki badań in vitro i in vivo odnośnie przeciwwirusowego (1-7), przeciwbakteryjnego (1-3, 8-10) i przeciwgrzybiczego (1-3, 11, 12) oddziaływania wyciągów z propolisu (EEP) stały się bodźcem do podjęcia badań nad nieantybiotykowym lekiem dowymieniowym.
Celem pracy było zbadanie reakcji wymion krów na infuzję emulsji wodnej EEP oraz dwóch komercyjnych leków przeciwgrzybiczych Pimafucin i Pimavecort, jak też ustalenie okresu karencji zwierząt po leczeniu emulsją EEP.
Materiał i metody
Badania wykonano na 15 krowach rasy ncb o masie 450-550 kg, będących w okresie laktacji. Zwierzęta były klinicznie zdrowe i nie wykazywały w badaniu przedmiotowym żadnych uchwytnych zmian w wymieniu i mleku. Podczas wykonywania badań przebywały one w tej samej oborze i były dojone mechanicznie przez tę samą osobę. Krowy podzielono losowo na trzy grupy liczące po 5 zwierząt. Każdej grupie zwierząt podawano jeden z wymienionych leków. Do badań użyto emulsji wodnej EEP oraz dwóch leków przeciwgrzybiczych: Pimafucin i Pimavecort. Leki te zawierały w swym składzie antybiotyk przeciwgrzybiczy natamycynę, cechujący się szerokim zakresem działania na drożdżaki. Poza tym Pimavecort, oprócz natamycyny zawierał neomycynę i hydrokortyzon.
W oparciu o wyniki oznaczeń aktywności przeciwbakteryjnej i przeciwgrzybiczej in vitro do dalszych badań użyto 2% emulsji wodnej EEP (2). W tym celu do 50 ml 20% EEP w jałowej butelce Le Groux dodawano 450 ml wyjałowionej wody redestylowanej. Po dokładnym wymieszaniu uzyskiwano emulsję o żółto-mlecznym zabarwieniu i przyjemnym zapachu. Preparaty Pimafucin i Pimavecort rozpuszczano w 100 ml jałowej wody redestylowanej.
Do płatów doświadczalnych (ćwiartki b i d lewej połowy wymienia) wprowadzano trzykrotnie, w odstępach co 24 godz., po 100 ml badanych leków, a płaty a i c prawej połowy wymienia traktowano jako kontrolne. Przed podaniem leków, a także przez 12 dni po ich infuzji, przed każdym udojem (2 x dziennie) wykonywano badanie kliniczne wg Udalla (13). Mleko oceniano organoleptycznie na płytce Schalma (2) i pobierano próbki mleka z badanych ćwiartek do badań laboratoryjnych. W laboratorium próbki mleka nanoszono na szkiełka podstawowe i po zabarwieniu preparatów metodą Bradhorsta liczono pod mikroskopem liczbę komórek somatycznych w 1 ml mleka metodą Prescot-Breeda (2). Z uzyskanych podczas kolejnych badań wartości wyliczono średnie arytmetyczne dla płatów doświadczalnych i kontrolnych każdej grupy.
Wyniki obserwacji klinicznych do 11 dnia włącznie zebrano w tabeli 1, a średnie grupowe liczby komórek somatycznych przedstawiono na ryc. 1, 2 i 3, z uwzględnieniem wartości maksymalnych i minimalnych (rozrzut wyników).
Tabela 1. Ocena kliniczna stanu wymienia i organoleptyczna mleka po dowymieniowej infuzji badanych preparatów przeciwgrzybiczych.
Badane preparaty | Zmiany organoleptyczne mleka i kliniczne w wymieniu powstałe pod wpływem dowymieniowej infuzji badanych preparatów |
| przed infuzją | w czasie infuzji | po infuzji preparatów |
| 24 h | 12 h | 0 | 12 h | 24 h | 36 h | 48 h | 60 h | 72 h | 84 h | 96 h | 108 h | 120 h | 132 h | lOd | lid |
| Propolis | d | n | n | n | b | b | b/strz | b/strz | b/lw | b/lw | n | n | n | n | n | n | n |
| k | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| Pimafucin | d | n | n | n | n | strz | strz | sw | strz | sw | sw | lw | lw | n | n | n | n |
| k | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| Pimavecort | d | n | n | n | strz/lz | sw/lz | sw/lz | sw/lz | sw/lz | strz/lz | kr/lz | strz/lz | sw/lz | lw/lz | lw/lz | n | n |
| k | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
Objaśnienia: d – płaty doświadczalne, k – płaty kontrolne, n – brak zmian klinicznych w wymieniu i organoleptycznych w mleku; zmiany organoleptyczne w mleku: b – zmiana barwy, lw – mleko lekko wodniste, sw – mleko silnie wodniste, strz – obecność strzępków (kłaczków) w mleku, kr – obecność krwi w mleku; zmiany kliniczne w wymieniu: lz – lekkie zwłóknienie płata, wz – wyraźne zwłóknienie, h – liczba godzin, d – liczba dób.
Tabela 2. Wyniki oznaczania okresu karencji propolisu w mleku po trzykrotnej dowymieniowej infuzji emulsji EEP.
| Szeregi wzorców | Stężenia emulsji propolisu w mleku |
| A | B | |
| 1 | I | 0% |
| 2 | II | 2% |
| 3 | III | 1% |
| 4 | IV | 0,5% |
| 5 | V | 0,25% |
| 6 | VI | 0,125% |
| 7 | VII | 0,0625% |
| 8 | VIII | 0,03125% |
| 9 | IX | 0,015625% |
| 10 | X | kontrola |
| Numer próby | Ćwiartki wymienia | Czas ostatniej infuzji preparatu w godzinach | Odpowiednik barwy wzorca A | Odpowiednik barwy wzorca B |
| 1 | a | 12 | 5 | V |
| 2 | b | 1 | IX |
| 3 | c | 1 | VIII |
| 4 | d | 1 | IX |
| 5 | a | 24 | 5-6 | VII |
| 6 | b | 1 | I |
| 7 | c | 1 | I |
| 8 | d | 1 | I |
| 9 | a | 48 | 6 | I |
| 10 | b | 1 | I |
| 11 | c | 1 | I |
| 12 | d | 1 | I |
| 13 | a | 72 | 1 | I |
| 14 | b | 1 | I |
| 15 | c | 1 | I |
| 16 | d | 1 | I |
| 17 | a | 120 | 1 | I |
| 18 | b | 1 | I |
| 19 | c | 1 | I |
| 20 | d | 1 | l |
Objaśnienia: 0% – jałowe mleko, kontrola – jałowe mleko + TTC + inokulum, A – wzorce barwy malejących stężeń propolisu w mleku, B – wzorce barwy malejących stężeń propolisu w mleku + TTC + inokulum. Inokulum Bacillus stearotermophilus – 3,6x1014 cfu/ml.
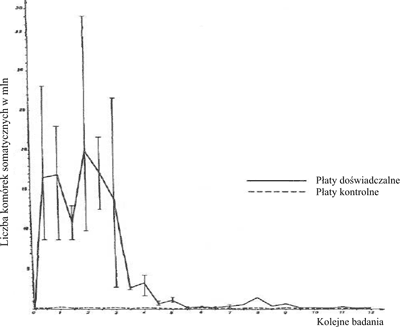
Ryc. 1. Drażniący wpływ emulsji wodnej EEP na wymiona krowie.
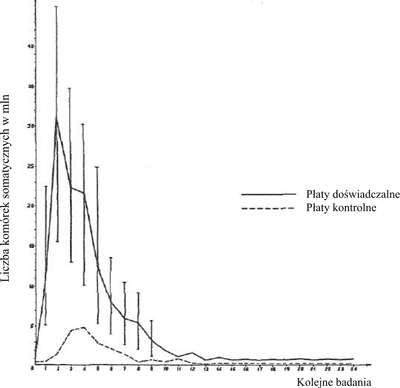
Ryc. 2. Drażniący wpływ preparatu Pimafucin na wymiona krowie.
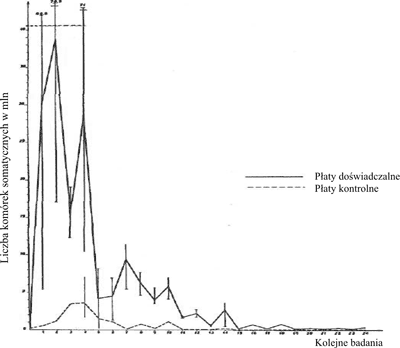
Ryc. 3. Drażniący wpływ preparatu Pimavecort na wymiona krowie.
Badanie nad określeniem czasu karencji propolisu przeprowadzono u 5 klinicznie zdrowych krów, którym do prawego przedniego płata wymienia (ćwiartka a) wprowadzano dozatokowo co 24 godz., przez 3 kolejne dni, po 100 ml 2% emulsji wodnej EEP. Od tych krów pobierano w sposób aseptyczny, po 12, 24, 48, 72 i 120 godz. od ostatniej infuzji dowymieniowej preparatu, próbki mleka z badanych ćwiartek i oznaczano w nich stężenie propolisu według opisanej we wcześniejszej pracy metody Rutczyńskiej-Skoniecznej (14). W tym celu do 10 ml mleka dodawano 0,3 ml 4% roztworu wodnego chlorku 2,3,5-trifenylotetrazolu i 1 ml zawiesiny Bacillus stearothermophilus var. calidolactis G-954 o gęstości 3,6 x 1014cfu/ml, po czym inkubowano w cieplarce o temp. 44°C.
Dla oceny wyników przygotowano dwa szeregi wzorców barwnych. Szereg wzorców A stanowiły kolejno malejące stężenia propolisu w jałowym mleku, przy czym wzorzec 1 – kontrolny zawierał samo mleko. Szereg wzorców B przygotowano wg metody opisanej przez Woźniak (15). Do kolejnych stężeń od 2,0 do 0,01562% propolisu w jałowym mleku dodawano wskaźnika i zawiesiny szczepu testowego. Kontrolę stanowiły: wzorzec I zawierający mleko, wskaźnik i inokulum oraz wzorzec X zawierający samo jałowe mleko. Szereg wzorców B inkubowano przez 24 godz. w temp. 44°C. Obydwa wzorce przechowywano w chłodni w temp. 5°C. Wyniki odczytywano przez porównanie barwy próbek mleka z badanych ćwiartek bezpośrednio po ich pobraniu z szeregiem wzorców A oraz tych samych próbek mleka po dodaniu wskaźnika i inokulum oraz inkubacji z szeregiem wzorców B. Wyniki przedstawiono w tabeli 2. Badania nad drażniącym działaniem wodnej emulsji etanolowego ekstraktu propolisu i mykostatyków na wymię przeprowadzono wg metody Krzyżanowskiego i wsp. (13).
Omówienie wyników
W tabeli 1 przedstawiono wyniki obserwacji klinicznych po dowymieniowym zastosowaniu emulsji propolisu oraz preparatów Pimafucin i Pimavecort. Pierwszą reakcję na dowymieniowe wprowadzenie emulsji EEP stwierdzono już po 12 godz. od pierwszej infuzji, w postaci żółtawego zabarwienia pierwszych 200-300 ml wydojonego mleka. Zabarwienie to powstałe pod wpływem EEP utrzymywało się w czasie podawania preparatu i ustąpiło po 36 godz. od trzeciej infuzji. W drugim dniu doświadczenia stwierdzono ponadto lekką wodnistość mleka, które normalną konsystencję odzyskało również dopiero po 36 godz. od trzeciej infuzji. Przez cały czas prowadzonych obserwacji nie odnotowano żadnych uchwytnych zmian klinicznych w wymieniu i mleku płatów kontrolnych.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Dimov V, Ivanowska N, Bankova V i wsp. Immunomodulatory action of propolis. Vaccine 1992; 10:12,817. 2. Dudko P. Badania nad czynnikami etiologicznymi, leczeniem i zwalczaniem zapaleń gruczołu mlekowego u krów. Dys dokt, Lublin 1986. 3. Hausen BM, Evers P, Stuwe HT i wsp. Studies with further sensitisers from propolis and constituents common to propolis, poplar buds and balsam of Peru. Cont Derm 1992; 26:34. 4. Kędzia B, Iwaszkiewicz J, Gepert B. Badania farmakologiczne etanolowego wyciągu z propolisu. Herba Pol 1988; 34:4,243. 5. Scheller S, Gazda G, Pietsz G i wsp. The ability of ethanol extract of propolis to stimulate plaque formation in immunized mouse spleen cells. Pharm Res Com 1988; 20:4,323. 6. Scheller S, Król W, Wójcik J i wsp. Antitumoral property of ethanolic extract of propolis in mice-bearing Ehrlich carcinoma. Z Naturforsch 1989; 44c:1063. 7. Su ZZ, Lin J, Grunberger D i wsp. Growth suppression and toxicity induced by caffeic acid phenyl ester in type 5 adenovirus-transformed rat embryo cells correlate directly with transformation progression. Cancer Res 1994; 54:1865. 8. Kędzia A. Wrażliwość bakterii bezwzględnie beztlenowych na wyciąg etanolowy z propolisu. Herba Pol 1988; 34:4,267. 9. Rao CV, Desai D, Kaul B i wsp. Effect of caffeic acid esters on carcinogen-induced mutagenicity and human colon adenocarcinoma cell growth. Chem -Biol Interactions 1992; 84:277. 10. Saxena MJ, Chhabra MD, Joshi H.C i wsp. Non-antibiotic herbal therapy for mastitis. Proc 3rd Inter Mastitis Seminar, Tel-Aviv 1995; 5:79. 11. Kędzia B. Hołderna-Kędzia E. Produkty pszczele w profilaktyce i lecznictwie. Wydawnictwo Duszpasterstwa Rolników. Włocławek 1999. 12. Khayal MT, El-Ghazaly MA, El-Khatib A.S. Mechanisms involved in the antiinflammatory effect of propolis extract. Dmgs Expl Clin Res 1993; 19:5,197. 13. Krzyżanowski J, Malinowski E, Rubaj Z. Ocena przydatności piany aerozolowej jako vehiculum do środków leczniczych stosowanych dowymieniowo. Nowości Wet 1980; 10,1,69. 14. Rutczyńska-Skonieczna EM. Metody oznaczania antybiotyków w środkach spożywczych. Wydawnictwa Metodyczne PZH 1972; 42:3,4. 15. Woźniak W. Mikrobiologiczne metody badania leków i materiałów biologicznych. PZWL, Warszawa 1973. 16. Grunberger D, Banerjee R, Eisinger K i wsp. Preferentiai cytotoxicity cells by caffeic phenyl ester isolated from propolis. Experientia 1988; 44:230. 17. Król U, Czuba Z, Scheller S i wsp. Anti-oxidant property of EEP as evaluated by inhibiting the chemiluminiscence oxidation of luminol. Bioch Int 1990; 21:4,539.



