© Borgis - Postępy Fitoterapii 2/2009, s. 122-128
*Bogdan Kędzia
Skład chemiczny propolisu polskiego. Cz. II. Nowe badania
CHEMICAL COMPOSITION OF POLISH PROPOLIS. PART II. NEW STUDIES
Instytut Włókien Naturalnych i Roślin Zielarskich w Poznaniu Oddział Roślin Zielarskich w Poznaniu
Dyrektor Instytutu: prof. dr hab. Grzegorz Spychalski
Summary
The recent studies on Polish propolis showed in ethanolic extracts from this crude drug the presence of determined flavonoid compounds, acyclic and aromatic acids, phenols, phenolic acids and caffeic acid esters. To the most important and useful for standarization groups of chemical compounds of Polish propolis belong: flavonoids (on average 4.8%), including chrysine, galangine, pinocembrine and pinobanxine; phenolic acid (on average 2.6%) including such acids like: caffeic acid, p-cumaric acid and ferulic acid, also caffeic acid esters (on average 1.4%) like phenylethyl and 1.1-dimethylallyl acids.

Wprowadzenie
W I cz. pracy uwzględniono dane dotyczące składu chemicznego propolisu polskiego opublikowane w latach 1978-2000 (1). Uwzględniały one skład surowego propolisu pochodzenia krajowego oraz związki flawonoidowe, kwasy i estry aromatyczne, terpeny i seskwiterpeny, steroidy, biopierwiastki i enzymy oznaczane w ekstrakcie etanolowym z propolisu (EEP) (1).
W II cz. pracy zostały przeanalizowane publikacje obejmujące skład chemiczny EEP pochodzenia krajowego, które ukazały się w latach 2002-2007 (2-5). Potwierdzają one wcześniejsze doniesienia odnośnie składu chemicznego polskiego propolisu, ale także wnoszą nowe elementy poznawcze, wynikające głównie z użycia bardziej nowoczesnych technik badawczych.
W podsumowaniu uwzględniono najbardziej charakterystyczne elementy składu chemicznego EEP pochodzenia krajowego, wynikające z najnowszych opublikowanych na ten temat badań.
Sucha pozostałość i popiół ogólny
Kaleta (2) wykazała, że sucha pozostałość dla 7 próbek EEP, otrzymanych z surowego propolisu krajowego za pomocą 70% etanolu, mieściła się w granicach 76,4-85,6% (średnio 79,2%) (tab. 1). Natomiast popiół ogólny dla 7 próbek EEP wynosił od 0,07 do 0,20% (średnio 0,14%) (tab. 1).
Tabela 1. Zawartość suchej pozostałości i popiołu ogólnego w próbkach EEP pochodzenia krajowego (wg 2).
| Nr próbki | Sucha pozostałość (%) | Popiół ogólny (%) |
1
2
3
4
5
6
7 | 79,8
76,4
85,6
80,9
78,1
76,4
77,2 | 0,10
0,20
0,20
0,10
0,07
0,20
0,10 |
| Średnia | 79,2 | 0,14 |
W obu przypadkach zostały spełnione wymagania Polskiej Normy dla koncentratu propolisowego (PN-A-77627) i Farmakopei Poskiej VII.
Składniki mineralne
Jony cynku, miedzi i żelaza należą do składników mineralnych niezbędnych dla prawidłowego funkcjonowania organizmu. Według Kalety (2) zawartość cynku w EEP mieści się w granicach 5,6-31,6 μg/g (średnio 15,4 μg/g), miedzi w granicach 1,7-2,6 μg/g (średnio 2,2 μg/g), i żelaza w granicach 32,5-72,4 μg/g (średnio 52,9 μg/g) (tab. 2).
Tabela 2. Zawartość jonów miedzi, cynku i żelaza w próbkach EEP pochodzenia krajowego (wg 2).
| Nr próbki | Zawartość jonów metali (?g/g) |
| cynk | miedź | żelazo |
1
2
3
4
5
6
7
8
9
10 | 6,9
6,6
5,6
-
26,0
25,5
16,4
31,6
10,7
9,6 | 1,7
1,8
2,1
2,4
2,5
2,6
2,4
1,7
2,0
2,4 | 72,4
38,2
46,1
39,8
32,5
65,3
63,2
70,7
45,8
55,2 |
| Średnia | 15,4 | 2,2 | 52,9 |
Związki flawonoidowe
Z badań Kalety (2) wynika, że zawartość związków flawonoidowych w płynnych ekstraktach propolisowych, które oznaczano metodą spektrofotometryczną, wynosiła od 2,21 do 6,69% (średnio 4,78%) (tab. 3).
Tabela 3. Zawartość związków flawonoidowych w płynnych ekstraktach propolisowych pochodzenia krajowego (wg 2).
| Nr próbki | Zawartość flawonoidów (%) |
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15 | 4,43
5,15
6,69
5,25
6,46
5,03
6,65
5,42
3,68
4,79
2,21
5,37
5,17
2,54
2,81 |
| Średnia |
4,78
|
Autorka (2) oznaczała ponadto w płynnych ekstraktach propolisowych zawartość wybranych związków flawonoidowych, a mianowicie chryzyny (flawon), galanginy (flawonol), pinocembryny i 7-metoksypinocembryny (flawanony) oraz pinobanksyny (flawanonol) (ryc. 1). Z przeprowadzonych badań wynika, że w ekstraktach tych w największej ilości występowała pinocembryna (37,7%) i octan pinobanksyny (20,7%), a następnie 4-metoksypinocembryna (15,8%), galangina (13,8%) i chryzyna (12,0%) (ryc. 2). Co istotne, związki te wykryto we wszystkich 15 badanych płynnych ekstraktach etanolowych. Warto także dodać, że w jednym z losowo przebadanych ekstraktów wykryto obecność tektochryzyny i 5-hydroksy-4´,7-dimetoksyflawonu (2).
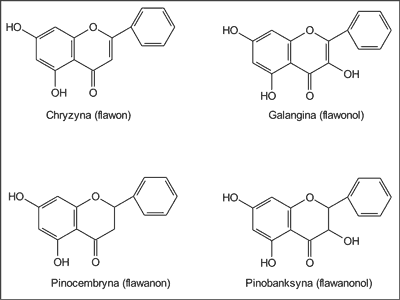
Ryc. 1. Związki flawonoidowe występujące w ekstraktach etanolowych z propolisu krajowego (wg 2).
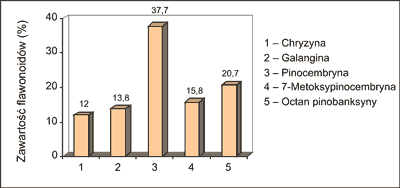
Ryc. 2. Zawartość oznaczanych związków flawonoidowych w płynnych ekstraktach propolisowych pochodzenia krajowego (wg 2).
Kwasy alifatyczne i aromatyczne
Maciejewicz i wsp. (3) z 4 płynnych etanolowych ekstraktów propolisowych, za pomocą ekstrakcji eterowej, kwaśnego węglanu amonowego i kwasu solnego o pH 3,0, otrzymali frakcje kwaśne zawierające w swoim składzie kwasy alifatyczne i aromatyczne.
We frakcjach kwaśnych z propolisu wykryto 7 kwasów alifatycznych i kwas 2-hydroksykapronowy (tab. 4), w tym kwas propionowy, kwas 3,4-dihydroksymasłowy (ryc. 3), a także 9 kwasów aromatycznych (tab. 4), w tym kwas benzoesowy, kwas cynamonowy, kwas anyżowy i kwas migdałowy (ryc. 4).
Tabela 4. Występowanie kwasów alifatycznych i aromatycznych w płynnych etanolowych ekstraktach z propolisu pochodzenia krajowego (wg 3).
Kwasy alifatyczne
Kwas propionowy
Kwas 3,4-dihydroksymasłowy
Kwas 3-hydroksymasłowy
Kwas 4-hydroksymasłowy
Kwas 3-hydroksy-3-metylomasłowy
Kwas 3-hydroksy-3-metoksymasłowy
Kwas 2-hydroksykapronowy |
Kwasy aromatyczne
Kwas benzoesowy
Kwas cynamonowy
Kwas anyżowy (p-metoksybenzoesowy)
Kwas migdałowy
Kwas hydrocynamonowy
Kwas 4-metoksycynamonowy
Kwas 3,4-dimetoksycynamonowy
Kwas 2-amino-3-metoksybenzoesowy
Kwas ftalowy |
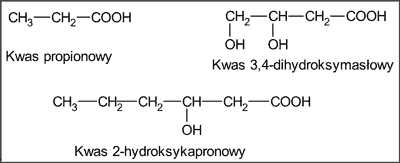
Ryc. 3. Kwasy alifatyczne występujące w płynnych ekstraktach etanolowych z propolisu pochodzenia krajowego (wg 3).
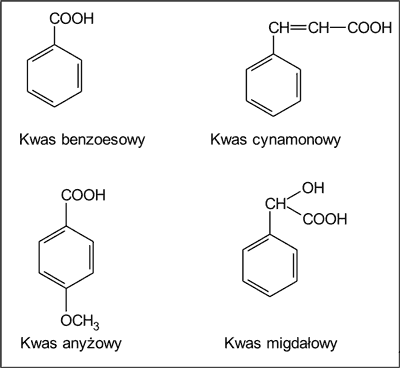
Ryc. 4. Kwasy aromatyczne występujące w płynnych ekstraktach etanolowych z propolisu pochodzenia krajowego (wg 3).
Kaleta (2) w płynnym ekstrakcie etanolowym z propolisu wykryła ponadto kwas 3-(4-hydroksyfenylo)-2-propionowy.
Badania Maciejewicz i wsp. (3) wykazały, że frakcje kwaśne stanowiły od 3,49 do 8,82% suchej masy ekstraktu etanolowego z propolisu (tab. 5). We frakcjach kwaśnych znajdowało się od 26,9 do 78,3% kwasów, zarówno alifatycznych, jak i aromatycznych, w tym od 0,03 do 2,44% kwasu benzoesowego oraz od 0,01 do 0,09% kwasu cynamonowego (tab. 5).
Tabela 5. Zawartość frakcji kwaśnej oraz kwasów alifatycznych i aromatycznych w suchych ekstraktach etanolowych z propolisu pochodzenia krajowego (wg 3).
| Nr próbki | Sucha masa frakcji kwaśnej | Zawartość kwasów (%) |
| ogólna | kwas benzoesowy | kwas cynamonowy |
1
2
3
4 | 3,53
6,14
8,82
3,49 | 77,20
26,90
78,31
30,86 | 0,06
0,03
2,44
0,04 | 0,01
0,04
0,09
0,01 |
| Średnia | 5,50 | 53,32 | 0,64 | 0,04 |
Fenole
Do fenoli zalicza się dużą grupę związków stanowiących wodorotlenowe pochodne węglowodorów aromatycznych. Grupy wodorotlenowe mogą być wolne lub podstawione. W grupie tej znajdują się wolne fenole, alkoholofenole, aldehydofenole, ketonofenole i eterofenole. Kwasy fenolowe stanowią odrębną grupę i ich występowanie w propolisie krajowym zostanie omówione osobno. Z kolei do wielofenoli (polifenoli) należą połączenia kilku pierścieni aromatycznych z wolnymi lub podstawionymi grupami wodorotlenowymi, takie jak flawonoidy (opisane uprzednio), antocyjany i garbniki.
Maciejewicz i wsp. (3) we frakcji kwaśnej z propolisu wykryli 8 fenoli (tab. 6), wśród nich pirokatechol, hydrochinon, 4-metoksyfenol, wanilinę (aldehyd 3-metoksysalicylowy) i 3-hydroksyacetofenon (ryc. 5).
Tabela 6. Fenole wykryte w płynnych etanolowych ekstraktach z propolisu pochodzenia krajowego (wg 3).
Fenole
Pirokatechol
Hydrochinon
1,4-Dimetylohydrochinon
4-Metoksyfenol
4-Hydroksybenzaldehyd
Wanilina (aldehyd 3-metoksysalicylowy)
3-Hydroksyacetofenon
Fenetol (eter etylowo-fenylowy) |

Ryc. 5. Fenole występujące w płynnych etanolowych ekstraktach z propolisu pochodzenia krajowego (wg 3).
Kwasy fenolowe
Kwasy fenolowe (fenolokwasy) należą do związków, które zbudowane są z pierścienia benzoesowego oraz grup karboksylowych i hydroksylowych (fenolowych). Często grupy hydroksylowe ulegają metylacji i powstają grupy metoksylowe. W świecie roślinnym największe znaczenie mają fenolokwasy pochodne kwasu benzoesowego i cynamonowego.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Kędzia B. Skład chemiczny propolisu polskiego. Cz. I. Początkowy okres badań. Post Fitoter 2009; Nr 1:39-44. 2. Kaleta J. Analiza fizykochemiczna propolisu i możliwości jego standaryzacji. Praca doktorska. Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii Nieorganicznej i Analitycznej, Kraków 2007. 3. Maciejewicz W, Daniewski M, Dzido TH i wsp. GC-MS and HPLC analysis of phenolic acids extracted from propolis and from Populus nigra bud exudate. Chem Anal 2002; 47:21-30. 4. Krzek J, Kaleta J, Hubicka U i wsp. Reversed-phase high-performance liquid chromatography determination of selected phenolic acids in propolis concentrates in terms of standarization for drug manufacturing purposes. J AOAC Int 2006; 89:352-8. 5. Hubicka U, Krzek J, Kaleta J i wsp. Evaluation of densitometric TLC for quantitative analysis of selected phenolic acids for standarization of propolis concentrates. J Plan Chromatogr 2006; 19: 449-53. 6. Marcucci MC, Ferreres F, Garcia-Viguera C i wsp. Phenolic compounds from Brazilian propolis with pharmacological activities. J Ethnopharmacol 2001; 74:105-12.





