© Borgis - Medycyna Rodzinna 2/2006, s. 45-53
*Małgorzata Michalska-Jakubus1, Tomasz Jakubus2, Dorota Krasowska1
Czerniak – epidemiologia, etiopatogeneza i rokowanie
Malignant melanoma – epidemiology, etiopathogenesis and prognosis
1Katedra i Klinika Dermatologii, Wenerologii i Dermatologii Dziecięcej AM w Lublinie
Kierownik Kliniki: prof. dr hab. n. med. Grażyna Chodorowska
2Klinika Chorób Wewnętrznych, Zawodowych i Toksykologii Instytutu Medycyny Wsi w Lublinie
Kierownik Kliniki: prof. dr hab. n. med. Wojciech Sodolski
Summary
Malignant melanoma is one of the most rapidly increasing cancers worldwide over the last decades. There are about 133 000 new cases of melanoma diagnosed each year. The main and wellknown risk factor for melanoma development is UV irradiation but some genetic predisposition seems to be involved, too. There is still no effective therapy for this tumor, so it is a potentially fatal disease. However there is a chance of complete cure if detected early enough. The future for melanoma vaccines is promising.
This paper will discuss present data about epidemiology. pathogenesis and prognostic factors in malignant melanomas.

Czerniak (łac. melanoma malignum) jest nowotworem złośliwym wywodzącym się z melanocytów komórek barwnikowych pochodzenia neuroektodermalnego, które we wczesnym okresie rozwoju embrionalnego wywędrowują z cewy nerwowej do różnych tkanek i narządów (skóra, błony śluzowe przewodu pokarmowego, układu moczowo-płciowego, dróg oddechowych, opony mózgowe, błona naczyniowa oka). Komórki te występują w warstwie podstawnej naskórka, gdzie syntetyzują i wydzielają swoisty barwnik – melaninę, warunkujący fenotyp skóry (tzw. karnację) i jej wrażliwość na promieniowanie ultrafioletowe (UV). Najczęstszym punktem wyjścia czerniaka jest skóra, ale niemal co 10-ty czerniak rozwija się pierwotnie w innych niż skóra narządach, najczęściej w gałce ocznej oraz błonach śluzowych jamy ustnej i narządów płciowych (tab. 1) (14).
Tabela 1. Umiejscowienie czerniaka na podstawie Warszawskiego Rejestru Nowotworów (1987-2003).
| Umiejscowienie czerniaka | % |
| Skóra | 91 |
| ? kończyny dolne | 32,6 (głównie u kobiet) |
| ? tułów | 31,6 (głównie u mężczyzn) |
| ? kończyny górne | 14,9 |
| ? głowa i szyja | 11,1 |
| ? inne | 9,8 |
| Pozaskórne | 9 |
| ? spojówki oka i gałka oczna | 70,9 |
| ? okolica anogenitalna | 16,5 |
| ? nosogardło, krtań i zatoki | 7,1 |
| ? CUN | 2,4 |
| ? żołądek | 0,8 |
Epidemiologia
Pomimo, że czerniak stanowi zaledwie 1% nowotworów występujących u człowieka, to stanowi istotny problem współczesnej onkologii i dermatologii, ze względu na obserwowany od kilkudziesięciu lat ogólnoświatowy dynamiczny wzrost zachorowalności oraz z uwagi na stosunkowo młody wiek chorych (30-50 lat) i związane z tym konsekwencje społeczne (13, 22).
Badania epidemiologiczne wskazują, że zapadalność na czerniaka wzrasta średnio o 5% rocznie, a co 10 lat liczba nowych przypadków ulega podwojeniu (12, 16). Wzrost zachorowań dotyczy przede wszystkim rasy białej. Obecnie liczbę zachorowań na świecie szacuje się na 133 tys. rocznie (22). Przewiduje się, że w roku 2010 życiowe ryzyko zachorowania na czerniaka wzrośnie 2-4-krotnie (z 1/100-1/200 do 1/50) (3, 7).
Zachorowalność wykazuje znaczne różnice geograficzne. Najwyższe współczynniki zachorowalności obserwuje się wśród ludności napływowej Australii i Ameryki Północnej oraz w Europie (tab. 2) (22).
Tabela 2. Współczynniki zachorowalności na czerniaka skóry na świecie na podstawie CIFC (1993-1997).
| Kraj | Mężczyźni | Kobiety |
| Australia | 27,3 | 24,6 |
| Europa | 10,0 |
| Szwajcaria | 15,5 | 13,1 |
| Francja | 9,4 | 11,0 |
| Wielka Brytania | 5,8 | 7,4 |
| Włochy | 5,5 | 5,9 |
| Polska | 4,1 | 4,1 |
| USA | 11,3 | 9,3 |
| Japonia | 0,3 | 0,3 |
| Indie | 0,3 | 0,2 |
Polska należy do krajów o średnioniskiej zachorowalności na czerniaka. Według danych Krajowego Rejestru Nowotworów w 2002 roku w Polsce rozpoznano 1831 nowych zachorowań na czerniaka skóry, co daje 15 miejsce wśród zachorowań na nowotwory złośliwe (22). Natomiast jako przyczyna zgonu na nowotwór złośliwy czerniak zajął w 2002 roku 19 miejsce z liczbą zgonów 875 u obu płci (424 mężczyzn i 451 kobiet). Surowy współczynnik umieralności wynosił w tym samym roku 2,3/100 tys. u obu płci, natomiast współczynnik standaryzowany był wyższy u mężczyzn (1,8) niż u kobiet (1,4). Podobnie jak na świecie, także w Polsce obserwuje się dynamiczny wzrost zachorowań. W latach 1982-2002 liczba nowych przypadków czerniaka skóry wzrosła w polskiej populacji blisko 3-krotnie, a liczba zgonów w tym samym okresie – ponad 2-krotnie (ryc. 1 i 2). Zmniejszył się natomiast wskaźnik śmiertelności (iloraz liczby zgonów do liczby zachorowań), co świadczy o nieco lepszej wyleczalności czerniaka w Polsce w ostatnich latach (22).
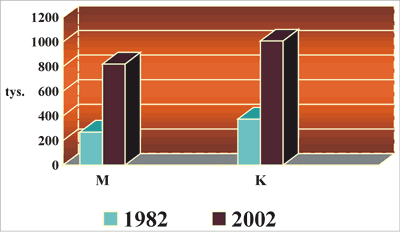
Ryc. 1. Liczba zachorowań na czerniaka skóry w Polsce w latach 1982-2002.
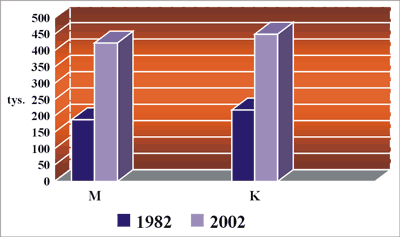
Ryc. 2. Liczba zgonów z powodu czerniaka skóry w Polsce w latach 1982-2002.
Czerniak jest nowotworem osób w średnim wieku, a zachorowania u dzieci przed okresem pokwitania należą do rzadkości. W rejonach o największej zachorowalności nie stwierdza się istotnych różnic w zależności od płci. W Polsce czerniaki nieco częściej rozpoznaje się u kobiet (stosunek M:K = 4:5). Natomiast w niektórych krajach (np. w Szkocji) wzrost zachorowań wśród kobiet osiągnął plateau, podczas gdy u mężczyzn wykazuje tendencję wzrostową. U mężczyzn choroba ma też zwykle cięższy przebieg i gorsza jest odpowiedź na leczenie (12, 22, 24).
Czerniak należy do najbardziej złośliwych nowotworów, ponieważ charakteryzuje się wczesnymi przerzutami, niską wrażliwością na leki cytostatyczne, a w związku z tym wysoką śmiertelnością (11, 12, 22).
Należy jednak podkreślić, że rokowanie u pacjentów z czerniakiem rozpoznanym we wczesnym stadium rozwoju jest bardzo dobre (12).
Przykładem jest sytuacja epidemiologiczna w krajach o wysokiej zachorowalności na ten nowotwór, gdzie dzięki wysokiej świadomości onkologicznej społeczeństwa i wyczuleniu lekarzy, zwłaszcza pierwszego kontaktu, na różnicowanie zmian barwnikowych i wczesne rozpoznawanie czerniaka skóry, ponad 90% przypadków diagnozowanych jest w okresie wzrostu miejscowego (ograniczonego do skóry/błony śluzowej). W Polsce większość chorych zgłasza się do lekarza z już zaawansowanym czerniakiem i obecnością przerzutów w węzłach chłonnych lub narządach wewnętrznych (24).
Patogeneza
Odpowiedź na pytanie „jak powstaje czerniak” pozostaje niepełna. Uważa się, że rozwój tego nowotworu, podobnie jak wielu innych guzów złośliwych, jest wynikiem wzajemnego oddziaływania szkodliwych czynników egzogennych (środowiskowych) oraz endogennych, przede wszystkim zmian w genomie melanocytów warunkujących większą wrażliwość tych komórek na mutagenne działanie czynników zewnątrzpochodnych (15).
Coraz częściej czerniak określany jest jako choroba genetyczna, spowodowana kumulowaniem się mutacji, tzn. trwałych zmian, w genomie melanocytów. W rozwoju czerniaka bierze się pod uwagę udział co najmniej 4 genów zlokalizowanych na chromosomach 1, 6, 7 i 9, a należących do genów supresorowych i naprawy DNA, genów czynników transkrypcyjnych oraz genów związanych z przekaźnictwem sygnałów komórkowych. Główną rolę w nabywaniu przez melanocyty fenotypu złośliwego przypisuje się zaburzeniu równowagi między genami supresorowymi a protoonkogenami. Inaktywacja genów należących do pierwszej grupy odgrywa rolę w rozwoju ponad 50% przypadków czerniaka. Zidentyfikowano niektóre zmiany o kluczowym znaczeniu w procesie transformacji nowotworowej melanocytów i nabywaniu przez komórki czerniaka zdolności do tworzenia przerzutów, m.in. zahamowanie ekspresji genu p16/INK4 (MTS1 – multiple tumor supressor gene 1), którego produkt białkowy (białko p16) pełni istotną rolę w regulacji cyklu komórkowego, a jego brak prowadzi do niekontrolowanego wzrostu komórek. Wypadnięcie funkcji tego genu stwierdza się w 25-40% przypadków sporadycznie występującego czerniaka, a odziedziczone mutacje w genie aż u 30-50% osób z tzw. czerniakiem rodzinnym, czyli pochodzących z rodzin o dużej częstości występowania tego nowotworu (3, 15, 20). Test wykrywający mutacje w obrębie genu MTS1 (Melaris(r); Myriad Genetic Laboratories) jest obecnie jedynym dostępnym klinicznie testem w diagnostyce rodzinnych predyspozycji do zachorowania na czerniaka (4). Warto podkreślić, że silnym czynnikiem inaktywującym p16/INK4 jest promieniowanie UV (15).
Dużą rolę w patogenezie czerniaka przypisuje się zmianom w obrębie głównego genu supresorowego, którego produkt – białko p53 zapobiega trwałym mutacjom DNA indukowanym przez światło słoneczne. W miarę progresji guza dochodzi do utraty ekspresji nawet 30-40 genów supresorowych, dlatego czerniaka określa się jako „chorobę genów supresorowych”. Niemniej jednak aktywacja niektórych onkogenów (m.in. rodziny genów RAS) również odgrywa rolę w rozwoju tego nowotworu (15).
Uważa się, że zmiany dziedziczne odgrywają rolę w rozwoju około 10% przypadków czerniaka. Za znaczeniem czynników dziedzicznych przemawia m.in. wyższe ryzyko zachorowania u osób pochodzących z rodzin z dodatnim wywiadem w kierunku tego nowotworu oraz rozwój czerniaka w tym samym wieku i tej samej lokalizacji u bliźniąt monozygotycznych. Identyfikacja mutacji może mieć znaczenie w badaniu predyspozycji rodzinnych do zachorowania, w diagnostyce i rokowaniu, a nawet mieć wpływ na wybór terapii (15). Należy jednak podkreślić, że choroby nowotworowe (w tym czerniak) nie są chorobami dziedzicznymi. Dziedziczy się tylko predyspozycje do zachorowania związane z utrwalonymi zmianami w genomie melanocytów (20).
Czynniki ryzyka
Najistotniejszym czynnikiem ryzyka rozwoju czerniaka skóry jest ekspozycja na promieniowanie ultrafioletowe (UV), przede wszystkim o długości fali 280-320 nm (UVB) zarówno naturalne jak i sztuczne (solaria). Uważa się, że większą rolę niż przewlekła ekspozycja ogrywają krótkie, ale intensywne ekspozycje na światło słoneczne (nawet raz lub dwa razy w czasie wakacji), a przede wszystkim ciężkie oparzenia słoneczne z odczynem pęcherzowym przed 15 rokiem życia (6, 12). Wyjątek stanowią czerniaki wywodzące się ze złośliwej plamy soczewicowatej (tab. 3), które wykazują silny związek z przewlekłą ekspozycją na UV (6). Szkodliwość promieniowania słonecznego i ryzyko rozwoju czerniaka zależy w dużej mierze od szerokości geograficznej – im bliżej równika tym większe natężenie promieniowania UV docierającego do ziemi i większe ryzyko zachorowania. Podobna zależność dotyczy wysokości n.p.m. (3).
Tabela 3. Typy histogenetyczne czerniaka skóry (1, 5, 7, 14).
| Typ | Charakterystyka |
| Czerniak szerzący się powierzchownie (superficial spreading melanoma - SSM) | - najczęstsza postać kliniczna (70%)
- zwykle u osób młodych i w średnim wieku po krótkich, ale intensywnych ekspozycjach na promieniowanie UV
- w skórze odsłoniętej, ale bez cech uszkodzenia posłonecznego
- u kobiet najczęściej na kończynach dolnych (podudzia), u mężczyzn na tułowiu
- płaskie lub płasko-wyniosłe zmiany barwnikowe, początkowo wyraźnie odgraniczone, o policyklicznym brzegu
- długi okres wzrostu śródnaskórkowego (faza in situ), późno przerzuty loko-regionalne
- stosunkowo dobre rokowanie |
| Czerniak guzkowy (nodular melanoma - NM) | - druga co do częstości postać kliniczna (10-20%)
- częściej u mężczyzn (2:1), po 40 rż.
- typowa lokalizacja: skóra głowy, karku i górnej części pleców
- w skórze klinicznie niezmienionej
- wyniosły lub kopulasty guzek, bardzo ciemno zabarwiony i szybko się powiększający, zwykle z owrzodzeniem na powierzchni
- wywiad w kierunku istnienia zmiany zazwyczaj krótki (1-2 lata)
- niemal od początku wzrost wertykalny, szybko daje przerzuty |
| Czerniak z plamy soczewicowatej (lentigo maligna melanoma - LMM) | - 5-10% czerniaków skóry
- u osób starszych, po 60 roku życia
- 2 razy częściej u kobiet
- w skórze odsłoniętej z cechami uszkodzenia posłonecznego jako wynik przewlekłej ekspozycji na promieniowanie UV
- typowa lokalizacja: twarz (policzki, nos, okolica skroniowa lub czołowa)
- nieostro odgraniczona płaska zmiana barwnikowa o dość dużych wymiarach, nieregularnym kształcie i rozkładzie barwnika z obecnością ciemniejszego guzka
- powolny rozwój komponenty inwazyjnej w obrębie złośliwej plamy soczewicowatej (15-20 lat) |
Czerniak podpaznokciowo-kończynowy (dawniej odmiana akralna wywodząca sią ze złośliwej plamy soczewicowatej - acral lentiginous melanoma - ALM)
- czerniak powierzchni dłoniowej lub podeszwowej
- czerniak podpaznokciowy | - rzadko u osób rasy kaukaskiej, najczęstsza odmiana czerniaka u osób należących do rasy czarnej oraz u Azjatów
- prawdopodobnie bez związku z promieniowaniem słonecznym
- skóra powierzchni podeszwowej stóp lub powierzchni dłoniowej rąk oraz okolica około- i podpaznokciowa (najczęściej w obrębie palców, przede wszystkim kciuka i palucha)
- przebieg powolny (1-3 lata)
- początkowo przypomina LMM lub SSM
- nieregularne przebarwienie i zniekształcenie płytki paznokciowej, wynaczynienie krwi pod płytką paznokciową, obrzęk palca
- objaw Hutchinsona (szerzenie się przebarwienia z płytki paznokciowej na obrąbek naskórkowy i/lub opuszkę palca
- tworzenie się wykwitów guzkowych (często amelanotyczne) i przerzuty we wczesnych fazach rozwoju
- ulega rozpadowi ze zniszczeniem płytki paznokciowej
- zwykle złe rokowanie ze względu na późne rozpoznanie
- błędnie rozpoznawane i leczone jako brodawki wirusowe lub krwiaki podpaznokciowe |
| Czerniak amelanotyczny (bezbarwnikowy) | - bardzo rzadka postać
- brak lub znikome ilości barwnika jako wynik mniejszego zróżnicowania komórek, a tym samym większej złośliwości
- zmiany płaskie lub guzkowe |
Fakt występowania czerniaka w miejscach nieeksponowanych na światło słoneczne, takich jak błony śluzowe jamy ustnej i narządów płciowych, sugeruje udział innych czynników w etiopatogenezie tego nowotworu (3). Ważnym czynnikiem ryzyka jest obecność na skórze znamion melanocytowych, zwłaszcza znamion atypowych (patrz niżej) i dużych (> 20 cm średnicy) znamion wrodzonych, tzw. znamion kąpielowych (6, 14).
Trzecim istotnym czynnikiem są ww. uwarunkowania genetyczne związane z czerniakiem rodzinnym oraz fenotyp skóry. Ryzyko zachorowania wzrasta wraz ze zmniejszeniem się zawartości barwnika (melaniny) w skórze, który to barwnik odgrywa kluczową rolę w „odpowiedzi” skóry na światło słoneczne. Reakcja skóry zależy także od typu melaniny. Stwierdzono 4-krotnie większe ryzyko wystąpienia czerniaka u osób z czerwoną odmianą melaniny (feomelaniną) w porównaniu do osób ciemnoskórych, u których dominuje czarna eumelanina, dająca lepsze zabezpieczenie przed UVB. Synteza i rodzaj melaniny jest kontrolowany przez hormon MSH (melanocyte stimulating hormone), który działa przez gen MCR1 (melanocortin receptor 1) występujący w różnych wariantach dla osób o jasnej i ciemnej karnacji (1). Uważa się, że polimorfizm tego receptora może modyfikować ryzyko rozwoju czerniaka w rodzinach z mutacjami w obrębie MTS1 (7). Najbardziej narażone na zachorowanie są więc osoby o jasnej karnacji, rudych lub blond włosach, niebieskich oczach, których skóra łatwo ulega oparzeniom słonecznym (3, 6, 12).
Do grupy szczególnego ryzyka należą także osoby, u których już wcześniej rozpoznano i leczono czerniaka skóry – ryzyko wystąpienia drugiego czerniaka wynosi od 3 do 5% (24). Najwyższe, nawet 1000-krotne (w stosunku do populacji ogólnej) ryzyko rozwoju czerniaka skóry występuje u osób z xeroderma pigmentosum (skóra pergaminowata i barwnikowa), niezwykle rzadką, dziedziczoną autosomalnie recesywnie dermatozą, w której łatwo dochodzi do uszkodzeń genomu melanocytów pod wpływem promieniowania UV ze względu na defekt mechanizmów naprawczych DNA (2).
Do czynników ryzyka rozwoju czerniaka skóry zalicza się także ogólny spadek odporności, np. przy stosowaniu immunosupresji czy w AIDS oraz zmiany hormonalne okresu pokwitania, ciąży i połogu, a także niektóre składniki diety, alkohol, światło lamp fluorescencyjnych i farby do włosów (12).
Czerniak skóry jest nowotworem o zróżnicowanym obrazie klinicznym i kilku podtypach histologicznych różniących się w sposób istotny rokowaniem (tab. 3).
U 50-60% osób do rozwoju czerniaka dochodzi de novo w obrębie skóry pozornie niezmienionej, dlatego lekarz powinien zwrócić szczególną uwagę na pojawianie się nowych zmian barwnikowych, zwłaszcza u osób dorosłych. Pozostałe przypadki czerniaka powstają na podłożu wcześniej istniejących zmian, tzw. prekursorów czerniaka lub stanów przedczerniakowych. Najczęstszymi prekursorami czerniaka są wrodzone znamiona melanocytowe oraz znamiona dysplastyczne. Przemiana złośliwa dotyczy od 5-40% znamion wrodzonych. Ponadto punktem wyjścia czerniaka mogą być znamiona barwnikowe nabyte typu brzeżnego, tzn. z komponentem skórno-naskórkowym. Rzadko przemianie złośliwej ulegają znamiona błękitne (14, 24).
Znamiona barwnikowe wrodzone (naevi congenitales) najczęściej umiejscawiają się na tułowiu, są zwykle większe niż znamiona nabyte (nawet> 20 cm średnicy), bywają owłosione i guzowate. Jeżeli jest to możliwe technicznie i nie spowoduje oszpecenia, to zaleca się ich profilaktyczne wycięcie chirurgiczne jeszcze przed okresem pokwitania (6, 24).
Znamiona barwnikowe atypowe (dysplastyczne) mogą występować jako zmiany pojedyncze lub w tzw. zespole znamion dysplastycznych (ZZD, rodzinny zespół znamion atypowych i czerniaka złośliwego – FAMMM), który często jest uwarunkowany rodzinnie (dziedziczenie autosomalne dominujące). Występują one u około 2-9% populacji i stanowią pośredni etap między zmianą łagodną a czerniakiem. Są większe od zwykłych znamion nabytych i wykazują cechy morfologiczne podobne do czerniaka, a mianowicie nieregularny kształt, nierównomierną powierzchnię, często z obecnością centralnie położonego guzka (tzw. wygląd „sadzonego jajka”) oraz niejednolite zabarwienie. Ryzyko rozwoju czerniaka w przypadku sporadycznie występujących znamion dysplastycznych jest 3-8 razy większe niż dla populacji ogólnej, natomiast w przypadku obciążenia rodzinnego ryzyko to sięga nawet 100% (6, 8, 24). Znamiona melanocytowe nabyte typu łączącego (naevi junctionales) pojawiają się najczęściej u dzieci lub u młodzieży w okresie pokwitania, są płaskie lub tylko nieznacznie wyniosłe, o średnicy nieprzekraczającej 5 mm i jednolitym jasno- lub ciemnobrązowym zabarwieniu. Zdecydowanie mniejsze ryzyko zezłośliwienia dotyczy znamion błękitnych (naevi coerulei), które są zwykle niewielkimi (do 0,5 cm), lekko wyniosłymi lub guzkowymi zmianami o gładkiej powierzchni i charakterystycznym niebieskawym zabarwieniu (6, 24).
U osoby rasy kaukaskiej stwierdza się przeciętnie około 20-25 nabytych znamion barwnikowych. Usuwanie ich ze względów profilaktycznych nie jest uzasadnione, chociaż niektórzy autorzy uważają, że duża ilość znamion łączących zwiększa ryzyko rozwoju czerniaka. Wskazana jest ścisła obserwacja znamion oraz okresowa kontrola onkologiczna (w przypadku ZZD co 6 miesięcy), najlepiej z dokumentacją fotograficzną i badaniem dermatoskopowym (patrz niżej) (3, 6). Znamiona budzące jakiekolwiek podejrzenie należy usuwać (w całości!) chirurgicznie i poddać badaniu histopatologicznemu. Profilaktyczne wycięcie nawet łagodnie wyglądającej zmiany barwnikowej należy rozważyć w przypadku narażenia na przewlekłe drażnienie i mikrourazy (np. kołnierzykiem, gumką od bielizny, butami), które stanowią czynniki sprzyjające transformacji nowotworowej (3, 12).
Jakie zmiany w obrębie znamienia mogą sugerować przemianę złośliwą? Podejrzane są znamiona o średnicy powyżej 6-7 mm, powiększające się oraz te, które stają się wyniosłe, ulegają zgrubieniu. Ponadto dla czerniaka charakterystyczna jest asymetria, zarówno co do kształtu, jak i barwy (nierównomierny rozkład barwnika) oraz nierówne brzegi. Niebezpieczne są także objawy, takie jak owrzodzenie, sączenie czy krwawienie ze zmiany oraz świąd i pieczenie. Wymienione cechy makroskopowe i objawy czerniaka skóry zostały zgrupowane w systemie literowym, który stanowi podstawę klinicznego różnicowania zmian barwnikowych skóry i rozpoznawania czerniaka (tab. 4) (3).
Tabela 4. Reguła ABCDE oceny klinicznej znamion barwnikowych wg Amerykańskiego Towarzystwa Nowotworowego (3, 12).
A (asymmetry) = asymetria
B (borders) = brzegi nierówne, postrzępione
C (color) = kolor różnorodny, niejednolity nierównomierny rozkład barwnika
D (diameter) = średnica > 6-7 mm
E (elevation) = uniesienie zmiany
lub (extention) = powiększanie się średnicy |
Typowym stanem przedczerniakowym są złośliwe plamy soczewicowate (plamy Hutchinsona), uważane nawet za wolno wzrastającego czerniaka w fazie in situ (nieprzekraczającej błony podstawnej naskórka), który może przejść w postać inwazyjną. Występują u osób starszych (po 60 rż.), częściej u kobiet. Typowo lokalizują się w obrębie skóry odsłoniętej z cechami uszkodzenia posłonecznego (twarz, powierzchnia grzbietowa dłoni) i są wynikiem przewlekłej ekspozycji na promieniowanie UV. Początkowo mają postać niewielkich plam barwy brązowej do czarnej, które stopniowo powiększają się, przyjmują nieregularne kształty i zabarwienie, są nieostro odgraniczone od skóry otaczającej. Przebieg i rokowanie są trudne do przewidzenia. Do rozwoju komponenty inwazyjnej dochodzi w około jednej czwartej złośliwych plam soczewicowatych, średnio po 10-20 latach. Dlatego zaleca się ich profilaktyczne usuwanie chirurgiczne (3, 14).
Rokowanie
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Bajcar S., Grzegorczyk L.: Epidemiologia czerniaka. [W:] Atlas diagnostyki zmian barwnikowych skóry. Bajcar S., Grzegorczyk L. (red.). Wydawnictwo Uniwersytetu Jagiellońskiego, Kraków 2000, 9-14. 2. Braun-Falco O., i wsp.: Choroby powstałe pod wpływem ekspozycji na czynniki środowiskowe lub uraz. [W:] Dermatologia. Gliński W., Wolska H. (red. wyd. pol.). Wydawnictwo Czelej, Lublin 2004, 495-543. 3. Braun-Falco O., i wsp.: Zmiany melanocytowe. [W:] Dermatologia. Gliński W., Wolska H., (red. wyd. pol.). Wydawnictwo Czelej, Lublin 2004, 1419-1463. 4. Burrall B.A.: Melanoma Update 2003: Clinical types, genetic testing. http//www.medscape.com. 5. Demierre M-F., et al.: New treatments for melanoma. http//www.medscape.com. 6. Du Vivier A.: Znamiona barwnikowe i czerniak złośliwy. [W:] Atlas dermatologii klinicznej. Majewski S. (red. wyd. pol.). Wydawnictwo Medyczne Urban&Partner, Wrocław 2005, 203-235. 7. Heymann W.R.: New strategies in melanoma. J. Am. Acad. Dermatol., 2006, 54, 147. 8. Kraemer K.H., Green M.H.: Dysplastic nevus syndrome: Familial and sporadic precursors of cutaneous melanoma. Dermatol. Clin., 1985, 3, 225. 9. Krzakowski M.: Leczenie systemowe czerniaka skóry. Współczesna Onkologia, 2003, 7(8), 604. 10. Kunz R.M., Matusik J.: Amelanotyczny czerniak złośliwy jamy ustnej u 16-latki. http//www.oncology.am.poznan.pl/pathology/przypadek5. 11. Langiewicz P., i wsp.: Biochemioterapia przerzutowego czerniaka skóry – doświadczenia kliniczne i analiza perspektyw. Współczesna onkologia, 2003, 7(8), 611. 12. Murawa P., Murawa D.P.: Współczesne metody diagnostyki i leczenia czerniaka skóry. Postępy Dermatologii i Alergologii XIX, 2002, 3, 166. 13. Nejc D.: Biopsja węzła wartowniczego jest ważnym elementem diagnostyki u chorych na czerniaka skóry. Współczesna onkologia, 2003, 7(8), 641. 14. Niesierowska-Guttmejer A.: Patologia czerniaka skóry. [W:] Czerniaki skóry u dorosłych. Ruka W., Nowecki Z.I., Rutkowski P. (red.). MediPage, Warszawa 2005, 16-27. 15. Pawlak W.Z., i wsp.: Biologia molekularna czerniaka skóry. Współczesna Onkologia, 2003, 7(8), 548. 16. Rataj D., i wsp.: Ocena jakości życia pacjentów po radykalnym usunięciu czerniaka skóry. Dermatologia Kliniczna, 2004, 6(4), 215. 17. Rogers R.S., Gibson L.E.: Mucosal, genital and unusual clinical variants of melanoma. Mayo Clinic Proceedings, 1997, 72, 362. 18. Ruka W., i wsp.: Biopsja węzła wartowniczego u chorych na czerniaka skóry – co osiągnęliśmy i dokąd zmierzamy? Współczesna Onkologia, 2003, 7(8), 580. 19. Rutkowski P.: Czynniki rokownicze i klasyfikacja stopni zaawansowania. [W:] Czerniaki skóry u dorosłych. Ruka W., Nowecki Z.I., Rutkowski P. (red.). MediPage, Warszawa 2005, 33-45. 20. Siedlecki J.A.: Biologia molekularna czerniaka. [W:] Czerniaki skóry u dorosłych. Ruka W., Nowecki Z.I., Rutkowski P. (red.). MediPage, Warszawa 2005, 27-33. 21. Sielużycka J.: Diagnostyka obrazowa w czerniaku złośliwym. Współczesna Onkologia, 2003, 7(8), 569. 22. Wronkowski Z., Zwierko M.: Epidemiologia czerniaka skóry. [W:] Czerniaki skóry u dorosłych. Ruka W., Nowecki Z.I., Rutkowski P. (red.). MediPage, Warszawa 2005, 9-16. 23. Wysocki P.J., Mackiewicz A.: Szczepionki czerniakowe. Współczesna Onkologia, 2003, 7(8), 626. 24. http//www.onkolink.pl: Czerniak złośliwy skóry.


