© Borgis - Medycyna Rodzinna 4/2016, s. 239-243
Paweł Kowalczyk1, Ewa Beata Górska2, Jakub Dobrzyński2, Koleta Aleksandra Gabrysiak2, Anna Misiewicz3, Anna Mikołajczuk-Szczyrba3, Teresa Krzyśko-Łupicka4, Sanaa Mahdi Oriabi5, Krystyna Cybulska5
Chorobotwórczość pałeczki ropy błękitnej Pseudomonas aeruginosa w chorobach uszu i oczu
Pathogenicity of Pseudomonas aeruginosa in diseases of the eye and ear
1Bionicum Sp. z o.o, Warszawa
2Samodzielny Zakład Biologii Mikroorganizmów, Wydział Rolnictwa i Biologii, Szkoła Główna Gospodarstwa Wiejskiego w Warszawie
3Instytut Biotechnologii Przemysłu Rolno-Spożywczego im. prof. Wacława Dąbrowskiego, Zakład Mikrobiologii, Warszawa
4Samodzielna Katedra Biotechnologii i Biologii Molekularnej, Uniwersytet Opolski
5Wydział Kształtowania Środowiska i Rolnictwa, Zachodniopomorski Uniwersytet Technologiczny w Szczecinie
Summary
This paper presents the characteristics of Gram-negative, opportunistic Pseudomonas aeruginosa. This ubiquitous bacterium has the ability to live in distilled water, and may utilize different substrates as a source of carbon and energy. The paper discusses the morphology and physiology, virulence factors, disease entities caused by Pseudomonas aeruginosa and their treatment. Also is described the role of Pseudomonas aeruginosa as a pathogen causing nosocomial infections. Due to the high antibiotic resistance of Pseudomonas aeruginosa is a major causative factor in diseases of the eye and ear.
Pseudomonas (Pseudomonas aeruginosa) is an extracellular pathogen that causes the characteristic infiltrates tissues purulent exudate mucopurulent of black color – hence its name. The bacterium occurs especially in patients with extensive burns, general immunocompromised after acute severe mechanical injuries. Pseudomonas has a low nutritional requirements, and has very different mechanisms of resistance to many antibiotics which greatly may block the treatment of infections caused by it. The organism has the ability to live in distilled water and different substrates can be used as a source of carbon and energy for what belongs to the most dangerous and most common etiological factors that cause a number of life-threatening hospital infections like very serious blood infection (sepsis, septic shock).

Wstęp
Pseudomonas aeruginosa (dawniej: Bacterium aeruginosum, Pseudomonas pyocyanea) swoją obecną nazwę zawdzięcza metalicznemu połyskowi, jakim charakteryzują się kolonie rosnące na agarze odżywczym (łac. aes – metaliczny). Bakterie z gatunku Pseudomonas aeruginosa to zakrzywione Gram-ujemne pałeczki, które nie wytwarzają endospor (przetrwalników) (1-3). Komórki Pseudomonas aeruginosa są urzęsione polarnie, monotrychalnie. Ponieważ flagelle Pseudomonas aeruginosa pobudzają bakteriobójcze systemy obronne gospodarza (IL-8, neutrofile), po skolonizowaniu tkanki docelowej wyłączona zostaje ekspresja genów odpowiedzialny za produkcję białek tworzących flagelle. Włączona natomiast zostaje wtedy ekspresja genów odpowiedzialnych za powstawanie biofilmu (4-7).
Błona cytoplazmatyczna bakterii ropy błękitnej stanowi barierę, której wydajność zależy od jej układu. Może ona bardzo szybko dostosowywać swoją płynność odpowiednio do zmian zachodzących w środowisku zewnętrznym, otaczającym daną komórkę bakteryjną. Błona ta jest bardzo wydajną i efektywną barierą dla wielu molekuł, w tym antybiotyków, a jednocześnie jest przepuszczalna dla związków odżywczych. Taką funkcjonalność zapewniają wbudowane w nią liczne białka (8). Błona zewnętrzna, tak jak i błona cytoplazmatyczna, to dwuwarstwa lipidów. Jednak w przeciwieństwie do błony cytoplazmatycznej, jest ona wysoce niesymetryczna. Wewnętrzna część błony zewnętrznej składa się z fosfolipidów, natomiast głównym składnikiem zewnętrznej części jest lipopolisacharyd (ang. lipopolysaccharide – LPS). W skład błony zewnętrznej wchodzą także wysoce antygenowe białka, zwane Opr, oraz poryny – białka, które tworzą pory (9, 10).
W budowie lipopolisacharydu można wyróżnić trzy główne części: antygen O, rdzeń oraz lipid A. Pseudomonas aeruginosa może produkować dwa typy LPS – A i B. LPS typu B nadaje komórce jej serologiczną specyficzność O-antygenową, natomiast typ A to powszechnie występujące antygeny. Bakterie syntetyzujące kompletny LPS typu B (wraz z antygenem O) zwane są formami S (ang. smooth), a bakterie syntetyzujące LPS typu A pozbawiony antygenu O zwane są formami R (ang. rough). Występują także formy AB (SR), które posiadają skrócony łańcuch O-swoisty. Typ B posiada dwa podtypy: jeden zwiększa hydrofobowość komórki, drugi hydrofilowość. Czynniki wpływające na proporcje pomiędzy tymi dwoma podtypami LPS wpływają także na zdolność do adhezji i przeżywalność komórek bakteryjnych. Typ A można podzielić na kilka podtypów ze względu na przyczynę braku antygenu O: Aa posiadają defekt w aparacie biosyntezy antygenu O, natomiast Ab, Ac, Ad, i Ae posiadają defekt w aparacie biosyntezy części rdzeniowej (11-15). W błonie zewnętrznej Pseudomonas aeruginosa oprócz LPS znajdują się także liczne białka poryny. Tworzą one selektywne bądź nieswoiste kanały i zwane są porynami. Oprócz poryn, w błonie zewnętrznej Pseudomonas aeruginosa znajduje się jeszcze wiele innych białek tworzących kanały dla przeróżnych substratów wykorzystywanych przez tę pałeczkę, co może indukować różnorodne jednostki chorobowe związane z układem uszu i przewodów słuchowych, jak i układem zatok ocznych.
Choroby uszu i przewodów słuchowych – zapalenie ucha środkowego
Zapalenie ucha środkowego (ang. otitis media) (ryc. 1) to schorzenie najczęściej występujące u niemowląt, u osób starszych występuje sporadycznie. Głównym czynnikiem powodującym powstawanie schorzenia są wirusy, dopiero po czasie dochodzi do nadkażenia bakteryjnego. Pseudomonas aeruginosa dość rzadko wywołuje zapalenie ucha środkowego, jednak ze względu na duże trudności w leczeniu schorzeń wywoływanych przez tę pałeczkę jest ona bardzo ważnym czynnikiem etiologicznym (16). Główne objawy otitis media to: silny ból ucha, bardzo często wzmagający się w nocy i w pozycji leżącej, gorączka, ból głowy, upośledzenie słuchu o różnym stopniu, wymioty. W około 10% przypadków choroba przebiega bezobjawowo, a dopiero badania wycieku z ucha pozwalają na zdiagnozowanie i rozpoznanie choroby (17).
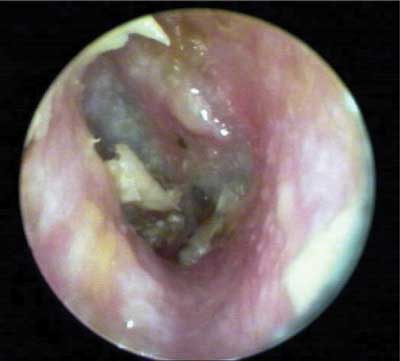
Ryc. 1. Zapalenie ucha środkowego
Źródło: http://faculty.washington.edu/alexbert/MEDEX/Fall/HEENT_PE_Obj.htm
Zapalenie ucha zewnętrznego
Zapalenie ucha zewnętrznego (ang. otitis externa, „swimmer’s ear”) jest najczęściej powodowane poprzez dostanie się do ucha nadmiernej wilgoci, która niesie ze sobą bakteryjne patogeny, lub poprzez zranienie, które ułatwia przedostanie się komórkom bakteryjnym w głąb skóry. Głównym czynnikiem etiologicznym jest Pseudomonas aeruginosa (18). Ogólnie zapalenie ucha zewnętrznego jest schorzeniem prostym do wyleczenia, jednak u osób z obniżoną odpornością i u osób chorych na cukrzycę może prowadzić do ciężkich powikłań, a także przekształcić się w złośliwe zapalenie ucha zewnętrznego, które może zagrażać życiu pacjenta. Schorzenie to najczęściej występuje u osób, które mają częsty kontakt z wodą i może ona zostać uwięziona w uchu (pływacy, nurkowie – stąd angielska nazwa schorzenia swimmer’s ear). Forma przewlekła zapalenia ucha zewnętrznego dotyka około 3% populacji. Choroba ta pojawia się u osób w każdym wieku, jednak najczęściej dotyka ona dzieci pomiędzy 7. a 12. rokiem życia. W niektórych przypadkach otitis externa może prowadzić do zapalenia szpiku i zapalenia tkanki łącznej, gdzie śmiertelność wynosi do 50%. Pałeczka ropy błękitnej wywołuje zapalenie ucha zewnętrznego nie tylko u ludzi, ale także u zwierząt (19).
Złośliwe (zmartwiające) zapalenie ucha zewnętrznego
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Garrity G: Bergey’s Manual of Systematic Bacteriology. 2nd ed. Vol. 2: The Proteobacteria, part B: The Gammaproteobacteria. Springer, 2005. 2. Cook J, Gambello M, Iglewski B et al.: Expression of Pseudomonas aeruginosa virulence genes requires cell-to-cell communication. Science 1993 May 21; 260(5111): 1127-1130. 3. Schaechter M (ed.): The Desk Encyclopedia of Microbiology. Elsevier Academic Press, London 2004. 4. Piekarniak P: Zapalenie ucha środkowego – rozpoznawanie i leczenie. LEK 1999. 5. Cook KA, Walsh MJ: Otitis externa. Medscape 2007. 6. Handzel O, Halperin D: Necrotizing (Malignant) External Otitis. Am Fam Physician 2003; 68(2): 309-312. 7. Millis TJ: Corneal Ulceration and Ulcerative Keratitis. Medscape 2008. 8. Elboudwarej O: Eye Infection-Fighting Protein Found. The Daily Californian 2004 Nov 10. 9. Silverman MA, Bessman E: Conjunctivities. Medscape 2009. 10. Gilliland GD: Dacryocystitis. Medscape 2007. 11. Harrington JN: Cellulitis, Orbital. Medscape 2008. 12. Górski NP, Palmer JN: Biofilmy bakteryjne w przewlekłym zapaleniu zatok przynosowych. Magazyn Otorynolaryngologiczny 2006; VI (supl. IX): 24-30. 13. Qarah S, Cunha BA, Pratibha D et al.: Pseudomonas aeruginosa infections. Medscape 2008. 14. Curtis DL: Cellulitis. Medscape 2008. 15. Gençer S, Özer S, Gül A et al.: Ecthyma gangrenosum without bacteremia in a previously healthy man: a case report. J Med Case Reports 2008, 2: 14. DOI: 10.1186/1752-1947-2-14. 16. Baj J, Markiewicz Z: Biologia molekularna bakterii. Wydawnictwo PWN, Warszawa 2006. 17. Kayser F, Bienz K, Eckert J, Zinkernagel R: Mikrobiologia lekarska. Wydawnictwo PZWL, Warszawa 2007. 18. Beveridge T: Structures of Gram-negative cell walls and their derived membrane vesicles. J Bacteriol 1999 Aug; 181(16): 4725-4733. 19. Baltch AL, Smith RP: Pseudomonas aeruginosa infections and treatment. Marcel Dekker, INC 1994. 20. Porter RS, Kaplan JL, Homeier BP, Beers MH: Merck Manuals Online Medical Library. Merc & CO., Inc., Kenilworth, NJ 2009. 21. Springer SC, Annibale DJ: Necrotizing Enterocolitis. Medscape 2008. 22. Krakós M, Krajewski P, Bernas S, Niedzielski J: Martwicze zapalenie jelit (NEC) u noworodków ze skrajnie niską wagą urodzeniową (ELBW) – doświadczenie jednego ośrodka. Chir Pol 2007; 9: 78-84. 23. Kraśnicki K, Wolski Z, Mikucka A, Gospodarek E: Wrażliwość pałeczek Gram-ujemnych na leki przeciwbakteryjne w oddziałach urologii. Prz Urol 2007; 8(3): 83-86. 24. Bennett NJ, Domachowske J, Holland BJ: Bacteremia. Medscape 2008. 25. Bjarnsholt T, Kirketerp-Møller K, Kristiansen S et al.: Silver against Pseudomonas aeruginosa biofilms. APMIS 2007; 115: 921-928. 26. Beveridge T, Hunter R: High-resolution visualization of Pseudomonas aeruginosa PAO1 biofilms by freeze-substitution transmission electron microscopy. J Bacteriol 2005 Nov; 187(22): 7619-7630. 27. Beveridge T, Kadurugamuwa J: Natural release of virulence factors in membrane vesicles by Pseudomonas aeruginosa and the effect of aminoglycoside antibiotics on their release. J Antimicrob Chemother 1997 Nov; 40(5): 615-621. 28. Beveridge T, Kadurugamuwa J: Periplasm, periplasmic spaces, and their relation to bacterial wall structure: novel secretion of selected periplasmic proteins from Pseudomonas aeruginosa. Microb Drug Resist 1996 Spring; 2(1): 1-8. 29. Beveridge T, Kadurugamuwa J: Virulence factors are released from Pseudomonas aeruginosa in association with membrane vesicles during normal growth and exposure to gentamicin: a novel mechanism of enzyme secretion. J Bacteriol 1995 Jul; 177(14): 3998-4008.

