Paula Melka
Ocena wpływu kwasu α-liponowego na obraz morfologiczny serca i nerki królików karmionych paszą z dodatkiem utlenionego oleju rzepakowego
Influence of α-lipoic acid on the morphological image of heart and kidney of rabbits fed a fodder with the addition of oxidized rapeseed oil
Katedra i Zakład Patologii, Wydział Nauk Farmaceutycznych, Śląski Uniwersytet Medyczny w Katowicach
Summary
Introduction. The peroxidation of lipids is the effect of subjecting them to the high temperature. The studies have shown that the created oxidative stress can be counteracted by strengthening the body’s antioxidative system by introducing antioxidant vitamins or non-vitamin compounds into the body. One of the best antioxidants that works in both the water and lipid phase is an α-lipoic acid.
Aim. The aim of the study was to assess the influence α-lipoic acid on morphological changes in heart and kidneys of rabbits exposed to oxidized or non-oxidized rapeseed oil.
Material and methods. The research was carried out on 36 rabbits of the Szynszyl breed. The animals were divided into 6 groups of 6 individuals. They were given the standard diet Labofeed Kamet (DS). They were drinking water at libitum. The animals in the control group received standard Labofeed Kamet feed, in group I (DS + LA) a-lipoic acid (LA) was added to the feed at a dose of 10 mg/kg, in group II (DS + NOR) ? there was added 10% non-oxidized rapeseed oil (NOR), in group III (DS + UOR) ? 10% oxidized rapeseed oil (UOR) was given, in group IV (DS + NOR + LA) the rabbits received feed enriched with non-oxidized rapeseed oil and α-lipoic acid, and group V (DS + UOR + LA) was enriched with oxidized rapeseed oil and α-lipoic acid in the same amounts as in the each group. After the experiment was completed and the animals were euthanised, the kidneys and hearts of the rabbits were collected for histopathological evaluation.
Results. A high-fat diet causes adverse changes in both examined organs. The administration of α-lipoic acid showed a preventive effect on changes observed in organs. It was fully effective in the case of exposure of rabbits to non-oxidized rapeseed oil. When exposed to an oxidized oil, persistence of changes of lesser intensity were observed than when exposed only to oxidized oil.
Conclusions. Dietary supplementation with antioxidants should be considered when exposed to oxidized lipids.

Wprowadzenie
Tłuszcze mają wysoką wartość energetyczną, dlatego powinny być spożywane każdego dnia. Według Światowej Organizacji Zdrowia (WHO) i Organizacji Narodów Zjednoczonych do spraw Wyżywienia i Rolnictwa (FAO) mają one dostarczać 20-35% całkowitej energii czerpanej wraz z pożywieniem (1). Pomimo wielu zalet tłuszczów, nie należy doprowadzać do powstania ich nadmiaru w organizmie. Szczególnie niebezpieczne jest przyjmowanie w dużych ilościach nasyconych kwasów tłuszczowych, tłuszczu pochodzenia zwierzęcego i nienasyconych kwasów tłuszczowych w konfiguracji trans. Dostarczane w nadmiarze zwiększają prawdopodobieństwo zachorowania na miażdżycę i jej następstw w postaci choroby niedokrwiennej serca i zawału (2). Hipercholesterolemia czy hipertriglicerydemia mogą prowadzić do powstawania blaszek miażdżycowych. Kumulujące się remnanty triglicerydów (TRL) oraz małych, gęstych lipoprotein o małej gęstości (sdLDL) powodują nasilenie utleniania lipoproteiny o małej gęstości (LDL) i zaburzenia równowagi w układzie oksydacyjno-redukcyjnym. Przyczynia się do powstania stresu oksydacyjnego i zmian w naczyniach krwionośnych, prowadzących do rozwoju miażdżycy. Izomery trans nienasyconych kwasów tłuszczowych podwyższają stężenie lipoproteiny (a) oraz obniżają stężenie lipoproteiny o wysokiej gęstości (HDL-u) (3).
Produkty utleniania lipidów można podzielić na pierwotne i wtórne. O ile pierwsze z nich nie są szkodliwe, to produkty wtórne już stwarzają zagrożenie dla organizmu ludzkiego. Zaburzają równowagę między wytwarzaniem a neutralizacją wolnych rodników tlenowych, a następnie przyczyniają się do peroksydacji lipidów strukturalnych (4). Najbardziej powszechnymi wtórnymi produktami opisywanego procesu są dialdehyd malonowy (MDA) i trans-4-hydroksynonenal (4-HNE). MDA jest związkiem silnie mutagennym. Poprzez oddziaływanie na komórkowy kwas deoksyrybonukleinowy (DNA) indukuje mutacje, co może się przyczyniać do rozwoju nowotworów. Jest to jeden z najlepszych markerów stresu oksydacyjnego. Natomiast 4-HNE jest najsilniej toksycznym produktem utleniania lipidów. Obecność MDA i 4-HNE powoduje liczne schorzenia. Sprzyja rozwojowi zwyrodnienia plamki żółtej oka związanego z wiekiem (AMD). Dochodzi do hamowania aktywności proteazy lizosomalnej (RPE), a następnie do dysfunkcji lizosomalnej. Nasila się produkcja lipofuscyny, co jest jedną z przyczyn AMD (5). Związki te mają swój udział w patomechanizmie chorób neurodegeneracyjnych: w chorobie Huntingtona, Alzheimera oraz Parkinsona (6). Zauważono również, że u pacjentów z zespołem antyfosfolipidowym nadmierne krzepnięcie krwi jest spowodowane wysokim poziomem utlenionych fosfolipidów. W wyniku działania reaktywnych form tlenu (ROS) na cholesterol może powstać 7-ketocholesterol. Ta utleniona forma indukuje śmierć kardiomiocytów. Wykazano obecność 7-ketocholesterolu w erytrocytach osób cierpiących na niewydolność serca, dlatego uznano go jako czynnik biorący udział w patogenezie niewydolności serca (7).
Liczne badania dowodzą, że sposobem na spowolnienie utleniania lipidów w organizmie jest suplementacja antyoksydantami (8-12). Jednym z dobrze poznanych takich związków jest kwas α-liponowy (13-20).
Cel pracy
Celem pracy była ocena wpływu kwasu α-liponowego ? dobrze poznanego antyoksydantu ? na morfologię serca i nerki królików karmionych paszą wzbogaconą utlenionym lub nieutlenionym olejem rzepakowym.
Materiał i metody
Badania przeprowadzono na trzymiesięcznych samcach królików rasy Szynszyl. Przed rozpoczęciem badania odbyła się dwutygodniowa adaptacja do warunków eksperymentu. Króliki przez cały czas były trzymane w oddzielnych klatkach. Podzielono je losowo na grupy po 6 osobników i utrzymywano je na standardowej paszy bytowej Labofeed Kamet. Pojono je wodą at libitum. Do badań użyto nieutlenionego lub utlenionego oleju rzepakowego. Olej rzepakowy utleniano według parametrów standaryzacji. Proces prowadzono w suszarce laboratoryjnej z wymuszonym obiegiem powietrza w temperaturze 180°C przez 6 godzin w szklanym naczyniu o średnicy 40 cm.
Grupy badane
Grupa kontrolna (DS) ? zwierzęta otrzymywały standardową paszę Labofeed Kamet.
Grupa I (DS + LA) ? zwierzętom podawano standardową paszę Labofeed Kamet z dodatkiem kwasu α-liponowego (LA) w dawce 10 mg/kg m.c.
Grupa II (DS + NOR) ? zwierzęta karmiono standardową paszą Labofeed Kamet z dodatkiem 10% nieutlenionego oleju rzepakowego (NOR).
Grupa III (DS + UOR) ? zwierzęta karmiono standardową paszą Labofeed Kamet z dodatkiem 10% utlenionego oleju rzepakowego (UOR).
Grupa IV (DS + NOR + LA) ? zwierzęta otrzymywały standardową paszę Labofeed Kamet z dodatkiem nieutlenionego 10% oleju rzepakowego oraz kwasu α-liponowego w dawce 10 mg/kg m.c.
Grupa V (DS + UOR + LA) ? zwierzętom podawano standardową paszę Labofeed Kamet z dodatkiem utlenionego 10% oleju rzepakowego oraz kwasu α-liponowego w dawce 10 mg/kg m.c.
Po 6 miesiącach zwierzęta usypiano. Podczas sekcji pobrano narządy królików ? serca i nerki ? do badań histopatologicznych. Ocenę mikroskopową przeprowadzano na podstawie preparatów wykonanych techniką parafinową, wybarwionych metodą przeglądową, wybarwionych hematoksyliną i eozyną.
Badania finansowane były z umowy nr: KNW-1-044/N/7/0.
Wyniki
Ocena mikroskopowa nerki
W nerkach pobranych od królików, którym podano z paszą bytową kwas α-liponowy (grupa I), nie stwierdzono żadnych zmian (ryc. 1). Natomiast niewielkie nacieki z komórek jednojądrzastych zaobserwowano w nerkach królików z grupy II (DS + NOR) utrzymywanych na diecie wzbogaconej nieutlenionym olejem rzepakowym (ryc. 2). Podanie królikom utlenionego oleju rzepakowego w grupie III (DS + UOR) spowodowało wiele zmian w badanym narządzie (ryc. 3-5). Wykazano przekrwienie nerek widoczne zarówno w korze (ryc. 3), jak i w rdzeniu nerki (ryc. 4). W korze nerek wystąpiły również liczne nacieki z komórek jednojądrzastych (ryc. 5). Nie stwierdzono zmian miażdżycowych w naczyniach nerki. W grupie IV (DS + NOR + LA) po podaniu z dietą nieutlenionego oleju rzepakowego i kwasu α-liponowego nie stwierdzono żadnych zmian w zakresie miąższu i zrębu nerki oraz w naczyniach krwionośnych (ryc. 6), co wskazuje na pełną skuteczność antyoksydacyjną przed szkodliwym działaniem nieutlenionego oleju rzepakowego. Natomiast nie wykazano pełnej skuteczności kwasu α-liponowego u królików narażonych na utleniony olej rzepakowy w grupie V (DS + UOR + LA). U dwóch królików w tej grupie utrzymywały się niewielkie przekrwienie oraz nacieki zapalne pomiędzy kanalikami (ryc. 7, 8).
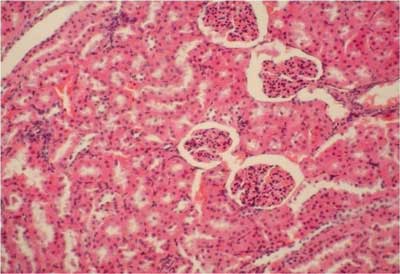
Ryc. 1. Grupa I (DS + LA). Nerka królika. Brak zmian morfologicznych w strukturach nerkowych. Widoczne przekroje przez kanaliki proksymalne i dystalne oraz ciałka nerkowe. Barwienie H-E. 200x

Ryc. 2. Grupa II (DS + NOR). Nerka królika. Widoczne ogniskowe nacieki między kanalikami w zrębie. Barwienie H-E. 200x
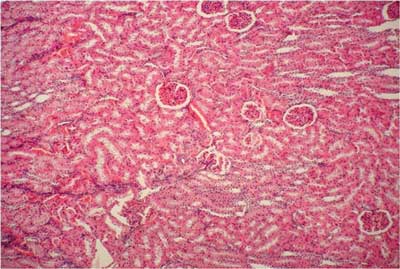
Ryc. 3. Grupa III (DS + UOR). Nerka królika. Widoczne wyraźne przekrwienie kłębuszków nerkowych. Barwienie H-E. 100x

Ryc. 4. Grupa III (DS + UOR). Nerka królika ? rdzeń. Widoczne przekrwienie w rdzeniu nerki. Barwienie H-E. 100x
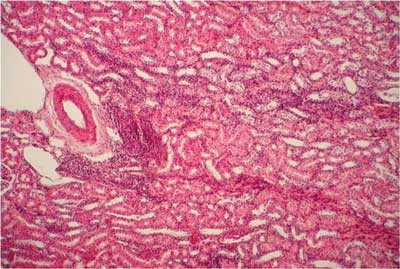
Ryc. 5. Grupa III (DS + UOR). Nerka królika. Obecne obfite nacieki z komórek jednojądrzastych w korze nerki. Barwienie H-E. 200x
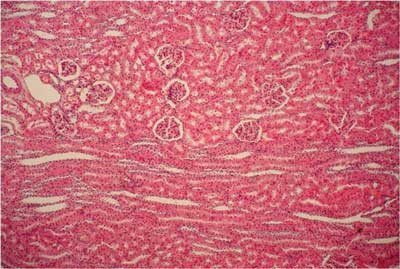
Ryc. 6. Grupa IV (DS + NOR + LA). Nerka królika. Brak zmian w korze nerki. Barwienie H-E. 100x

Ryc. 7. Grupa V (DS + UOR + LA). Nerka królika. Widoczne niewielkie nacieki pomiędzy kanalikami. Barwienie H-E. 200x
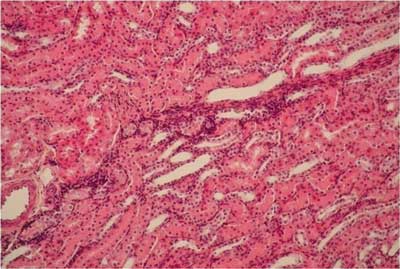
Ryc. 8. Grupa V (DS + UOR + LA). Nerka królika ? rdzeń. Widoczne nieznaczne przekrwienie w rdzeniu nerki. Barwienie H-E. 100x
Ocena mikroskopowa serca
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Ciborowska H, Rudnicka A: Dietetyka. Żywienie zdrowego i chorego człowieka. Wydawnictwo Lekarskie PZWL, Warszawa 2014: 66-92.
2. Głąbska D, Włodarek D: Tłuszcze. [W:] Włodarek D, Lange E, Kozłowska L, Głąbska D: Dietoterapia. Wydawnictwo Lekarskie PZWL, Warszawa 2014: 55-70.
3. Wądołowska L, Krusińska B, Tenderenda M: Znaczenie lipidów, w tym PUFA n-6 i PUFA n-3 w rozwoju chorób nowotworowych. Onkol Pol 2013; 16(2): 80-89.
4. Morita M, Ishida N, Uchiyama K et al.: Fatty liver induced by free radicals and lipid peroxidation. Free Radic Res 2012; 46(6): 758-765.
5. Wiktorowska-Owczarek A, Nowak JZ: Patogeneza i profilaktyka AMD: rola stresu oksydacyjnego i antyoksydantów. Post Hig 2010; 64: 333-343.
6. Perluigi M, Coccia R, Butterfield AD: 4-Hydroxy-2-Nonenal, a reactive product of lipid peroxidation, and neurodegenerative diseases: a toxic combination illuminated by redox proteomics studies. Mary Ann Liebert, Inc 2012; 17(11).
7. Tang HY, Wang CH, Ho HY et al.: Lipidomics reveals accumulation of the oxidized cholesterol in erythrocytes of heart failure patients. Redox Biol 2018; 14: 499-508.
8. Kowalska D: Wzbogacanie mięsa królików w nienasycone kwasy tłuszczowe i witaminy oraz przeciwdziałanie procesom utleniania. Rocz Nauk Zoot 2011; 38(2): 227-243.
9. Mika M, Kostogrys RB, Franczyk-Zarow M, Wikiera A: Wpływ dawki katechin modyfikowanych termicznie na hamowanie rozwoju miażdżycy u myszy apoE-knockout. Nauka Przyr Technol 2015; 32: 1-9.
10. Fenercioglu AK, Saler T, Genc E et al.: The effects of polyphenol-containing antioxidants on oxidative stress and lipid peroxidation in type 2 diabetes mellitus without complications. J Endocrinol Invest 2010; 33: 118-124.
11. Rafieian-Kopaei M, Shahinfard N, Rouhi-Boroujeni H et al.: Effects of Ferulago angulata extract on serum lipids and lipid peroxidation. Hindawi 2014; 1-4.
12. Kalender Y, Kaya S, Durak D et al.: Protective effects of catechin and quercetin on antioxidant status, lipid peroxidation and testis-histoarchitecture induced by chlorpyrifos in male rats. Environ Toxicol Pharm 2012; 33: 141-148.
13. Prathima P, Venkaiah K, Pavani R et al.: α-lipoic acid inhibits oxidative stress in testis and attenuates testicular toxicity in rats exposed to carbimazole during embryonic period. Tox Reports 2017; 4: 373-381.
14. Rochette L, Ghibu S, Muresan A, Vergely C: Alpha-lipoic acid: molecular mechanisms and therapeutic potential in diabetes. Can J Physiol Pharmacol 2015; 93: 1021-1027.
15. Malińska D, Winiarska K: Kwas liponowy ? charakterystyka i zastosowanie w terapii. Post Hig 2005; 59: 535-543.
16. Shimaa OA, Hebatallah AD, Nabila AI: Curcumin, silybin phytosome and α-R-lipoic acid mitigate chronic hepatitis in rat by inhibiting oxidative stress and inflammatory cytokines production. Basic Clin Pharmacol Toxicol 2016; 118: 369-380.
17. Koga T, Ishida T, Takeda T et al.: Restoration of dioxin-induced damage to fetal steroidogenesis and gonadotropin formation by maternal co-treatment with α-lipoic acid. PLoS 2012; 7(7): 1-12.
18. Ziegler D, Low PA, Litchy WJ et al.: Efficacy and safety of antioxidant treatment with α-lipoic acid over 4 years in diabetic polyneuropathy. Diab Care 2011; 34: 2054-2060.
19. Li Y, Liu YZ, Shi JM, Jia SB: Alpha lipoic acid protects lens from H2O2-induced cataract by inhibiting apoptosis of lens epithelial cells and inducing activation of anti-oxidative enzymes. APJTM 2013; 6(7): 548-551.
20. Al-Rasheed NM, Abdel Baky NA, Faddah LM et al.: Prophylactic role of α-lipoic acid and vitamin E against zinc oxide nanoparticles induced metabolic and immune disorders in rat’s liver. Eur Rev Med Pharmacol Sci 2014; 18: 1813-1828.
21. Herman-Edelstein M, Scherzer P, Tobar A et al.: Altered renal lipid metabolism and renal lipid accumulation in human diabetic nephropathy. J Lipid Res 2014; 55(3): 561-572.
22. Lozano I, Werf R, Bietiger W et al.: High-fructose and high-fat diet-induced disorders in rats: impact on diabetes risk, hepatic and vascular complications. Nutri Metab 2016; 30(15): 1-13.
23. Dutta M, Ghosh D, Ghosh AK et al.: High fat diet aggravates arsenic induced oxidative stress in rat heart and liver. Food Chem Toxycol 2014; 66: 262-277.
24. Zalejska-Fiolka J, Kasperczyk A, Kasperczyk S et al.: Influence of non-oxidised and oxidised repeseed oil consumption on liver metabolism pathways and non-alcoholic steatohepatitis development in rabbits. Bull Vet Inst Pulawy 2012; 56: 255-259.
25. Ghobadi S, Akhlaghi M, Mokhtari M, Mohammadian F: The effects of heated oils used in fast food restaurants on metabolic, inflammatory and oxidative stress markers, blood pressure, and liver histology in Sprague-Dawley rats. Iran Red Crescent Med J 2018; 20(2): 1-9.
26. Jaarin K, Hwa TC, Umar NA et al.: Enzymatic and microstructural changes in the liver of experimental rats fed with fatty diet and fresh or heated soy oil concurrently. Clin Ter 2010; 161(5): 429-433.
27. Wongmekiat O, Leelarungrayub D, Thamprasert K: Alpha-lipoic acid attenuates renal injury in rats with obstructive nephropathy. BioMed Research International 2013; 2013: 138719.
28. Stawiarska-Pięta B, Zalejska-Fiolka J, Wyszyńska M et al.: Influence of α-lipoic acid on morphology of organs of rabbits fed a high fat diet with the addition of oxidised rapeseed oil. J Vet Res 2017; 61: 1-9.
29. Cichoń M, Błaszczyk U, Zalejska-Fiolka J: Wpływ kwasu α-liponowego na procesy wolnorodnikowe w surowicy szczurów utrzymywanych na diecie wysokotłuszczowej. MED PR 2017; 68(3): 391-399.
30. Xu J, Gao H, Song L et al.: Flaxseed oil and alpha-lipoic acid combination ameliorates hepatic oxidative stress and lipid accumulation in comparison to lard. Lipids Health Dis 2013; 12(58): 1-7.
31. Zalejska-Fiolka J, Wielkoszyński T, Rokicki W et al.: The Influence of 𝛼-Lipoic Acid and Garlic Administration on Biomarkers of Oxidative Stress and Inflammation in Rabbits Exposed to Oxidized Nutrition Oils. Biomed Res Int 2015; 2015: 827879.
32. Kwiecień B, Dudek M, Bilska-Wilkosz A et al.: In vivo anti-inflammatory activity of lipoic acid derivatives in mice. Post Hig 2013; 67: 331-338.








