Patrycjusz Kołodziejczyk1, Katarzyna Baranowska-Kempisty2, Piotr Bernat3, Piotr Tutka1, 3, 4
Cytyzyna w terapii zaprzestania palenia tytoniu
Cytisine for tobacco smoking cessation: an overview
1Zakład Farmakologii Doświadczalnej i Klinicznej, Uniwersytet Rzeszowski, Polska
2Klinika Otolaryngologii, Kliniczny Szpital Wojewódzki nr 1 im. Fryderyka Chopina, Rzeszów, Polska
3Laboratorium Badań Innowacyjnych w Farmakologii, Uniwersytet Rzeszowski, Polska
4National Drug and Alcohol Research Centre, University of New South Wales, Sydney, NSW, Australia
Summary
Tobacco smoking is one of the leading causes of death among people. Cytisine, a plant alkaloid considered to be the oldest medication for smoking cessation, has been used in Poland since the 1970s. The drug is a partial nicotinic receptor agonist, with pharmacological actions close to those of nicotine and varenicline (a synthetic cytisine derivative and most expensive smoking cessation medication currently available). Cytisine has several advantages compared to existing smoking cessation drugs, including: 1) it is more effective than placebo and nicotine replacement therapy, and at least as effective as varenicline, 2) its use is associated with a low frequency of adverse events, 3) it is available as over the counter medicine and is much cheaper than other smoking cessation drugs that are cost-prohibitive, 4) it derives from a natural plant and may be preferred by smokers who do not want to use other treatments, 5) it has shorter duration of treatment (i.e. 25 days) compared to other medicines for smoking cessation. This review describes the use of cytisine for nicotine addiction treatment, mechanism of anti-smoking action, pharmacokinetics, efficacy, tolerability and safety.

Wstęp
Palenie tytoniu stanowi główny czynnik zagrożenia zdrowia ludzkiego. Na świecie około 1,3 mld osób używa tytoniu, z czego rocznie około 6 mln umiera z powodu chorób związanych z paleniem (1). Najczęstszymi przyczynami zgonów palaczy są przede wszystkim choroby układu sercowo-naczyniowego i choroby nowotworowe, takie jak: rak płuc, jamy ustno-gardłowej, krtani, nerki, trzustki i żołądka (2). Aż 24% Polaków i 18% Polek wciąż pali papierosy (3).
Najskuteczniejszą metodą ograniczenia ryzyka zdrowotnego i zapobiegania śmiertelności wśród palaczy jest zaprzestanie palenia. Udowodniono, że poprzez zaniechanie palenia zmniejsza się ryzyko przedwczesnej śmierci związanej z kontynuowaniem palenia aż o około 90% (4).
W Europie (także w Polsce) i Ameryce Północnej 80% palaczy deklaruje chęć rzucenia palenia papierosów. Jednak ze względu na szczególną złożoność problemu palenia, jedynie tylko 5% z nich jest w stanie rzucić palenie bez żadnego wspomagania (5). Odsetek całkowitej abstynencji wśród rzucających palenie papierosów po 6 miesiącach od podjęcia próby zaprzestania palenia wynosi tylko 7% (6).
Za uzależnienie od tytoniu odpowiada nikotyna. W leczeniu uzależnienia od nikotyny zaleca się stosowanie metod behawioralnych i środków farmakologicznych, wśród których rekomenduje się: nikotynową terapię zastępczą (NTZ), bupropion i wareniklinę. Wszystkie te środki mają dość ograniczoną skuteczność, a koszt pełnej kuracji nimi w wielu krajach (w tym i w Polsce) jest często zbyt wysoki dla większości palaczy i systemów opieki zdrowotnej; dlatego zalecane leczenie farmakologiczne uzależnienia od nikotyny jest niedostępne dla milionów palaczy na świecie. Zatem, jednym z najważniejszych priorytetów w badaniach nad leczeniem nikotynizmu, a przez to prewencji wielu zagrażających życiu chorób, jest poszukiwanie leków, które byłyby nie tylko skuteczne i bezpieczne, ale i dostępne dla palaczy.
Cytyzyna ? najstarszy lek w terapii uzależnienia od nikotyny
Uważa się, że cytyzyna jest najstarszym środkiem stosowanym w celu zaprzestania palenia tytoniu (7, 8).
Cytyzyna jest trójpierścieniowym alkaloidem chinolizydynowym i występuje głównie w roślinach z rodziny motylkowych (Leguminosae, Fabaceae), np. złotokapie zwyczajnym (Laburnum anagyroides, Cytisus laburnum, Golden Rain), a także Sophora, Anagyris, Baptisia, Genista, Retama, Thermopsis i Ulex spp. (7, 9, 10). Na skalę przemysłową cytyzyna jest otrzymywana z nasion (zawartość 1-3%), niekiedy z liści (0,3%) i kwiatów (0,2%) złotokapu zwyczajnego.
Historia wykorzystania roślin, w których znajduje się cytyzyna, sięga tysięcy lat. Już Indianie w Ameryce spożywali części roślin zawierających cytyzynę podczas rytualnych magicznych obrzędów (11). W Europie wyciągi alkoholowe ze złotokapu wykorzystywano od setek lat do różnych celów w medycynie ludowej. Podczas II wojny światowej liście złotokapu służyły jako substytut tytoniu (12).
Jako lek ułatwiający zaprzestanie palenia tytoniu cytyzyna została zastosowana pierwszy raz w Bułgarii w latach 60. XX wieku w postaci tabletek (Tabex, Sopharma, Bułgaria). Rok później opublikowano pierwsze badania kliniczne wykazujące przeciwnikotynową skuteczność alkaloidu (13). Począwszy od lat 60. cytyzyna jest szeroko stosowana w Europie Środkowej i Centralnej, a także Azji Centralnej (14). Obecnie, jako lek ułatwiający zaprzestanie palenia tytoniu jest dostępna na rynkach czterech krajów Unii Europejskiej (Bułgaria, Litwa, Łotwa i Polska) i 13 krajów poza Unią.
Polska jest jedynym krajem na świecie, w którym cytyzyna jest dostępna w postaci dwóch preparatów: tabletek (Tabex, Sopharma, Recigar, Adamed) i mikronizowanych kapsułek (Desmoxan, Aflofarm). W Polsce od 2005 roku było nią leczonych prawie 30% palaczy, czyli około 2,6 mln osób (15). Według ekspertów, stosowanie cytyzyny w istotny sposób może odpowiadać za zmniejszenie liczby palaczy w Polsce (16), ale ocena jej wpływu na redukcję palenia w Polsce wymaga przeprowadzenia badań na poziomie populacji. Jednym z powodów szerokiego stosowania cytyzyny jest jej dostępność dla palaczy. Dostępność leku w znacznym stopniu jest uwarunkowana jego ceną. Koszt terapii cytyzyną jest kilkunastokrotnie mniejszy od kosztów terapii warenikliną, burpopionem lub nikotynową terapią zastępczą (NTZ), a czas trwania pełnego leczenia jest najkrótszy spośród wymienionych farmakoterapii (tab. 1).
Tab. 1. Porównanie terapii cytyzyną i nikotynową terapią zastępczą (NTZ)
| | Cytyzyna | NTZ |
| Gumy do żucia | Plastry | Tabletki |
| Średni koszt pełnej kuracji | 50-70 zł | 500-600 zł | 700-800 zł | 180-270 zł |
| Średnia ilość opakowań potrzebnych na pełną terapię antynikotynową | 1 | 8,5 | 12 | 12-18 |
| Dostępność bez recepty | tak | tak | tak | tak |
| Czas pełnej kuracji | 25 dni | 90 dni | 12 tygodni | 6-9 miesięcy |
Co interesujące, cytyzyna stała się polską „specjalnością”, bowiem odkrycie „na nowo” cytyzyny nastąpiło właśnie w Polsce. W 2006 roku ukazała się pierwsza anglojęzyczna praca naukowa na temat potencjału cytyzyny w terapii nikotynizmu (7). Efektem działań polskich naukowców było zainteresowanie mało dotychczas znanym lekiem naukowców i lekarzy w Europie Zachodniej i USA. Zaowocowało to opublikowaniem badań wykazujących, że cytyzyna jest bardziej skutecznym środkiem leczącym z palenia tytoniu od placebo (17-19), a przy tym kilkakrotnie tańsza od innych leków przeciwnikotynowych. Ma to ogromne znaczenie dla populacji palaczy w krajach rozwijających się, których nie stać na leczenie przeciwnikotynowe za pomocą rekomendowanych leków. Odkrycie i wprowadzenie na rynek warenikliny, leku wzorowanego na cytyzynie, a przede wszystkim wyniki badań klinicznych sprawiły, że zainteresowanie cytyzyną w ostatnich latach na świecie ogromnie wzrosło i stała się ona atrakcyjną alternatywą dla dotychczasowych terapii antynikotynowych. W 2016 roku cytyzyna została zarejestrowana jako naturalny produkt dostępny bez recepty w Kanadzie (20, 21), a obecnie trwają intensywne badania naukowe w ramach programu mającego na celu wprowadzenie cytyzyny na światowy rynek globalny (22).
Niniejsza praca przeglądowa podsumowuje właściwości farmakologiczne cytyzyny, wyjaśnia mechanizm działania antynikotynowego i dyskutuje jej skuteczność i bezpieczeństwo stosowania w oparciu o wyniki badań nieklinicznych i klinicznych, a także metaanaliz. Ponadto, praca przedstawia implikacje praktyczne ostatnio uzyskanych dowodów naukowych na skuteczność cytyzyny oraz stara się określić miejsce tego leku w terapii uzależnienia od nikotyny w przyszłości.
Mechanizm przeciwnikotynowego działania cytyzyny
Nikotyna jest składnikiem tytoniu odpowiedzialnym za rozwój uzależnienia. Uzależnienie od tytoniu jest procesem złożonym i wieloczynnikowym. Składają się nań: pragnienie uzyskania efektów działania farmakologicznego nikotyny, mechanizmy genetyczne, wyuczone skojarzenia, czynniki środowiskowe i ulga związana z łagodzeniem objawów towarzyszących odstawieniu nikotyny (23).
Nikotyna zawarta w dymie papierosowym bardzo szybko przenika do ośrodkowego układu nerwowego (OUN). W układzie limbicznym mózgu powoduje uwolnienie wielu neuroprzekaźników, które zmniejszają poziom lęku i napięcia (kwas gamma-aminomasłowy, endorfiny), pobudzają (noradrenalina, acetylocholina), poprawiają funkcje poznawcze i pamięć (noradrenalina, acetylocholina, kwas glutaminowy), poprawiają nastrój (serotonina), a także obniżają apetyt (noradrenalina, serotonina, dopamina) (24). Wśród uwalnianych wskutek palenia papierosów neuroprzekaźników kluczowe znaczenie ma dopamina. Wpływa ona na ośrodek nagrody w mózgu, powodując m.in. nasilenie efektu odczuwania przyjemności. Zaprzestanie palenia papierosów przez osobę uzależnioną powoduje obniżenie stężenia dopaminy w układzie mezolimbicznym, a to z kolei prowadzi do wystąpienia tzw. zespołu odstawienia. Objawia się on złym samopoczuciem, lękiem i niepokojem, obniżeniem nastroju, osłabieniem, bezsennością, nasileniem kaszlu, zaburzeniami koncentracji i pamięci oraz objawami wegetatywnymi, które skłaniają osobę uzależnioną do sięgnięcia po kolejnego papierosa. W ten sposób powstaje błędne koło uzależnienia, które bardzo trudno jest przerwać (ryc. 1).
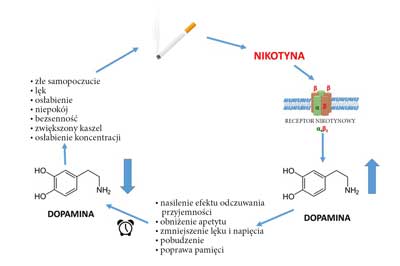
Ryc. 1. Mechanizm uzależnienia od nikotyny
Powszechnie przyjmuje się, że działanie uzależniające nikotyny wynika, przynajmniej w części, z jej oddziaływania na system acetylocholinergicznych receptorów nikotynowych (nAChR) podtypu α4β2 (25). Pobudzenie tych receptorów otwiera kanał, przez który napływają do wnętrza komórki jony wapnia lub sodu (26). To z kolei zwiększa uwalnianie dopaminy i innych neuroprzekaźników, czego wynikiem są opisane powyżej efekty kliniczne.
Optymalny środek stosowany w leczeniu uzależnienia od nikotyny powinien zatem działać dwojako ? z jednej strony blokować dostęp nikotyny do α4β2 nAChR, by nie dochodziło do nadmiernego uwalniania dopaminy i występowania efektów nagradzających, zaś z drugiej strony, w sytuacji braku nikotyny, zwiększać stężenie dopaminy, co łagodziłoby objawy odstawienne. Cytyzyna, która jest kompetycyjnym (konkurencyjnym) częściowym agonistą α4β2 nAChR (27-32), spełnia oba warunki.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. WHO: World Cancer Report 2014: 82-87.
2. http://onkologia.org.pl/palenie-tytoniu/ (data dostępu: 07.10.2019).
3. https://www.gov.pl/web/gis/postawy-polakow-wobec-palenia-tytoniu--raport-2017 (data dostępu: 21.04.2020).
4. Jha P, Ramasundarahettige C, Landsman V et al.: 21st century hazards of smoking and benefits of cessation in the United States. N Engl J Med 2013; 368(4): 341-350.
5. Prochaska JJ, Benowitz NL: The Past, Present, and Future of Nicotine Addiction Therapy. Annu Rev Med 2016; 67: 467-486.
6. Babb S, Malarcher A, Schauer G et al.: Quitting smoking among adults? United States, 2000-2015. Morb Mortal Wkly Rep 2017; 65: 1457-1464.
7. Tutka P, Zatoński W: Cytisine for the treatment of nicotine addiction: from a molecule to therapeutic efficacy. Pharmacol Rep 2006; 58(6): 777-798.
8. Prochaska JJ, Das S, Benowitz NL: Cytisine, the world’s oldest smoking cessation aid. Bmj 2013; 347: f5198.
9. Marion L, Cockburn WF: The Papilionaceous Alkaloids. V. Baptista minor Lehm. J Am Chem Soc 1948; 70: 3472-3480.
10. McDougal OM, Heenan PB, Jaksons P et al.: Alkaloid variation in New Zealand k?whai, Sophora species. Phytochemistry 2015; 118: 9-16.
11. Wood HC: Preliminary notes on a new medicinal plant and its alkaloid. Phyladelphia Medical Times 1877; 7: 510.
12. Seeger R: Cytisine as an aid for smoking cessation [in German]. Med Monatsschr Pharm 1992; 15: 20-21.
13. Stoyanov S, Yanachkova M: Treatment of nicotinism with the Bulgarian drug Tabex. Chimpharm 1965; 2: 13.
14. Tutka P, Vinnikov D, Courtney JR, Benowitz NL: Cytisine for nicotine addiction treatment: A review of pharmacology, therapeutics and an update of clinical trial evidence for smoking cessation. Addiction 2019; 114(11): 1951-1969.
15. Poland National Sales Data 2016/07. IQVIA Pharmascope 2017/12.2016.
16. Zatoński W, Zatoński M: Cytisine versus nicotine for smoking cessation. N Engl J Med 2015; 372(11): 1072.
17. Vinnikov D, Brimkulov N, Burjubaeva A: A double-blind, randomized, placebo-controlled trial of cytisine for smoking cessation in medium-dependent workers. Journal of Smoking Cessation 2008; 3: 57-62.
18. West R, Zatoński W, Cedzyńska M et al.: Placebo-controlled trial of cytisine for smoking cessation. N Engl J Med 2011; 365(13): 1193-1200.
19. Walker N, Howe C, Glover M et al.: Cytisine versus nicotine for smoking cessation. N Engl J Med 2014; 371(25): 2353-2362.
20. Government of Canada (2018): Licensed natural health products database (LNHPD): product information; https://health-products.canada.ca/lnhpd-bdpsnh/info.do?licence=80072429.
21. Karnieg T, Wang X: Cytisine for smoking cessation. CMAJ 2018; 190: E596.
22. http://achievelifesciences.com/.
23. Prochaska JJ, Benowitz NL: Current advances in research in treatment and recovery: Nicotine addiction. Sci Adv 2019; 5(10): 9763.
24. Corrigal WA, Franklin KBJ, Coen KM, Clarke PBS: The mesolimbic dopaminergic system in the reinforcing properties of nicotine. Psychopharmacology 1992; 107: 285-289.
25. Tapper AR, McKinney SL, Nashmi R et al.: Nicotine activation of alpha4* receptors: sufficient for reward, tolerance, and sensitization. Science 2004; 306: 1029-1032.
26. Dajas-Bailador F, Wonnacott S: Nicotinic acetylcholine receptors and the regulation of neuronal signalling. Trends Pharmacol Sci 2004; 25: 317-324.
27. Pabreza LA, Dhawan S, Kellar KJ: [3H]cytisine binding to nicotinic cholinergic receptors in brain. Mol Pharmacol 1991; 39: 9-12.
28. Hall M, Zerbe L, Leonard S, Freedman R: Characterization of [3H]cytisine binding to human brain membrane preparations. Brain Res 1993; 600: 127-133.
29. Monteggia LM, Gopalakirshnan M, Touma E et al.: Cloning and transient expression of genes encoding the human alpha 4 and beta 2 neuronal nicotinic acetylcholine receptor (nAChR) subunits. Gene 1995; 155: 189-193.
30. Parker MJ, Beck A, Luetje CW: Neuronal nicotinic receptor β2 and β4 subunits confer large differences in agonist binding affinity. Mol Pharmacol 1998; 54: 1132-1139.
31. Zhang J, Steinbach JH: Cytisine binds with similar affinity to nicotinic alpha4beta2 receptors on the cell surface and in homogenates. Brain Res 2003; 959: 98-102.
32. Fitch RW, Kaneko Y, Klaperski P et al.: Halogenated and isosteric cytisine derivatives with increased affinity and functional activity at nicotinic acetylcholine receptors. Bioorg Med Chem Lett 2005; 5: 1221-1224.
33. Reavill C, Walther B, Stolerman I, Testa B: Behavioural and pharmacokinetic studies on nicotine, cytisine and lobeline. Neuropharmacol 1990; 29: 619-624.
34. Rasmussen T, Swedberg MD: Reinforcing effects of nicotinic compounds: intravenous self-administration in drug-naïve mice. Br J Pharmacol 1998; 60: 567-573.
35. Coe JW, Brooks PR, Vetelino MG et al.: Varenicline, an R4β2 nicotinic receptor partial agonist for smoking cessation. J Med Chem 2005; 48: 3474-3477.
36. LeSage MG, Shelley D, Ross JT et al.: Effects of the nicotinic receptor partial agonists varenicline and cytisine on the discriminative stimulus effects of nicotine in rats. Pharmacol Biochem Behav 2009; 91: 461-467.
37. Rollema H, Shrikhande A, Ward KM et al.: Pre-clinical properties of the alpha4beta2 nicotinic acetylcholine receptor partial agonists varenicline, cytisine and dianicline translate to clinical efficacy for nicotine dependence. Br J Pharmacol 2010; 160: 334-345.
38. Radchenko EV, Dravolina OA, Bespalov AY: Agonist and antagonist effects of cytisine. Neuropharmacology 2015; 95: 206-214.
39. Jeong SH, Newcombe D, Sheridan J, Tingle M: Pharmacokinetics of cytisine, an α4β2 nicotinic receptor partial agonist, in healthy smokers following a single dose. Drug Test Anal 2015; 7(6): 475-482.
40. https://clinicaltrials.gov/ProvidedDocs/43/NCT03268343/Prot_000.pdf.
41. Klocking HP, Richter M, Damm G: Pharmacokinetic studies with 3H-cytisine. Arch Toxicol 1980; 4(suppl.): 312-314.
42. Jeong SH, Sheridan J, Bullen C et al.: Ascending single dose pharmacokinetics of cytisine in healthy adult smokers. Xenobiotica 2019; 49(11): 1332-1337.
43. Jeong SH, Sheridan J, Newcombe D, Tingle M: Plasma concentrations of cytisine, a commercially available plant-based alkaloid, in healthy adult smokers taking recommended doses for smoking cessation. Xenobiotica 2018; 48(12): 1245-1248.
44. Zatoński W, Cedzyńska M, Tutka P, West R: An uncontrolled trial of cytisine (Tabex) for smoking cessation. Tob Control 2006; 15(6): 481-484.
45. Levshin VF, Slepchenko II, Radkevich NV: Randomized controlled trial of cytisine for a treatment of tobacco dependence [Russian]. Vopr Narkol 2009; 5: 13-22.
46. Castaldelli-Maia JM, Martins SS, Walker N: The effectiveness of Cytisine versus Nicotine Replacement Treatment for smoking cessation in the Russian Federation. Int J Drug Policy 2018; 58: 121-125.
47. Etter JF, Stapleton JA: Nicotine replacement-therapy for long-term smoking cessation: a meta-analysis. Tob Control 2006; 15: 280-285.
48. Hajek P, McRobbie H, Myers K: Efficacy of cytisine in helping smokers to quit: systematic review and metaanalysis. Thorax 2013; 68: 1037-1042.
49. Cahill K, Lindson-Hawley N, Thomas KH et al.: Nicotine receptor partial agonists for smoking cessation. In: Cochrane Database of Systematic Reviews. John Wiley & Sons, Ltd 2016.
50. Scharfenberg G, Benndorf S, Kempe G: [Cytisine (Tabex) as a pharmaceutical aid in stopping smoking]. Dtsch Gesundheitsw 1971; 26: 463-465.
51. Schmidt F: Medical support of nicotine withdrawal. Report on a double blind trial in over 5000 smokers [in German, English translation]. MMW Munch Med Wochenschr 1974; 116: 557-564.
52. Stoyanov S, Yanachkova M: [Tabex-therapeutic efficacy and tolerance]. Savr Med 1972; 23: 6.
53. Richards HGH, Stephens A: A fatal case of laburnum seed poisoning. Med Sci Law 1970; 10(4): 260-266.

