Elżbieta Senkus-Konefka
Hormonalne leczenie nowotworów. Stan obecny i perspektywy
Hormonal treatment of cancer; Current status and perspectives
z Kliniki Onkologii i Radioterapii Akademii Medycznej w Gdańsku
Kierownik Kliniki: prof. dr hab. med. Jacek Jassem
Streszczenie
This paper reviews current knowledge and future prospects of hormonal treatment of malignant tumors, with particular attention to breast and prostate cancer. New drugs with novel mechanism of action, favorable toxicity profile and lack of cross-resistance to standard treatments are presented. Reviewed are also results of studies supporting new indications for hormonal manipulations, such as treatment of early stages of malignancy and prevention of cancer in high-risk groups.

Hormonoterapia jest najstarszą metodą systemowego leczenia nowotworów. Już w 1896 roku Beatson opisał regresję zaawansowanego raka piersi po usunięciu jajników. W leczeniu raka gruczołu krokowego usunięcie jąder stosowane jest od kilkudziesięciu lat (15). Początkowo jedynymi dostępnymi metodami manipulacji hormonalnych były zabiegi ablacyjne: usunięcie jajników, jąder, nadnerczy lub przysadki mózgowej. Wykorzystywane one były przede wszystkim w paliatywnym leczeniu zaawansowanych nowotworów. Z czasem pojawiły się farmakologiczne metody modulacji wpływu endogennych hormonów na komórki nowotworowe oraz syntetyczne preparaty hormonalne, a zakres wskazań poszerzył się o uzupełniające leczenie wczesnych postaci nowotworu. Ostatnie doniesienia wskazują, że metody hormonalne mogą także obniżyć zachorowalność na niektóre nowotwory złośliwe (5, 7).
Po okresie fascynacji nowymi lekami chemicznymi, w ostatnich latach obserwuje się rosnące zainteresowanie badaniami nad nowymi preparatami i nowymi wskazaniami do leczenia hormonalnego. Dotychczas najczęściej stosowane metody leczenia hormonalnego polegały głównie na ograniczeniu pobudzającego wpływu endogennych hormonów na nowotwór. Obecnie pojawiły się preparaty o innych mechanizmach działania, charakteryzujące się przynajmniej częściowym brakiem odporności krzyżowej w stosunku do leków standardowych. Pozwala to na ich sekwencyjne stosowanie, co stwarza nadzieje na wydłużenie czasu odpowiedzi na leczenie i całkowitego czasu przeżycia.
Jedną z podstawowych zalet hormonoterapii, wyróżniającą ją spośród innych metod leczenia nowotworów, jest niewielka toksyczność. Ponadto hormonoterapia jest pierwszą powszechnie stosowaną metodą leczenia nowotworów, w której praktyczne zastosowanie znalazły czynniki predykcyjne (określające prawdopodobieństwo odpowiedzi na leczenie) – receptory estrogenowe i progesteronowe w przypadku raka piersi (11).
Rak piersi
Hormonoterapia stanowi jedną z podstawowych metod leczenia raka piersi. Pozwala ona na uzyskanie regresji nowotworu u około 30% ogółu chorych (18). Eliminację wpływu estrogenów można uzyskać w wyniku usunięcia ich źródła (kastracja chirurgiczna lub radiologiczna, usunięcie nadnerczy), przez usunięcie lub hamowanie działania gonadotropin (usunięcie przysadki mózgowej, agoniści LHRH, danazol, progestageny), blokowanie receptora estrogenowego (tamoksyfen) lub w wyniku hamowania obwodowej syntezy estrogenów z ich prekursorów – androgenów (inhibitory aromatyzy) (tab. 1, ryc. 1) (18). Lekiem z wyboru w hormonoterapii zaawansowanego raka piersi jest tamoksyfen (13). Na podstawie zbiorczej analizy 55 badań randomizowanych obejmujących łącznie 37000 chorych wykazano ponadto, że preparat ten stosowany w leczeniu uzupełniającym wczesnego raka piersi pozwala na obniżenie względnego ryzyka nawrotu choroby o 47%, a umieralności – o 26%. Efekt ten jest niezależny od wieku i stanu menopauzalnego chorych oraz od obecności przerzutów do okolicznych węzłów chłonnych (4). Zmniejszenie ryzyka nawrotu dotyczy również chorych na przedinwazyjną postać raka piersi (6).
Tabela 1. Mechanizmy hormonalnego leczenia raka piersi.
| Mechanizm działania | Grupa preparatów/metoda | Budowa chemiczna | Preparaty |
| usunięcie źródła estrogenów | kastracja chirurgiczna | | |
| kastracja radiologiczna | | |
| usunięcie nadnerczy | | |
| usunięcie lub hamowanie działania gonadotropin | usunięcie przysadki mózgowej | | |
| analogi LHRH | peptydowa | goserelina,
buserelina,
tryptorelina,
leuprorelina |
| inne | steroidowa | danazol,
progestageny
(medroksyprogesteron, octan megestrolu) |
| blokowanie receptora estrogenowego | antyestrogeny | niesteroidowa | tamoksyfen,
toremifen,
idoksyfen,
droloksyfen,
TAT-59,
zindoksyfen,
trioksyfen,
raloksyfen,
EM-800 |
| steroidowa | ICI 182, 789 |
| hamowanie obwodowej syntezy estrogenów | inhibitory aromatazy | niesteroidowa | aminoglutetymid,
anastrozol,
letrozol,
worozol |
| steroidowa | formestan,
egzemestan |
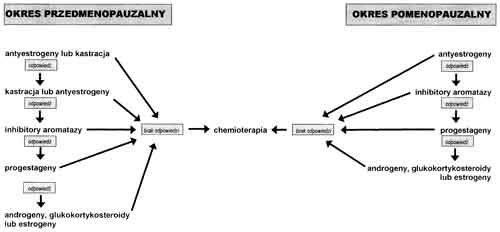
Ryc. 1. Kolejność leczenia hormonalnego chorych na raka piersi.
Ze względu na obserwowane u kobiet przyjmujących tamoksyfen obniżenie ryzyka występowania raka drugiej piersi, podjęto badania nad profilaktycznym stosowaniem tego preparatu u zdrowych kobiet obarczonych podwyższonym ryzykiem zachorowania na ten nowotwór. Zagadnienie to było przedmiotem trzech badań randomizowanych. W największym z nich (NSABP P-1) w grupie przyjmującej profilaktycznie tamoksyfen wykazano ponad 40-procentowe obniżenie ryzyka wystąpienia raka piersi (5). Pomimo braku potwierdzenia tych wyników w pozostałych dwóch badaniach oraz nieznanego wpływu takiego postępowania na umieralność związaną z rakiem piersi, z profilaktycznym zastosowaniem tamoksyfenu wiązane są duże nadzieje. W Stanach Zjednoczonych postępowanie to już obecnie uznane zostało za standardowe.
Aktywność przeciwnowotworowa tamoksyfenu opiera się na jego antagonizmie do receptorów estrogenowych w komórkach raka piersi. Preparat ten ma jednak również szereg korzystnych działań w odniesieniu do układu krążenia, a jego stosowanie w okresie pomenopauzalnym zapobiega obniżeniu się gęstości mineralnej kości (13). Efekty te są spowodowane częściowo agonistyczną aktywnością tamoksyfenu w odniesieniu do receptorów estrogenowych. Działanie takie jest jednak również związane z pewnym wzrostem ryzyka zachorowania na raka trzonu macicy (13). Sposób oddziaływania tamoksyfenu na poszczególne tkanki i narządy jest zależny od typu receptora estrogenowego, a także od oddziaływania na niego szeregu białkowych koaktywatorów i ko-represorów oraz czynników aktywujących transkrypcję (13). Istnieją dwa podstawowe typy receptorów estrogenowych: alfa – obecne głównie w komórkach gruczołu mlekowego i błonie śluzowej macicy, oraz beta – odpowiadające za oddziaływanie estrogenów na układ kostny i gospodarkę lipidową (13). Obecne badania koncentrują się na stworzeniu preparatów, które zachowując korzystny profil oddziaływań tamoksyfenu w odniesieniu do komórek raka piersi, układu kostnego i krążenia, będą pozbawione niekorzystnego wpływu na błonę śluzową macicy. Preparatami hipotetycznie spełniającymi te kryteria są wybiórcze modulatory receptora estrogenowego (SERM – selective estrogen receptor modulators) (13). Badania w tej dziedzinie doprowadziły do stworzenia szeregu leków, m.in. toremifenu, idoksyfenu, droloksyfenu, TAT-59, zindoksyfenu, trioksyfenu oraz raloksyfenu (11, 13). Największe zainteresowanie budzi obecnie raloksyfen. Preparat ten wykazuje korzystny wpływ na gęstość mineralną kości oraz gospodarkę lipidową, przy jednoczesnym braku wpływu na błonę śluzową macicy. Wydaje się on zatem potencjalnie wartościowym lekiem hormonalnym, zapobiegającym osteoporozie u kobiet o podwyższonym ryzyku raka piersi. U kobiet przyjmujących profilaktycznie raloksyfen obserwuje się także znaczące obniżenie ryzyka zachorowania na raka piersi, natomiast lek ten ma niewielką aktywność w leczeniu tego nowotworu (3, 13). Obecnie prowadzone są badania porównujące skuteczność raloksyfenu i tamoksyfenu w hormonalnej profilaktyce raka piersi.
Duże nadzieje wiązane są także z antagonistami receptora estrogenowego pozbawionymi agonistycznych działań estrogenopodobnych (tzw. czystymi antyestrogenami), takimi jak ICI 182, 780 (Faslodex(r)) (13). Wydaje się, że preparaty te nie wykazują krzyżowej oporności w odniesieniu do tamoksyfenu (11, 13). Kolejnym obiecującym związkiem z tej grupy jest EM-800. Jego aktywny metabolit (EM-652) charakteryzuje się najwyższym ze wszystkich preparatów w tej grupie powinowactwem do receptora estrogenowego. Mechanizm działania tych leków wydaje się być związany z hamowaniem przekazywania pobudzającego transkrypcję sygnału powstającego wskutek oddziaływania estrogenów na receptor (13).
Grupą leków, która w ostatnich latach przyczyniła się do zmiany schematów hormonalnego leczenia raka piersi, są inhibitory aromatazy nowej generacji (letrozol, anastrozol, worozol, formestan, egzemestan). Hamują one aktywność aromatazy – enzymu odpowiedzialnego za pozajajnikową syntezę estrogenów u kobiet w wieku pomenopauzalnym (18). Leki te pozbawione są agonistycznego efektu estrogenopodobnego tamoksyfenu oraz nie wykazują w odniesieniu do niego krzyżowej oporności (18). Dodatkową, potencjalnie ważną klinicznie zaletą niektórych leków tej grupy jest ich zdolność do hamowania wytwarzania estrogenów w guzie nowotworowym (18). Aktywność przeciwnowotworowa inhibitorów aromatazy nowej generacji jest nieco wyższa od standardowych leków „drugiego rzutu”, takich jak octan megestrolu. Powodują one ponadto mniej objawów niepożądanych i są lepiej tolerowane (18). Prowadzone są również badania nad zastosowaniem tych preparatów w pierwszorazowym leczeniu hormonalnym choroby zaawansowanej, w uzupełniającym leczeniu wczesnego raka piersi oraz w profilaktyce hormonalnej raka piersi.
Inną budzącą w ostatnich latach zainteresowanie grupą leków są analogi LHRH (hormonu uwalniającego gonadotropiny). Te pochodne naturalnego LHRH, charakteryzujące się podwyższoną aktywnością i wydłużonym czasem półtrwania w porównaniu do naturalnego hormonu, stosowane są w leczeniu raka piersi u kobiet w wieku przedmenopauzalnym. Wskutek związania i unieczynnienia receptorów w komórkach przysadki, leki te blokują działanie naturalnego LHRH, co prowadzi do zmniejszenia wydzielania gonadotropin w efekcie – do „kastracji farmakologicznej” (17). Skuteczność przeciwnowotworowa tych preparatów jest zbliżona do kastracji chirurgicznej i tamoksyfenu (17). Zaletami kastracji farmakologicznej w porównaniu z metodami „klasycznymi” jest brak niekorzystnych skutków fizycznych zabiegu operacyjnego lub radioterapii, mniejsze niekorzystne skutki psychologiczne oraz odwracalność kastracji. Leki te pozbawione są także objawów niepożądanych tamoksyfenu – niekorzystnego wzrostu poziomu estradiolu, ryzyka powstawania torbieli jajników oraz działania pobudzającego rozrost błony śluzowej macicy (17).
Połączenie analogów LHRH z antyestrogenami (tzw. całkowita blokada estrogenowa) pozwala na zniesienie potencjalnie niekorzystnego 3-4-krotnego wzrostu poziomu estradiolu, obserwowanego przy stosowaniu tamoksyfenu u kobiet w wieku przedmenopauzalnym (17). Wyniki czterech prospektywnych badań randomizowanych wskazują, że leczenie skojarzone pozwala uzyskać wyższy odsetek odpowiedzi klinicznych, dłuższy czas do progresji i dłuższy całkowity czas przeżycia, w porównaniu do monoterapii analogiem LHRH (17).
Zastosowanie analogów LHRH w uzupełnieniu miejscowych metod leczenia u chorych we wczesnych stadiach nowotworu jest obecnie przedmiotem kilku międzynarodowych prospektywnych badań randomizowanych, które łącznie obejmują ponad 8000 chorych. W części tych badań obserwowano obniżenie ryzyka nawrotu i raka drugiej piersi w grupach otrzymujących analogi LHRH w porównaniu do chorych leczonych chemicznie. Wydłużenie czasu do wznowy uzyskano również poprzez stosowanie analogu LHRH w skojarzeniu ze standardowym leczeniem uzupełniającym (17).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Agency for Health Care Policy and Research: Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostatic cancer. AHCPR Evidence Report/ Technology Assessment No 4, May 1999. http://www.ahcpr.gov/clinic prossumm.htm (04.04.2000). 2. Bolla M. et al.: Improved survival in patients with locally advanced prostate cancer treated with radiotherapy and goserelin. N. Engl. J. Med. 1997, 337:295. 3. Cummings S.R. et al.: The effect of raloxifene on risk of breast cancer in postmenopausal women. Results from the MORE randomized trial. JAMA 1999, 281:2189. 4. Early Breast Cancer Trialists´ Cooperative Group: Tamoxifen for early breast cancer: an overview of the randomised trials. Lancet 1998, 351:1451. 5. Fisher B. et al.: Tamoxifen for prevention of breast cancer: report of the National Surgical Adjuvant Breast and Bowel Project P-1 study. J. Natl. Cancer. Inst. 1998, 90:1371. 6. Fisher B. et al.: Tamoxifen in treatment of intraductal breast cancer: National Surgical Adjuvant Breast and Bowel Project B-24 randomised controlled trial. Lancet 1999, 353:1993. 7. Franceschi S. et al.: Colorectal cancer and hormone replacement therapy: an unexpected finding. Eur. J. Cancer Prev. 1998, 7:427. 8. Kath R. et al.: The significance of somatostatin analogues in the antiproliferative treatment of carcinomas. Recent Results Cancer Res. 2000, 153:23. 9. Kim Y.B. et al.: Progestin alone as primary treatment of endometrial carcinoma in premenopausal women. Report of seven cases and review of the literature. Cancer 1997, 79:320. 10. Kuyu H. Et al.: Recent advaces in the treatment of prostate cancer. Ann Oncol. 1999, 10:891. 11. Locker G.Y.: Hormonal therapy of breast cancer. Cancer Treat. Rev. 1998, 24:221. 12. Messing E.M. et al.: Immediate hormonal therapy compared with observation after cadical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer. N. Engl. J. Med. 1999, 341:1781. 13. Minton S.E.: New hormonal therapies for breast cancer. http:/www.hlmcc.org/pubs/ccj/v6n3/article3.htm (03.04.2000). 14. Prostate cancer (PDQ(r)). Treatment – Health Professionals. http:/cancernet.nci.nih.gov/cgi-bin/sechcgi.exe?DBID=se
arcg&SFMT=pdq–statement/1/0/0&Z208=208–01229H (03.04.2000). 15. Rago R.: Management of hormone – sensitive and hormone – refractory metastatic prostate cancer. http://www.moffitt.usf.edu/pubs/ccj/v5n6/article4.html (03.04.2000). 16. Rambeaud J.J.: Intermittent complete androgen blockade in metastatic prostate cancer. Eur. Urol. 1999, 35 Supl. 1:32. 17. Senkus-Konefka E.: Rola analogów LHRH w leczeniu raka piersi. Nowotwory 2000, 50:252. 18. Senkus-Konefka E., Jassem J.: Inhibitory aromatazy nowej generacji w leczeniu raka piersi. Nowotwory 1999, 49:183. 19. Trachtenberg J.: Innovative approaches to the hormonal treatment of advanced prostate cancer. Eur. Urol. 1997, 32 Supl. 3:78. 20. Yang F.E. et al.: The potential for normal tissue dose reduction with neoadjuvant hormonal therapy in conformal treatment planning for stage C prostate cancer. Int. J. Radiat. Oncol. Biol. Phys. 1995, 33:1009.


