© Borgis - Postępy Fitoterapii 4/2000, s. 21-28
Volker Schulz
Psychodynamiczne i farmakodynamiczne działanie leków
Psychodynamic and pharmacodynamic effects of herbal drugs
Oranienburger Chausee 25, 13465 Berlin, Germany
Summary
The therapeutic utiiity of medicines is nowadays usually measured in terms of parameters devised m the artificial surroundings of a double blind clinical trial. The difference between the actwe drug and the placebo is accepted as being the same as the desired overall effect. Yet, when applied to whole categories of medicines, this yardstick can be misleading, as has become apparent from the discussion which has recently arisen regarding the genuine and the illusory pharmacodynamic effects ofsynthetic antidepressants. Selectwe analysis of a representatwe number of placebo-controlled studies has shown that used for depressiue conditions, the psychodynamic components contribute far morę to the overall effect than do the pharmacodynamic components. In this respect, modern synthetic antidepressants arę no better than Hypericum products o f plant origin. Among other things, this means that for depressiue stałeś and similar indications, the safety, tolerability and acceptability of a medicine must be given much greater weight than its pharmacodynamic effect as assessed simply by testing against a placebo. The quantification of the two therapeutic components, as can be done by a placebo-controlled drug trial, has reuealed that the overall outcome of phytotherapy for uarious important indications o f this kind is predominantly attributable to the psychodynamic component. It may reasonably be assumed that the contribution madę by the pharmacodynamic effects to the overall therapeutic response will amount oniy to about 20-50%. This raises ąuestions regarding the clinical relevance and economic value of placebo-controlled studies. When assessing data on drug efficacy for the purpose of licensing applications, greater regard should be given to this reality.

Pojęcie „placebo” pojawiło się w niemieckim obszarze językowym na początku lat pięćdziesiątych w związku z „obiektywną" oceną skuteczności i tolerancji leków w ramach kontrolowanych badań klinicznych. Skuteczność definiowano wówczas jako przeciwieństwo efektu placebo, a zatem już wkrótce zaczęto deprecjonować placebo jako niespecyficzne i niepożądane. Znany słownik kliniczny Pschyrembla definiuje na przykład placebo następująco: „lek pozorny, nieskuteczna obojętna substancja, stosowana przez pacjenta i odpowiadająca wyobrażonej potrzebie farmakoterapii". Wprawdzie lekarze zauważyli już wcześniej, że efekt stosowania leku często nie zależy tak bardzo od jego farmakologii, jak od kontekstu terapeutycznego (zaufanie pacjenta do lekarza, pozytywnego nastawienia lekarza i pacjenta do leku, powszechnej opinii o skuteczności i bezpieczeństwie) (l). Rzeczowe stanowisko na temat klinicznego i ekonomicznego działania placebo pojawiło się jednak dopiero w ostatnich latach (5,19). Szczególnych powodów do nowej oceny dostarczają ostatnio zebrane wyniki licznych kontrolowanych przez placebo prób z neuropsycho-farmaceutykami, zwłaszcza lekami przeciwdepresyjnymi (2, 9, 14, 15, 18). Doświadczenia z preparatami syntetycznymi, jak fluoksetyna, nie różnią się od doświadczeń z roślinnymi środkami przeciwdepresyjnymi, takimi jak dziurawiec.
Decydujące nie jest zatem chemiczne, czy roślinne pochodzenie substancji czynnej, lecz udział obu części składowych skuteczności terapeutycznej (ryc. 4). Dotyczy to w szczególności wskazań, które odgrywają wiodącą rolę w fitoterapii. Przedmiotem niniejszego artykułu jest stanowisko krytyczne w tej sprawie oraz pytanie o konsekwencje, jakie mogą wynikać z zależnego od wskazań wyważenia obu aspektów działania. Ze względu na mylące i negatywne nacechowanie określenia „efekt placebo", nie będziemy go stosować w dal
szej części, lecz zastąpimy trafniejszym pojęciem „działanie psychodynamiczne" (7).
Krytyka dowodów skuteczności środków przeciwdepresyjnych
Podczas lektury krajowych i zagranicznych czasopism fachowych natrafia się obecnie na tytuły, które wydają nam się znane z fitoterapii. Podczas gdy angielskie pismo pyta jeszcze z nadzieją „Can the placebo be the cure?". (2), redakcja z siedzibą w Bawarii wybiera bardziej prowokujący nagłówek „Pigułki bez mocy?". (10). Okazuje się przy tym, że nie chodzi wcale o „kontrowersyjne" preparaty pochodzenia roślinnego, lecz o bardzo szanowaną grupę leków syntetycznych, mianowicie neuropsychofarmaceutyki.
Metaanaliza terapeutycznych efektów cząstkowych
Co jest powodem tej zaskakującej krytyki? Dwaj autorzy amerykańscy przeprowadzili analizę siły działania terapii syntetycznymi środkami przeciwko depresji. Spośród 1500 kontrolowanych prób klinicznych, przeprowadzonych w latach 1974 do 1995, wybrano dane z kontrolowanych przez placebo 19 prób, zawierających wszystkie niezbędne informacje. Na podstawie metaanalizy autorzy stwierdzili, że obserwowane efekty terapii można tylko w jednej czwartej przypisać substancji czynnej, w jednej czwartej działaniom niespecyficznym i w połowie działaniom placebo (ryc. l). Porównując wyniki badań środków przeciwdepresyjnych o różnej tolerancji autorzy stwierdzili ponadto dodatnią korelację pomiędzy częstotliwością charakterystycznych działań ubocznych a udziałem czynnika farmakodynamicznego w efekcie całościowym. Inaczej mówiąc, im wyższy wskaźnik wykazanych działań ubocznych, jak suchość w ustach, tym lepiej wypada dowód skuteczności w porównaniu z placebo (9).
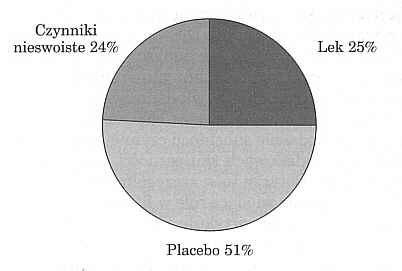
Ryc. l. Wynik metaanalizy 19 prób terapeutycznych z syntetycznymi lekami przeciwdepresyjnymi. Uzyskany u pacjenta całościowy efekt farmakoterapeutyczny zależy według tego obliczenia tylko w jednej czwartej od efektu farmakodynamicznego substancji czynnych (9).
Kryteria sukcesu według Hamiltona
Dla lepszego zrozumienia tezy Kirscha i Sapirsteina (9) oraz jej znaczenia przede wszystkim w próbach terapeutycznych z preparatami dziurawca, należy wyjaśnić metodę, która jak prawie żadna inna towarzyszy badaniom klinicznym wszystkich środków przeciwdepresyjnych, a mianowicie skalę depresji Hamiltona (HAMD). Tę zagraniczną skalę oceny wprowadzono w ogólnych zarysach już w roku 1960, kilka lat po pojawieniu się pierwszych tricyklicznych środków przeciwdepresyjnych (8). Na podstawie 17 lub 21 typowych cech depresji lekarz dokonuje oceny poszczególnych czynników w skali liczbowej, a następnie zlicza poszczególne wyniki, uzyskując jedną ocenę sumaryczną. Pozwala to z pewnymi ograniczeniami określić również natężenie choroby. Do dwunastu punktów stan uważa się za normalny, 13-19 wskazuje na lekką depresję, 20-25 - na depresję umiarkowaną, a ponad 25 punktów - depresję ciężką. Sukces kuracji lekami przeciwdepresyjnymi można wówczas ocenić jako zmniejszenie wartości oceny sumarycznej. Za reagujących na terapię uważa się przeważnie pacjentów, u których początkowy wynik obniża się co najmniej o 50% lub do wartości poniżej 10 punktów (tab. l).
Tabela l. Kryteria skali depresji według Hamiltona (8).
Publikacja oryginalna:
- Hamilton MA (1960) A rating scale for depression. J. Neurol. Neurosurg. Psychiatry 23, 56-62.
Metoda:
- Ocena 17 lub 21 cech ("items") przez lekarza w skali od zera do czterech.
-
Zsumowanie wyników dla uzyskania oceny ogólnej.
Ocena ogólna HAMD:
- ok. 0-12 wahania w zakresie normy;
- ok. 13-19 lekka depresja;
-
ok. 20-25 umiarkowana depresja;
- ok. 26-40 ciężka depresja.
Efekt terapeutyczny:
- Ocena statystyczna różnic przebiegu i różnic grupowych;
-
U chorych reagujących na lek wynik powinien zmniejszyć się o 50% lub do wartości poniżej 10 punktów. |
Porównanie siły działania preparatów dziurawca z tzw. inhibitorami SSRI
Na rycinie 2 przedstawiono typowe zjawisko zmniejszenia ogólnego wyniku HAMD w kontrolowanej przez placebo próbie z preparatem z dziurawca (6). W ciągu czterotygodniowej terapii z zastosowaniem 900 mg wyciągu w porównaniu z placebo wynik na skali Hamiltona obniżył się w stosunku do początkowego rezultatu w obu grupach, wynoszącego około 21 do 14 punktów dla placebo i 9 dla Hypericum. Z przyczyn etycznych obie grupy terapeutyczne zostały przestawione na verum. Różnica grupowa wobec placebo była wyraźnie mniejsza niż różnica w przebiegu leczenia za pomocą verum. Względną przewagę efektu placebo, występującą także w większości innych badań tego rodzaju, tłumaczy się na ogół jako dowód niepewności działania preparatów z dziurawca w porównaniu z syntetycznymi środkami antydepresyjnymi. Jak właściwie wygląda sprawa tych ostatnich?
Dzięki istniejącej w USA wolności informacji każdy ma możliwość wglądu w dokumentację FDA związaną z dopuszczeniem leku do obrotu.
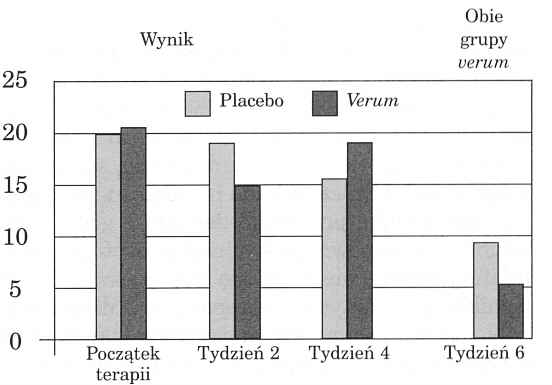
Ryc. 2. Typowy rozkład wartości średnich na skali Hamiltona w kontrolowanym przez placebo badaniu preparatu z dziurawca (6).
Na tej podstawie uzyskaliśmy wypisy z oryginału New Drug Application 20-031 dotyczące dopuszczenia leku przeciwdepresyjnego paroksetyny oraz wypisy z oryginału New Drug Application 18-936 dotyczące dopuszczenia fluoksetyny. Obie substancje lecznicze należą do nowej generacji syntetycznych leków przeciwdepresyjnych, uważanych za równie skuteczne jak klasyczne substancje tricykliczne. Dopuszczenie paroksetyny przed FDA w roku 1992 opierało się na jedenastu próbach kontrolowanych przez placebo. Średnia różnica ogólnej oceny na skali Hamiltona wynosiła dla tych jedenastu prób po czterotygodniowej terapii 10,1 punktów dla paroksetyny i 6,8 punktów dla placebo. Oszacowany efekt środka leczniczego wynosił zatem 3,3 punkty i był tym samym mniejszy od jednej trzeciej całościowego efektu terapeutycznego (tab. 2). Siła działania, wykazana w badaniach klinicznych dla nowoczesnego syntetycznego środka przeciwko depresji z grupy tzw. inhibitorów ponownego wychwytu serotoniny (inhibitory SSRI), nie różni się więc zasadniczo od wyników uzyskanych dla preparatów z dziurawca.
Tabela 2. Przedruk oryginalnego wyciągu z "New Drug Application" (NDA) 20-031 dla środka antydepresyjnego paroksetyny, opracowanego przez FDA. Zmiany ogólnego wyniku HAMD wynosiły wił próbach z paroksetyną średnio 10,1, z placebo natomiast 6,8. Efekt farmakodynamiczny był zatem mniejszy niż jedna trzecia całościowego efektu terapeutycznego (4).
| Próba | Paroksetyną | Placebo | Wartość p1 | Ocena statystyczna2 |
| N3 | (%)4 | HAM | N | (%) | HAM-DB |
| 01-001 | 24 | 79 | -12,9 | 24 | 75 | -10,4 | .20 | negatywna |
| 02-001 | 43 | 77 | -11,6 | 44 | 77 | 7,4 | .02 | zachęcająca |
| 02-002 | 36 | 78 | -10,2 | 34 | 74 | -6,6 | .07 | zachęcająca |
| 02-003 | 39 | 82 | -8,9 | 37 | 68 | -7,4 | .49 | negatywna |
| 02-003 | 36 | 92 | -12,2 | 38 | 71 | -7,2 | .002 | pozytywna |
| 03-001 | 39 | 75 | -9,8 | 37 | 71 | -5,1 | .002 | pozytywna |
| 03-002 | 40 | 68 | -8,0 | 40 | 55 | -6,2 | .5 | brak |
| 03-003 | 39 | 73 | -9,3 | 42 | 79 | -9,2 | .98 | brak |
| 03-004 | 37 | 73 | -9,3 | 42 | 79 | -9,2 | .04 | zachęcająca |
| 03-005 | 40 | 78 | -9,6 | 42 | 79 | -5,2 | .02 | pozytywna |
| 03-006 | 39 | 56 | -7,9 | 37 | 34 | -3,4 | .01 | pozytywna |
1 Wynik sponsora ANOVA
2 Ocena statystyczna skuteczności wykazuje wyższość paroksetyny względem placebo według analiz statystycznych (Pacjent Petronis próba 01 i 02, pacjentka Mele próba 03)
3 Liczba pacjentów dostępnych w czwartym tygodniu analizy LOCF
4 % pacjentów uczestniczących w czwartym tygodniu terapii
Aśrednia = 10,1; Brednia = 6,8; różnica średnich = 3,3
Najbardziej znanym syntetycznym lekiem przeciwdepresyjnym z grupy tzw. inhibitorów ponownego wychwytu serotoniny jest fluoksetyna, dopuszczona do obrotu przez FDA w roku 1988. Dokumentacja wnioskodawcy obejmowała cztery próby z kontrolą placebo, w tym jedną z obszernymi badaniami, przeprowadzonymi na 746 pacjentach ambulatoryjnych leczących depresję. Chorych podzielono mniej więcej na połowę, kwalifikując jako przypadki depresji „łagodnej" i „umiarkowanej". Dokonano ponadto prospektywnej kontroli z trzema dawkowaniami, mianowicie 20, 40 i 60 mg dziennie. Jak widać z tabeli 3, u pacjentów z depresją „łagodną" nie zauważono w ogóle znaczących różnic pomiędzy placebo a trzema dawkami verum. U pacjentów z „umiarkowanym" nasileniem depresji zmniejszenie ogólnego wyniku na skali Hamiltona było w przypadku dawki 20 i 40 mg o mniej więcej jedną trzecią większe niż dla placebo. Optymalny efekt uzyskano dla dawki 20 mg dziennie; przy 60 mg dziennie różnica względem placebo nie była już znacząca. Zjawisko podobnej zależności pomiędzy dawką a działaniem obserwowano - przynajmniej w eksperymencie farmakologicznym - również dla wyciągu z dziurawca.
Na rycinie 3 przedstawiono jeszcze raz w nieco innej formie relacje wartości końcowych skali Hamiltona przy dawkowaniu w wysokości 20 mg fluoksetyny dziennie. Z wykresu wynika, że w takich badaniach wynik wyjściowy na skali Hamiltona jest dość wysoki. Zmiana zależy u pacjentów z lekką depresją niemal wyłącznie, a u pacjentów z umiarkowaną depresją jeszcze prawie w dwóch trzecich od działania psychodynamicznego, czyli inaczej mówiąc od efektu placebo. Do tego stwierdzenia nawiążemy w dalszych wywodach, omawiając „konsekwencje dla fitoterapii".
Tabela 3. Wynik poczwórnej próby terapeutycznej z dokumentacji dopuszczenia do obrotu środka przeciwdepresyjnego fluoksetyny. Brak istotnej różnicy dla trzech dawek verum w stosunku do placebo u pacjentów z depresją "łagodną", przy depresji "umiarkowanej" zależność skuteczności od dawki po osiągnięciu maksimum ma postać krzywej malejącej (3).
| Fluoksetyna (mg/d) | 0 | 20 | 40 | 60 |
| Różnica HAMD | depresja "łagodna" | -5,82 | -6,23 | -6,04 | -5,39 |
| "umiarkowana" | -5,69 | -9,78** | -9,58** | -7,2 |
**= p <0,01
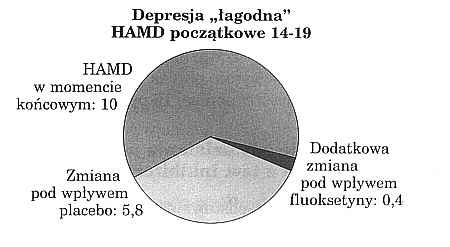
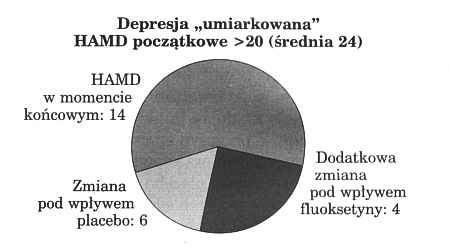
Ryc. 3. Rezultat badań jak w tabeli 3, przedstawiony w formie wykresu kołowego wyników na skali HAMD po 6 tygodniach terapii z uwzględnieniem różnic w stosunku do początku terapii. Różnice te w „łagodnych" depresjach zależą niemal wyłącznie, a w depresjach "umiarkowanych" jeszcze w przeważającej części od efektu psychodynamicznego (3).
Porównanie tolerancji syntetycznych i roślinnych środków przeciwdepresyjnych
W momencie dopuszczenia fluoksetyny do obrotu przez FDA dostępna była dokumentacja działań ubocznych w postaci wyników badań kontrolowanych leczenia 1173 przypadków fluoksetyna i 243 przypadków terapii uzupełniającej tricyklicznym lekiem przeciwdepresyjnym imipraminą. Najczęstszym działaniem ubocznym imipraminy była suchość w ustach, występująca u nie mniej niż 70% leczonych. U leczonych fluoksetyna największą częstotliwość, wynoszącą 25%, stwierdzono dla odruchu wymiotnego (tab. 4).
Tabela 4. Częstotliwość działań niepożądanych imipraminy i fluoksetyny na podstawie wyników badań przedłożonych jako dokumentacja wniosków o dopuszczenie do obrotu (3).
| Niepożądane działanie leku | Imipramina
(%) | Fluoksetyna
(%) |
| Suchość w ustach | 70 | 15 |
| Zawroty głowy | 28 | 10 |
| Mdłości | 16 | 25 |
| Zaparcie | 22 | - |
| Senność | 22 | 15 |
| Poty | 21 | 12 |
| Nerwowość | - | 21 |
| Ból głowy | 17 | 18 |
| Drżenie | 17 | 15 |
| Biegunka | - | 11 |
Wysoki wskaźnik specyficznych działań ubocznych, jak suchość w ustach, zmęczenie lub zawroty głowy podczas terapii tricyklicznymi lekami przeciwdepresyjnymi jest znany w literaturze i stwierdzony m.in. w przeprowadzonej przez Whetleya (20) próbie porównawczej amitryptyliny z preparatem z dziurawca LI 160 (tab. 5). W przypadku preparatu z dziurawca nie obserwowano natomiast zwiększonej częstotliwości specyficznych dla określonej substancji działań ubocznych, co oznacza m.in., że próby terapeutyczne z preparatami z dziurawca są całkowicie ślepe, czego nie można powiedzieć o badaniach syntetycznych leków przeciwdepresyjnych.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Balint M.: Der Arzt, sein Patient und die Krankheit. Klett Verlag, Stuttgart 1957. 2. Enserink M.: Science 1999, 284:238. 3. FDA: New drug application 18-936, 1988. 4. FDA: New drug application 20-031, 1992. 5. Gauler T. C., Weihrauch T. R.: Placebo - ein wirksames und ungefahriiches Medikament? Urban und Schawrzenberg, Mimchen 1997. 6. Hansgen K.D., Vesper J.: Munch. Med. Wschr. 1996, 138:29. 7. Hansel R. et al.:Pharmakognosie - Phytopharmazie. Springer, Berlin-Heidelberg-New York 1999, s. 1198. 8. Hamilton M.:J. Neurol. Neurosurg. Psychiatry 1960, 23:56. 9. Kirsch I., Sapirstein G.: Prevent. Treatment 1998, l, 0002a. 10. Kurz A.: Munch. Med. Wchr./Fortschr. Med. 1999, 141:17. 11. Linden M. i wsp.: Munch. Med. Wchr. 1992, 134:836. 12. Maxwell ER. et al.: Lancet 1997, 350, 1691.13. Metzker H. et al.: Urologe (B) 1996, 36, 292.14. Montgomery S.A.: Eur. Neuropsychopharmacol. 1999, 9, 265. 15. Montgomery S.A.: Eur. Neuropsychopharmacol. 1999, 9, 271. 16. Nickel J.C.: Brit. J. Urology 1998, 81, 383. 17. Nickel J.C. et al.: Can. Med. Assoc. J. 1996, 155, 1251. 18. Quitkin KM.: Am. J. Psychiatry 1999, 156, 829. 19. Weihrauch T.R., Gauler T.C.: Arzneimittelfbrsch./Drug Res. 1999, 49, 385. 20. Wheatley D.: Pharmacopsychiatr. 1997, 30 (supl.), 77. 21. Woelk H. et al.: J. Geriatr. Psychiatry Neurol. 1994, 7 (Supl. l), 34.




