© Borgis - Postępy Fitoterapii 1-2/2005, s. 15-28
Tadeusz Wolski1, 2, Agnieszka Najda2
Substancje słodzące pochodzenia naturalnego
Sweetening substances of natural origin
1Katedra i Zakład Farmakognozji z Pracownią Roślin Leczniczych Akademii Medycznej im. prof. F. Skubiszewskiego w Lublinie
Kierownik Katedry i Zakładu: prof. dr hab. n. farm. Kazimierz Głowniak
2Katedra Warzywnictwa i Roślin Leczniczych Akademii Rolniczej w Lublinie
Kierownik Katedry: prof. dr hab. Jan Dyduch
Summary
The investigation presented in this paper focuses on the search of substitutive sweetening substances. Such an aim results from excessive intake of saccharose which may lead to such diseases as arteriosclerosis or obesity and increase the number of patients suffering from diabetes. The substances responsible for the sweet taste can be divided into four groups: proteins, peptides, natural organic compounds and synthetic organic compounds. In the investigation, the mechanism of the sense of the sweet taste depending on its chemical structure was described. On the basis of our investigation it can be observed that the chemical structure of substances has vital influence on the intensity of the sweet taste. Thanks to the hypothesis about the possibility of making hydrogen bonds between adequate structures of the sweet substance and the centres of the taste receptor, there has been considerable progress in the explanation of the sense of sweet taste on molecular level. The aim of the investigations is to make a model or theory that will allow to predict the structure of the effective sweetening substance safe for the health of people.
The division of saccharids and sweetening substances included in this group were presented in this paper. Starch syrups and other syrups, their characteristics, importance and application were widely described. In the further part of our paper, the importance of sugars in the nourishment of people was thoroughly discussed. The relative sweetness of sweet substances as opposed to glucose and saccharose was also compared and described.
Maraculine, moneline, taumatine and its alluminium complex (i. e. taline) as natural substances belonging to plant proteins were discussed. Another huge group of natural sweetening substances are dihydrochalcon glycosides that can be obtained from nargenine. The relative sweetness of dihydrochalcons´ analogues is greater than that of saccharose (about 1000 to 2000 times). In the further part of our paper other natural sweetening substances as glicerisine (occurring in the roots of licorice ( Gliceriza glabla L.), stewioside (occurring in Stevia rebaudiana), osladine (occurring in the rhizome of ordinary fern) were described. Moreover, triterpene glycoside obtained from the fruit of the Chinese plant Mamordica grosvenori, hexahydrofluorendicarboxylic acid occurring in the resin of the Pinus species as well as chlorogene acid and cinarine having properties that can modify the taste. Phytodulcine, which occurs in the leaves of Hydrangea aerophylla, is considered the representative of natural isocumarins and is 200 up to 300 times sweeter than saccharose. Another compound is perilaltime which occurs in Perylla nankinensis and which, after the transformation of its aldehyde structure into aldoxime (E-periloaldoxime), remains 2000 times sweeter than saccharose.

Zainteresowanie substancjami słodzącymi pochodzenia naturalnego stale wzrasta. Problematyka ta interesuje specjalistów z zakresu żywienia i produkcji żywności, a także lekarzy oraz dietetyków. Poszukiwanie zastępczych środków słodzących podyktowane jest tym, że spożywanie nadmiernych ilości sacharozy wywołuje miażdżycę, otyłość i wzrastającą liczbę zachorowań na cukrzycę. Substancje wywołujące słodki smak można podzielić na cztery grupy: białka, dipeptydy, naturalne związki organiczne i syntetyczne związki organiczne.
Dotychczas nie udało się znaleźć środka słodzącego, który pełniłby w sposób doskonały rolę zastępczą, zarówno pod względem słodkości, rozpuszczalności i trwałości, a przy tym miał niską wartość energetyczną i był nietoksyczny oraz niekarcinogenny. Substancje o słodkim smaku mają olbrzymie praktyczne znaczenie w żywieniu człowieka, jednak równocześnie wykazują szkodliwy wpływ na jego zdrowie (32, 38, 48).
BUDOWA CHEMICZNA A SŁODKI SMAK
Reakcja smakowa jest procesem złożonym i niedostatecznie zbadanym. Jej pojawienie się jest wynikiem interakcji cząsteczek substancji wywołującej smak z odpowiednim receptorem. Układ sensoryczny u człowieka zawiera kilka rodzajów receptorów smakowych, znajdujących się w poszczególnych strefach języka. Reagują one na różne rodzaje substancji wywołujących cztery podstawowe smaki: słony, kwaśny, gorzki i słodki, przy czym receptory reagujące na smak słodki znajdują się w kubeczkach smakowych w przedniej części języka. Jak wykazały badania, struktura chemiczna substancji ma istotny wpływ na słodki smak. Okazało się, że sacharydy różnią się od siebie intensywnością słodkiego smaku. Smak słodki acyklicznych polioli, takich jak glikol etylenowy czy gliceryna, które mają fragmenty strukturalne podobne jak cukry, początkowo wiązano z ogólną liczbą grup hydroksylowych znajdujących się w ich cząsteczkach. Takie przypuszczenie okazało się niesłuszne. Stwierdzono, że takie cukry jak glukoza i galaktoza, zawierające taką samą liczbę grup hydroksylowych, różnią się intensywnością słodkości. Również poliole z pięcioma grupami hydroksylowymi, np. ksylitol, są słodsze od tych, które mają tych grup sześć, np. sorbitol (6). Gdy ustalono pierścieniową strukturę sacharydów okazało się, że różnica w słodkości diastereoizomerów może być powodowana konfiguracją przy jednym atomie węgla, jak to jest w przypadku par a-D-glukopiranozy, która jest słodka i a-D-galaktopiranozy, która jest mniej słodka oraz a-D-mannopiranozy i b-D-mannopiranozy, z których pierwsza jest słodka a druga gorzka (51).
Próbą wyjaśnienia odczucia słodkiego smaku jest hipoteza Shallenbergera (42, 43), który wyraził przypuszczenie, że kontakt między substancją smakową i receptorem powstaje poprzez utworzenie wiązania wodorowego między odpowiednimi strukturami substancji słodkiej i aktywnymi centrami receptora, który charakteryzuje się zdolnością do wiązania cząsteczki o właściwej konfiguracji. Tworzenie się międzycząsteczkowego wiązania wodorowego jest możliwe dzięki obecności ugrupowań protonodonorowych (typu AH) i elektronodonorowych (typu B) w strukturach substancji słodkiej, jak również i w odpowiednich receptorach. Powstający dwurdzeniowy kompleks wodorowy wywołuje odczucie słodkiego smaku, a trwałość tego wiązania decyduje o jego intensywności (8, 44, 45). Interakcja pomiędzy receptorem a substancją słodką przedstawiona jest na rycinie 1.
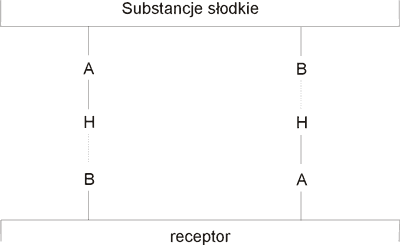
Ryc. l. Międzycząsteczkowe wiązanie wodorowe między strukturami substancji słodkiej i aktywnym centrum rerceptora (32).
Stwierdzono, że geometria układów protonodonorowych (AH) oraz elektronodonorowych (B) cząsteczek sacharydów i aktywnego centrum w receptorze stwarza pewność powstania kompleksu. Odczucie słodkości wywołane przez cukry trwa krótko wskutek tego, że trwałość wiązań wodorowych, które powstały, jest niewielka. Natomiast syntetyczne środki słodzące, które są kilkaset razy słodsze od cukrów, tworzą trwałe wiązania wodorowe z receptorami i to z dużą szybkością. Stwierdzono, że gdy słodka cząsteczka pasuje stereochemicznie do aktywnego centrum receptora, szybkość z jaką centra wzajemnie reagują, może być czynnikiem bardziej decydującym niż trwałość samego kompleksu. Mechanizm wzajemnej orientacji pary; receptor-związek słodki, został ustalony na podstawie danych uzyskanych w badaniach słodkiego smaku stereoizomerycznych aminokwasów (5, 46, 49, 59). Fakt, że wiele D-aminokwasów ma słodki smak, podczas gdy ich izomery L-aminokwasów są gorzkie lub bez smaku, świadczy o stereospecyficzności receptora i wskazuje, że istnieje jeszcze trzecie miejsce kontaktu związku słodkiego z receptorem. To trzecie miejsce słodkiego farmakoforu jest uważane za centrum wiązania dyspersyjnego lub kombinowanej funkcji lipofilowej i hydrofilowej (19, 27, 47).
Istotną i niedocenianą właściwością związku o słodkim smaku jest zdolność do tworzenia wiązań wodorowych i rozpuszczalność w wodzie. Duże znaczenie ma też część hydrofobowa, która oddziaływuje ze smakowymi centrami receptora. Ten etap zależy od interakcji grup hydroksylowych, stopnia polarności, odległości poszczególnych ładunków w cząsteczce, gęstości elektronowej, stałej Hammetta i efektów sterycznych (11). Badano wpływ stopnia hydrofobowości i geometrii podstawników w bocznym łańcuchu dipeptydów na intensywność ich słodkiego smaku. Stwierdzono, że centrum rozgałęzionego łańcucha bocznego w aspartamie jest w środku pierścienia benzenowego. Przypuszcza się, że im dokładniej zewnętrzny obrys związku słodkiego odpowiada powierzchni receptora, tym łatwiej osiąga się odpowiedni kontakt między nimi i tym intensywniej objawi się słodki smak związku (17, 25, 34, 37, 54).
Badania w zakresie doznań smakowych wskazują na ścisłą zależność między smakiem słodkim i gorzkim. Te dwa odczucia zależą od całkowitej stereochemii cząsteczki substratu wywołującego smak. Bardzo łatwo można przeprowadzić słodkie cukry w gorzkie pochodne. Podczas badań cukrów typu glukopiranozydowego stwierdzono, że położenia l, 2 i 6, a także atom tlenu pierścienia pirazonowego są odpowiedzialne za gorzki smak (7, 8).
Dotychczas brak jest instrumentalnych metod oceny słodkości. Do opracowania obiektywnej metody mogą prowadzić osiągnięcia biochemii w dziedzinie czułych na słodycz białek receptorowych izolowanych z języka. Pewne osiągnięcia w tej dziedzinie zostały już zrobione (12). Akualnie ocenę słodkości można prowadzić trzema sposobami: przez ustalenie odpowiedniej skali wartości, ustalenie listy kwalifikacyjnej słodkich substancji oraz ustalenie wartości progowych. Wszystkie te trzy metody dają porównywalne i powtarzalne wyniki.
Reasumując należy stwierdzić, że w ciągu ostatnich dwudziestu lat, dzięki hipotezie wiązań wodorowych, nastąpił znaczny postęp w wyjaśnianiu smaku słodkiego na poziomie molekularnym. Ostatecznym celem badań w dziedzinie smaku słodkiego winno być stworzenie modelu lub teorii, która pozwoli przewidzieć strukturę w pełni efektywnego środka słodzącego nieszkodliwego dla zdrowia człowieka (9, 32, 52).
SACHARYDY
Już w czasach prehistorycznych człowiek używał substancji słodkich. Najstarszymi substancjami o smaku słodkim były miód i soki różnych roślin. Najpopularniejszym środkiem słodzącym naszych czasów jest sacharoza, którą najpierw otrzymywano z trzciny cukrowej, później próbowano również otrzymywać ją z soku klonowego i brzozowego, a także z marchwi i innych roślin, co było bardzo trudne i nie zaspokajało nań popytu. W osiemnastym wieku Merggrat otrzymał po raz pierwszy cukier z buraka cukrowego, a jego uczeń Archard ulepszył uprawę i zwiększył w nim zawartość cukru do tego stopnia, że burak cukrowy stał się przemysłowym surowcem. W ciągu dwuch lat produkcja cukru z buraków wyniosła ok. 35 ton, zaś w 1855 roku osiągnęła już 45 tys. ton (32).
Najpowszechniejszy naturalny środek słodzący, jakim jest sacharoza, należy do sacharydów. Sacharydy nazywane cukrami lub glicydami, wchodzą w skład tkanek roślinnych i zwierzęcych. Są dla żywych organizmów nie tylko źródłem energii chemicznej, ale również tworzą tkankę podporową roślin, a także błony biologiczne. Sacharydy określa się zazwyczaj jako polihydroksylowe aldehydy i ketony. Taka definicja, która uwzględnia główne grupy funkcyjne sacharydów nie jest jednak w pełni prawdziwa, gdyż sacharydy występują, przeważnie w formach cyklicznych, tj. półacetalowej i acetalowej. Podział sacharydów przedstawia rycina 2.
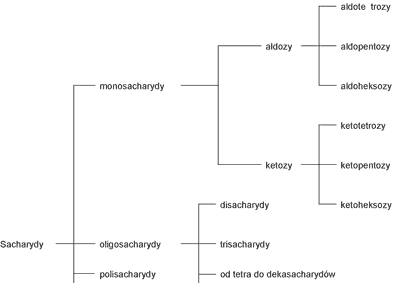
Ryc. 2. Schematyczny podział sacharydów (32).
Środki słodzące z grupy sacharydów
Z aldoheksoz najważniejsza jest D-glukoza. Glukozę wykorzystuje się najczęściej w dietetyce. Z uwagi na szybką resorbcję nadaje się jako źródło energii w żywności dla dzieci, do wyrobu tabletek, ewentualnie preparatów wzmacniających, jako środek słodzący w niealkoholowych napojach orzeźwiających, w czekoladzie i piwie. W lecznictwie glukozę stosuje się do sporządzania roztworów iniekcyjnych i infuzyjnych, maści gojących itp.
Najważniejsza ketoheksozą jest D-fruktoza, którą stosuje się w dietetyce, gdyż nie powoduje ona zwiększenia zapotrzebowania na insulinę. W organizmie fruktoza szybko ulega metabolizmowi przechodząc w wątrobie w glikogen. D-fruktoza jest cukrem najlepiej rozpuszczalnym w wodzie, jest higroskopijna, zawarta w sokach nie ulega krystalizacji. Działa przy okazji jako substancja pochłaniająca wilgoć. Dalszą korzystną, właściwością D-fruktozy jest mniejsza lepkość jej roztworów w porównaniu z roztworami sacharozy oraz wzmacnianie smaku i woni owoców. Fruktoza znalazła zastosowanie jako produkt handlowy do produkcji konserwowanych owoców, słodyczy, lodów, napojów bezalkoholowych, jogurtów i soków owocowych, napojów w proszku, mieszanin budyniowych i napojów tonizujących. Niektóre firmy zachodnie produkują krystaliczną fruktozę jako specjalny środek słodzący. Jak podaje piśmiennictwo (14) w USA powstała duża wytwórnia czystej krystalicznej fruktozy. Ostatnio fruktoza wzbudziła także duże zainteresowanie przemysłu spożywczego, głównie ze względu na swe korzystne właściwości. Związek ten jest lepiej rozpuszczalny od sacharozy, jest również bardziej reaktywny, nie ulega inwersji, tworzy substancje wonne, smakowe i barwne, dwukrotnie przyspiesza rozkład etanolu w organizmie, zapobiega próchnicy zębów. Nadaje się do wyrobu cukierków, a zastosowany w napojach bezalkoholowych zwiększa ich lepkość i zmniejsza wartość energetyczną.
Z ważnych disacharydów oprócz sacharozy należy wymienić laktozę, która jest składnikiem mleka wszystkich ssaków. W porównaniu z sacharozą jej słodkość wynosi tylko 0,16. Podstawowym źródłem laktozy jest serwatka, z której otrzymuje się ją przez bezpośrednią krystalizację albo, po usunięciu białek, przez ultrafiltrację. Przegląd źródeł laktozy podaje tabela l.
Tabela 1. Przegląd źródeł laktozy w artykułach spożywczych (dane w promilach) (32).
| Artykuł spożywczy | Laktoza | Białka | Tłuszcz | Popiół | Woda |
| Mleko pełnotłuste | 4,8 | 3,5 | 3,5 | 0,7 | 87,4 |
| Mleko odciągane | 5,1 | 3,6 | 0,1 | 0,7 | 90,5 |
| Mleko skondensowane słodzone | 16,3 | 10,0 | 0,3 | 2,3 | 28,4 |
| Zagęszczona serwatka | 38,5 | 7,0 | 2,4 | 4,0 | 48,1 |
| Mleko w proszku chude | 52,0 | 35,9 | 0,8 | 8,0 | 3,0 |
| Słodka serwatka w proszku | 73,5 | 12,9 | 0,9 | 8,0 | 4,5 |
| Kwaśna serwatka w proszku | 66,5 | 13,0 | - | 10,2 | 3,2 |
| Serwatka w proszku | 56,6 | 39,0 | 3,3 | 2,4 | 9,7 |
Laktoza jest słabo rozpuszczalna w wodzie, gdyż w temperaturze pokojowej wynosi ona ok. 20%, natomiast bardzo trudno rozpuszcza się w etanolu 95° i praktycznie nie rozpuszcza się w eterze i chloroformie. Laktoza jest stosowana w farmacji jako substancja wypełniająca przy produkcji granulatów i tabletek. Ma jednocześnie właściwości adsorpcyjne, a granulaty sporządzone z dodatkiem laktozy charakteryzuje duża trwałość oraz przedłużony czas rozpadu. Laktoza jest najczęściej stosowaną substancja w recepturze do sporządzania rozcierek i rozcieńczeń. W przemyśle spożywczym laktozę można wykorzystać do innych celów, np. jako nośnik syntetycznych substancji słodkich. Polepsza ona jakościowe parametry wyrobów spożywczych, zapewnia właściwy wygląd produktów przy termicznej obróbce w piecach mikrofalowych, polepsza jakość napojów mlecznych. Znaczna część światowej populacji ludzkiej nie toleruje laktozy z powodu braku w organizmie enzymu rozszczepiającego ten cukier (32, 48, 52).
Syropy skrobiowe i inne
Spośród hydrolitycznych procesów scukrzania wyższych polisacharydów największe znaczenie ma hydroliza skrobi. Aktualnie w świecie istnieje wielkie zapotrzebowanie na syropy glukozowe i fruktozowe. Początkowo wytwarzano je ze skrobi ziemniaczanej, obecnie stosuje się do tego celu głównie skrobię kukurydzianą. Z chemicznego punktu widzenia hydroliza skrobi jest procesem stosunkowo złożonym, który zachodzi pod wpływem kwasów, enzymów lub obu tych czynników łącznie. Scukrzenie przebiega poprzez disacharyd maltozę do monosacharydu D-glukozy. Tak powstają produkty, które się klasyfikuje według stopnia scukrzenia, tj. wartości DE (dextrose equivalent), przy której uzyskuje się taką zawartość cukrów redukujących, jaką ma D-glukoza w suchej masie (tab. 2).
Tabela 2. Skład syropu skrobiowego (S DE=92)* (32).
| Sucha masa (%) | 71,40?0,5 |
| Monosacharydy (w przeliczeniu na suchą masę) (%) | min 92.000 |
| Popiół (%) | max. 0,05 |
| Metale ciężkie (mg/kg) | max. 2,6 |
| SO2 (mg/kg) | 3-4 |
| pH syropu nierozcieńczonego | 3,5-4,5 |
*S – stopień scukrzenia
DE – dextrose equivalent
Kolejnym etapem scukrzania skrobi jest izomeryzacja uzyskanych syropów glukozowych na fruktozowe. Izomeryzację można prowadzić chemicznie (kwasy lub zasady), przy użyciu jonitów lub enzymatycznie. Nowoczesne metody polegają na łączeniu tych procesów lub na stosowaniu enzymów izomeryzujących glukozę na fruktozę. Przyszłość w tym względzie należy do immobilizowanych enzymów stosowanych w reaktorach przemysłowych w biotechnologii. W porównaniu z sacharozą syropy glukozowe wykazują wiele zalet. Jak wykazały próby na zwierzętach, syropy te powodują mniejsze odkładanie się tłuszczu w porówaniu z sachorozą.
Syropy fruktozowe otrzymuje się na bazie kukurydzy, która z innymi płodami zawierającymi skrobię jest najbardziej wydajna. W skład syropu fruktozowego wchodzi około 42% fruktozy, 55% glukozy oraz ok. 3% mieszaniny innych sacharydów. Produkowana w USA nowa generacja syropów fruktozowych zawiera ponad 55% fruktozy (39). Dalszy rozwój badań zmierza w kierunku wyprodukowania trzeciej generacji syropów, które będą miały postać sproszkowaną lub krystaliczną. Syropy fruktozowe są wygodne w użyciu, zwłaszcza tam, gdzie przedtem trzeba było stosować kombinacje glukozy z fruktozą, aby nie dopuścić do krystalizacji sacharozy. We wszystkich napojach bezalkoholowych dzięki zastosowaniu syropu fruktozowego zapach i smak owocowy są wyraźniejsze i nie znikają przy przechowywaniu.
Z innych syropów należy wymienić ekstrakt słodowy i syrop klonowy. Ekstrakt słodowy jest wyciągiem wodnym ze słodu jęczmiennego i zawiera substancje rozpuszczalne w wodzie, które powstają pod działaniem enzymów słodowych. Jest to mieszanina składająca się z różnych sacharydów, białek, enzymów i związków mineralnych, zawierająca 4-5% sacharozy oraz fruktozę i maltozę. Ekstrakt słodowy stosuje się do produkcji słodyczy, pożywek dla kultur drożdżowych w wyrobie pieczywa oraz żywności dla rekonwalescentów i małych dzieci. Syrop klonowy i cukier klonowy są to produkty otrzymane z soku klonu cukrowego ( Acer saccharinum), produkowane w USA, Kanadzie i Japonii, zawierające 98% sacharydów, w których 80-99% atanowi sacharoza.
Alkohole sacharydowe (poliole) są to produkty redukcji monosacharydów. Z ważniejszych polioli należy wymienić: d-sorbitol, d-mannitol i ksylitol, który jest najbardziej rozpowszechniony w świecie roślinnym i można go otrzymywać przez katalityczne uwodornienime d-ksylozy, która jest podstawowym składnikiem ksylanów drewna, słomy i innych produktów roślinnych. Poliole stosuje się do słodzenia produktów spożywczych dla diabetyków, gdyż ich metabolizm nie wymaga insuliny, a energia wytwarzana w czasie ich przemiany jest obniżona (17,0-8,5 kJ/g).
Wiadomo również, że ksylolit wytwarzany na skalę przemysłową z kory brzozowej, jest czynnikiem zapobiegającym próchnicy zębów. Wyroby z dodatkiem ksylitolu nie ulegają rozkładowi mikrobiologicznemu, gdyż nie jest on wykorzystywany przez większość drobnoustrojów. Badania na zwierzętach i próby kliniczne wykazały, że sorbitol zwiększa wydzielanie żółci oraz wpływa dodatnio na wydzielanie soków w żołądku, dwunastnicy i jelicie cienkim. Jego powolna resorpcja wywołuje jednak biegunki (13, 32, 36, 48, 52).
Cukier a żywienie człowieka
Dzienne zapotrzebowanie człowieka na sacharydy wynosi około 500 g, przy czym głównym źródłem sacharydów jest skrobia zawarta w produktach mącznych i ziemniaczanych. Powolny rozkład skrobi umożliwia utrzymanie równomiernego poziomu cukru we krwi. W przeciwieństwie do tego szybki rozkład sacharozy w organizmie powoduje, że nadmiar glukozy we krwi przechodzi w tłuszcz i dlatego tylko część sacharydów może być zastąpiona cukrem. Ta część nie powinna przakraczać 25% całkowitego zapotrzebowania na sacharydy, tj. około 125 g sacharozy dziennie (45 kg/rok). Przy właściwym odżywianiu wystarczy tylko ok. 75 g sacharozy dziennie (28 kg/rok). Energetyczna watortość sacharozy waha się w granicach od 16,54 do 16,75 kJ/g.
Ze względu na znaczenie cukru w pożywieniu ludzkim, prowadzone są na całym świecie szerokie badania nad wartością spożywczą cukru. Bada się szczegółowo metabolizm cukru z punktu widzenia całkowitej gospodarki witaminami w organizmie, związek między pożywieniem sacharydowym i prawdopodobieństwem wystąpienia próchnicy zębów, poziomem witamin, zwłaszcza grupy B, fosforu, wapnia i innych składników pożywienia w optymalnym wykorzystaniu sacharydów, wpływ cukru na wykorzystanie podstawowych aminokwasów w organizmie człowieka itp. Dziś wiadomo, że o wiele szybciej można dostarczyć organizmowi energię stosując sacharozę niż glukozę.
Należy podkreślić, że cukier jest znanym czynnikiem konserwującym. Produkcja konserw nakłada ostre wymagi na bakteriologiczną czystość cukru. Roztwory cukru z 30% zawartością suchej masy normalnie nie ulegają fermentacji, zaś z 60% zawartością są także odporne na działanie bakterii. Niesłusznie twierdzi się, że surowy cukier jest pożywniejszy od rafinowanego, który zawiera co najmniej 99,8% sacharozy. Na światowym rynku produkowany jest cukier kompletny, składający się z sacharozy i dodatków użytecznych dla organizmu ludzkiego, takich jak preparaty wapnia, magnezu, chlorek sodu, kwasy organiczne i witaminy oraz cukier szybko rozpuszczalny (13, 32, 48, 52).
Głównymi konkurentami sacharozy w niektórych dziedzinach zastosowań w przemyśle spożywczym są nadal środki słodzące wytwarzane ze skrobi, przede wazystkim syrop skrobiowy z podwyższoną zawartością fruktozy, który znajduje zastosowanie przy produkcji żywności o obniżonej wartości energetycznej i żywieniu dla diabetyków (32, 52).
Przy wprowadzaniu środków słodzących zastępujących sacharozę nie można zapomnieć o roli sacharozy w produktach spożywczych, a więc jej wadze, zdolnościach konserwujących, wpływie na wytwarzanie tekstury, smaku itp. Zastąpienie sacharozy niskoenergetycznymi środkami słodzącymi wywołuje konieczność wprowadzania dalszych dodatków w postaci środków konserwujących, wypełniaczy, dodatków żelujących i innych. Należy również pamiętać, że koszt 1 kg jednostkowej słodkości syropu fruktozowego jest ok. 1,5 raza, glukozy 3 razy, zaś sorbitolu ponad 10 razy wyższy w porównaniu z sacharozą (ryc. 3 i 4) (3, 13).
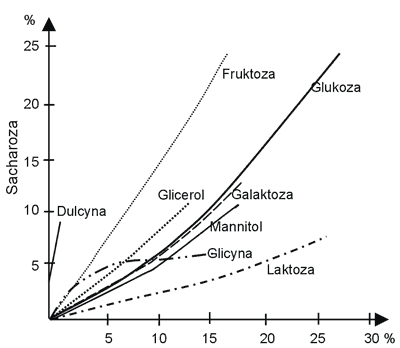
Ryc. 3. Słodycz względna substancji słodkich w odniesieniu do sacharozy (3).
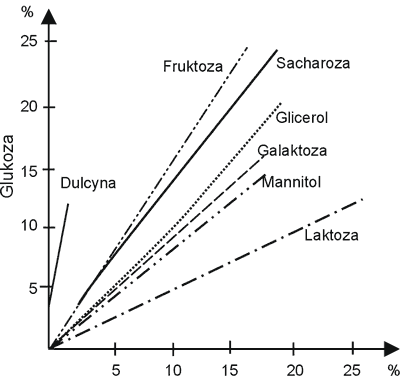
Ryc. 4. Słodycz względna substancji słodkich w odniesienu do glukozy (3).
BIAŁKA JAKO ŚRODKI SŁODZĄCE
W połowie lat sześćdzisiątych ubiegłego stulecia zaczęło znacznie wzrastać zaiteresowanie środkami słodzącymi będącymi naturalnymi białkami. To zapotrzebowanie wynikało z konieczności nastąpienia niektórych syntetycznych, niskoenergetycznych środków słodzących, zakazanych do stosowania z powodu podejrzenia ich o karcenogenność.
Mimo, że białkowe środki słodzące są dość trudno dostępne, dzięki ich dużej zdolności słodzącej i innym efektom występującym przy ich stosowaniu, mogą one skutecznie konkurować z nowymi syntetycznymi środkami słodzącymi Do białkowych środków słodzących należą białka roślinne o nazwach: mirakulina, monelina, taumatyna i jej kompleks z glinem – talina.
Mirakulina
Mirakulina jest glikoproteiną (16) o masie cząsteczkowej ok. 42 tys. daltonów zawierającą w części białkowej 373 aminokwasy i wykazującą punkt izoelektryczny przy pH=9. W części sacharydowej znaleziono różne cukry, takie jak: arabinoza, ksyloza, ramnoza, galaktoza, mannoza oraz glukoza i fruktoza. Mirakulina jest białkiem termicznie trwałym w przedziale pH=3-12. Źródłem mirakuliny jest tzw. „cudowny owoc”, którego dostarcza afrykański krzew Richardella dulcifica, znany wcześniej jako Synsepalum dulcificum danielli, rosnący w Afryce Zachodniej. Owoce tego krzewu mają barwę czerwoną i owalny kształt. Mirakulina znajduje się w cienkiej warstwie miąższowej otaczajacej pestkę kształtu oliwki. Czynnik aktywny ma niezwykłe zdolności zmiany odczuć smakowych kwaśnego smaku soku cytrynowego na smak słodkiego napoju z delikatnym posmakiem cytrynowym, lub smaku octu na smak napoju podobnym do portweinu. Efekty te sa długotrwałe, co może być niedogodne przy spożywaniu różnych pokarmów. Do dziś mirakulina jest najwiekszą cząsteczką spośród znanych substancji zdolnych wywoływać słodki smak.
Proteolityczna modyfikacja mirakuliny prowadzi do utraty aktywności, jest zatem jasne, że część białkowa odgrywa ważną rolę W mechanizmie jej działania. Przeprowadzono wiele prób wyjaśnienia efektu wzmacniającego słodki smak mirakuliny; żadna z podanych teorii nie wyjaśnia tego zjawiska. Stwierdzono, że mirakulina w środowisku kwaśnym staje się jeszcze słodsza. Tan efekt predysponował ją do zastosowania w gumach do żucia, wodach do płukania ust itp.
Z początkiem lat siedemdziesiątych amerykańska firma Maralin Cooperation rozszerzyła plantacje Synsepalum dulcificum na Indie i Brazylię i zaoferowała sprzedaż koncentratu z cudownego owocu (MFC – miracle fruit cencentrate), który zalecano używać tuż przed spożyciem niesłodkich potraw lub bezpośrednio dodając go do produktów spożywczych
W wyniku dalszych badań w 1977 r. FDA wprowadziła zakaz stosowania produktów i wyrobów zawierających dodatki mirakuliny lub MFC (32, 52).
Monelina
Rośliną o intensywnie słodkich owocach, która została opisana w sposób bardziej szczegółowy przez Irvine´a (24), jest zachodnio-afrykańska roślina Dioscoreophyllum cumminisci. Ma ona długie, włochate pnące się łodygi, przypominające winną latorośl i sercowate liście. Żelowata masa o oszałamiająco słodkim smaku jest ułożona wokół kolcowatych pestek, które są częścią składową czerwonych jagódek rosnących na długich kiściach. Pozyskiwanie tej masy wymaga starannego i długiego postępowania. Początkowo sądzono, że wydzielina ta jest polisacharydem. W wyniku dalszych badań (35, 56) stwierdzono, że żelowata masa jest białkiem, które nazwano monellin. Współczesne techniki ekstrakcyjne zapewniają uzyskanie z l kg owoców 3-6 g czystego białka, które jest 1500-2000 razy słodsze od sacharozy. Ustalono pierwszorzędową strukturę moneliny, masę cząsteczkową (10700-11500) i punkt izoelektryczny przy pH=9,03. Hudson i Biemann (21) ustalili, że monelina ma dwie niekowalencyjnie związane podjednostki, które udało się rozdzielić jako łańcuchy A i B, zawierające odpowiednio: 44 i 50 fragmentów aminokwasów, których sekwencję oznaczono dla obu podjednostek.
Monelinę otrzymano również w postaci krystalicznej. Badając wpływ modyfikacji struktury moneliny na jej słodki smak stwierdzono, że ogrzewanie (55-65°C) i hydroliza enzymatyczna, powodują zanik słodkości. Podobnie też działa rozdział poszczególnych podjednostek A i B powodując zanik słodkiego smaku i żadna z nich samodzielnie go nie wywołuje. Badania konformacyjne (26) wykazały, że mniejsza część cząsteczki ma strukturę kłębkową a, a większa część ma konformację b. Struktura trzeciorzędowa jest istotna dla wywołania efektu słodkiego smaku. Okazało się, że reakcja człowieka na monelinę jest różna. Mimo, że niektóre ssaki reagują na słodki smak sacharozy, to monelina nie wywołuje u nich uczucia słodkości. Można stąd wnosić, że słodkie białka wywołują smak słodki w poszczególnych tkankach receptorowych, których niektóre ssaki nie mają. Monelina nie jest toksyczna, ale przy braku jej odporności cieplnej i uciążliwej uprawie surowca, wprowadzenie jej do handlu jest mało prawdopodobne (32, 52).
Taumatyny i talina
Kolejną egzotyczną rośliną, której owoce dostarczają roślinnego białka o intenyswnie słodkim smaku jest Thaumatococcus danielli (Benth.). Roślina ta występuje w Afryce Zachodniej od Sierra Leone do Zairu, a także w Republice Środkowoafrykańskiej i w Angoli. Ma ona szerokie, owalne, jakby papierowe liście na długich trzymetrowych łodygach. Owoce jej są mięsiste, kształtu trójkątnego, dojrzałe mają barwę jasnoczerwoną. Słodkie białko znajduje się w części nasienia oddzielonej błoną. Roślinę tę udało się przenieść do innych części świata. I tak np. hoduje się ją w szklarniach w Anglii.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Acton E.M., Stone H.: Science 1976, 193, 584. 2.Asahino Y., Asano J.: Ber. 1929, 62, 171. 3.Baryłko-Pikielna N.: Zarys Analizy Sensorycznej Żywności. PWN, Warszawa 1975, 150. 4.Beerens H.: Ann. Fals. Exp. Chim. 1981, 74, 261. 5.Belitz H.D., Wieser H.Z.: Lebensm. Unters. Forsch. 1976, B 160, 251. 6.Birch G.G.: Crit. Rev. Food Sci. Nutr. 1976, 8, 57. 7.Birch G.C., Lee C.K.: J. Food Sci. 1976, 41, 1403.8. Birch G.G., Lee C.K.: Dev. Sweeten. 1979, l, 165. 9.Blaha K., et al.: Chem. Listy 1979, 73, 689. 10.Brtoshuk L.M., et al.: Science 1972, 178, 988. 11.Deutsch E.W., Hansch C.: Nature 1966, 211, 75. 12.Edwardson J.A., Hough C.A.: Nature 1978, 271, 381. 13.Encyclopedia of Food Science, Food Technology and Nutrition. Academic Press, London 1993. 14.Food Technol. 1981, 35. 98, 15.Gentili B., Horowitz R.M.: J. Chromatogr. 1971, 63, 467. 16.Giroux E.L., Henkin R.I.: J. Agr. Food Chem. 1974, 22, 595. 17.Heijden A., et al.: Food Chem. 1978, 3, 207.18. Higginbotham J.D.: Dev. Sweeten. 1979, 1, 87. 19.Holtje H.D., Kier L.B.: Pharm. Sci. 1977, 211, 75. 20.Horowitz R.M., Gentili B.: J. Agr. Food Chem. 1969, 17, 696.21. Hudson G., Biemann K.: Biochem. Biophys. Res. Commun. 1976, 71, 212. 22.Inglett G.E.: Sweeten. Dent. Carr. 1977, 327. 23.Inglett G.E.: Food Technol. 1981, 37. 24.Irvine F.R.: Woody plants of Ghana. Oxford Univ. Press, London 1961, 256. 25.Jasiczek J., Zalewski R.: Wiad. Chem. 1994, 48, 277. 26.Jirgensons B.: Biochem. Biophys. Acta 1976, 446, 255. 27.Kier L.B.: J. Pharm. Sci. 1972, 61, 1394. 28.Kohlmünzer S.: Farmakognozja. PZWL, Warszawa 1998. 29.Kowalowski P., i wsp.: Herba Pol. 2003, 49, 105. 30.Krbechek L., i wsp.: J. Agr. Food Chem. 1968, 16, 108. 31.Kresanek J., Krejca J.: Atlas liecivych rastlin a lesnych plodov. Ostveta, Martin 1977, 554. 32.Krutosikowa A., Uher M.: Naturalne i syntetyczne substancje o słodkim smaku. PWN, Warszawa 1990. 33.Lec C.H.: Experientia 1975, 31, 533. 34.Lelj F., i wsp.: J. Am. Chem. Soc. 1976, 98, 6669. 35.Morris J.A., Cagan R.H.: Biochem. Biophys. Acta 1972, 261, 114. 36.Okolska G., i wsp.: Nowa Medycyna 1996, 21, 31. 37.Pawłowa L.A., i wsp.: Usp. Chin. 1981, 4, 590. 38.Piewznier P.A.: Sienzornyje sistiemy. Izd. Nauka, Moskwa 1978, 115. 39.Pohlova M., Kastl F.: Sladidla v potravinarskom prewmysle, najma fruktozove sirupy. Vysk. Ustav Potrav. Priem., Praha 1979, 7. 40.Samuelsson G.: Drugs of Natural Origin Swedish. Pharm. Press, Stokholm 1992. 41.Settzer R.J.: Chem. Eng. News 1975, 34, 27. 42.Shallenberger R.S.: J. Food Sci, 1963, 28, 584. 43.Shallenberger R.S.: Agr. Sci. Rev. 1964, 2, 11. 44.Shallenberger R.S., Acree T.E.: Nature 1967, 216, 480. 45.Shallenberger R.S., Acree T.E.: J. Agric. Food Chem. 1969, 17, 701. 46.Shallenberger R.S., Acree T.E.: Nature 1969, 221, 555. 47.Shallenherger R.S., Lindley M.G.: Food Chem. 1977, 2, 145. 48.Sikorski Z.E. (Red.): Chemia żywności. WNT, Warszawa 2000. 49.Solms J.: J. Agric. Food Chem. 1969, 17, 686. 50.Steinegger E., Hänsel R.: Lehrbuch der Pharmakognosie und Phytopharmazie. Springer-Verlag, Berlin-Heidelberg-New York-London-Paris-Tokyo 1988. 51.Steinhardt R.G., et al.: Science 1962, 135, 367. 52.Świderski F. (Red.): Żywność wygodna i żywność funkcjonalna. WNT, Warszawa 1999. 53.Tehara A., et al.: Nature 1971, 233, 619. 54.Temussi P.A., et al.: J. Med. Chem. 1978, 21, 1154. 55.Tsuzuki Y.: J. Chem. Educ. 1970, 47, 695. 56.Van der Wel H.: FEBS Lett. 1972, 21, 88. 57.Van der Wel H., Loeve K.: Eur. J. Biochem. 1972, 31, 221. 58.Van der Wel H., Bel W.M.: Chem. Senses Flavor 1976, 2, 221. 59.Wieser H., et al.: Lebensm. Unters. Forsch. 1977, 164, 277. 60.Wood H.B., et al.: J. Org. Chem. 1955, 20, 875.




