© Borgis - Postępy Fitoterapii 3/2008, s. 170-175
*Jolanta Nazaruk, Tomasz Brzóska
Aktualny stan wiedzy na temat aktywności farmakologicznej roślin z rodzaju Cirsium Mill.
Current state of the knowledge about the pharmacological activity of plants from cirsium mill. genus
Zakład Farmakognozji Uniwersytetu Medycznego w Białymstoku
Kierownik Zakładu: dr n. farm. Michał Tomczyk
Summary
Cirsium genus belonging to sunflower family contain about 300 species widespread in Europe, Asia, north part of Africa and North America. There are biennial or perennial plants with characteristic inflorescence capitulum. Flower heads consist of numerous disc florets. Flavonoids, phenolic acids, triterpenes are their main chemical compounds. Some species are use in folk medicine, especially in Asia and Europe. From many years and particularly in the last time scientists carrying out research of Cirsium spp. The results of the pharmacological investigations have proved a broad spectrum of activity of extracts and isolated compounds. Amongst types of activity it is possible to replace analgesic, anti-inflammatory, anti-hemorrhagic, antidiabetic, antioxidant, hepatoprotective, antimicrobial, anticancer, cytotoxic action, influence on cardiovascular and central nervous systems. In many cases they have confirmed traditional uses of these plants.

Rodzaj Cirsium Mill. – ostrożeń, należący do rodziny Asteraceae – Astrowate, obejmuje ok. 300 gatunków roślin występujących na obszarze Europy, Azji, północnej Afryki i Ameryki Północnej. Rośliny te charakteryzują się obecnością kwiatostanu typu koszyczek, złożonego wyłącznie z kwiatów promienistych o koronie rurkowatej lub lejkowatej. U wszystkich gatunków występuje rozwinięty puch kielichowy, którego pierzaste włoski są ze sobą u nasady pierścieniowato zrośnięte. Liście na pędach ułożone są skrętolegle, kolczasto lub ościsto ząbkowane, kłujące (1, 2).
Skład chemiczny poszczególnych gatunków jest w różnym stopniu poznany. Najwięcej prac badawczych dotyczy izolacji i identyfikacji związków flawonoidowych. Poza tym wymieniane są poliacetyleny, fenolokwasy, triterpeny, sole mineralne (3-5).
Wiele roślin z rodzaju Cirsium znalazło zastosowanie w medycynie ludowej różnych krajów.
Rozpowszechniony na terenie Japonii, Chin i Korei C. japonicum DC, w medycynie ludowej tamtejszych kultur znalazł zastosowanie jako środek przeciwkrwotoczny, hipertensyjny, moczopędny, stosowany również w zapaleniu wątroby oraz jako środek przeciwnowotworowy (m.in. nowotwory wątroby, macicy i białaczka). Kłącze i korzeń tego gatunku umieszczone zostały, jako surowce lecznicze, w farmakopeach chińskiej i japońskiej (6, 7). We florze Turcji rodzaj reprezentowany jest przez 59 gatunków. Odwary z nasion i korzeni stosowano w leczeniu hemoroidów, a kwiaty miały zastosowanie jako środek przeciwkrwotoczny, natomiast pędy roślin stosowane były w leczeniu wrzodów trawiennych, kaszlu i zapalenia oskrzeli (8). Występujący na terenie południowych Włoch C. tenoreanum Petrak wykorzystywany był w leczeniu żylaków (9). Często spotykany w Polsce ostrożeń łąkowy C. rivulare, w medycynie ludowej zwany „strachopłochem”, w regionie Tarnopolskim stosowany był, zarówno zewnętrznie, jak i wewnętrznie, jako środek leczniczy działający anksjolitycznie i sedatywnie. Analogicznie stosowany był na Podlasiu ostrożeń lancetowaty C. vulgare, a w Wielkopolsce ostrożeń warzywny C. oleraceum. Ostrożeń warzywny spożywany był w postaci surówek lub po ugotowaniu. Przypisywano mu działanie pobudzające apetyt. Jędrzejko i wsp. (12) wspominają o zastosowaniu C. oleraceum jako środka moczopędnego, ściągającego i przeciwreumatycznego, a także w kosmetyce (kąpiele przeciw wypadaniu włosów). Ostrożeń polny wykorzystywany był w schorzeniach zatok nosowych. Wywar z ziela używano do mycia głowy (10-12). C. subcoriaceum (Less.) Schultz-Bip. jest gatunkiem, który spotkać można w pasie od centralnego Meksyku po Panamę. W medycynie ludowej roślina ta stosowana była w leczeniu zapaleń piersi i wielu różnorodnych schorzeń układu oddechowego. C. pascuarense (H.B.K.) Spreng., również występujący na terenie Meksyku, stanowił lek przeciwcukrzycowy (13, 14).
Aktywność farmakologiczna różnych gatunków roślin z rodzaju Cirsium
Wiedza na temat aktywności farmakologicznej różnych gatunków z rodzaju Cirsium coraz bardziej się poszerza. Szczególnie ostatnie lata przyniosły wiele doniesień o możliwościach terapeutycznych wyciągów z roślin i wyizolowanych z nich związków.
Działanie przeciwbólowe, przeciwzapalne i przeciwgorączkowe
Występujące w licznych gatunkach ostrożeni flawonoidy – linaryna i pektolinaryna (ryc. 1, 2), wykazały istotny, zależny od dawki efekt analgetyczny, przy czym działanie pektolinaryny było silniejsze.
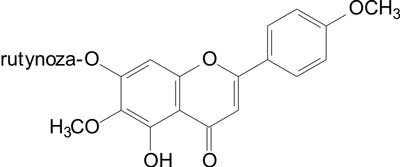
Ryc. 1. Pektolinaryna.
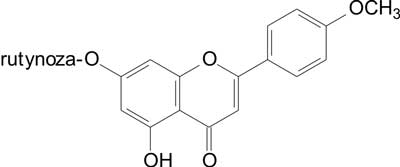
Ryc. 2. Linaryna.
Porównując działanie wymienionych flawonoidów z kwasem acetylosalicylowym (ASA) i siarczanem morfiny (MS) (stymulacja chemiczna) stwierdzono, że pektolinaryna w dawce 100 mg/kg wywołuje efekt porównywalny do ASA, który zastosowany był w tej samej dawce. Pektolinaryna zastosowana natomiast w dawce 200 mg/kg wywiera działanie podobne do MS w dawce 1,15 mg/kg. Linaryna w dawce 200 mg/kg wywiera, w porównaniu do pektolinaryny i MS, jedynie średnie działanie.
Przy termicznej stymulacji bólowej zastosowanie znajdują analgetyki działające ośrodkowo (MS), ASA jest w tym wypadku nieskuteczny. Okazało się, że pektolinaryna w dawce 100 mg/kg, przy takiej stymulacji, wywoływała efekt zbliżony do MS w dawce 3 mg/kg.
Swoisty antagonista receptorów opioidowych (Naloxon) znosił działanie linaryny i pektolinaryny; sugeruje to morfinopodobny, ośrodkowy profil działania ww. związków. Jednocześnie stwierdzono przeciwzapalną, zależną od dawki, aktywność linaryny i pektolinaryny. Porównując efekt działania obydwu flawonoidów i indometacyny okazało się, że był on największy w przypadku linaryny. Przypuszczalnie aktywność przeciwzapalna badanych flawonoidów może być częściowo uwarunkowana przeciwdziałaniem efektom przemiany kwasu arachidonowego. Niektóre badania wskazują, iż akacetyna (aglikon linaryny) hamuje cyklooksygenazę (COX) poprzez związanie się z grupą prostetyczną enzymu i utworzenie nieaktywnego kompleksu. Stwierdzono także, że linaryna jest związkiem o aktywności przeciwgorączkowej (13, 15). Metanolowy wyciąg z C. arvense wykazuje wyraźne działanie przeciwzapalne w procesie indukowanym przez TPA (12- O -tetradekanoilo-13-acetyloforbol) (16).
Wykazano, że linaryna, poprzez pobudzenie produkcji cytokin (IL-1, TNF), stymuluje makrofagi i jest to proces zarówno pośredni, jak i bezpośredni. Mimo, że są to mediatory stanu zapalnego, stanowią one ważny czynnik w procesie immunologicznym. Odgrywają ważną rolę w utrzymaniu homeostazy komórek i tkanek. Obie cytokiny wywierają szeroki wpływ na przebudowę i naprawę uszkodzonych elementów tkankowych na drodze koordynowania aktywności wielu innych komórek, m.in. fibroblastów, osteoklastów, komórek śródbłonka.
Pod wpływem lipopolisacharydów bakteryjnych dochodzi do zwiększenia produkcji tlenku azotu (NO), czynnika powodującego silne rozszerzenie naczyń krwionośnych i hipotensję obserwowaną w szoku septycznym. Stwierdzono, że linaryna wpływa na zahamowanie wytwarzania NO, co potencjalnie może być wykorzystane m.in. w endotoksemii i w zapaleniach towarzyszących nadprodukcji NO (17).
Działanie przeciwkrwotoczne
Po dożylnym podaniu zespołu flawonoidów występujących w C. oleraceum nastąpił wzrost indeksu protrombinowego, przy jednoczesnym skróceniu czasu krwawienia i zmniejszeniu utraty krwi. Stwierdzono, że efekt ten utrzymywał się przez 25-30 dni, gdy iniekcje stosowane były przez 5 dni. Po pięciodniowym stosowaniu iniekcji następowało także przyspieszenie tworzenia się trombocytów.
Podobną aktywność wykazano dla C. japonicum. Z rośliny wyizolowano związek odpowiedzialny za działanie przeciwkrwotoczne, którym okazała się pektolinaryna (18, 19).
Wpływ na układ sercowo-naczyniowy
Zbadano wpływ 7- O -neohesperydozydu hispiduliny na układ sercowo-naczyniowy zdrowych szczurów. Związek ten wywoływał zwiększenie liczby spontanicznych skurczów prawego przedsionka i wzrost siły skurczu przedsionka lewego. Pod jego wpływem następował także skurcz piersiowego odcinka aorty i wzrost ciśnienia tętniczego (20).
W badaniach piersiowego odcinka aorty szczura wykazano, zależne od dawki, działanie wazorelaksacyjne wodnego wyciągu z całej rośliny C. japonicum. Związane ono było z podwyższeniem stężenia tlenku azotu w komórkach śródbłonka. Na podstawie wyników autorzy sugerują, że efekt rozkurczowy u człowieka powinien wystąpić po zastosowaniu ekstraktu w dawce ok. 1,4 g dziennie (21).
Działanie przeciwcukrzycowe
Podawanie różnych dawek wyciągu heksanowego z liści C. pascuarense myszom, u których wywołano hiperglikemię aloksanem, powodowało znaczący efekt hipoglikemiczny. Dodatkowo okazało się, że w teście tolerancji na glukozę następowało zahamowanie wzrostu jej stężenia we krwi. Aktywność wyciągu okazała się być w tym względzie porównywalna z aktywnością tolbutamidu. Wyniki badań wskazywały, że mechanizm może być zbliżony do mechanizmu działania tolbutamidu, tj. działania hipoglikemicznego poprzez pobudzenie trzustkowych komórek β do produkcji większej ilości insuliny (14).
Badania prowadzone nad hamowaniem aktywności α-glukozydazy i α-amylazy przez różne flawonoidy wykazały, że luteolina i jej 7- O -glukozyd (dość pospolicie występujące w rodzaju Cirsium) miały znaczące działanie w tym zakresie. Szczególnie luteolina, w stężeniu 0,5 mg/ml, hamowała α-glukozydazę w 36% i jest to działanie silniejsze od działania akarbozy (22).
Wpływ na układ nerwowy
W badaniach prowadzonych na myszach stwierdzono działanie antydepresyjne doustnie podawanego wyciągu z C. japonicum. Testy ruchowe wykazały skrócenie czasu bezruchu i znaczny wzrost aktywności po podaniu wyciągu. Otrzymane wyniki okazały się być porównywalne z efektami działania imipraminy i fluoksetyny. Warto zauważyć, że wyciąg nie powodował osłabienia aktywności i spadku koordynacji (23).
Zbadano także aktywność neuroprotekcyjną wyciągu z C. japonicum. W wyniku jego działania na komórki mikrogleju, których stan zapalny wywołano lipopolisacharydami, nastąpiło zmniejszenie ekspresji indukowalnej syntetazy tlenku azotu (iNOS), a także znaczące zmniejszenie aktywacji cyklooksygenazy 2 (COX-2) (24).
Alkohol poliacetylenowy – triol ((8S,9R,10S)-heptadeka-1-en-11,13-diyn-8,9,10-triol), który został wyizolowany z korzeni C. japonicum, wykazał pozytywny wpływ na rozwój neurytów myszy, co może znaleźć zastosowanie w leczeniu chorób neurodegeneracyjnych (25).
Działanie antyoksydacyjne
Reaktywne formy tlenu, takie jak wolne rodniki (hydroksylowy ˙OH, ponadtlenkowy ˙O2-), toksyczne formy tlenu (nadtlenek wodoru H2O2), stanowią ważny czynnik w patomechanizmie powstawania chorób układu krążenia, nowotworów, cukrzycy, wrzodów, zapaleń. Silne właściwości przeciwutleniające wykazują związki flawonoidowe. Ich aktywność uwarunkowana jest liczbą i rozmieszczeniem grup hydroksylowych przy pierścieniu B. Najaktywniejsze są flawonoidy z grupami hydroksylowymi w pozycjach 3´, 4´ pierścienia B lub/i grupą hydroksylową przy C-3. Obecność orto -dihydroksylowej struktury przy pierścieniu B warunkuje wyższy stopień stabilizacji związku. Zależność tą wykazano dla dwóch związków wyizolowanych z C. hypoleucum 3- O -rutynozydu kwercetyny (rutyny) i 3- O -rutynozydu kemferolu (nikotyfloryny) (ryc. 3).
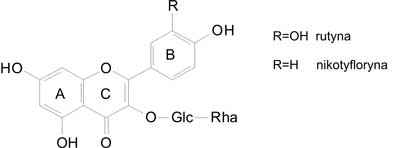
Ryc. 3. Flawonoidy z C. hypoleucum.
Właściwości przeciwutleniające badano metodą elektronowego rezonansu spinowego (ESR), z użyciem trwałego rodnika DPPH. W przypadku rutyny aktywność ta była wyższa (8).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Broda B, Mowszowicz J. Przewodnik do oznaczania roślin leczniczych, trujących i użytkowych. PZWL, Warszawa 1996. 2. Rutkowski L. Klucz do oznaczania roślin naczyniowych Polski niżowej. PWN, Warszawa 2004. 3. Jordan-Thaden IE, Londa SM. Chemistry of Cirsium and Carduus: a role in ecological risk assestment for biological control of weeds. Biochem Syst Ecol 2003; 31:1353-96. 4. Nazaruk J, Gudej J. Flavonoid compounds from the flowers of Cirsium rivulare (Jacq.) All. Acta Pol Pharm 2003; 60(1):87-9. 5. Nazaruk J, Jakoniuk P. Flavonoid composition and antimicrobial activity of Cirsium rivulare (Jacq.) All. flowers. J Ethnopharmacol 2005; 102: 208-12. 6. Liu S, Luo X., Li D i wsp. Tumor inhibition and improved immunity in mice treated with flavone from Cirsium japonicum DC. Int Immunopharmacol 2006; 6: 1387-93 7. Liu S, Zhang J, Li D i wsp. Anticancer activity and quantitative analysis of flavone of Cirsium japonicum DC. Nat Prod Res 2007; 21(10): 915-22. 8. Deliorman Orhan D, Ergun F, Yeşilada E i wsp. Antioxidant activity of two flavonol glycosides from Cirsium hypoleucum DC. through bioassay-guided fraction. Turkish J Pharma Sci 2007; 4 (1): 1-14. 9. Loizzo MR, Statti GA, Tundis R i wsp. Antimicrobial activity and cytotoxicity of Cirsium tenoreanum. Fitoterapia 2004; 75: 577-80. 10. Paluch A. Ziołolecznictwo ludowe w Polsce w XIX i początku XX wieku. Polskie Towarzystwo Ludoznawcze, Wrocław 1989. 11. Kuźniewski E, Augustyn-Puziewicz J. Przewodnik ziołolecznictwa ludowego. Państwowe Wydawnictwo Naukowe, Warszawa 1984. 12. Jędrzejko K, Klama H, Żarnowiec J. Zarys wiedzy o roślinach leczniczych. Śląska Akademia Medyczna w Katowicach, Katowice 1997. 13. Martinez-Vázquez M, Ramirez Apan TO, Lastra AL, Bye R. A comparative study of the analgesic and anti-inflammatory activities of pectolinarin isolated from Cirsium subcoriaceum and linarin isolated from Buddleia cordata. Planta Med 1998; 64: 134-7. 14. Perez GRM, Ramirez L ME, Vargas SR. Effect of Cirsium pascuarense on blood glucose levels of normoglycaemic and alloxan-diabetic mice. Phytother Res 2001; 15: 552-4. 15. Martinez-Vázquez M, Ramirez Apan TO, Lastra AL, Bye R. Analgesic and antipyretic activities of an aqueous extract and of the flavone linarin of Buddleia cordata. Planta Med 1996; 62(2): 137-40. 16. Yasukawa K, Akihisa T, Inoue Y i wsp. Inhibitory effect of the methanol extracts from compositae plants on 12-O-tetradecanoylphorbol-13-acetate-induced ear oedema in mice. Phytother Res 1998; 12(7): 484-7. 17. Han S, Sung KH, Yim D i wsp. The effect of linarin on LPS-induced cytokine production and nitric oxide inhibition in murine macrophages cell line RAW264. 7. Arch Pharm Res 2002; 25(2): 170-7. 18. Kolla V, Kamaeva A, Aleksandrova ZN. Flavonoid complex from Cirsium oleraceum: effects on blood coagulation. Farmakol Regul Regener Protsessov Eksp Klin 1981, 13-17,. C.A 1983: 172910. 19. Ishida H, Umino T, Tsuji K, Kosuge T: Studies on antihemorrhagic substances in herbs classified as hemostatics in chinese medicine. VII. On antihemorrhagic principle in Cirsium japonicum DC. Chem Pharm Bull 1987; 35(2): 861-4. 20. Lim SS, Lee JH, Park JC. Isolation of flavone glycoside from Cirsium japonicum var. ussuriense and biological activity on the cardiovascular system. Han´guk Sikp´um Yongyang Kwahak Hoechi 1997; 26(2): 242-7. 21. Kim EY, Jho HK, Kim DI, Rhyu MR. Cirsium japonicum elicits endothelium-dependent relaxation via histamine H1-receptor in rat thoracic aorta. J Ethnopharmacol 2008; 116: 223-7. 22. Kim JS, Kwon CS, Son KH. Inhibition of alpha-glucosidase and alpha-amylase by luteolin, a flavonoid. Biosci Biotech Biochem 2000; 64(11): 2458-61. 23. Park HK, Yoon SY, Choi JH i wsp. The antidepressant effects of Cirsium japonicum in ICR mice. Yakhak Hoeji 2006; 50(6): 429-35. 24. Yeo HS, Kim DW, Jun CY i wsp. Neuroprotective effect of Cirsium japonicum and silibinin on lipopolysaccharide-induced inflammation in BV2 microglial cells. J Kor Orient Intern Med 2007; 28(1): 166-75. 25. Yamazaki M, Hirakura K, Miyaichi Y i wsp. Effect of polyacetylenes on the neurite outgrowth of neuronal culture cells and scopolamine-induced memory impairment in mice. Biol Pharm Bull 2001; 24(12): 1434-6. 26. Jeong DM, Jung HA, Choi JS. Comparative antioxidant activity and HPLC profiles of some selected Korean thistles. Arch Pharm Res 2008; 31(1): 28-33. 27. Nazaruk J. Antioxidant activity and total phenolic content in Cirsium five species from north-east region of Poland. Fitoterapia 2008; 79: 194-6. 28. Chon SU, Boo HO, Lee SY. Assessment on in vitro antioxidant properties of common thistle ( Cirsium pendulum Fisch.) plant parts. Korean J Medicinal Crop Sci 2006; 14(2): 82-6. 29. Sawaguchi K, Nakao K, Shimamura T, Ohsawa K. A new antimicrobial and antioxidative component of extracts from the rhizomes of Cirsium brevicaule A. Gray var. irumtiense Kitam. J Antibact Antifungal Agents 1994; 22(5): 271-75. 30. Park JC, Baek NI, Chung SK i wsp. Effect of hispidulin 7-O-neohesperidoside on lipid peroxidation in rat liver and NMR assignment. Korean J Pharmacogn 28 (2), 1997, 88-92. 31. Park JC, Hur JM, Park JG i wsp. Effects of metanol extract of Cirsium japonicum var. ussuriense and its principle hispidulin-7-O-neohesperidoside on hepatic alcohol-metabolizing enzymes and lipid peroxidation in ethanol-treated rats. Phytother Res 2004; 18: 19-24. 32. Yoo YM, Nam JH, Kim MY i wsp. Pectolinarin and pectolinarigenin of Cirsium setidens prevent the hepatic injury in rats coused by D-galactosamine via an antioxidant mechanism. Biol Pharm Bull 2008; 31(4): 760-4. 33. Tarle D, Dvoržak I. Antimicrobial activity of Cirsium oleraceum (L.) Scop. Acta Pharm Jugosl 1990; 40: 569-71. 34. Özçelik B, Deliorman Orhan D, Karaogˇlu T, Ergun F. Antimicrobial activities of various Cirsium hypoleucum extracts. Ann Microbiol 2005; 55: 51-4. 35. Konarev AV, Anisimova IN, Gavrilova VA i wsp. Serine proteinase inhibitors in the Compositae: distribution, polymorphism and properties. Phytochemistry 2002; 59(3): 279-91. 36. Rodriguez-Zaragoza S, Ordaz C, Avila G i wsp. In vitro evaluation of amebicidial activity of Buddleia cordata (Loganiaceae, H.B.K.) on several strains of Acanthamoeba. J Ethnopharmacol 1999; 66(3): 327-34. 37. Kawazu K, Nashii Y, Ishii K, Tada M. A convenient screening method for nematicidal activity. Agric Biol Chem 1980; 44(3): 631-6. 38. Kawazu K, Nashii Y, Nakajima S. Two nematicidal substances from roots of Cirsium japonicum. Agric Biol Chem 1980; 44(4)903-6. 39. Grzycka K, Krzaczek T, Miłkowska J. Badanie aktywności biologicznej wybranych gatunków roślin kwiatowych. Ann Univers Mariae Curie-Skłodowska, Sectio D 1978; 33(36): 275-83. 40. Grzycka K, Miłkowska J. Badanie aktywności cytostatycznej pektolinaryny. Ann Univers Mariae Curie-Skłodowska, Sectio D 1983; 38(9): 63-6. 41. Amirghofran Z, Bahmani M, Azadmehr A, Javidnia K. Anticancer effects of various Iranian native medicinal plants on human tumor cell lines. Neoplasma 2006; 53(5): 428-33. 42. Lee WB, Kwon HC, Cho OR i wsp. Phytochemical constituents of Cirsium setidens Nakai and their cytotoxicity against human cancer cell lines. Arch Pharm Res 2002; 25(5)628-35. 43. Loizzo MR, Statti GA, Tundis R i wsp. Antiestrogenic activity of flavonoids from Cirsium tenoreanum Petrak. 51st Annual Congress of the Society for Medicinal Plant Research, Kiel (Germany), 2003; P 218. 44. Nakasugi T, Nakashima M, Komai K. Antimutagens in Cirsium maritimum. J Herb Spices Med Plants 2002; 10(1): 19-28. 45. Girotti C, Ginet M, Demarte FC i wsp. Lipolytic activity of cirsimarin extracted from Microtea debilis. Planta Med 2005; 71(12): 1170-2. 46. Park MK, Rhyu MR, Yoon BK i wsp. Modulation of genomic estrogen receptor pathway by water extracts of Cirsium japonicum. Arch Pharmacol Res 2008; 31(2): 225-30. 47. Hata K, Iwahori Y, Okada Y i wsp. Inhibitory effect of some wild plants in Akita on melanin biosynthesis. Nat Med 2000; 54(3): 144-7.



