© Borgis - Postępy Fitoterapii 1/2009, s. 3-11
*Elżbieta Hołderna-Kędzia, Bogdan Kędzia, Alina Mścisz
Poszukiwanie wyciągów roślinnych o wysokiej aktywności antybiotycznej1)
INVESTIGATIONS OF PLANT EXTRACTS WITH HIGH ANTIBIOTIC ACTIVITY
Instytut Włókien Naturalnych i Roślin Zielarskich w Poznaniu Oddział Roślin Zielarskich w Poznaniu
Dyrektor Instytutu: prof. dr hab. Grzegorz Spychalski
Summary
According to the great danger caused by antibiotic therapy there is a necessity of searching for new, natural substances with antibiotic properties. Medicinal plants are an excellent source of such compounds. The purpose of our research was to examine the antibiotic activity and chemical composition of some herbal materials used in traditional medicine, which have no or just partial scientific documentation in this range. 405 hydro- and lipophilic fractions, which were obtained from 135 medicinal domestic and far east plants belonging to 43, families (mainly Compositae, Labiatae, Umbelliferae) were used in this research. The minimal inhibitory concentration (MIC) of extracts was determined by serial dilution method in fluid medium using S. aureus ATCC 6538P standard strain. The research showed that 9 extracts obtained from Hypericum perforatum L., Melissa officinalis L. (2 extracts), Glycyrrhiza glabra L., Harpagophytum procumbens DC, Inula helenium L., Rosmarinus officinalis L. (2 extracts), and Salvia miltiorrhiza Bunge had high antibiotic activity (MIC<10 (?g/ml), 52 extracts coming mainly from families Compositae, Labiatae and Rosaceae had medium activity (MIC 10-100 ?g/ml), and 209 had low activity (MIC 100-1000 ?g/ml). The high activity extracts were examined on clinical strains: S. aureus, S. faecalis, E. coli, K. pneumoniae, P. aeruginosa, C. albicans and M. gypseum. It is noted, that the examined extracts showed higher antibiotic activity against Gram-positive cocci and dermatophytes than against Gram-negative bacilli and yeasts.

Badania miały na celu określenie stopnia aktywności przeciwdrobnoustrojowej otrzymanych wyciągów. Na wstępie postanowiono wyciągi poddać skriningowi mikrobiologicznemu z użyciem wrażliwego na działanie antybiotyków międzynarodowego szczepu standardowego gronkowca złocistego S. aureus ATCC 6538P. Następnie wyciągi o najwyższej aktywności antybiotycznej (MIC <10 ?g/ml) planowano przebadać według rozszerzonego programu badawczego z użyciem szczepów drobnoustrojów wyizolowanych ze środowiska szpitalnego. Na tej podstawie miano nadzieję na wyselekcjonowanie wyciągów wykazujących wysoką aktywność antybiotyczną wobec szerokiego spektrum drobnoustrojów o znaczeniu klinicznym. Dawałoby to nadzieję na wykorzystanie najbardziej aktywnych wyciągów w lecznictwie.
Materiał i metody
Badane surowce i przygotowanie wyciągów
Przedmiotem badań było 135 surowców zielarskich pochodzenia krajowego i zagranicznego, z których za pomocą standardowej procedury (ryc. 1) otrzymano wyciągi: H – heksanowy, E – etylooctanowy i A – wodny. Łącznie skriningowym badaniom mikrobiologicznym poddano 405 wyciągów lipofilnych i hydrofilnych.
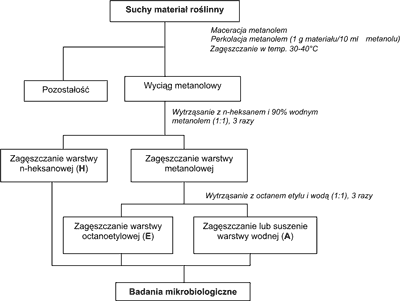
Ryc. l. Standardowa procedura ekstrakcji materiału roślinnego.
Przeprowadzenie mikrobiologicznych badań skriningowych
Badania skriningowe prowadzono z użyciem wrażliwego na substancje antybiotyczne międzynarodowego szczepu standardowego Staphylococcus aureus ATCC 6538P. Wyciągi rozpuszczano w DMSO w stężeniu 20 mg/ml i przygotowywano z nich rozcieńczenia w płynnym podłożu Penassay Broth (firmy Difco) w stężeniach: 1, 10, 100 i 1000 ?g/ml. Do przygotowanych rozcieńczeń wyciągów o objętości l ml dodawano po 0,1 ml 18-godzinnej hodowli szczepu standardowego, zawierającej 105 komórek w 1 ml. Następnie określano najmniejsze stężenia hamujące(MIC – minimal inhibitory concentration) badanych wyciągów wobec szczepu standardowego. Jako kryterium wysokiej aktywności mikrobiologicznej wyciągów przyjmowano MIC poniżej 10 ?g/ml.
Przeprowadzenie rozszerzonego programu badań mikrobiologicznych
Badania przeprowadzono z użyciem 7 szczepów drobnoustrojów ważnych z punktu widzenia klinicznego, takich jak bakterie Staphylococcus aureus, Enterococcus faecalis, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, grzyby drożdżoidalne Candida albicans i dermatofity Microsporum gypseum. Szczepy bakterii namnażano przed badaniem w płynnym podłożu Penassay Broth (firmy Difco) przez okres 18 godzin w temperaturze 37°C, natomiast grzyby drożdżoidalne namnażano w płynnym podłożu Sabouraud Broth (firmy Difco) również przez 18 godzin w temperaturze 37°C. Dermatofity namnażano na skosach podłoża Sabouraud Agar (firmy Difco) przez 7 dni w temperaturze 37°C, po czym hodowlę szczepu zmywano ze skosu przy użyciu 3 ml jałowej wody destylowanej. Przed doświadczeniem hodowle bakterii i grzybów rozcieńczano w odpowiednim podłożu w taki sposób, aby w 1 ml znajdowało się 105-106 komórek lub strzępek.
Wyciągi rozpuszczano w DMSO w stężeniu 20 mg/ml i przygotowywano rozcieńczenia w odpowiednim podłożu (dla bakterii Penassay Broth, dla grzybów drożdżoidalnych i dermatofitów Sabouraud Broth) w stężeniach: 5, 10, 25, 50, 75, 100, 250, 500, 750 i 1000 ?g/ml. Po dodaniu drobnoustrojów rzędy rozcieńczonych wyciągów w podłożach (0,1 ml rozcieńczonej hodowli drobnoustrojów + l ml odpowiedniego rozcieńczenia wyciągu) inkubowano: bakterie i grzyby drożdżoidalne 24 godz., a dermatofity 7 dni w temperaturze 37°C i określano ich MIC.
Wyniki
Badania skriningowe wykazały, że wśród 405 wyciągów lipofilnych i hydrofilnych otrzymanych ze 135 surowców zielarskich wysoką aktywnością antybiotyczną odznaczało się 9 wyciągów (MIC <10 ?g/ml), średnią 52 wyciągi (MIC = 100 ?g/ml), niską 209 wyciągów (MIC = 1000 ?g/ml) i bardzo niską aktywnością odznaczało się 135 wyciągów (MIC>1000 ?g/ml) (tab. 1). Wyciągi o wysokiej aktywności antybiotycznej zebrano w tabeli 2, natomiast wyciągi o średniej aktywności antybiotycznej w tabeli 3.
Tabela 1. Aktywność antybiotyczna badanych wyciągów.
| Nazwa surowca | Część rośliny | MIC (μg/ml) |
| H | E | A |
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
49.
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
84.
85.
86.
87.
88.
89.
90.
91.
92.
93.
94.
95.
96.
97.
98.
99.
100.
101.
102.
103.
104.
105.
106.
107.
108.
109.
110.
111.
112.
113.
114.
115.
116.
117.
118.
119.
120.
121.
122.
123.
124.
125.
126.
127.
128.
129.
130.
131.
132.
133.
134.
135. | Bidens tripartita
Echinacea purpurea
Echinacea purpurea
Centaurea cyanus
Silybum marianum
Matricaria chamomilla
Arctostaphylos uva-ursi
Hypericum perforatum
Melissa officinalis
alvia officinalis
ajorana hortensis
Ocimum basilicum
Glycyrrhiza glabra
Harpagophytum procumbens
Prunus spinosa
Solanum dulcamara
Levisticum officinale
Eupatorium cannabinum
Cnicus benedictus
Solidago virgaurea
Satureja hortensis
Lavandula officinalis
Althaea rosea var. nigra
Carum carvi
Orthosiphon stamineus
Sambucus nigra
Arnica montana
Artemisia abrotanum
Artemisia absinthium
Artemisia vulgaris
Achillea millefolium
Calendula officinalis
Helichrysum arenarium
Calluna vulgaris
Hamamelis virginiana
Aesculus hippocastanum
Viscum album
Crataegus oxyacantha
Euphrasia officinalis
Verbascum phlomoides
Tilia cordata
Viola tricolor
Geranium robertianum
Lamium album
Trifolium arvense
Urtica dioica
Equisetum arvense
Fumaria officinalis
Papaver rhoeas
Leonurus cardiaca
Chrysanthemum parthenium
Acorus calamus
Aegopodium podagraria
Agrimonia eupatoria
Archangalica officinalis
Archangelica officinalis
Arctium lappa
Asarum europaeum
Bergenia crassifolia
Betonica officinalis
Bryonia dioica
Capsella bursa pastoris
Fagopyrum esculentum
Hedera helix
Hedera helix
Herniaria glabra
Inula helenium
Oenothera biennis
Plantago lanceolata
Połygonum hydropiper
Potentilla anserina
Rhodiola rosea
Rumex hydrolapathum
Tanacetum vulgare
Vinca minor
Zea mays
Helianthus annuus
Plantago psyllium
Bellis perennis
Anethum graveolens
Filipendula ulmaria
Melilotus officinalis
Tussilago farfara
Fucus vesiculosus
Cassia angustifolia
Fragaria vesca
Sambucus nigra
Glycyrrhiza echinata
Rosmarinus officinalis
Primula officinalis
Urtica dioica
Lycopus europaeus
Alchemilla pastoralis
Viburnum opulus
Juniperis communis
Marrubium vulgare
Lamium purpureum
Ficaria verna
Glechoma hederacea
Aegopodium podagraria
Bergenia crassifolia
Helianthus tuberosus
Rumex patientia
Veronica chamaedrys
Chelidonium maius
Mentha piperita
Levisticum officinale
Tagetes erecta
Tagetes erecta
Digitalis lanata
Achillea millefolium
Anthemis nobilis
Połygonum aviculare
Menyanthes trifoliata
Vaccinium vitis-idaea
Betula verrucosa
Rubus caesius
Juglans regia
Ribes nigrum
Althaea officinalis
Centaurium umbellatum
Saponaria officinalis
Ononis spinosa
Althaea officinalis
Polygonum bistorta
Taraxacum officinale
Taraxacum mongolicum
Cornus officinalis
Salvia miltiorrhiza
Lycopus ramosissimus var. japonicus
Polygonatum odoratum var. pluriflorum
Smilax china
Ophiopogon japonicus
Rehmania glutinosa
Vitex rotundifolia | liść
ziele
korzeń
kwiat
nasienie
kwiat
liść
ziele
liść
liść
ziele
ziele
korzeń
bulwa
kwiat
ziele
korzeń
ziele
ziele
ziele
liść
kwiat
kwiat
nasienie
liść
kwiat
kwiat
ziele
ziele
ziele
ziele
liść
kwiat
kwiat
liść
kwiat
ziele
kwiat
ziele
kwiat
liść
ziele
ziele
ziele
ziele
kwiat
ziele
ziele
ziele
ziele
ziele
kłącze
ziele
ziele
ziele
korzeń
korzeń
ziele
kwiat
ziele
korzeń
ziele
ziele
owoc
liść
ziele
korzeń
nasienie
liść
ziele
ziele
korzeń
kłącze
kwiatostan
ziele
znamię
kwiat
nasienie
kwiat
nasienie
kwiat
ziele
kwiat
plecha
liść
liść
owoc
ziele
liść
kwiat
korzeń
ziele
ziele
owoc
owoc
ziele
ziele
ziele
ziele
kłącze
kłącze
bulwa
korzeń
ziele
ziele
liść
ziele
kwiat
liść
liść
kwiat
kwiat
ziele
liść
liść
liść
liść
liść
liść
liść
korzeń
korzeń
korzeń
korzeń
kłącze
korzeń
korzeń + ziele
owoc
korzeń
ziele
kłącze
kłącze
bulwa
korzeń
owoc | 100
100
1000
1000
1000
1000
1000
<10
100
100
1000
100
100
100
100
1000
1000
1000
1000
1000
1000
100
1000
1000
100
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
100
100
1000
1000
1000
1000
1000
100
1000
1000
1000
100
1000
100
1000
100
1000
1000
1000
100
1000
100
1000
100
1000
1000
100
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
100
1000
1000
1000
1000
1000
1000
1000
<10
1000
100
100
100
1000
100
100
1000
1000
100
100
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
100
1000
1000
1000
1000
1000
1000
1000
100
1000
1000
1000
1000
1000
1000
1000
1000 | 1000
1000
1000
1000
1000
1000
100
100
<10
100
100
1000
<10
<10
1000
1000
1000
100
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
100
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
100
1000
1000
100
1000
1000
1000
100
1000
1000
1000
100
1000
100
1000
1000
<10
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
100
1000
1000
1000
1000
1000
1000
100
<10
1000
1000
1000
1000
1000
100
1000
1000
1000
1000
100
1000
1000
1000
1000
1000
1000
1000
100
100
1000
1000
1000
1000
1000
1000
100
1000
100
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
<10
1000
1000
1000
1000
1000
1000 | 1000
1000
1000
1000
1000
1000
1000
1000
<10
1000
1000
1000
1000
100
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
100
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
100
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000
1000 |
| Wyciągi: H - heksanowy, E - etylooctanowy, A - wodny |
Tabela 2. Wyciągi o wysokiej aktywności antybiotycznej (MIC<10 ?g/ml).
| Badane surowce zielarskie | Część rośliny | Wyciągi o wysokiej aktywności antybiotycznej |
Glycyrrhiza glabra
Harpagophytum procumbens
Hypericum perforatum
Inula helenium
Melissa officinalis
Rosmarinus officinalis
Salvia miltiorrhiza | korzeń
bulwa
ziele
korzeń
liść
liść
korzeń | E
E
H
E
E, A
H, E
E |
| Wyciągi: H - heksanowy, E - etylooctanowy, A - wodny |
Tabela 3. Wyciągi o średniej aktywności antybiotycznej (MIC 10-100 ?g/ml).
| Badane surowce zielarskie | Część rośliny | Wyciągi o średniej aktywności antybiotycznej |
Aegopodium podagraria
Acorus calamus
Agrimonia eupatoria
Alchemilla pastoralis
Archangelica officinalis
Arctostaphylos uva-ursi
Asarum europaeum
Betonica officinalis
Betula verrucosa
Bidens tripartita
Capsella bursa pastoris
Chrysanthemum parthenium
Echinacea purpurea
Eupatorium cannabinum
Filipendula ulmaria
Fumaria officinalis
Glechoma hederacea
Glycyrrhiza echinata
Glycyrrhiza glabra
Hamamelis virginiana
Harpagophytum procumbens
Hedera helix
Hypericum perforatum
Inula helenium
Juglans regia
Juniperus communis
Lavandula officinalis
Lycopus europaeus
Majorana hortensis
Marrubium vulgare
Melissa officinalis
Ocimum basilicum
Orthosiphon stamineus
Prunus spinosa
Ribes nigrum
Rosmarinus officinalis
Salvia officinalis
Tagetes erecta
Tagetes erecta
Taraxacum mongolicum
Tilia cordata
Urtica dioica
Viola tricolor | kłącze
kłącze
ziele
ziele
kłącze
liść
ziele
ziele
liść
liść
ziele
ziele
ziele
ziele
kwiat
ziele
ziele
ziele
korzeń
liść
bulwa
owoc
ziele
kłącze
liść
owoc
kwiat
ziele
ziele
ziele
liść
ziele
liść
kwiat
liść
liść
liść
liść
kwiat
korzeń + ziele
kwiat
korzeń
ziele | H, E
H, A
H, E
H
H
E
E
H
E
H
H, E
E
H
E
H, E
H
H
E
H
E
H, A
H, E
E
H
E
H, E
H
H
E
H
H
H
H
H
H
A
H, E
E
E
H
H
H
H |
| Wyciągi: H - heksanowy, E - etylooctanowy, A - wodny |
Analizując najbardziej aktywne antybiotycznie wyciągi (tab. 2 i 3) należy stwierdzić, że na 61 wyciągów o MIC <10 ?g/ml i MIC 10-100 ?g/ml, najwięcej należało do wyciągów heksanowych (32 wyciągi), nieco mniej do etylooctanowych (25 wyciągów) i najmniej do wyciągów wodnych (4 wyciągi).
Program badań mikrobiologicznych poszerzony o szczepy drobnoustrojów ważnych klinicznie wskazuje, że największą aktywność antybiotyczą wobec badanych drobnoustrojów wykazywał wyciąg etylooctanowy z korzeni Salvia miltiorrhiza (tab. 4).
Tabela 4. Działanie wyciągów o wysokiej aktywności antybiotycznej (MIC <10 ?g/ml) na drobnoustroje ważne klinicznie.
| Badane surowce zielarskie | Część rośliny | Wyciąg | MIC (?g/ml) |
| A | B | C | D | E | F | G |
Glycyrrhiza glabra
Harpagophytum procumbens
Hypericum perforatum
Inula helenium
Melissa officinalis
Melissa officinalis
Rosmarinus officinalis
Rosmarinus officinalis
Salvia miltiorrhiza | korzeń
bulwa
ziele
korzeń
liść
liść
liść
liść
korzeń | E
E
H
E
E
A
H
E
E | 50
750
50
50
500
500
250
500
25 | 50
1000
100
100
>1000
>1000
250
250
500 | >1000
>1000
>1000
>1000
>1000
>1000
>1000
>1000
1000 | >1000
>1000
>1000
1000
>1000
>1000
>1000
>1000
500 | >1000
>1000
1000
>1000
1000
750
1000
1000
500 | 750
>1000
1000
75
>1000
>1000
>1000
75
250 | 25
250
100
25
250
250
250
25
50 |
| A - Staphylococcus aureus, B - Enterococcus faecalis, C - Escherichia coli, D - Klebsiella pneumoniae, E - Pseudomonas aeruginosa, F - Candida albicans, G - Microsporum gypseum |
Hamował on zarówno bakterie Gram-dodatnie, Gram-ujemne, grzyby drożdżoidalne i dermatofity w granicach stężeń 25-1000 ?g/ml. Z pozostałych wyciągów wyróżniały się wyciągi etylooctanowe z korzeni Glycyrrhiza glabra i Inula helenium oraz wyciąg heksanowy z ziela Hypericum perforatum, które silnie działały na gronkowce ( Staphylococcus aureus) i enterokoki ( Enterococcus faecalis) (MIC w granicach 50-100 ?g/ml) oraz wyciągi: etylooctanowy z korzeni Inula helenium i liści Rosmarinus officinalis, które silnie działały na grzyby drożdżoidalne ( Candida albicans) i dermatofity ( Microsporum gypseum) (MIC w granicach 25-75 ?g/ml).
Oceniając wszystkie wyciągi tej grupy można stwierdzić, że wykazywały one większą aktywność antybiotyczną wobec ziarniaków Gram-dodatnich ( S. aureus i E. faecalis) oraz dermatofitów ( M. gypseum) w porównaniu do pałeczek Gram-ujemnych ( E. coli, K. pneumoniae, P. aeruginosa) i grzybów drożdżoidalnych ( C. albicans) (tab. 4).
Wnioski
1. Ekstrakcja frakcjonowana pozwoliła na otrzymanie ze 135 badanych surowców zielarskich około 40% wyciągów lipofilnych i hydrofilnych o wyraźnie zaznaczonej aktywności antybiotycznej.
2. Z 9 wyciągów o najwyższej aktywności antybiotycznej na szczególną uwagę zasługuje etylooctanowy wyciąg z korzeni Salvia miltiorrhiza, który odznacza się szerokim spektrum działania na drobnoustroje ważne klinicznie, zarówno ziarniaki Gram-dodatnie, pałeczki Gram- -ujemne, grzyby drożdżoidalne, jak i dermatofity.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Okada K, Tamura Y, Yamamoto M i wsp. Chem Pharm Bull 1989; 37:2528-30. 2. Mitscher LA, Park YH, Omoto S i wsp. Heterocycles 1978; 9:1533-38. 3. Mitscher LA, Han-Park YH, Clark D. Antimicrobial agents from higher plants. Antimicrobial isoflavonoids and related substances from Glycyrrhiza glabra L. var. typica. J Nat Prod 1980; 43:259-69. 4. Li W, Asada Y, Yoshikawa T. Antimicrobial flavonoids from Glycyrrhiza glabra hairy root cultures. Planta Med 1998; 64:746-7. 5. Demizu S, Jahiyama K, Takahashi K i wsp. Chem Pharm Bull 1988; 36:3474-9. 6. Segal R, Pisanty S, Wormser R i wsp. Anticariogenic activity of licorice and glycyrrhizin. I. Inhibition of in vitro plaque formation by Streptococcus mutans. J Pharm Sci 1985; 74:79-81. 7. Namba T, Tsumezuka M, Dissanayake U i wsp. Studies on dental caries prevention by traditional medicines. VII. Screening of Ayurvedic Medicines for antiplaque action. Shoyakugaku Zasshi 1985; 2:146-53. 8. Hatano T, Yasuhara T, Miyamato K i wsp. Chem Pharm Bull 1988; 36:2286-8. 9. Bielenberg J. Süssholzwurzel. Wirkungen und Anwendungen unter dem Aspekt neuer pharmakologischer Erkenntnisse. Ztschr Phytother 1998; 197-208. 10. Pompei R, Pani A, Flore D i wsp. Antiviral activity of glycyrrhizic acid. Experientia 1980; 36:304-8. 11. Crance JM, Biziagos E, Passagot J i wsp. J Med Virol 1990; 31:155-60. 12. Gue-rin JC, Reveille-re HP. Activite- antifongique d´extraits ve-ge-taux a usage the-rapeutique. II. Etude de 40 extraits sur 9 souches fongiques. Ann Pharm Franç 1985; 43:77-81. 13. Hagenström U. Das Vorkommen einer antibakteriellen Fraktion in den kapseln einiger Hypericum-Arten. Arzneim-Forsch 1955; 5:155. 14. Rozenfeld LI, Chazanowicz RL. K woprosu o sochrannosti letuczich frakcji fitoncidow w lekarstwiennom syrie. Apt Deło 1958; Nr 4:22-6. 15. Babajewa NG. Antibakterialnoje dejstwie razlicznych widow zwieroboja. Ref Żurn Farmakol 1969; Nr 5:73. 16. Skwarek T. Wpływ preparatów pochodzenia roślinnego na rozwój wirusów grypy. Acta Polon Pharm 1979; 36: 605-12. 17. Barbagallo C, Chisari G. Antimicrobial activity of three Hypericum species. Fitoterapia 1987; 58:175-7. 18. Gurevich AI, Dobrynin VN, Kolosov MN i wsp. Hyperforin, an antibiotic from Hypericum perforatum L. Antibiotiki 1971; 16:510-13. 19. Schempp CM, Pelz K, Wittmer A i wsp. Antibacterial activity of hyperforin from St. John´s wort, against multiresistant Staphylococcus aureus and Gram-positive bacteria. Lancet 1999; 353:2129. 20. Yip L. Hudson JB, Gruszecka-Kowalik E i wsp. Antiviral activity of a derivative of the photosensitive compound hypericin. Phytomedicine 1996; 3:185-90. 21. Axarlis S, Mentis A, Demetzos C i wsp. Antiviral in vitro activity of Hypericum perforatum L. extract on the human cytomegalovirus (HCMV). Phytother Res 1998; 12:507-11. 22. Andersen DO, Weber ND, Wood SG i wsp.: In vitro virucidal activity of selected anthraquinones and anthraquinones derivatives. Antiviral Res 1991; 16:185-96. 23. Weseler A, Saller R, Reichling J. Antimicrobial activity of various tea preparations of Hypericum perforatum L. 48th Ann Mert Soc Med Res Zurich 2000; P3B/16. 24. Recio MC, Rios JL, Villar A. Antimicrobial activity of selected plants employed in the Spanish Mediterranean area. Part II. Phytother Res 1989; 3:77-80. 25. Petkov V. Bulgarian traditional medicine: a source of ideas for phytopharmacological investigations. J Ethnopharmacol 1986, 15, 121-132. 26. Wat CK, John T, Towers GHN. Phytotoxic and antibiotic activities of plants of the Asteraceae used in folk medicine. J Ethnopharmacol 1980; 2:279-90. 27. Leifertova I, Lisa M. The antifungal properties of higher plants affecting some species of the genus Aspergillus. Univ Carol Pragen Fol Pharm 1979; 2:29-54. 28. Olechnowicz-Stępień W, Stępień S. Badania in vitro i in vivo działania heleniny i jej składników na niektóre gatunki dermatofitów. Dissert Pharm 1963; 15:17-22. 29. Kowalewski Z, Kędzia W, Koniar H. Action of helenin on microorganisms. Arch Immunol Ther Exp 1976; 24: 121-5. 30. Cantrell CL, Abate L, Fronczek FR i wsp. Antimycobacterial endesmanolides from Inula helenium and Rudbeckia subtomentosa. Planta Med 1999; 65:351-5. 31. Wahab S, Lal B, Jacob Z i wsp. Mycopatholologia 1979; 68:31-8. 32. Bourrel C, Vilarem G, Perineau F. Chemical analysis, bacteriostatic and fungistatic properties of the essential oil of elecampane ( Inula helenium L.). J Essent Oil Res 1993; 5:411-7. 33. Koch-Heitzmann I, Schultze W. 2000 Jahre Melissa officinalis. Von der Bienenpflanze zum Virustaticum. Ztschr Phytother 1988; 9:77-85. 34. Möse JR, Lukas G. Zur Wirksamkeit einiger ätherischer Öle und deren Inhaltsstoffe auf Bakterien. Arzneim -Forsch 1957; 7:687-92. 35. Wagner H, Sprinkmeyer L. Über die pharmakologische Wirkung von Melissengeist. Dtsch. Apoth -Ztg 1973; 113:1159-66. 36. Masakova NS, Tserevatuy BS, Trofimenko SL i wsp. The chemical composition of volatile oil in lemon-balm as an indicator of therapeutic use. Planta Med 1979; 36:274. 37. Dikshit A, Husain A. Antifungal action of some essential oils against animal pathogen. Fitoterapia 1984; 55:171-6. 38. Kędzia B, Krzyżaniak M, Hołderna-Kędzia E i wsp. Skład i właściwości przeciwdrobnoustrojowe Ol. Melissae i jego składników. Herba Pol 1994; 40: 5-11. 39. Cohen RA, Kucera LS, Herrmann EC. Proc Soc Exp Biol Med 1964; 117, 431-4. 40. May G,Willuhn G. Antivirale Wirkung wässriger Pflanzenextrakte in Gewebekulturen. Arzneim -Forsch/Drug Res 1978; 28:1-7. 41. Dorner WG. Antivirale Wirkstoffe in Melissa officinalis. Pharm Unserer Zeit 1985; 14:112-21. 42. Llewellyn GC, Burkett ML, Eadie T. J Assoc Off Anal Chem 1981; 64: 955-60. 43. Zaika LL, Kissinger JC, Wasserman AE. J Food Sci 1983; 48:1455-9. 44. Shelef LA, Naglik A, Bogen DW. Sensitivity of some common foodborne bacteria to the spices sage, rosemary, and allspice. J Food Sci 1980; 45: 1042-4. 45. Perez C, Anesini C. In vitro antibacterial activity of Argentine folk medicinal plants against Salmonella typhi. J Ethnopharmacol 1994; 44:41-6. 46. May G, Willuhn G. Antivirale Wirkung wässriger Pflanzenextrakte in Gewebekulturen. Arzneim -Forsch 1978; 28:1-7. 47. Izzo AA, Di Carlo G, De Fusco R i wsp. Biological screening of Italian medicinal plants for antibacterial activity. Phytother Res 1995; 9: 281-6. 48. Huhtanen CN. J Food Prot 1980; 43:195-6; 200. 49. Câceres A, Girô LM, Alvarado SR i wsp. Screening of antimicrobial activity of plants popularly used in Guatemala for the treatment of dermatomucosal diseases. J Ethnopharmacol 1987; 20: 223-37. 50. Pariš A, Štrukelj B, Renko M i wsp. Inhibitory effect of carnosolic acid on HIV-1 protease in cell-free assays. J Nat Prod 1993; 56: 1426-30. 51. Takenaka M, Watanabe T, Sugahara K i wsp. New antimicrobial substances against Streptomyces scabies from rosemary ( Rosmarinus officinalis L.). Biosci Biotech Biochem 1997; 61: 1440-4. 52. Banthorpe DV, Bilyard HJ, Brown GD. Enol esters of caffeic acid in several genera of the Labiatae. Phytochem 1989; 28: 2109-13. 53. He-thelyi E, Kaposi P, Domonkos J i wsp. GC/MS investigation of the essential oils Rosmarinus officinalis L. Acta Pharm Hung 1987; 57:159-69. 54. Perucci S, Mancianti F, Cioni PL i wsp. In vitro antifungal activity of essential oils against some isolates of Microsporum canis and Microsporum gypseum. Planta Med 1994; 60:184-7.

