© Borgis - Postępy Fitoterapii 1/2009, s. 24-38
*Natalia Wszelaki
Hamowanie aktywności acetylocholinoesterazy i butyrylocholinoesterazy przez surowce roślinne i ich substancje czynne
PLANTS AS A SOURCE OF ACETYLCHOLINESTERASE AND BUTYRYLCHOLINESTERASE INHIBITORS
Institut für Pharmazie, Pharmazeutische Biologie, Freie Universität Berlin
Kierownik grupy badawczej: prof. Matthias F. Melzig
Summary
Acetylcholinesterase (AChE) inhibitors are widely used as a drug for the symptomatic treatment of Alzheimer´s disease (AD) – a progressive, neurodegenerative disorder associated with a decline in cognitive abilities. In the treatment of AD only following AChE inhibitors are used: donepezil, rivastigmine and galantamine. Since they have many unpleasant side effects, new substances are being investigated. Herbal extracts seem to be a significant source of new potential AChE and butyrylcholinesterase (BuChE) inhibitors, like hupercine A isolated from club moss (Huperzia serrata). The biologically active plant-derived substances come from different class of compounds and they are characterized by the diversity of structure. Majority of the bioactive substances are indol, steroids, piperidine, Amaryllidaceae type alkaloids, phenylpropanoids (furanocoumarins, xantons, and flavonoids) and terpenoids (diterpenes). There are many reports that not only pure isolated substances could be applied but also standardized plant extracts (Ginkgo biloba or Salvia officinalis), since they have other constituents also helpful in the therapy (antioxidants). The aim of this article is to collect all the informations from the literature about plants that have been tested for AChE or/and BuChE inhibitory activity and which plants or the constituents remarkable are.

Choroba Alzheimera
Choroba Alzheimera należy do schorzeń neurodegeneracyjnych przebiegających z otępieniem. Zajmuje ona pierwsze miejsce wśród otępień i dotyczy 50% przypadków przed otępieniem z ciałami Lewy´ego (20% przypadków) i otępieniem na podłożu zmian naczyniowych (10% przypadków) (1). Choroba ta charakteryzuje się zaburzeniami w sferze czynności poznawczych, postępującym zanikiem pamięci, zatracaniem zdolności do myślenia abstrakcyjnego, do wykonywania w sposób logicznie uporządkowany złożonych, a potem, w miarę postępu choroby, nawet prostych zadań (1).
Etiologia choroby Alzheimera nadal pozostaje niewyjaśniona. Z pewnością jest to choroba heterogenna, tzn. do jej powstania przyczynia się wiele czynników, m.in. wiek ponad 65 lat. Schorzenie to związane jest ze zmianami zachodzącymi w układzie limbicznym z hipokampem i okolicą okołohipokampalną, cholinergicznym jądrem Meynerta, (odpowiedzialnym za wytwarzanie około 93% acetylocholiny w ośrodkowym układzie nerwowym) i ciele migdałowatym, które mają udział w funkcjonowaniu pamięci (2, 3). Wewnątrz neuronów dochodzi do akumulacji ufosforylowanych białek tau cytoszkieletu, natomiast na zewnątrz neuronów oraz w naczyniach mózgowych do odkładania tzw. płytek starczych, które składają się głównie z białek i peptydów, często glikolizowanych, zwanych β-amyloidem. β-amyloid powstaje z białka prekursorowego – APP (amyloid precursor protein), które obecne jest w każdej komórce organizmu, i które w normalnych warunkach ulega degradacji przez enzym α-sekretazę, dając produkty rozpuszczalne. Jeśli APP zostanie rozcięte przez obecną w komórce β-sekretazę, a następnie produkt tej hydrolizy ulegnie proteolizie przy udziale γ-sekretazy, powstaje wtedy peptyd β-amyloidowy, który buduje płytki starcze. Nie wyjaśniono jeszcze, dlaczego dochodzi do alternatywnego cięcia przez β-sekretazę. Złogi β-amyloidu oraz ufosforylowane białko tau, przyczyniając się do powstawania stanów zapalnych (na skutek aktywacji komórek astrogleju i mikrogleju) i uwalniania wolnych rodników, spadku produkcji energii (utrata mitochondriów), zachwiania równowagi jonowej oraz napływu jonów wapnia wewnątrz neuronu, mogą sprzyjać deregulacji aktywności szeregu białek wiążących wapń i w rezultacie powodować uszkodzenie neuronów cholinergicznych i ich śmierć. Same fragmenty płytek starczych mają właściwości hamowania przewodnictwa cholinergicznego, a występujący wewnątrz nich enzym butyrylocholinoesteraza dodatkowo obniża i tak niskie już stężenie acetylocholiny (3, 4).
Znaczenie acetylocholinoesterazy i butyrylocholinoesterazy
Obecnie leczenie choroby Alzheimera koncentruje się na zmniejszaniu objawów choroby, tzn. na poprawie funkcji poznawczych oraz behawioralnych poprzez normalizację neurotransmisji cholinergicznej w mózgu. Z teoretycznie możliwych metod zwiększania przekaźnictwa w układzie cholinergicznym (bezpośrednie podawanie acetylocholiny, zwiększona podaż prekursorów, np. lecytyny, poprawa uwalniania acetylocholiny z pęcherzyków presynaptycznych, hamowanie rozkładu, bezpośrednie działanie na receptory), jedynie inhibitorom acetylocholinoesterazy udowodniono skuteczność przy stosunkowo niewielkich działaniach niepożądanych (5). Acetylocholina [1] (wzory strukturalne substancji 1-13 umieszczono na ryc. nr 1 i 2) jest rozkładana w ośrodkowym układzie nerwowym przez enzymy o właściwościach hydrolitycznych, tzw. cholinoesterazy. Stąd ważną rolę w terapii tej choroby neurodegeneracyjnej odgrywają leki z grupy inhibitorów acetylocholinoesterazy, hamujące przez pewien czas rozwój zmian degeneracyjnych, choć nie likwidujące jej przyczyn. Odnotowuje się w czasie ich stosowania pozytywny wpływ w zakresie procesów poznawczych, nastroju i zachowania oraz opóźnienie wystąpienia zmian neuropsychiatrycznych. Skuteczność inhibitorów acetylocholinoesterazy tłumaczy się pobudzaniem przez acetylocholinę receptorów muskarynowych M1, które aktywując kinazę białkową C, zwiększają aktywność α-sekretazy i zapobiegają w ten sposób powstawaniu płytek starczych (6).
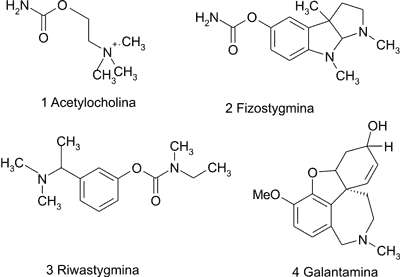
Ryc. 1. Wzory strukturalne acetylocholiny i inhibitorów cholinoesterazy.
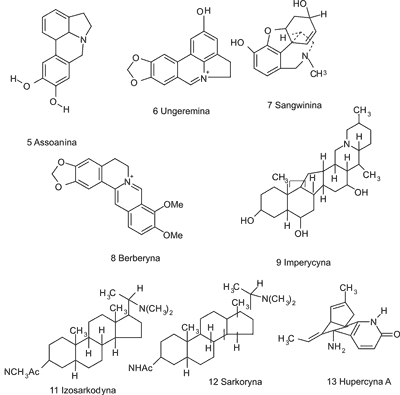
Ryc. 2. Wzory strukturalne inhibitorów cholinoesteraz.
W mózgu ssaków istnieją dwa rodzaje cholinoesteraz: acetylocholinoesteraza (AChE), występująca w synapsach neuronów ośrodkowego i obwodowego układu nerwowego oraz butyrylocholinoesteraza (BuChE), związana z komórkami glejowymi, komórkami śródbłonka, neuronami oraz płytkami starczymi, której rola nie została jeszcze w pełni wyjaśniona. W stanie fizjologicznym aktywność butyrylocholinoesterazy jest niewielka, dopiero w miarę rozwoju choroby Alzheimera, gdy neurony cholinergiczne obumierają, enzym ten staje się bardziej aktywny i jego zahamowanie pozwala na efektywniejsze zwiększenie stężenia acetylocholiny w mózgu (7). Wraz z postępem choroby poziom acetylocholinoesterazy w różnych rejonach mózgu spada o 85%, podczas gdy BuChE wzrasta. Stosunek BuChE do AChE na skutek choroby zmienia się od 0,2 do 11. Dlatego selektywne inhibitory BuChE mogłyby poprawić przekaźnictwo cholinergiczne poprzez wykorzystanie zwiększonego stężenia butyrylocholinoesterazy w ośrodkowym układzie nerwowym (8). Ponadto badania histochemiczne wykazały, że niektóre neurony cholinergiczne, zamiast AChE zawierają BuChE. 10-15% komórek ciała migdałowatego oraz hipokampu jest regulowanych przez BuChE, niezależnie od AChE (8). Ten fakt wydaje się potwierdzać skuteczność nieselektywnego inhibitora acetylo- i butyrylocholinoesterazy – riwastygminy w poprawie funkcji poznawczych.
Źródła nowych inhibitorów AChE i BuChE
Lekarze w terapii początkowych i średnio zaawansowanych stadiów choroby Alzheimera mają do dyspozycji zaledwie trzy inhibitory acetylocholinoesterazy: galantaminę (Reminyl), riwastygminę (Exelon) oraz donepezil (Aricept). Jednak substancje te powodują wiele działań niepożądanych, m.in. zaburzenia żołądkowo-jelitowe, mają niską biodostępność lub słabą przenikalność przez barierę krew-mózg (5), co zmusza do poszukiwania nowych, bezpieczniejszych oraz skuteczniejszych środków leczniczych.
Źródłem nowych substancji hamujących hydrolizę acetylocholiny są m.in. surowce roślinne. W medycynie ludowej wymienianych jest szereg roślin, które tradycyjnie stosowano w celu wspomagania pamięci lub funkcji poznawczych, bądź też w schorzeniach ośrodkowego układu nerwowego. Związki pochodzenia roślinnego, którym udowodniono działanie hamujące aktywność acetylocholinoesterazy oraz butyrylocholinoesterazy, odznaczają się różnorodną budową chemiczną i należą do różnych grup związków.
Przeważająca część substancji działających hamująco na cholinoesterazy należy do alkaloidów. Do najaktywniejszych z tej grupy związków zaliczają się alkaloidy steroidowe i indolowe. Najbardziej znanym alkaloidem indolowym jest fizostygmina [2] (ryc. 1), pochodząca z Physostigma venenosum Balf., używana przez plemiona afrykańskie jako trucizna. Silnie hamuje zarówno acetylocholinoesterazę, jak i butyrylocholinoesterazę, jednak ze względu na krótki czas półtrwania nie może być stosowana w terapii choroby Alzheimera (9, 10). Poprzez modyfikację cząsteczki fizostygminy otrzymano nową substancję – riwastygminę [3] (ryc. 1), która nie wymaga wielokrotnego podawania w ciągu dnia.
Galantaminę [4] (ryc. 1), alkaloid typu Amaryllidaceae dziś otrzymywany syntetycznie, wyizolowano z przebiśniegu ( Galanthus nivalis L.), z którego wyciągi były stosowane w medycynie ludowej w Bułgarii i Turcji w schorzeniach neurologicznych (10). Działa ona 10-12 razy silniej od fizostygminy na mózgową acetylocholinoesterazę, ponadto jest w 89% wchłaniana z układu pokarmowego (5, 11). Powinowactwo galantaminy do acetylocholinoesterazy jest 100 razy większe niż do butyrylocholinoesterazy. Ponadto związek ten jest allosterycznym aktywatorem receptora nikotynowego, czyli łączy się z receptorem w miejscu innym niż miejsce wiązania acetylocholiny, nasilając jej działanie. Okres półtrwania galantaminy wynosi ok. 7-8 godzin (5). U pacjentów, którzy brali udział w badaniach klinicznych, stwierdzono poprawę funkcji poznawczych oraz większą samodzielność w zajęciach dnia codziennego (5, 9). Kilka innych alkaloidów Amaryllidaceae, okazało się mieć właściwości hamujące AChE, lecz nie ma dla nich dostępnych badań dotyczących farmakokinetyki, ani bezpieczeństwa stosowania (5).
Oprócz pojedynczych substancji, trwają badania nad stosowaniem standaryzowanych wyciągów z surowców roślinnych przydatnych w hamowaniu postępu choroby Alzheimera. Przykładem jest wyciąg z Ginkgo biloba L, który w badaniach na szczurach skutecznością działania dorównywał galantaminie, riwastygminie, czy donepezilowi, natomiast pozbawiony był poważniejszych działań niepożądanych (12). Przeprowadzone następnie przez Wettsteina (13) badania na grupie pacjentów potwierdziły wcześniejsze wyniki uzyskane na zwierzętach. Dodatkowo zawarte w wyciągu Ginkgo biloba L. ginkgolidy, poprawiające przekaźnictwo w układzie cholinergicznym, wykazują korzystne działanie przeciwutleniające oraz neuroochronne (14, 15). Badania na grupie 48 pacjentów dowiodły poza tym znaczną poprawę pamięci u osób z chorobą Alzheimera, które przyjmowały wyciąg z Salvia officinalis L. (16). Podobną skuteczność uzyskano stosując wyciąg z liści melisy ( Melissa officinalis L.) u pacjentów z łagodnym i umiarkowanym otępieniem w chorobie Alzheimera (17).
Do tej pory stwierdzono wśród bardzo licznej grupy surowców roślinnych właściwości hamujące aktywność acetylocholinoesterazy. Spośród zbadanych dotąd surowców największą inhibicję AChE wykazywał wyciąg metanolowy z ziela Myricaria elegans Royle ( Tamaricaceae), który już w stężeniu 0,2 μg/ml hamował aktywność AChE w 74,8% (18). Natomiast wyciąg etanolowy ze Spatholobus suberectus w stężeniu 9 μg/ml wykazał zdolność hamowania enzymu w 50%. Do surowców wykazujących silne zdolności inhibicji AChE, wynoszące ponad 80% w stężeniu 0,1 mg/ml, należą: Rhei radix et rhizome, Polygoni multiflori radix, Salviae miltiorrhiza radix, Radix Paeoniae alba, Radix Paeonie rubra, Chelidonii herba, Corydalis intermediae bulbus , Corydalis intermediae herba , Corydalis cavae bulbus i Corydalis cavae herba z rodziny Papaveraceae, ponadto Tabernaemontanae radix ( Apocynaceae) i Stephaniae radix (Menispermaceae) (19-22). Także dla wyciągów metanolowych z korzenia Butea superba Roxb. i korzenia Cassia fistula L. z rodziny Fabaceae, z szypułek Piper interruptum Opiz. i nasion Piper nigrum L. z rodziny Piperaceae, odnotowano ponad 50% inhibicji w stężeniu 0,1mg/ml (21). Surowce, mające właściwości inhibicji aktywności AChE, przedstawiono w tabeli 1.
Tabela 1. Inhibicja aktywności AChE przez wybrane surowce roślinne.
| Roślina | Rodzina | Częśćrośliny | Rozpuszczalnik | Inhibicja AChE (%) | Zródło |
| Abutilon indicum | Malvaceae | cała | metanol | 30,66?1,06
(0,1 mg/ml) | (21) |
| Acanthus ebracteatus | Acanthaceae | nadziemna | metanol | 36,19?8,00
(0,1 mg/ml) | (21) |
| Acorus calamus | Araceae | kłącze | metanol | 53,7?5,50
(0,2 mg/ml) | (23) |
| Aegle marmelos | Rutaceae | miąższ owoców | metanol | 44,65?3,04
(0,1 mg/ml) | (21) |
| Albizia procera | Fabaceae | kora | metanol | 40,71?0,46
(0,1 mg/ml) | (21) |
| Bacopa monniera | Scrophulariaceae | cała | etanol | 42,9?1,2
(0,1 mg/ml) | (12) |
| Butea superba | Fabaceae | kora korzenia | metanol | 55,87?5,83
(0,1 mg/ml) | (21) |
| Buxus sempervirens | Buxaceae | cała | chloroform:metanol (1:1) | 61,76?0,76
(1 mg/ml) | (24) |
| Carthamus tinctorius | Compositae | kwiat | metanol | 30,33?9,22
(0,1 mg/ml) | (21) |
| Cassia fistula | Fabaceae | korzeń | metanol | 54,13?3,90
(0,1 mg/ml) | (21) |
| Chelidonium majus | Papaveraceae | ziele | etanol | 98,00
(0,2 mg/ml) | (20) |
| Cichorium intybus | Compositae | korzeń | dicholormetan | 70,00
(1 mg/ml) | (25) |
| Combretum kraussii | Combretaceae | liść | octan etylu | 96?4,6
(1 mg/ml) | (26) |
| kora | octan etylu | 82?6,1
(1 mg/ml) |
| korzeń | octan etylu | 81?4,1
(1 mg/ml) |
| Corydalis cava | Papaveraceae | ziele | metanol | 85,0
(0,1 mg/ml) | (19) |
| Corydalis cava | Papaveraceae | bulwa | metanol | 92,0
(0,1 mg/ml) | (19) |
| Corydalis intermedia | Papaveraceae | ziele | metanol | 84,0
(0,1 mg/ml) | (19) |
| bulwa | metanol | 97,0
(0,1 mg/ml) | (19) |
| Corydalis solida | Papaveraceae | cała | chloroform:metanol (1:1) | 87,56?1,24
(1 mg/ml) | (24) |
| Corydalis turtschaninovii | Papaveraceae | tuber | etanol | 72,5
(0,1 mg/ml) | (27) |
| Crinum jagus | Amaryllidaceae | bulwa | metanol | 45,1
(0,1 mg/ml) | (28) |
| Crinum glaucum | Amaryllidaceae | bulwa | metanol | 40,8
(0,1 mg/ml) | (28) |
| Cyperus rotundus | Cyperaceae | cała | metanol | 44,19?2,27
(0,1 mg/ml) | (21) |
| Epimediumkoreanum | Berberidaceae | ziele | metanol | 47,5?4,10
(0,2 mg/ml) | (23) |
| Euphorbium antiquorum | Euphorbiaceae | łodyga | metanol | 42,31?9,10
(0,1 mg/ml) | (21) |
| Fumaria asepala | Fumariaceae | cała | chloroform:metanol (1:1) | 91,99?0,70
(1 mg/ml) | (24) |
| Fumaria capreolata | Fumariaceae | cała | chloroform:metanol (1:1) | 96,89?0,17
(1 mg/ml) | (24) |
| Fumaria cilicica | Fumariaceae | cała | chloroform:metanol (1:1) | 88,03?0,65
(1 mg/ml) | (24) |
| Fumaria densiflora | Fumariaceae | cała | chloroform:metanol (1:1) | 93,42?0,92
(1 mg/ml) | (24) |
| Fumaria flabellata | Fumariaceae | cała | chloroform:metanol (1:1) | 92,14?1,01
(1 mg/ml) | (24) |
| Fumaria judaica | Fumariaceae | cała | chloroform:metanol (1:1) | 96,47?0,63
(1 mg/ml) | (24) |
| Fumaria kralikii | Fumariaceae | cała | chloroform:metanol (1:1) | 84,98?1,07
(1 mg/ml) | (24) |
| Fumaria macrocarpa | Fumariaceae | cała | chloroform:metanol (1:1) | 93,43?0,64
(1 mg/ml) | (24) |
| Fumaria parviflora | Fumariaceae | cała | chloroform:metanol (1:1) | 87,02 ?0,31
(1 mg/ml) | (24) |
| Fumaria petteri subsp. Thuretti | Fumariaceae | cała | chloroform:metanol (1:1) | 89,45?0,86
(1 mg/ml) | (24) |
| Fumaria vaillantii | Fumariaceae | cała | chloroform:metanol (1:1) | 94,23?0,47
(1mg/ml) | (24) |
| Ginkgo biloba | Ginkgoaceae | cała | etanol | 50,0
(268,33 ?g) | (12, 14) |
| Glaucium corniculatum | Papaveraceae | cała | chloroform:metanol (1:1) | 86,55?0,67
(1 mg/ml) | (24) |
| Glinus oppositifolius | Molluginaceae | cała | metanol | 27,78?9,44
(0,1 mg/ml) | (21) |
| Laurus nobilis | Lauraceae | cała | etanol | 64,0
(1 mg/ml) | (29) |
| Lavandula angustifolia | Lamiaceae | ziele | metanol | 34,0
(0,1mg/ml) | (19) |
| Lycopodium clavatum | Lycopodiaceae | cała | chloroform:metanol (1:1) | 49,85?1,33
(1 mg/ml) | (24) |
| Hypericum undulatum | Guttiferae | cała | etanol | 68,0
(0,5 mg/ml) | (29) |
| Mammea harmandii | Guttiferae | kwiat | metanol | 33,63?8,00
(1 mg/ml) | (21) |
| Melissa officinalis | Lamiaceae | cała | olejek eteryczny | 76,3
(0,1 ?g/ml) | (30) |
| Michelia champaca | Magnoliaceae | liść | metanol | 34,88?4,56
(0,1 mg/ml) | (21) |
| Mimusops elengi | Sapotaceae | kwiat | metanol | 32,81?5,36
(0,1 mg/ml) | (21) |
| Musa sapientum | Musaceae | owoc | metanol | 29,14?4,73
(0,1 mg/ml) | (21) |
| Myricaria elegans | Tamaricaceae | nadziemna | metanol | 74,8
(0,2 ?g/ml) | (18) |
| Paederia linearis | Rubiaceae | cała | metanol | 29,31?6,39
(0,1 mg/ml) | (21) |
| Paeonia alba | Paeoniaceae | korzeń | etanol | 50,0
(8 mg/ml) | (22) |
| Paeonia rubra | Paeoniaceae | korzeń | etanol | 50,0
(14 ?g/ml) | (22) |
| woda | 50,0
(45 ?g/ml) | (22) |
| Piper interruptum | Piperaceae | szypuła | metanol | 65,16?8,13
(0,1 mg/ml) | (21) |
| Piper nigrum | Piperaceae | nasiona | metanol | 58,02?3,83
(0,1 mg/ml) | (21) |
| Plumbago indica | Plumbaginaceae | korzeń | metanol | 30,14?3,28
(0,1 mg/ml) | (21) |
| Polygonum multiflorum | Polygonaceae | korzeń | etanol | 50,0
(65 ?g/ml) | (22) |
| woda | 50,0
(13 ?g/ml) | (22) |
| Rheum officinale | Polygonaceae | korzeń i kłącze | etanol | 50,0
(18 ?g/ml) | (22) |
| korzeń i klącze | woda | 50,0
(32 ?g/ml) | (22) |
| Rhodiola rosea | Crassulaceae | korzeń | metanol | 42,00?3,20
(1 mg/ml) | (31) |
| Rhododendron luteum | Ericaceae | cała | chloroform:metanol (1:1) | 76,32?0,58
(1 mg/ml) | (24) |
| Rhododendron ponticum | Ericaceae | cała | chloroform:metanol (1:1) | 93,03?1,12
(1 mg/ml) | (24) |
| Rosmarinus officinalis | Lamiaceae | ziele | olejek eteryczny | 63,7 ? 1,23
(1 mg/ml) | (21) |
| Ruta graveolens | Rutaceae | ziele | metanol | 39,0
(0,1 mg/ml) | (19) |
| Salix mucronata | Salicaceae | kora | octan etylu | 82,00?3,9
(1 mg/ml) | (26) |
| Sanguisorba minor | Rosaceae | cała | etanol | 78,0
(1,0 mg/ml) | (29) |
| Salvia lavandulaefolia | Lamiaceae | cała | olejek eteryczny | 63,0?3,7
(0,1 ?g/ml) | (30) |
| Salvia miltiorrhiza | Lamiaceae | korzeń | etanol | 50,0
(5 ?g/ml) | (22) |
| Salvia miltiorrhiza | korzeń | etanol | 50,0
(50 ?g/ml) | (22) |
| Salvia officinalis | Lamiaceae | cała | etanol | 68,2? 15,6
(2,5 mg/ml) | (30) |
| olejek eteryczny | 52,4?0,8
(0,1 ?g/ml) |
| Salvia sclareoides | Lamiaceae | części nadziemne | aceton | 61,0
(0,5 mg/ml) | (33) |
| butanol | 61,0
(10 ?g/ml) |
| etanol | 56,0
(0,5 mg/ml) |
| woda | 65,0
(10 ?g/ml) |
| Spatholobus suberectus | Fabaceae | łodyga | etanol | 50,0
(9 ?g/ml) | (22) |
| Stephania suberosa | Menispermaceae | korzeń | metanol | 91,93?10,80
(0,1 mg/ml) | (21) |
| Streblus asper | Moraceae | nasiona | metanol | 30,51?4,21
(0,1 mg/ml) | (21) |
| Tabernaemontana divaricata | Apocynaceae | korzeń | metanol | 93,50?0,37
(0,1 mg/ml) | (21) |
| Terminalia bellirica | Combretaceae | owoc | metanol | 39,68?8,15
(0,1 mg/ml) | (21) |
| Tiliacora triandra | Menispermaceae | korzeń | metanol | 42,29?2,89
(0,1 mg/ml) | (21) |
| Vicia faba | Fabaceae | cała | chloroform:metanol (1:1) | 39,68?8,15
(0,1 mg/ml) | (21) |
Mniej wyników badań dotyczy inhibicji butyrylocholinoesterazy przez surowce roślinne. Najaktywniejszy surowiec – Myricaria elegans Royle ( Tamaricaceae) w stężeniu 0,2 μg/ml hamował aktywność BuChE w 96% (18). W stężeniu 1mg/ml zdolność inhibicji aktywności BuChE w ponad 80% miały różne gatunki Fumaria, najsilniej F. vaillantii Loisel oraz F. judaica Boiss., a najsłabiej F. kralikii Jord. (24). Również silnymi inhibitorami okazały się być wyciągi z Buxus sempervirens L. ( Buxaceae), Corydalis solida subsp. solida L. ( Papaveraceae), Lycopodium clavatum L. ( Lycopodiaceae), Rosmarinus officinalis ( Lamiaceae) i Rhododendron ponticum L. ( Ericaceae), Salvia sclaroides ( Lamiaceae), które w stężeniu 1 mg/ml wykazały ponad 65% inhibicji (24, 32, 33). Surowce, u których wykazano inhibicję aktywności BuChE przedstawiono w tabeli 2.
Tabela 2. Inhibicja aktywności BuChE przez wybrane surowce roślinne.
| Roślina | Rodzina | Część rośliny | Rozpuszczalnik | Inhibicja BuChE(%) | Zródło |
| Buxus sempervirens | Buxaceae | cała | chloroform:metanol (1:1) | 93,64?0,87
(1 mg/ml) | (24) |
| Corydalis solida subsp.solida | Papaveraceae | cała | chloroform:metanol (1:1) | 93,18?0,89
(1 mg/ml) | (24) |
| Fumaria asepala | Fumariaceae | cała | chloroform:metanol (1:1) | 93,12?0,28
(1 mg/ml) | (24) |
| Fumaria capreolata | Fumariaceae | cała | chloroform:metanol (1:1) | 89,24?0,83
(1 mg/ml) | (24) |
| Fumaria cilicica | Fumariaceae | cała | chloroform:metanol (1:1) | 80,03?0,28
(1 mg/ml) | (24) |
| Fumaria densiflora | Fumariaceae | cała | chloroform:metanol (1:1) | 85,66?1,24
(1 mg/ml) | (24) |
| Fumaria flabellata | Fumariaceae | cała | chloroform:metanol (1:1) | 87,91?0,61
(1 mg/ml) | (24) |
| Fumaria judaica | Fumariaceae | cała | chloroform:metanol (1:1) | 98,43?0,39
(1 mg/ml) | (24) |
| Fumaria kralikii | Fumariaceae | cała | chloroform:metanol (1:1) | 75,43?0,98
(1 mg/ml) | (24) |
| Fumaria macrocarpa | Fumariaceae | cała | chloroform:metanol (1:1) | 88,74?0,64
(1 mg/ml) | (24) |
| Fumaria parviflora | Fumariaceae | cała | chloroform:metanol (1:1) | 87,09 ?1,45
(1 mg/ml) | (24) |
| Fumaria petteri subsp. Thuretti | Fumariaceae | cała | chloroform:metanol (1:1) | 87,32?0,76
(1 mg/ml) | (24) |
| Fumaria vaillantii | Fumariaceae | cała | chloroform:metanol (1:1) | 99,32?0,25
(1 mg/ml) | (24) |
| Glaucium corniculatum | Papaveraceae | cała | chloroform:metanol (1:1) | 81,45?0,74
(1 mg/ml) | (24) |
| Lycopodium clavatum | Lycopodiaceae | cała | chloroform:metanol (1:1) | 71,05?0,25
(1 mg/ml) | (24) |
| Myricaria elegans | Tamaricaceae | cała | metanol | 96,00
(0,2 ?g/ml) | (18) |
| Rhododendron luteum | Ericaceae | cała | chloroform:metanol (1:1) | 69,14?1,89
(1 mg/ml) | (24) |
| Rhododendron ponticum | Ericaceae | cała | chloroform:metanol (1:1) | 95,23?1,28
(1 mg/ml) | (24) |
| Rosmarinus officinalis | Lamiaceae | ziele | metanol | 83,9 ? 0,97
(1 mg/ml) | (32) |
| ziele | octan etylu | 34,2 ? 0,85
(1 mg/ml) |
| ziele | olejek eteryczny | 74,0 ? 0,79
(1 mg/ml) |
| ziele | eter naftowy | 54,2 ? 1,55
(1 mg/ml) |
| Salvia fruticosa | Lamiaceae | cała | olejek eteryczny | 50,00
(0,035 mg/ml) | (34) |
| Salvia officinalis | Lamiaceae | - | olejek eteryczny | 50,00
(0,07 ?g/ml) | (30) |
| Salvia officinalis var. purpurea | Lamiaceae | cała | olejek eteryczny | 50,00
(0,06 mg/ml) | (34) |
| Salvia sclareoides | Lamiaceae | części nadziemne | aceton | 72,00
(0,5 mg/ml) | (33) |
| butanol | 86,00
(0,5 mg/ml) |
| etanol | 79,00
(1 mg/ml) |
| Vicia faba | Fabaceae | cała | chloroform:metanol (1:1) | 45,23?0,48
(1 mg/ml) | (24) |
| Zygophyllum fabago | Zygophyllaceae | cała | chloroform:metanol (1:1) | 78,37?0,95
(1 mg/ml) | (24) |
Jednym z najaktywniejszych naturalnych odwracalnych inhibitorów acetylocholinoesterazy, oprócz fizostygminy, jest (-) hupercyna A [13] (wzory substancji 5-13 umieszczono na rycinie 2), będąca alkaloidem chinolizydynowym pozyskiwanym z widłaka Huperzia serrata Thunb. Surowiec ten był stosowany od wielu wieków w tradycyjnej medycynie ludowej Chin. Hupercyna A w chwili obecnej znajduje się w fazie badań klinicznych. W porównaniu z dotąd zarejestrowanymi inhibitorami AChE lepiej przenika przez barierę krew-mózg, ma wysoką biodostępność przy podaniu doustnym, jej metabolizm nie jest zbyt intensywny, dzięki czemu działanie tego związku jest przedłużone i utrzymuje się na stałym poziomie. Ponadto w trakcie badań klinicznych nie zaobserwowano u pacjentów objawów toksyczności, działania niepożądane ze strony układu cholinergicznego były minimalne, a poprawa pamięci u osób starszych wyraźna (35). Hupercyna A działa także neuroochronnie, gdyż działa przeciwzapalnie, obniża toksyczny poziom glutaminianu, a także poprzez hamowanie aktywności kaspazy-3 ma wpływ na peptydowy fragment 25-35 β-amyloidu, co zapobiega apoptozie neuronów (36).
Wśród licznej grupy substancji wyizolowanych z surowców stosowanych w medycynie ludowej, wykazujących najsilniejsze hamowanie aktywności acetylocholinoesterazy (IC50 wynoszące mniej niż 2 μM), znajdują się: berberyna [8] (ryc. 2), 8-hydroksydihydrochelerytryna, 8-hydroksydihydrosangwinaryna – alkaloidy izochinolinowe występujące m.in. w Chelidonium majus L. (Papaveraceae), a także alkaloidy typu Amaryllidaceae, takie jak galantamina i jej pochodna 11-hydroksygalantamina, assoanina [5] (ryc. 2), 1-o-acetylolikoryna i ungeremina [6] (ryc. 2) (14, 41).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Leszek J. Choroby otępienne. Teoria i praktyka. Wrocław. Continuo; 2003; p.20-1. 2. Ball MJ, Fisman M, Hachinski V i wsp. A new definition of Alzheimer´s disease: a hippocampal dementia. Lancet 1985; 8419:14-6. 3. Ball S. Chemia szarych komórek. Neurochemia i toksykologia ośrodkowego układu nerwowego. Warszawa. Medyk; 2003; p.128-130. 4. Nawrot B. Proteazy aspartylowe w chorobie Alzheimera. Szkoła Wiosenna Polskiego Towarzystwa Badań Układu Nerwowego oraz Komitetu Neurobiologii Polskiej Akademii Nauk przy współpracy z II Kliniką Neurologiczną Instytutu Psychiatrii i Neurologii w Warszawie "Genetyczne Podstawy Chorób Neurodegeneracyjnych". 11 marca 2005, http://www.ptbun.org.pl/archiv/sw05_nawrot.pdf. 5. Magierski R, Kłoszewska I, Sobów T. Farmakoterapia otępienia w chorobie Alzheimera i otępienia mieszanego w chorobie Alzheimera. Aktualna Neurologia 2004; 3:171-9. 6. Kostowski W, Herman ZS. Farmakologia. Podstawy farmakoterapii. Tom 2. W: rozdział 55. Leki nootropowe i prokognitywne. Farmakoterapia choroby Alzheimera. Warszawa, Wydawnictwo Lekarskie PZWL;2005; p.161-7. 7. Gabini E. Selective inhibitors of butyrylcholinesterase: a valid alternative for therapy of Alzheimer´s disease? Drugs aging 2001; 18:891-898. 8. Greig NH, Utsuki T, Ingram DK i wsp. Selective butyrylcholinesterase inhibition elevates brain acetylcholine, augments learning and lowers Alzheimer beta-amyloid peptide in rodent. PNAS 2005; 102:17213-172138. 9. Houghton PJ, Howes MJ. Natural products and derivatives affecting neurotransmission relevant to Alzheimer´s and Parkinson´s disease. Neurosignals 2005; 14:2-22. 10. Mukherjee PK, Kumar V, Mal M i wsp. Acetylcholinesterase inhibitors from plants. Phytomedicine 2007; 14:289-300. 11. http://www.sopharma.pl/nivalin.htm 12. Das A, Shanker G, Nath C i wsp. A comparative study in rodents of standardized extracts of Bacopa monniera and Ginkgo biloba. Anticholinesterase and cognitive enhancing activities. Pharmacol Biochem Behav 2002; 73:893-900. 13. Wettstein A. Cholinesterase inhibitors and Gingko extracts - are they comparable in the treatment of dementia? Comparison of published placebo-controlled efficacy studies of at least six months´ duration. Phytomedicine 2000; 6:393-401. 14. Perry EK, Pickering AT, Wang WW i wsp. Medicinal plants and Alzheimer´s disease: from ethnobotany to phytotherapy. J Pharm Pharmacol 1999; 51:527-34. 15. Schulz V. Ginkgo extract or cholinesterase inhibitors in patients with dementia: what clinical trials and guidelines fail to consider. Phytomedicine 10 Suplement 2003; 4:74-9. 16. Akhondzadeh S, Noroozian M, Mohammadi M i wsp. Salvia officinalis extract in the treatment of patients with mild to moderate Alzheimer´s disease: a double blind, randomized and placebo-controlled trial. J Clin Pharm Therapeut 2003; 28:53-9. 17. Akhondzadeh S, Noroozian M, Mohammadi M i wsp. Melissa officinalis extract in the treatment of patients with mild to moderate Alzheimer´s disease: a double blind, randomised, placebo controlled trial. J Neurol Neurosurg Psychiatr 2003; 74:863-6. 18. Ahmad W, Ahmad B, Ahmad M i wsp. In vitro inhibition of acetylcholinesterase, butyrylcholinesterase and lipoxygenase by crude extract of Myricaria elegans Royle. Int J Biol Sci 2003; 3:1046-9. 19. Adsersen A, Gauguin B, Gudiksen L i wsp. Screening of plants used in Danish folk medicine to treat memory dysfunction for acetylcholinesterase inhibitory activity. J Ethnopharmacol 2006; 104:418-22. 20. Cho KM, Yoo ID, Kim WG. 8-hydroxydihydrochelerythrine and 8-hydroxydihydrosanguinarine with a potent acetylcholinesterase inhibitory activity from Chelidonium majus L. Biol Pharmacut Bull 2006; 29:2317-20. 21. Ingkaninan K, Temkitthawon P, Chuenchom K i wsp. Screening for acetylcholinesterase inhibitory activity in plants used in Thai traditional rejuvenating and neurotonic remedies. J Ethnopharmacol 2003; 89:261-4. 22. Lin HQ, Ho MT, Lau LS i wsp. Anti-acetylcholinesterase activities of traditional Chinese medicine for treating Alzheimer´s disease. Chem Biol Interact 2008; 175:352-4. 23. Oh MH, Houghton PJ, Whang WK i wsp. Screening of Korean herbal medicines used to improve cognitive function for anti-cholinesterase activity. Phytomedicine 2004; 11:544-8. 24. Orhan MH, Sener B, Choudhary MI i wsp. Acetylcholinesterase and butyrylcholinesterase inhibitory activity of some Turkish plants. J Ethnopharmacol 2004; 91:57-60. 25. Rollinger JM, Mocka P, Zidorn C i wsp. Application of the in combo screening approach for the discovery of non-alkaloid acetylcholinesterase inhibitors from Cichorium intybus. Curr Drug Discov Tech 2005; 3:185-93. 26. Eldeen IM, Elgorashi EE, van Staden J. Antibacterial, anti-inflammatory, anti-cholinesterase and mutagenic effects of extracts obtained from some trees used in South African traditional medicine. J Ethnopharmacol 2005; 102:457-64. 27. Hung TM, Na M, Tien Dat N. i wsp. Cholinesterase inhibitory and anti-amnesic activity of alkaloids from Corydalis turtschaninovii. J Ethnopharmacol 2008; 119:74-80. 28. Houghton PJ, Agbedahunsi JM, Adegbulugbe A. Choline esterase inhibitory properties of alkaloids from two Nigerian Crinum species. Phytochemistry 2006; 65:2893-6. 29. Ferreira A, Proenca C, Serralheiro ML i wsp. The in vitro screening for acetylcholinesterase inhibition and antioxidant activity of medicinal plants from Portugal. J Ethnopharmacol 2006; 108:31-7. 30. Perry N, Court G, Bidet N i wsp. European herbs with cholinergic activities: potential in dementia therapy. Int J Geriatr Psychiatr 1996; 11:1063-9. 31. Hillhouse BJ, Ming DS, French CJ i wsp. Acetylcholinesterase inhibitors in Rhodiola rosea. Pharmaceut Biol 2004; 42:68-72. 32. Orhan I, Aslan S, Kartal M i wsp. Inhibitory effect of Turkish Rosmarinus officinalis L. on acetylcholinesterase and butyrylcholinesterase enzymes. Food Chem 2008; 108:663-8. 33. Rauter AP, Branco I, Lopes RG i wsp. A new lupene triterpenetriol and anticholinesterase activity of Salvia sclareoides.Fitoterapia 2007; 78:474-81. 34. Savelev SU, Okello EJ, Perry EK. Butyryl- and acetylcholinesterase inhibitory activities in essential oils of Salvia species and their constituents. Phytother Res 2004; 18:315-24. 35. Wang R, Yan H, Tang XC. Progress in studies of huperzine A. Acta Pharmacol Sin 2006; 27:1-26. 36. Xiao XQ, Zhang HY, Tang XC. Huperzine A attenuates amyloid beta-peptide fragment 25-35-induced apoptosis in rat cortical neurons via inhibiting reactive oxygen species formation and caspase-3 activation. J Neurosci Res 2002; 67:30-6. 37. Lopez S, Bastida J, Viladomat F i wsp. Acetylcholinesterase inhibitory activity of some Amaryllidaceae alkaloids and Narcissus extracts. Life Sci 2002; 71:2521-9. 38. Khalid A, Zaheer-ul-Haq, Ghayur MN i wsp. Cholinesterase inhibitory and spasmolytic potential of steroidal alkaloids. J Steroid Biochem Mol Biol 2004; 92:477-84. 39. Ahmed E, Nawaz SA, Malik A i wsp. Isolation and cholinesterase-inhibition studies of sterols from Haloxylon recurvum.Bioorg Med Chem Lett 2006; 16:573-80. 40. Choudhary MI, Yousuf S, Nawaz SA i wsp. Cholinesterase inhibiting withanolides from Withania somnifera. Chem Pharmaceut Bull 2004; 52:1358-61. 41. Sung SH, Kang SY, Lee KY i wsp. (+)-Alpha-viniferin, a stilbene trimer from Caragana chamlague, inhibits acetylcholinesterase. Biol Pharmacet Bull 2002; 25:125-7. 42. Ferheen S, Ahmed E, Afza N i wsp. Haloxylines A and B, antifungal and cholinesterase inhibiting piperidine alkaloids from Haloxylon salicornicum. Chem Pharmaceut Bull 2005; 53:570-2. 43. Pan L, Tan JH, Hou JQ i wsp. Design, synthesis and evaluation of isaindigotone derivatives as acetylcholinesterase and butyrylcholinesterase inhibitors. Bioorg Med Chem Lett 2008; 18: 3790-3. 44. Atta-Ur-Rahman, Akhtar MN, Choudhary MI i wsp. New steroidal alkaloids from Fritillaria imperialis and their cholinesterase inhibiting activities. Chem Pharmaceut Bull 2002; 50:1013-16. 45. Atta-Ur-Rahman, Atia-Tul-Wahab, Nawaz SA i wsp. New cholinesterase inhibiting bisbenzylisoquinoline alkaloids from Cocculus pendulus. Chem Pharmaceut Bull 2004; 52:802-6. 46. Andrade MT, Lima JA, Pinto AC i wsp. Indole alkaloids from Tabernaemontana australis (Muell. Arg) Miers that inhibit acetylcholinesterase enzyme. Bioorg Med Chem 2005; 13:4092-5. 47. Kim DK. Inhibitory effect of corynoline isolated from the aerial parts of Corydalis incisa on the acetylcholinesterase. Archives of Pharmacol Research 2002; 25:817-9. 48. Elgorashi EE, Stafford GI, Van Staden J. Acetylcholinesterase enzyme inhibitory effects of amaryllidaceae alkaloids. Planta Med 2004; 70:260-2. 49. Kim DK, Lee KT, Baek NI i wsp. Acetylcholinesterase inhibitors from the aerial parts of Corydalis speciosa. Archives of Pharmacol Research 2004; 27:1127-31. 50. McGehee DS, Krasowski MD, Fung DL i wsp. Cholinesterase inhibition by potato glycoalkaloids slows mivacurium metabolism. Anesthesiol 2000; 93:510-19. 51. Rhee IK, Appels N, Luijendijk T i wsp. Determining acetylcholinesterase inhibitory activity in plant extracts using a fluorimetric flow assay. Phytochemical Analysis 2003; 14:145-9. 52. Ren Y, Houghton PJ, Hider RC, Howes MJ. Novel diterpenoid acetylcholinesterase inhibitors from Salvia miltiorhiza. Planta Med 2004; 70: 201-4. 53. Ahmad VU, Khan A, Farooq U i wsp. Three new cholinesterase-inhibiting cis-clerodane diterpenoids from Otostegia limbata. Chem Pharm Bull 2005; 53:378-81. 54. Orhan I, Terzioglu S, Sener B. Alpha-onocerin: an acetylcholinesterase inhibitor from Lycopodium clavatum. Planta Med 2003; 69:265-7. 55. Chung YK, Heo HJ, Kim EK i wsp. Inhibitory effect of ursolic acid purified from Origanum majorana L. on the acetylcholinesterase. Mol and Cell 2001; 11:137-43. 56. Urbain A, Marston A, Queiroz EF i wsp. Xanthones from Gentiana campestris as new acetylcholinesterase inhibitors. Planta Med 2004; 70:1011-14. 57. Kang SY, Lee KY, Sung SH i wsp. Coumarins isolated from Angelica gigas inhibit acetylcholinesterase: structure-activity relationships. J Nat Prod 2001; 64:683-5. 58. Ahmad I, Anis I, Malik A i wsp. Cholinesterase inhibitory constituents from Onosma hispida. Chem Pharmaceut Bull 2003; 51:412-4. 59. Oinonen PP, Jokela JK, Hatakka AI i wsp. Linarin, a selective acetylcholinesterase inhibitor from Mentha arvensis. Fitoterapia 2006; 77:429-34. 60. Choudhary MI, Azizuddin, Khalid A i wsp. A new coumarin from Murraya paniculata. Planta Med 2002; 68:81-3.


