© Borgis - Postępy Nauk Medycznych 5/2007, s. 180-185
*Andrzej Więcek, Jerzy Chudek, Teresa Nieszporek
Perspektywy leczenia niedokrwistości nerkopochodnej – nowe koncepcje, nowe preparaty
Perspectives in the treatment of renal anemia – new concepts and new drugs
Katedra i Klinika Nefrologii Endokrynologii i Chorób Przemiany Materii Śląskiej Akademii Medycznej w Katowicach
Kierownik Katedry i Kliniki: prof. dr hab. med. Andrzej Więcek
Streszczenie
W latach 80-tych ubiegłego wieku rozpoczęto leczenie niedokrwistości nerkopochodnej spowodowanej niedoborem endogennej erytropoetyny przy pomocy epoetyn uzyskanych metodą rekombinacji genetycznej. Zastosowanie epoetyn było kamieniem milowym w leczeniu niedokrwistości u chorych z przewlekłą niewydolnością nerek. W ciągu ostatnich lat wytworzono wiele nowych czynników stymulujących erytropoezę, które mogą w najbliższej przyszłości znaleźć zastosowanie w leczeniu niedokrwistości towarzyszącej przewlekłym chorobom nerek.
Niektóre z tych nowych czynników powstały przez modyfikację sekwencji aminokwasowej cząsteczki erytropoetyny i przyłączenie dodatkowych reszt węglowodanowych, co pozwoliło na poprawę własności farmakokinetycznych tych leków (darbopoetyna i CERA) poprzez wydłużenie ich okresu półtrwania, w porównaniu do klasycznych epoetyn. Czynniki te mogą być podawane w dłuższych odstępach czasowych niż epoetyny i pozwalają na uzyskanie lepszej stabilności stężenia hemoglobiny we krwi.
W najbliższym czasie należy spodziewać się wprowadzenia czynników stymulujących erytropoezę, podawanych doustnie. Do tych nie-peptydowych leków należą inhibitory hydroksylazy prolilowej i inhibitory czynnika transkrypcyjnego GATA-2, których mechanizm działania polega na zwiększeniu wytwarzania endogennej erytropoetyny w resztkowym miąższu nerek oraz w wątrobie.
Summary
The management of anemia in patients with chronic kidney disease caused by endogenous erythropoietin deficiency was revolutionized in the late eighties of the last century by introduction of the recombinant human erythropoietin (epoetin). Recently several new erythropoiesis stimulating agents that may potentially improve in the near future management of anemia in patients with chronic kidney disease were synthesized.
Some of the new erythropoiesis stimulating agents were synthesised by modification of the aminoacide sequence of the EPO molecule and hyperglycosylation and therefore they have improved pharmakokinetics (darbopoietin or CERA) by prolongation of the serum elimination half-life compared to epoietins. These agents may be administrated less frequently with better stabilisation of blood hemoglobin concentration.
There are promising attempts to overcome the parenteral way of drug administration. Such non-peptide drugs acts as inhibitors of prolyl hydroxylase and GATA-2 transcription factor enhancing the endogenous EPO synthesis by the failure kidneys or liver.

Wprowadzenie
Począwszy od lat 80-tych ubiegłego wieku, w leczeniu niedokrwistości towarzyszącej przewlekłej niewydolności nerek stosowana jest erytropoetyna uzyskana metodą rekombinacji genetycznej (rHuEPO) (1). Obniżone stężenie hemoglobiny we krwi jest znanym czynikiem ryzyka powikłań sercowo-naczyniowych u chorych na przewlekłą chorobę nerek (PChN) (2). W latach 80-tych i 90-tych ubiegłego wieku, chorzy z przewlekłą niewydolnością nerek rozpoczynali leczenie rHuEPO jednocześnie z rozpoczęciem dializoterapii. U wielu z tych chorych występowały powikłania ze strony układu sercowo-naczyniowego częściowo związane z długotrwałą niedokrwistością. Aby uniknąć takich powikłań, należy zacząć leczenie niedokrwistości towarzyszącej PChN jeszcze przed rozpoczęciem leczenia nerkozastępczego. Takie postępowanie pozwala na zmniejszenie zarówno chorobowości jak i śmiertelności z powodu powikłań sercowo-naczyniowych (3). Zalecane docelowe stężenie hemoglobiny we krwi u chorych z PChN jest niższe niż stężenie hemoglobiny u osób zdrowych i identyczne dla obu płci, pomimo fizjologicznie wyższego stężenia hemoglobiny we krwi u mężczyzn. Zalecenia większości towarzystw naukowych dotyczące docelowego stężenia hemoglobiny we krwi u chorych na PChN leczonych w USA, Europie i Australii nie uległy istotnym zmianom od 1997 r. Zgodnie z zaleceniami europejskimi (European Best Practice Guidelines) stężenie hemoglobiny we krwi u chorych dializowanych powinno być wyższe od 11 g/dl (4). W myśl nowych zaleceń amerykańskich (National Kidney Foundation Guidelines) takie stężenie hemoglobiny we krwi również traktowane jest za dolną granicę zakresu docelowego. Jednocześnie w zaleceniach tych zwraca się uwagę, aby stężenie hemoglobiny we krwi nie przekroczyło 13.0g/dl (5). Normalizacja stężenia hemoglobiny we krwi nie jest zalecana nie tylko u chorych dializowanych (6), ale też u chorych z PChN nie wymagających jeszcze leczenia dializami. Wykazano bowiem, że takie postępowanie przynosi jedynie znamienną poprawę jakości życia, bez jednoczesnego zmniejszenia śmiertelności u chorych (badanie CREATE – Cardiovascular risk Reduction by Early Anaemia Treatment with Epoietin-β) (7), a nawet może zwiększać ryzyko wystąpienia udaru mózgu i zawału mięśnia sercowego (badanie CHOIR – Correction of Hemoglobin and Outcomes in Renal Insufficiency) (8). Po opublikowaniu wyników tych wieloośrodkowych badań nie można ustalić jednoznacznie górnej granicy stężenia hemoglobiny we krwi u chorych z PChN.
Endogenna erytropoetyna (EPO) jest białkiem wytwarzanym głównie w nerkach przez komórki okołocewkowe przypominające fibroblasty. Głównym czynnikiem stymulującym wydzielanie EPO jest niedobór tlenu, a zasadniczym fizjologicznym działaniem, stymulacja erytropoezy w szpiku kostnym. EPO po związaniu się z domeną pozakomórkową swoistego receptora zlokalizowanego na komórkach progenitorowych układu czerwonokrwinkowego (głównie CFU-E, w mniejszym stopniu na BFU-E i normoblastach) zapobiega ich apoptozie zwiększając powstawanie młodych erytrocytów.
Receptor dla EPO po przyłączeniu agonisty ulega dimeryzacji, a jego konformacja zmienia się (9) (ryc. 1). Pod wpływem tych zmian białko JAK2 ulega autofosforylacji, a następnie fosforyluje receptor dla EPO oraz białko STAT, które po przemieszczeniu do jądra komórkowego aktywuje transkrypcję genów docelowych. Mechanizmem wygaszającym pobudzenie kaskady sygnałowej receptora dla EPO jest defosforylacja białka JAK2 przez fosfatazę komórek hematopoetycznych (HCP).
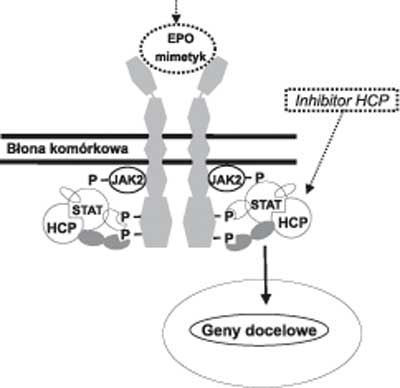
Ryc. 1. Szlak wewnątrzkomórkowego przekazywania sygnału pobudzenia receptora dla EPO oraz mechanizm działania EPO-mimetyków.
Obecnie na skalę przemysłową wytwarzane są cztery izoformy ludzkiej rekombinowanej erytropoetyny: epoetin-α (Eprex(r), Procrit(r)), epoetin-β (NeoRecormon(r)), epoetin-ω (Epomax(r)) i epoetin-δ (Dynepo(r)). Te glikoproteiny są wytwarzane przez zmodyfikowane genetycznie klony komórek jajnika chomika chińskiego (epoetin-α i epoetin-β), noworodkowych komórek nerkowych chomika (epoetin-ω) lub komórek ludzkich (epoetin-δ). Glikoproteiny te różnią się między sobą miejscami przyłączenia reszt węglowodanowych i właściwościami farmakokinetycznymi (epoetin-β charakteryzuje się dłuższym czasem półtrwania), jednak ich skuteczność w leczeniu niedokrwistości u chorych z niewydolnością nerek jest niemal identyczna.
Dalsze modyfikacje struktury erytropoetyny poprzez przyłączenie dodatkowych reszt węglowodanowych oraz zmianę sekwencji aminokwasowej doprowadziły do powstania darbepoetyny alfa, Ciągłego Aktywatora Receptora Erytropoetynowego (CERA – Continuous Erythropoietin Receptor Activator) oraz Syntetycznych Białek Erytropoetycznych (SEP – Synthetic Erythropoiesis Protein), glikoprotein o znacznie dłuższym okresie półtrwania.
W ostatnich latach podjęto również próby dla uzyskania białek o większej aktywności hematopoetycznej niż EPO tworząc dimeryczne białka fuzyjne (np. EPO-EPO) i syntetyczne polipeptydy sprzężone z glikolem polietylenowym, takie jak Hematide (AF37702). Wyższa aktywność biologiczna tych dimerów jest następstwem łatwiejszej dimeryzacji receptora dla EPO. Jednak modyfikacje te nie umożliwiły zmiany parenteralnej drogi podaży potencjalnego nowego leku.
Ostatnio, pojawiła się nowa koncepcja leczenia niedokrwistości nerkopochodnej polegająca na stymulacji wydzielania endogennej EPO przez resztkowy miąższ nerek i przez wątrobę. Wykryto, że inhibitor hydroksylazy prolilowej, enzymu katalizującego hydroksylację HIF, nasila endogenną syntezę EPO. Wraz z odkryciem tego inhibitora o niepeptydowej strukturze narodziła się nadzieja na wytworzenie leku podawanego doustnie.
W najbliższych latach niektóre firmy farmaceutyczne stracą wyłączność na wytwarzanie wielu zarejestrowanych biofarmaceutyków, w tym erytropoetyny. Licencja na wytwarzanie epoietin alfa wygasła w Europie w 2004 r. i w związku z tym pojawiły się na rynku nowe odmiany tego leku, wykazujące dużą zgodność biologiczną z pierwowzorem, czyli tzw. „biosimilarytyki” (10). Produkcja biozgodnych peptydów jest znacznie bardziej złożona niż typowych leków generycznych. Takie biozgodne, heterogenne peptydy wytwarzane są zwykle w inny sposób niż leki oryginalne i w związku z tym własności farmakodynamiczne i efektywność kliniczna takich preparatów może się różnić. Nawet niewielkie różnice mogą przyczynić się do wystąpienia istotnych powikłań [np. wytworzenie przeciwciał antyerytropoetynowych grozi powstaniem czerwonokrwinkowej aplazji szpiku kostnego (PRCA)]. W ubiegłych latach stwierdzono, że niewielkie zmiany w procesie technologicznym konfekcjonowania erytropoetyny alfa przyczyniły się do zmiany immunogenności niektórych epoetyn (przede wszystkim dotyczyło to preparatu Eprex) i wytwarzania przeciwciał przeciw erytropoetynie z następowym PRCA. Jak wynika z dotychczasowych doświadczeń wymagania stawiane biosymilarykom przed dopuszczeniem do stosowania u ludzi są znacznie większe niż tylko potwierdzenie ich biorównoważności farmakokinetycznej. Dotychczas nie ustalono jednak jednoznacznych i jednolitych wymagań stawianych przed dopuszczeniem takich leków do stosowania u chorych. Niezbędnym warunkiem otrzymania zgody na wytwarzanie biozgodnej erytropoetyny przez firmy farmaceutyczne będzie przeprowadzenie odpowiednich badań klinicznych oraz prowadzenie ścisłego nadzoru występowania działań niepożądanych po wprowadzeniu leku na rynek (11). Z tych powodów niektóre firmy farmaceutyczne zrezygnowały z dalszych badań nad biosymilarykami erytropoetyny i wprowadzania tych preparatów do praktyki klinicznej. Biosymilaryki erytropoetyny stosowane są obecnie w takich krajach jak Chiny, Indie, Korea i Kuba a aktywność biologiczna tych preparatów wykazuje dużą zmienność (12).
Nowe peptydy stymulujące erytropoezę – NESP (Darbepoetyna alfa)
Modyfikacja cząsteczki erytropoetyny przez przyłączenie dodatkowych reszt kwasu sialowego doprowadziła do wydłużenia czasu póltrwania w surowicy . Na tej podstawie stworzono darbepoetynę alfa, która w przeciwieństwie do natywnej cząsteczki EPO zawiera nie trzy, ale pięć reszt węglowodanowych (13, 14). Struktura aminokwasowa EPO została zmodyfikowana w 5 miejscach (Ala30Asn, His32Thr, Pro87Val, Trn88Asn i Pro90Thr), w celu przyłączenia dodatkowych reszt węglowodanowych do cząsteczek asparaginy w pozycji 30 i 88 (13, 14). Darbepoetyna alfa przyłącza się do receptora dla EPO tak jak natywna, nie zmieniona cząsteczka EPO. Profil farmakokinetyczny tej glikoproteiny jest jednak odmienny. Eliminacja darbepoetyny alfa z krążenia jest wolniejsza, a czas półtrwania 3-krotnie dłuższy (25,3 vs 8,5 godziny po podaniu dożylnym u chorych hemodializowanych) (13, 14). Podanie podskórne wydłuża czas półtrwania nawet do 48,4 godzin (13) (tab. 1).
Tabela 1. Czas póltrwania (godziny) epoetyn, darbepoetyny alfa oraz CERA po podaniu dożylnym i podskórnym (14, 20, 22).
| Preparat | Droga podania |
| dożylna | podskórna |
| Epoetyna alfa | 6,8 ? 0,6 | 19,4 ? 2,5 |
| Epoetyna beta | 8,8 ? 0,5 | 24,2 ? 2,6 |
| Epoetyna omega | nie określono | nie określono |
| Darbepoetyna alfa | 25,3 ? 2,2 | 48,8 ? 5,2 |
| CERA | 133 ? 10 | 137 ? 22 |
średnie ± SEM
Dłuższy czas półtrwania darbepoetyny alfa pozwala na podawanie tego leku w dłuższych odstępach czasowych w porównaniu z epoetynami. Darbepoetynę alfa można podawać raz w tygodniu, a nawet co drugi tydzień w początkowym okresie leczenia niedokrwistości, a następnie raz na 3-4 tygodnie w celu utrzymania stabilnego stężenia hemoglobiny we krwi (15).
Darbepoetyna alfa wykazuje podobną skuteczność, jak epoetyny w leczeniu niedokrwistości towarzyszącej przewlekłym chorobom nerek (16). Lek ten jest stosowany w praktyce klinicznej od 2002 r., a koszt terapii wydaje się być zbliżony do nakładów ponoszonych na zakup epoetyn (16).
Poza jednym opisanym w piśmiennictwie przypadkiem zespołu PRCA u chorego leczonego darbepoetyną alfa nie obserwowano powstawania przeciwciał anty-erytropoetynowych przy stosowaniu tego leku (17).
Syntetyczne Białka Erytropoetyczne (SEP)
Kochendoerfer i wsp. opisali 166-aminokwasowy polipeptyd o sekwencji zbliżonej do EPO, wyróżniający się przyłączonymi do głównego łańcucha dwoma rozgałęzionymi peptydami, których celem było zwiększenie ładunku ujemnego cząsteczki i w konsekwencji przedłużenie czasu półtrwania in vivo (18). Aktywność biologiczna tego białka – SEP jest większa od aktywności epoetyny alfa dzięki 2-krotnie dłuższemu czasowi półtrwania (18). Jednak czas półtrwania SEP jest krótszy w porównaniu z darbepoetyną alfa (18), co zmniejsza szanse na wprowadzenie tego czynnika stymulującego erytropoezę do praktyki klinicznej.
Ciągły Aktywator Receptora Erytropoetynowego (CERA)
CERA jest nowym czynnikiem stymulującym erytropoezę (syntetyczny polipeptyd sprzężony z metoksy-polietyleno-glikobursztynylo-butylowym kwasem). Ostatnio zakończono wieloośrodkowe badania przedkliniczne (faza III). Cztery badania I fazy wykazały, że CERA w sposób zależny od dawki pobudza erytropoezę i charakteryzuje się znacznie dłuższym od darbepoetyny alfa czasem półtrwania (19). Po podaniu dożylnym jak i podskórnym czas półtrwania dla CERA wynosi około 130 godzin (20) (tab. 1). Taki profil farmakokinetyczny CERA umożliwi podawanie tego leku w dłuższych niż dla darbepoetyny alfa odstępach czasu. Dotychczas wykazano, że podobny wzrost stężenia hemoglobiny we krwi uzyskuje się podając CERA jeden raz w tygodniu i raz na 3 tygodnie (21).
Białka fuzyjne
Koncepcja stworzenia białka fuzyjnego pobudzającego receptor dla EPO wiąże się z jego dimeryzacją po przyłączeniu agonisty, jako procesu niezbędnego dla aktywacji szlaku wewnątrzkomórkowego (22). Białka fuzyjne zbudowane są z 2 fragmentów polipeptydowych o dużym powinowactwie do receptora dla EPO oraz peptydu łączącego (23).
Dimeryczne białko EPO-EPO z 6-aminokwasowym peptydem łączącym uzyskane metodą rekombinacji DNA posiada zbliżony do natywnego EPO profil farmakokinetyczny oraz 3-4 krotnie wyższą aktywność biologiczną (24).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Eschbach J.W., i wsp.: The anemia of chronic renal failure: pathophysiology and effects of recombinant erythropoietin. Contrib. Nephrol., 1990; 78: 24-36.
2. Eckardt K.U.: Managing a fatefull alliance: anaemia and cardiovascular outcomes. Nephrol. Dial. Transplant., 2005, (Suppl. 6) vi16-vi20.
3. Xue J.L., i wsp.: Anemia treatment in the pre-ESRD period and associated mortality in elderly pateints Am. J. Kidney Dis., 2002, 40, 1153-1161.
4. Locatelli F., i wsp.: Anaemia in hemodialysis patients of five European countries: association with morbidity and mortality in the Dialysis outcomes and Practice patterns Study (DOPPS) Nephrol. Dial. Transplant., 2004, 19 (Suppl. 2) 1-43.
5. Clinical practice guidelines and clinical practice recommendations for anemia in chronic kidney disease in adults. Am. J. Kidney Dis., 2006, 47 (Suppl. 3) S16-S85.
6. Besarab A., i wsp.: The effects of normals compared with low hematocrit values in patients with cardiac disease who are receiving hemodialysis and epoietin. N. Engl. J. Med., 1998, 339, 584-590.
7. Druecke T.B., i wsp.: Normalisation of hemoglobin level in patients with chronic kidney disease and anemia. N. Engl. J. Med., 2006, 355, 2071-2084.
8. Singh A.K., i wsp.: Correction of anemia with epoietin-alfa in chronic kidney disease N. Engl. J. Med., 2006, 355,2085-2089.
9. Watowich S.S.: Activation of erythropoietin signaling by receptor dimerization. Int. J. Biochem. Cell Biol., 1999; 31: 1075-1088.
10. Schellekens H.: Follow on biologics: challenges of the "next generation” Nephrol. Dial. Transplant., 2005, 20 (Suppl. 4) iv31-iv36.
11. Więcek A., Mikhail A.: European regulatory guidelines for biosimilars. Nephrol. Dial. Transplant., 2006, 21 (Suppl. 5) v17-v20.
12. Macdougall I.C.: Recent advances in erythropoietin agents in renal anemia. Semin. Nephrol., 2006, 26, 313-318.
13 Macdougall I.C.: Novel erythropoiesis stimulating protein. Semin. Nephrol., 2000; 20: 375-381.
14. Nissenson A.R.: Novel erythropoiesis stimulating protein for managing the anemia of chronic kidney disease. Am. J. Kidney Dis., 2001; 38: 1390-1397.
15. Jadoul M., i wsp.: Darbepoetin alfa administered once monthly maintains haemoglobin levels in stable dialysis patients. Nephrol. Dial. Transplant., 2004; 19: 898-903.
16. Morreale A., i wsp.: Clinical and economic comparison of epoetin alfa and darbepoetin alfa. Curr. Med. Res. Opin., 2004; 20: 381-395.
17. Jacob A., i wsp.: Antibody-mediated pure red cell aplasia in a dialysis patient receiving darbepoetin alfa as the sole erythropoietic agent. Nephrol. Dial. Transplant., 2006, 21, 2963-2965.
18. Kochendoerfer G.G., i wsp.: Design and chemical synthesis of a homogeneous polymer-modified erythropoiesis protein. Science 2003; 299: 884-887.
19. Macdougall J.C., i wsp.: Pharmacokinetics and pharmakodynamics of intravenous and subcutaneus continuous erythropoietin receptor activator (C.E.R.A.) in patients with chronic kidney disease. J. Am. Soc. Nephrol., 2006, 1, 1211-1215.
20. Haselbeck A., i wsp.: The discovery and characterization of CERA (Continuous Erythropoietin Receptor Activator), an innovative agent for the treatment of anemia. Blood 2002, 100, 227A.
21. Locatelli F., i wsp.: CERA (Continuous Erythropoietin Receptor Activator) maintains hemoglobin levels in dialysis patents when administered subcutaneously up to once every 4 weeks J. Am. Soc. Nephrol., 2005, 15, 543A.
22. Fisher J.W.: Erythropoietin, physiology and pharmacology update. Exp. Biol. Med., 2003; 228: 1-14.
23. Sytkowski A.J., i wsp.: An erythropoietin fusion protein comprised of identical repeating domains exhibits enhanced biological properties. J. Biol. Chem., 1999; 274: 24773-24778.
24. Dalle B., i wsp.: Dimeric erythropoietin fusion protein with enhanced erythropoietic activity in vitro and in vivo. Blood 2001; 97: 3776-3782.
25. Coscarella A., i wsp.: Pharmacokinetic and immunogenic behavior of three recombinant human GM-CSF-EPO hybrid proteins in cynomolgus monkeys. Mol. Biotechnol., 1998; 10: 115-122.
26. Dumont J.A., i wsp.: Delivery of an erythropoietin-Fc fusion protein by inhalation in humans through an immunoglobuline transport pathway J. Aerosol. Med., 2005 Fall, 18, 294-303.
27. Barbone F.P., i wsp.: New epoetin molecules and novel therapeutic approaches. Nephrol. Dial. Transplant., 1999; 14, (Suppl. 2): 80-84.
28. Wrighton N.C., i wsp.: Small peptides as potent mimetics of the protein hormone erythropoietin. Science 1996; 273: 458-464.
29. Johnson D.L., i wsp.: Amino-terminal dimerization of an erythropoietin mimetic peptide results in increased erythropoietic activity. Chem. Biol., 1997; 4: 939-950.
30. www.affymax.com.
31. Lee J.W., i wsp.: Hypoxia-inducible factor (HIF-1) alpha, its protein stability and biological functions. Exp. Mol. Med., 2004; 36: 1-12.
32. Groulx I., Lee S.: Oxygen-dependent ubiquitination and degradation of hypoxia-inducible factor requires nuclear-cytoplasmic trafficking of the von Hippel-Lindau tumor suppressor protein. Mol. Cell. Biol., 2002; 22: 5319-5336.
33. Zimmer M., i wsp.: Inhibition of hypoxia-inducible factor is sufficient for growth suppression of VHL-/- tumors. Mol. Cancer. Res., 2004; 2: 89-95.
34. Liu C., i wsp.: Suppression of the dual-specificity phosphatase MKP-1 enhances HIF-1 trans-activation and increases expression of EPO. Biochem. Biophys. Res. Commun., 2003; 312: 780-786.
35. Masson N., Ratcliffe P.J.: HIF prolyl and asparaginyl hydroxylases in the biological response to intracellular O(2) levels. J. Cell. Sci., 2003; 116: 3041-3049.
36. Urquilla P., i wsp.: Upregulation of endogenous erythropoietin (EPO) in healthy subjects by inhibition of hypoxia inducible factor (HIF) prolyl hydroxylase. J. Am. Soc. Nephrol., 2004, 15, 546A.
37. Langsetmo I., i wsp.: Effect of FG-2216 on anaemia and iron transport in rat model of anemia of chronic disease. J. Am. Soc. Nephrol., 2005,15, 548A.
38. Więcek A., i wsp.: Pharmacological stabilization of HIF increases hemoglobin concentration in anemic patients with chronic kidney disease.Nephrol. Dial. Transplant., 2005, 20 (Suppl. 5) v195.
39. La Ferla K., i wsp.: Inhibition of erythropoietin gene expression signaling involves the transcription factors GATA-2 and NF-kappaB FASEB J., 2002, 16, 1811-1813.
40. Imagawa S., i wsp.: A GATA-specific inhibitor (K-7174 rescues anemia induced by Il-1β, TNFα or L-NMMA. FASEB J., 2003, 17,1742-1744.
41. Nakano Y., i wsp.: Oral administration of K-11706 inhibits GATA binding activity, enhances hypoxia-inducible factor 1 binding activity, and restores indicators in an in vivo mouse model of anemia of chronic disease. Blood 2004, 104, 4300-4307.

