© Borgis - Postępy Nauk Medycznych 5/2007, s. 186-191
Marcin Adamczak, *Andrzej Więcek
Zmiany morfologiczne w kłębuszkach nerkowych w przewlekłej chorobie nerek – czy mogą być odwracalne?
Glomerular lesions in chronic kidney disease – are they reversible?
Katedra i Klinika Nefrologii, Endokrynologii i Chorób Przemiany Materii Śląskiej Akademii Medycznej w Katowicach
Kierownik Katedry i Kliniki: prof. dr hab. med. Andrzej Więcek
Streszczenie
Liczne badania przeprowadzone w ostatnich trzech dekadach pozwoliły na poznanie patomechanizmów uczestniczących w progresji przewlekłej choroby nerek. Wyniki badań klinicznych wykazały, że leki blokujące układ renina-angiotensyna istotnie zwalniają postęp przewlekłej choroby nerek. Stwierdzenie, w badaniach eksperymentalnych jak i w nielicznych badaniach klinicznych, że możliwe jest nie tylko zahamowanie postępu przewlekłej nefropatii, ale również regresja występujących już zmian otwiera nowe, fascynujące perspektywy w badaniach nad patogenezą i leczeniem chorób nerek. Wyniki tych badań mogą w przyszłości poprawić niekorzystne jak dotąd rokowanie u chorych na przewlekłe choroby nerek.
Summary
In the last three decades the pathogenesis of progressive kidney diseases has been essentially elucidated. Several clinical studies showed that blockade of the renin angiotensin system halts the progression of chronic nephropathies. In recent years it was shown in the experimental studies and in the some preliminary clinical studies and case reports that it is possible not only to inhibit the progression but also to achieve partial regression of glomerular lesions in some chronic nephropathies. Results of these studies may extend the horizons concerning the pathogenesis and treatment of chronic kidney disease and finally improve the sad outcome.

Wstęp
Wzrost zachorowania na przewlekłą chorobę nerek (PChN) i w następstwie tego wzrost liczby chorych leczonych metodami nerkozastępczymi jest obecnie jednym z głównych problemów zdrowotnych rozwiniętych społeczeństw. U człowieka kłębuszki nerkowe powstają jedynie w początkowej fazie rozwoju osobniczego tj. w okresie życia płodowego. Po urodzeniu nowe kłębuszki nerkowe nie mogą być już wytworzone. Dlatego też nerki są narządem o bardzo ograniczonych możliwościach regeneracyjnych. Nie leczona PChN ma charakter nieodwracalny i postępujący, prowadząc nieuchronnie do niewydolności tego narządu. Postęp PChN zachodzi również wtedy, gdy pierwotny czynnik sprawczy procesu chorobowego już nie jest aktywny. Uważa się, że mechanizmy prowadzące do progresji PChN w dużej mierze nie zależą już od pierwotnego czynnika etiologicznego, lecz są wyrazem nieprawidłowej adaptacji (hemodynamicznej i związanej z przerostem kłębuszków nerkowych) pozostałych czynnych nefronów. U nie leczonych chorych na PChN stwierdzono, że zależność pomiędzy odwrotnością stężenia kreatyniny w surowicy (odzwierciedlającej wielkość filtracji kłębuszkowej), a czasem obserwacji chorego ma charakter liniowy (1, 2). Pozwala to przewidzieć czas, w którym u danego chorego, jeżeli nie zastosuje się leczenia nefroprotekcyjnego, wystąpi schyłkowa niewydolność nerek (1, 2). Liczne badania przeprowadzone w ostatnich trzech dekadach umożliwiły poznanie mechanizmów patogenetycznych progresji PChN. Mechanizmy te są bardzo złożone (ryc. 1) (3, 4). Angiotensyna II odgrywa kluczową rolę w patogenezie postępu niewydolności nerek poprzez zarówno mechanizmy hemodynamiczne tj. związane z podwyższeniem ciśnienia obwodowego i wewnątrzkłębuszkowego, jak i niehemodynamiczne (4). W wielu badaniach eksperymentalnych wykazano, że leki blokujące układ renina-angiotensyna (RA), zwalniają procesy szkliwienia i bliznowacenia kłębuszków nerkowych (5, 6). Postęp w zakresie poznania mechanizmów progresji chorób nerek pozwolił na przeprowadzenie badań klinicznych u chorych na PChN. W badaniach tych wykazano, że farmakologiczne zahamowanie układu RA prowadzi do zwolnienia szybkości progresji PChN (tab. 1) (7-13). Pozostaje jednak pytanie, czy możliwe jest nie tylko zahamowanie postępu przewlekłej nefropatii, ale również regresja występujących zmian.
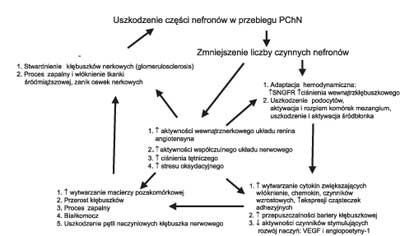
Ryc. 1. Mechanizmy progresji przewlekłej choroby nerek (PChN).
SNGFR – przesączanie kłębuszkowe w pojedynczym nefronie; VEGF – czynnik wzrostowy śródbłonka naczyń krwionośnych.
Tabela 1. Farmakologiczne zahamowanie aktywności układu renina-angiotensyna zwalnia postęp nefropatii. Na podstawie danych z prac: Maschio G. i wsp., N. Engl. J. Med., 1996, 334, 939-945.; The GISEN Group (Gruppo Italiano di Studi Epidemiologici in Nefrologia) Lancet 1997, 349, 1857-1863.; Lewis E.J., i wsp. N. Engl. J. Med., 1993, 329, 1456-1462.; Lewis E.J., i wsp. N. Engl. J. Med., 2001, 345, 851-860.; Brenner B.M., i wsp., N. Engl. J. Med., 2001, 345, 861-869.
| Nazwa badania | AIPRI | REIN | Lewis i wsp. | IDNT | RENAAL |
| Badana grupa chorych na PChN | Różne nefropatie | Nefropatie u chorych bez cukrzycy | Nefropatia u chorych na cukrzycę typu 1 | Nefropatia u chorych na cukrzycę typu 2 | Nefropatia u chorych na cukrzycę typu 2 |
| Czas badania (lata) | 3,0 | 2,2 | 3,0 | 2,6 | 4,5 |
| Badany lek (dobowa dawka) | Benazepryl
(10 mg) | Ramipryl
(1,25-5 mg) | Kaptopryl
(75 mg) | Irbesartan
(300 mg) | Losartan
(50-100 mg) |
| Względne ryzyko wystąpienia schyłkowej niewydolności nerek w grupie badanej (odsetek zmniejszenia ryzyka) | 0,89
(11%) | 0,51
(49%) | 0,50
(50%) | 0,83
(17%) | 0,75
(25%) |
| Względne ryzyko podwojenia kreatyninemii w grupie badanej (odsetek zmniejszenia ryzyka) | 0,44
(56%) | 0,47
(53%) | 0,48
(52%) | 0,71
(29%) | 0,72
(28%) |
Badania doświadczalne na zwierzętach
Przed wieloma dekadami wykazano, że stwardnienie kłębuszków nerkowych wywołane ich szkliwieniem i bliznowaceniem jest morfologicznym wykładnikiem niewydolności nerek. Na obraz stwardnienia kłębuszków nerkowych (ang. glomerulosclerosis) składa się: a) obliteracja części pętli naczyniowych kłębuszka i b) zwiększenie objętości macierzy komórkowej. Jednym z modeli doświadczalnych PChN, w którym dochodzi do rozwoju stwardnienia kłębuszków nerkowych są szczury poddane subtotalnej nefrektomii tj. usunięciu 5/6 masy nerek.
W roku 1991 Ikoma i wsp. opublikowali wyniki badań doświadczalnych u szczurów poddanych subtotalnej nefrektomii, u których zastosowano inhibitor enzymu konwertującego (IACE) i stwierdzono częściową regresję zmian w kłębuszkach nerkowych. W eksperymencie tym szczury poddane subtotalnej nefrektomii obserwowano początkowo przez 8 tygodni (14). Następnie, po wykonaniu otwartej biopsji nerki, szczurom podawano IACE – enalapryl w dawkach 12 mg/kg m.c. (dawka wystarczająca do osiągnięcia największego możliwego efektu przeciwnadciśnieniowego) i 48 mg/kg m.c. Ciśnienie tętnicze uległo normalizacji podczas podawania zarówno enalaprylu w dawce 12 mg/kg m.c., jak i 48 mg/kg m.c. Po 4 tygodniach takiej interwencji farmakologicznej ponownie wykonano biopsję nerki stwierdzając, u zwierząt, którym podawano bardzo wysokie dawki enalaprylu tj. 48 mg/kg m.c. częściową regresję zmian w kłębuszkach nerkowych. Takiej regresji nie obserwowano w grupie zwierząt którym podawano enalapryl w dawce 12 mg/kg m.c. (14). Wyniki tego badania zostały poddane jednak istotnej krytyce z powodu zastosowania do badań morfologicznych materiału pobranego przy pomocy powtarzanych biopsji nerek, co umożliwiało uzyskanie jedynie niewielkich niewystandaryzowanych próbek nerki. Materiał ten był pobierany bez odpowiednio kontrolowanej perfuzji tkanek. Wybór takiej metody badawczej uniemożliwiał uzyskanie ilościowych danych dotyczących geometrii kłębuszków nerkowych jak i ich składu komórkowego. Ponadto jedynym ocenianym parametrem był wskaźnik stwardnienia kłębuszków nerkowych, który nie jest wskaźnikiem w pełni obiektywnym.
Adamczak i wsp. przeprowadzili badanie, które było pozbawione w/w ograniczeń (15, 16). W badaniu tym szczury Sprague-Dawley, poddano subtotalnej nefrektomii (SNX) lub operacji rzekomej tj. zabiegowi polegającemu jedynie na przecięciu powłok, odsłonięciu nerek i zaszyciu powłok (GK). Część szczurów poddanych subtotalnej nefrektomii i grupy kontrolnej obserwowano jedynie przez 8 tygodni. Innym grupom zwierząt poddanych subtotalnej nefrektomii jak i tworzącym grupę kontrolną podawano enalapryl w dawce 48 mg/kg m.c. przez 4 tygodnie. Pozostałe grupy szczurów pozostawiono przez cały czas badania (12 tygodnie) bez interwencji farmakologicznej. Szczury karmiono z użyciem protokołu pair-feeding tj. grupy SNX otrzymywały dokładnie tyle samo pokarmu co zwierzęta w grupach kontrolnych, poddane operacji rzekomej. Materiał do badań morfologicznych pobierano przy użyciu wstecznej aortalnej perfuzji nerek wykonanej pod kontrolą ciśnienia perfuzyjnego. Jak to przedstawiono na rycinach 2 i 3 zwierzęta, którym podawano bardzo wysokie dawki enalaprylu tj. 48 mg/kg m.c. charakteryzowały się znamiennie niższym wskaźnikiem stwardnienia kłębuszków nerkowych (GSI) jak i niższą średnią objętością kłębuszków nerkowych w porównaniu do zwierząt, którym nie podawano enalaprylu. Co więcej GSI jak i średnia objętość kłębuszków nerkowych były znamiennie niższe u zwierząt, którym podawano bardzo wysokie dawki enalaprylu w porównaniu do grupy zwierząt poddanych autopsji przed taką interwencją farmakologiczną (tj. w 8 tygodniu). Wyniki tych badań sugerują częściową regresję uprzednio powstałych zmian w kłębuszkach nerkowych (15). Procesowi częściowej regresji stwardnienia kłębuszków nerkowych towarzyszyło zmniejszenie względnej objętości macierzy mezangium, zmniejszenie liczby komórek śródbłonka i komórek w mezangium, bez istotnych zmian liczby podocytów. W badaniu tym oceniano również w sposób ilościowy mikroarchitekturę naczyń kłębuszków nerkowych (16). Stwierdzono, że w przeroście kłębuszków nerkowych, podczas progresji zmian morfologicznych, dochodzi również do wzrostu liczby naczyń śródkłębuszkowych. Proces regresji tych zmian przebiegał natomiast ze zmniejszeniem liczby naczyń w kłębuszkach nerkowych. Zarówno w trakcie progresji jak i regresji zmian morfologicznych nie dochodziło do zmian geometrii jak i składu komórkowego pojedynczych naczyń (16).
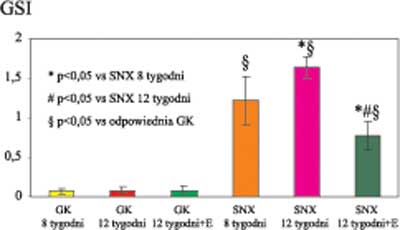
Ryc. 2. Wskaźnik stwardnienia kłębuszków nerkowych (GSI) u szczurów Sprague-Dawley, które poddano subtotalnej nefrektomii (SNX) lub operacji rzekomej tj. zabiegowi polegającemu jedynie na przecięciu powłok, odsłonięciu nerek i zaszyciu powłok (GK). Część szczurów poddanych subtotalnej nefrektomii w grupie kontrolnej obserwowano jedynie przez 8 tygodni. Innym zwierzętom poddanym subtotalnej nefrektomii jak i tworzącym grupę kontrolną podawano enalapryl w dawce 48 mg/kg m.c. przez 4 tygodnie (E). Pozostałe grupy szczurów pozostawiono przez cały czas badania (12 tygodnie) bez takiej interwencji farmakologicznej. Na podstawie danych z pracy: Adamczak M. i wsp. J Am Soc Nephrol 2003; 14: 2833-2842.

Ryc. 3. Średnia objętość kłębuszka nerkowego u szczurów Sprague-Dawley, które poddano subtotalnej nefrektomii (SNX) lub operacji rzekomej tj. zabiegowi polegającemu jedynie na przecięciu powłok, odsłonięciu nerek i zaszyciu powłok (GK). Część szczurów poddanych subtotalnej nefrektomii i grupy kontrolnej obserwowano jedynie przez 8 tygodni. Innym grupom zwierząt poddanych subtotalnej nefrektomii jak i tworzącym grupę kontrolną podawano enalapryl w dawce 48 mg/kg m.c. przez 4 tygodnie (E). Pozostałe grupy szczurów pozostawiono przez cały czas badania (12 tygodnie) bez takiej interwencji farmakologicznej. Na podstawie danych z pracy: Adamczak M. i wsp. J Am Soc Nephrol 2003;14:2833-2842.
Adamczak i wsp. wykazali w sposób ilościowy w modelu doświadczalnym, że możliwe jest przy zastosowaniu bardzo wysokich dawek IACE nie tylko zwolnienie postępu, ale również częściowa regresja już istniejącego stwardnienia kłębuszków nerkowych (15, 16).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Mitch W.E., i wsp.: A simple method of estimating progression of chronic renal failure. Lancet 1976; 7999: 1326-8.
2. Jones R.H., i wsp.: Progression of diabetic nephropathy. Lancet. 1979; 8126:1105-6.
3. Remuzzi G., i wsp.: Mechanisms of progression and regression of renal lesions of chronic nephropathies and diabetes. J. Clin. Invest., 2006; 116: 288-96.
4. Brenner B.M.: Remission of renal disease: recounting the challenge, acquiring the goal. J. Clin. Invest., 2002; 110: 1753-8.
5. Anderson S., i wsp.: Control of glomerular hypertension limits glomerular injury in rats with reduced renal mass. J. Clin. Invest., 1985; 76: 612-9.
6. Anderson S., i wsp.: Therapeutic advantage of converting enzyme inhibitors in arresting progressive renal disease associated with systemic hypertension in the rat. J. Clin. Invest., 1986; 77: 1993-2000.
7. Adamczak M., i wsp.: Kidney and hypertension. Kidney Int., 2002; 61: S62-7.
8. Lewis E.J., i wsp.: Collaborative Study Group. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N. Engl. J. Med., 2001; 345: 851-60.
9. Brenner B.M., i wsp.: RENAAL Study Investigators Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N. Engl. J. Med., 2001; 345:861-9.
10. Maschio G., i wsp.: The Angiotensin-Converting-Enzyme Inhibition in Progressive Renal Insufficiency Study Group. Effect of the angiotensin-converting-enzyme inhibitor benazepril on the progression of chronic renal insufficiency. N. Engl. J. Med., 1996; 334: 939-45.
11. Lewis E.J., i wsp.: The Collaborative Study Group. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. N. Engl. J. Med., 1993; 329: 1456-62.
12. The GISEN Group (Gruppo Italiano di Studi Epidemiologici in Nefrologia) Randomised placebo-controlled trial of effect of ramipril on decline in glomerular filtration rate and risk of terminal renal failure in proteinuric, non-diabetic nephropathy. Lancet 1997; 349: 1857-63.
13. Ruggenenti P., i wsp.: Renal function and requirement for dialysis in chronic nephropathy patients on long-term ramipril: REIN follow-up trial. Gruppo Italiano di Studi Epidemiologici in Nefrologia (GISEN). Ramipril Efficacy in Nephropathy. Lancet 1998; 352: 1252-6.
14. Ikoma M., i wsp.: Cause of variable therapeutic efficiency of angiotensin converting enzyme inhibitor on glomerular lesions. Kidney Int., 1991; 40: 195-202.
15. Adamczak M., i wsp.: Reversal of glomerulosclerosis after high dose enalapril treatment in subtotally nephrectomized rats. J. Am. Soc. Nephrol., 2003; 14: 2823-32.
16. Adamczak M., i wsp.: Reversal of glomerular lesions involves coordinated restructuring of glomerular microvasculature. J. Am. Soc. Nephrol., 2004; 15: 3063-82.
17. Ma L.J., i wsp.: Regression of glomerulosclerosis with high-dose angiotensin inhibition is linked to decreased plasminogen activator inhibitor-1. J. Am. Soc. Nephrol., 2005; 16: 966-76.
18. Remuzzi A., i wsp.: Effect of angiotensin II antagonism on the regression of kidney disease in the rat. Kidney Int., 2002; 62: 885-94.
19. Boffa J.J., i wsp.: Regression of renal vascular and glomerular fibrosis: role of angiotensin II receptor antagonism and matrix metalloproteinases. J. Am. Soc. Nephrol., 2003; 14: 1132-44.
20. Kang D.H., i wsp.: Impaired angiogenesis in the remnant kidney model: II. Vascular endothelial growth factor administration reduces renal fibrosis and stabilizes renal function. J. Am. Soc. Nephrol., 2001; 12: 1448-57.
21. Liang X.B., i wsp.: Angiotensin type 1 receptor blocker restores podocyte potential to promote glomerular endothelial cell growth. J. Am. Soc. Nephrol., 2006; 17: 1886-95.
22. Matsumoto K., i wsp.: Prevention of renal damage by angiotensin II blockade, accompanied by increased renal hepatocyte growth factor in experimental hypertensive rats. Hypertension 1999; 34: 279-84.
23. Boffa J.J., i wsp.: Regression of renal vascular fibrosis by endothelin receptor antagonism. Hypertension 2001; 37: 490-6.
24. Hruska K.A., i wsp.: Osteogenic protein-1 prevents renal fibrogenesis associated with ureteral obstruction. Am. J. Physiol. Renal. Physiol., 2000; 279 :F130-43.
25. Morrissey J., i wsp.: Bone morphogenetic protein-7 improves renal fibrosis and accelerates the return of renal function. J. Am. Soc. Nephrol., 2002; 13: S14-S21.
26. Cruzado J.M., i wsp.: Regression of advanced diabetic nephropathy by hepatocyte growth factor gene therapy in rats. Diabetes 2004; 53: 1119-27.
27. Abouna G.M., i wsp.: Reversal of diabetic nephropathy in human cadaveric kidneys after transplantation into non-diabetic recipients. Lancet 1983; 8362: 1274-6.
28. Fioretto P., i wsp.: Reversal of lesions of diabetic nephropathy after pancreas transplantation. N. Engl. J. Med., 1998; 339: 69-75.
29. Hotta O., i wsp.: Regression of IgA nephropathy: a repeat biopsy study. Am. J. Kidney Dis., 2002; 39: 493-502.



