© Borgis - Postępy Nauk Medycznych 1/2000, s. 46-49
Waldemar Urbanowicz
Rola wątroby w odpowiedzi ostrej fazy
The liver in the acute phase response
Katedra i Klinika Chorób Zakaźnych, PAM w Szczecinie
Kierownik Katedry: prof. dr hab. n. med. Anna Boroń-Kaczmarska
Streszczenie
Odpowiedź ostrej fazy to niespecyficzne reakcje organizmu na każde zaburzenie jego homeostazy wywołane różnymi czynnikami miejscowymi mające na celu przywrócenie procesów fizjologicznych. Biorą w niej udział liczne mediatory i białka zwane białkami ostrej fazy. Wątroba odgrywa jedną z najważniejszych ról w tym procesie. Z jednej strony jest ona narządem, który odbiera poprzez mediatory sygnały z miejsc zaburzonej homeostazy, z drugiej, poprzez produkcję białek ostrej fazy, modeluje jej przebieg. Liczne choroby wątroby mogą nie tylko same inicjować odpowiedź ostrej fazy ale także, poprzez zmianę w jej funkcjonowaniu, wpływać na jej przebieg.
Summary
The acute phase response is the answer of the organism to disturbances of its homeostasis with the aim of restoring the disturbed physiological processes. The studies indicate that IL-6 is the main inducer of the acute phase response in the human. IL-6 acts on many different cells but the hepatocytes are the major target cells and the liver is the organ which plays a main role in the acute phase response throught the synthesis and releasing of acute phase proteins including C reactive protein.
Słowa kluczowe: hepatologia,
choroby wątroby,
wątroba,
WZW typu B,
czasopismo medyczne,
borgis,
klekowski,
postępy nauk medycznych,
wydawnictwo,
czasopismo,
medycyna.

Odpowiedź ostrej fazy
Reakcja odpowiedzi ostrej fazy (ang. acute phase response) to niespecyficzna odpowiedź organizmu na każde zaburzenia jego homeostazy będącej wynikiem zakażenia, uszkodzenia tkanek, rozrostu nowotworowego bądź zaburzeń immunologicznych. Ich celem jest przywrócenie zaburzonych fizjologicznych procesów homeostazy.
Miejscowe reakcje wywołane przez czynniki zaburzające homeostazę to, między innymi, agregacja krwinek płytkowych, formowanie skrzepu, zmiany naczyniowe, akumulacja i aktywacja granulocytów i komórek jednojądrzastych oraz aktywacja występujących w miejscu fibroblastów i komórek endotelium, które rozpoczynają uwalnianie cytokin ostrej fazy. Mediatory te działają na specyficzne receptory znajdujące się na różnych komórkach wywołując reakcję ogólnoustrojową charakteryzującą się między innymi gorączką, leukocytozą, wzrostem sekrecji ACTH i glukokortykosteroidów, aktywacją składowych dopełniacza, obniżeniem osoczowego poziomu żelaza i cynku, ujemnym bilansem azotowym i często dramatycznymi zmianami w koncentracji niektórych białek osocza (7, 10, 12).
Białka te nazywane są białkami ostrej fazy. Pojęcie „ostrej fazy” wprowadzili w 1941 roku Abernethy i Avery, którzy opisali właściwości osocza gorączkującego chorego. Osocze to zawierało białko ostrej fazy: białko C-reaktywne (CRP ang. C-reactive protein) (1).
Białka ostrej fazy są różne gatunkowo. U człowieka największy wzrost w ostrej fazie wykazuje białko C-reaktywne oraz amyloid A, u szczura natomiast alfa2?makroglobulina. Jednak u większości gatunków w trakcie odpowiedzi ostrej fazy wzrastają poziomy fibrynogenu, haptoglobiny, alfa1-antychymotrypsyny i alfa1-antytrypsyny a obniżeniu ulegają albuminy i transferyna (3, 7).
W 1951 roku Miller i wsp. wykazali, że głównym narządem syntetyzującym białka ostrej fazy jest wątroba. Od tej pory podejmowane są liczne badania nad cechami biologicznymi mediatorów, które przekazują sygnał z miejsca, w którym doszło do zaburzenia homeostazy, do wątroby czyli miejsca produkcji białek ostrej fazy (7, 9) (ryc. 1).
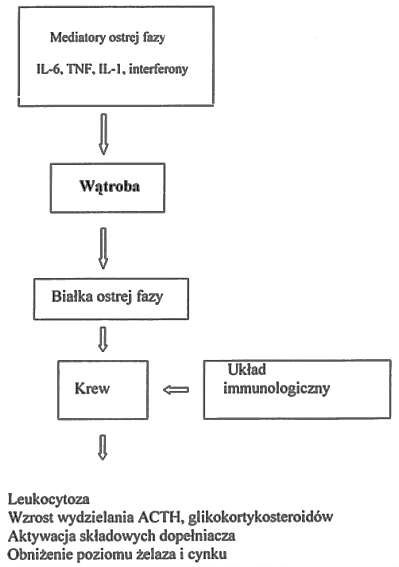
Ryc. 1. Watroba w reakcji ostrej fazy.
Reakcja ostrej fazy to niewątpliwie dominująca część reakcji alarmowych w takich zjawiskach jak: inwazja mikroorganizmów, reakcja alergiczna, zabiegi chirurgiczne, urazy, oparzenia, niedokrwienie tkanek. Wydaje się, że przewód pokarmowy jest jednym z ważnych elementów tej reakcji głównie poprzez udział wątroby. Pełni ona trzy ważne role: 1. moduluje reakcje ostrej fazy poprzez syntezę białek ostrej fazy; 2. reguluje aktywację i produkcję, a także inaktywację takich mediatorów jak prostaglandyny i leukotrieny; 3. eliminuje toksyny (2).
Mediatory i białka odpowiedzi ostrej fazy
Najważniejszym obiektem zainteresowania stały się leukocyty, które jako pierwsze angażują się w mechanizmy obronne. Rzeczywiście wykazano, że to leukocyty, a wśród nich głównie monocyty i makrofagi są najważniejszymi producentami mediatorów reakcji ostrej fazy. Pierwsze doniesienia o fakcie, że głównym mediatorem indukcji białek ostrej fazy jest interleukina-6 (IL-6) pochodzi z badań nad hodowlą ludzkich hepatocytów. IL?6 w badaniach tych okazała się induktorem syntezy CRP i amyloidu A (3). W dalszych badaniach wykazano, że również interleukina-1 (IL-1) oraz czynnik martwiczy guzów (ang. tumor necrosis factor – TNF) są induktorami białek ostrej fazy. W badaniach porównawczych tych trzech cytokin wykazano jednak, że tylko IL-6 stymuluje syntezę pełnego spektrum białek ostrej fazy, podczas gdy IL?1 i TNFalfa hamują syntezę beta-fibrynogenu, albumin i transferyny. Te dane sugerują więc, że IL-6 gra kluczową rolę w syntezie białek ostrej fazy u ludzi (7) (tab. 1).
Tabela 1. Wplyw mediatorów ostrej fazy na poziom bialek ostrej fazy.
| Mediator ostrej fazy | Bialka ostrej fazy |
| Wzrost poziomu | Obnizenie poziomu |
| IL-6 (interleukina-6) | Bialko C-reaktywne, Amyloid A, Beta-fibrynogen,
Alfa1-antychymotrypsyna, Haptoglobina, Ceruloplazmina, Skladowe C3 dopelniacza, Alfa2-antyplazmina | Transferyna, Prealbumina, Albuminy,
Alfa1-lipoproteiny |
| IL-1 (interleukina-1) | | Beta-fibrynogen, Albuminy, Transferyna |
| TNF alfa (czynnik martwiczy guzów;
ang. tumor necrosis factor) | | Beta-fibrynogen, Albuminy, Transferyna |
| IL-8 (interleukina-8) | Bialko C-reaktywne,
Alfa1-antychymotrypsyna | Transferyna, Prealbuminy |
| IL-4 (interleukina 4) | | Bialko C-reaktywne |
IL-6 oprócz swojego działania na hepatocyty wykazuje wiele innych działań. Między innymi IL-6 działa bezpośrednio na limfocyty B aktywowane przez IL-4 i IL-5 indukując produkcję immunoglobulin M, G i A; gra kluczową rolę w końcowym różnicowaniu limfocytów B w komórki wydzielające immunoglobuliny; jest ważnym czynnikiem w pierwotnej aktywacji limfocytów T i ich proliferacji; wzmaga proliferację multipotencjalnych komórek hematopoezy; wpływa na wzrost i różnicowanie wielu innych komórek; bierze udział w pośredniczeniu pomiędzy układem neuroendokrynnym a immunologicznym; jest też wraz z IL-1 i TNFalfa endogennym pirogenem (7, 10, 12).
Synteza IL-6 zachodzi w różnych komórkach organizmu człowieka poddanych odpowiedniej stymulacji. Spontaniczną produkcję IL-6 wykazują też niektóre komórki nowotworowe. Jednakże komórki endotelium, fibroblasty oraz monocyty i makrofagi są prawdopodobnie głównym źródłem IL-6 podczas reakcji zapalnych. IL-1 i TNFalfa, które stymulują syntezę IL-6 w ludzkich fibroblastach, działają poprzez kinazę białkową C oraz cykliczny AMP. Synteza IL-6 może być również kontrolowana przez hormony steroidowe np.: deksametazon hamuje produkcję IL-6 w ludzkich monocytach, estradiol-17beta w komórkach endometrium (7, 10).
Pomimo potwierdzonych biologicznych licznych działań IL-6 wydaje się jednak, że wątroba jest głównym narządem efektorowym jej działania in vivo. W badaniach wykazano bowiem, że już w 20 minut po podaniu znakowanej, rekombinowanej ludzkiej IL-6, 80% znika z krążenia i znajdowana jest w wątrobie. IL-6 lokalizowana jest na powierzchni hepatocytów co sugeruje istnienie specyficznych receptorów zaś znaczna produkcja białek ostrej fazy– istnienie silnego systemu amplifikacji (7).
W miarę prowadzonych prac badawczych okazuje się, że istnieje wiele czynników, które modulują działanie IL-6 oraz produkcję białek ostrej fazy. Takim czynnikiem okazała się między innymi interleukina-8 (IL-8), która nasila produkcję CRP, alfa1-antychymotrypsyny i obniża produkcję transferyny i prealbumin; interleukina-4 (IL?4),która obniża produkcję CRP. Istnieje też wiele innych substancji jak np. aktiwina (ang.activin) i jej białko wiążące – follistatyna, które w powiązaniu z IL-1 i IL-6 regulują i koordynują produkcję białek ostrej fazy (13,16).
Osobnym zagadnieniem związanym z badaniami nad oceną poziomu czynników ostrej fazy jest możliwość wykorzystywania ich do celów diagnostycznych. W jednym z badań japońskich przeprowadzono porównanie użyteczności tych czynników w ocenie ciężkości ostrego zapalenia trzustki. Porównano trzy czynniki: czynnik wzrostu hepatocytów (ang. hepatocyte growth factor-HGF), CRP oraz IL-6. Okazało się, że HGF jest tak samo użyteczny jak CRP w wykrywaniu ciężkiego zapalenia trzustki i przewidywania dysfunkcji wątroby. HGF był bardziej użyteczny w przewidywaniu dysfunkcji nerek i układu oddechowego niż CRP i IL-6. HGF może stać się nowym klinicznym parametrem ściśle związanym z dysfunkcją narządów w przebiegu ostrego zapalenia trzustki (15).
Mediatory i białka ostrej fazy w chorobach wątroby
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Abernethy T.J. et al.: J. Exp. Med. 1941, 73: 173.
2. Bengmark S.: Nutrition, 1998, 14: 563.
3. Castell J.V. et al.: FEBS Lett. 1989, 242: 237.
4. Fabris C. et al.: Cancer Invest. 1996, 14: 103.
5. Floerani A. et al.: Ital. J. Gastroenterol. Hepatol. 1999, 31; 56.
6. Geneva-Popova M. et al.: Folia. Med. Plovdiv. 1999, 41: 78.
7. Heinrich P.C. et al.: Biocem. J. 1990, 265; 621.
8. McClain C.J. et al.: Alcohol Clin. Exp. Res. 1998, 22: 248s.
9. Miller L.L. et al.: J. Exp. Med. 1951, 94: 431.
10. Muller Ch. et al.: J. Hepatol. 1992, 15: 372.
11. Perlmutter D.H.: Semin. Liver Dis. 1998, 18: 217.
12. Propst A. et al.: Eur. J. Gastroenterol. Hepatol. 1998, 10: 497.
13. Russel C.E. et al.: Moll. Cell. Eocrinol. 1999, 148: 129.
14. Shima M. et al.: Tohoku. J. Exp. Med. 1996, 178: 287.
15. Ueda T. et al.: J. Gastroenterol. 1997, 32: 63.
16. Wigmore S.J. et al.: Am. J. Physiol. 1997, 273: 720.
17. Wigmore S.J. et al.: Intensive Care Med. 1998, 24: 224.
18. Zylberberg H. et al.: J. Hepatol. 1999, 30: 185.

