© Borgis - Postępy Nauk Medycznych 3-4/2001, s. 30-40
Katarzyna Osiak
Chirurgia nerwów obwodowych u progu trzeciego tysiąclecia
Peripheral nerve surgery at the beginning of third millenium
Klinika Chirurgii Plastycznej, Centrum Medyczne Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki: prof. dr hab. n. med. Józef Jethon
Streszczenie
Chirurgia nerwów obwodowych stanowi nadal jedno z trudniejszych ale i ciekawszych zagadnień w chirurgii rekonstrukcyjnej. W pracy tej przedstawiono poszczególne etapy rozwoju chirurgii nerwów obwodowych, dużo miejsca poświęcając badaniom eksperymentalnym, które umożliwiły poznanie procesu regeneracji na poziomie komórkowym. W procesie tym ogromną rolę odgrywają substancje neurotropowe. „Złotą zasadą” w chirurgii nerwów obwodowych pozostaje precyzyjne zbliżenie końców uszkodzonego nerwu z zastosowaniem techniki mikrochirurgicznej. Drogą wiodącą do poprawy wyników leczenia może stać się podawanie różnych substancji neurotropowych, jednak jak dotąd, stosowanie ich nie wyszło poza ramy eksperymentu. Kluczowym zjawiskiem tłumaczącym powrót funkcji po operacji naprawczej nerwu jest funkcjonalna reorganizacja kory mózgowej, a wykorzystanie tej plastyczności mózgu wydaje się stanowić najważniejszy kierunek dalszej poprawy wyników leczenia operacyjnego uszkodzonych nerwów obwodowych. Do przyszłości należy implantowanie mikroprocesorów w centralnym układzie nerwowym oraz zastosowanie osiągnięć inżynierii genowej celem wpływania na proces degeneracji i regeneracji nerwów.
Summary
Peripheral nerve surgery still belongs to the most challenging and difficult surgical reconstructive problems. In this paper, the consecutive stages of peripheral nerve surgery development are shown during the last decades. A lot of attention is paid on experimental studies, which enabled cognition of nerve regenerating process at molecular level. Techniques for clinical approximation of severed nerve ends have reached an optimal technical refinement and new concepts are needed to further increase the results from nerve repair. Posttraumatic functional reorganizations occuring in brain cortex are key phenomena explaining much of the inferior functional outcome following nerve repair, and increased knowledge regarding factors involved in brain plasticity may help to further improve the results. Implantation of microchips in the nervous system may provide a new interface between biology and technology. Developing gene technology may introduce new possibilities in the manipulation of nerve degeneration and regeneration.

W ciągu ostatniego ćwierćwiecza znacznie poszerzyła się nasza wiedza o biologicznych mechanizmach regulujących proces regeneracji nerwu po urazie. Jednak wyniki badań eksperymentalnych opartych na rozwijających się teoriach naukowych nie mogą być przeniesione bezpośrednio do pracy klinicznej. Dodanie czynników neurotropowych podtrzymuje procesy życiowe w komórkach nerwowych i stymuluje wzrost aksonów w warunkach eksperymentu, ale jak do tej pory nie znalazło zastosowania klinicznego.
Podobnie rzecz się ma ze stosowaniem gangliozydów, hormonów, tlenu hiperbarycznego i pola magnetycznego.
W związku z tym wydaje się że jedynie doskonalenie techniki chirurgicznej prowadzącej do precyzyjnego zbliżenia uszkodzonych końców nerwów może prowadzić do uzyskania pożądanego efektu.
Wiele prac poświęcono poszukiwaniu alternatywnych do autologicznych przeszczepów nerwów używając jako rusztowania różnych błon, tkanek, struktur biologicznych i niebiologicznych z zastosowaniem lub bez czynników neurotropowych oraz komórek innych niż nerwowe.
Pomostowanie końców uszkodzonego pnia nerwu przeszczepem kablowym z innego własnego nerwu pozostaje „złotym standardem” w chirurgii nerwów obwodowych. Prace nad zastosowaniem alloprzeszczepu nerwu z użyciem nowych i łatwiej tolerowanych czynników immunosupresyjnych otworzyły nową drogę do transplantacji ręki.
Prace nad zespoleniami nerwów „koniec do boku” stworzyły nowe możliwości reimplantacji wyrwanych korzeni w chirurgii splotu barkowego.
Przyszłość chirurgii nerwów obwodowych związana jest z zastosowaniem czynników wzrostowych, implantacją mikroprocesorów do obwodowego i ośrodkowego układu nerwowego, łączeniem uszkodzonych części aksonu i sterowaniem procesami degeneracji i regeneracji poprzez zastosowanie technologii genowej.
Rękę określa się jako wypustkę mózgu a jej sprawność czuciowa i ruchowa związana jest z prawidłowym funkcjonowaniem odpowiednich elementów zarówno w obwodowym jak i ośrodkowym układzie nerwowym.
Z punktu widzenia chirurgii ręki uszkodzenie nerwu obwodowego jest przyczyną ciężkiego uszkodzenia funkcji ręki. Często pomimo technicznie doskonałego zespolenia nerwu oraz rehabilitacji wyniki są trudne do przewidzenia.
U progu nowego tysiąclecia możemy postawić pytanie: dlaczego ciągły postęp w neurobiologii nie wpływa na poprawę rezultatów pierwotnej jak i wtórnej rekonstrukcji nerwu obwodowego?
Zainteresowanie procesami naprawczymi nerwu trwa od ponad 100 lat (25). W badaniach eksperymentalnych na zwierzętach, stosując barwienie preparatów solami srebra obserwowano obecność stożków wzrostowych w zakończeniach regenerujących aksonów.
Cajal zaobserwował zjawisko neurotropizmu aksonu przejawiające się w większym powinowactwie regenerującego neurytu do obwodowego segmentu nerwu niż do innej tkanki. Dzięki odkryciom biologii molekularnej można przestudiować dokładnie wiele zjawisk zaobserwowanych wcześniej. Przedmiotem szczególnego zainteresowania neurofizjologów w ciągu ostatniej dekady stały się czynniki neurotropowe, które pojawiają się zawsze po urazie nerwu w miejscu jego uszkodzenia. Ich podaż z zewnątrz w badaniach eksperymentalnych może podtrzymywać życie komórki i wpływać na wzrost aksonów.
Pomimo ogromnego rozwoju neurofizjologii eksperymentalnej, generalne założenia chirurgii urazów układu nerwowego nie uległy zmianie. Powszechnie uznana i upowszechniona technika przeszczepiania nerwów Millesi´ego nieoczekiwanie ograniczyła rozwój badań klinicznych, a rozwój nowoczesnych koncepcji neurofizjologicznych dotyczących modeli zwierzęcych i ich zastosowanie w leczeniu ludzi nie idą w parze. Współczesne kliniczne podejście do zagadnień naprawy i rekonstrukcji nerwów nie różni się od tego sprzed 25 lat. W zależności od rzetelności informacji wyniki funkcjonalne po operacjach naprawczych nerwów mogą się różnić, ale całkowity powrót funkcji czuciowej i ruchowej u dorosłego pacjenta ciągle należy do rzadkości. Uszkodzenie pnia nerwu obwodowego różni się od wszystkich innych typów urazów. Przecięcie aksonu powoduje zmiany na całej jego długości (to znaczy: na całej drodze od ciała komórki w rdzeniu kręgowym lub zwoju korzeni grzbietowych do odlegle położonego obszaru przyporządkowanego danej komórce nerwowej) a procesy naprawcze dokonują się poprzez wzrost neurytów i ich wrastanie do narządu docelowego, pokonując nawet bardzo duże odległości. Ponadto, w przeciwieństwie do większości urazów, uszkodzenie nerwu ma natychmiastowe następstwa funkcjonalne dla mózgu, polegające na szybkiej reorganizacji w samej korze mózgowej.
Z biologicznego punktu widzenia, fizjologiczne następstwa uszkodzenia i regeneracji nerwu zależą od takich czynników jak:
1. ilość komórek nerwowych pozostałych przy życiu,
2. jakość i stopień wzrostu aksonu,
3. ukierunkowanie i specyficzność wzrastania regenerujących aksonów,
4. rodzaje reorganizacji w obrębie somatosensorycznej i ruchowej kory mózgowej.
Z klinicznego punktu widzenia regeneracja jest zazwyczaj niecałkowita, co ma swój wyraz w zaburzeniach czucia, ubytkach funkcji ruchowych, nietolerancji zimna i bólu – czynnikach, które prowadzą do upośledzenia ręki, pogorszenia jakości życia, problemów w pracy, w życiu osobistym i społecznym.
Celem tego artykułu jest przypomnienie rozwoju myśli naukowej w chirurgii obwodowego układu nerwowego, a także wypunktowanie „kamieni milowych” oraz ich znaczenia w rozwiązywaniu problemów klinicznych związanych z uszkodzeniem nerwów obwodowych.
Czynniki neurotropowe
Badania nad czynnikami neurotropowymi w tkance nerwowej trwają od ponad 35 lat i ukazują ogromną złożoność zagadnień związanych z przeżyciem i regeneracją neuronów (65, 164).
U podłoża tych zjawisk leży skomplikowany mechanizm neurochemiczny wzajemnego oddziaływania zakończenia komórki nerwowej oraz samego aksonu, uruchamiany po zadziałaniu czynnika uszkadzającego.
Niezbędnym warunkiem regeneracji aksonu po jego przecięciu jest przeżycie ciała komórki, co jest możliwe dzięki działaniu czynników neurotropowych.
W zależności od rodzaju receptora czynniki neurotropowe możemy sklasyfikować w trzech głównych grupach:
1. neurotropiny,
2. cytokiny neuropoetyczne (m.in. rzęskowy czynnik neuropoetyczny i interleukinę),
3. czynniki wzrostu fibroblastów (kwaśny i zasadowy czynnik wzrostu fibroblastów).
Znane są inne czynniki neurotropowe do których zaliczamy:
1. insulinopodobny czynnik wzrostowy,
2. naskórkowy czynnik wzrostowy,
3. białaczkowy czynnik hamujący,
4. glejowy czynnik neurotropowy.
Czynniki wzrostowe działają poprzez wiązanie enzymu synkinazy do poszczególnych grup receptorów zwanych trks, znajdujących się na powierzchni komórek nerwowych oraz receptorów o małym powinowactwie do czynników wzrostowych (NGF) zwanych „p75”.
Aktywacja miejsc receptorowych powoduje aktywację odpowiedniego genu w komórce nerwowej.
Do najlepiej poznanych neurotropin należą: NGF(nerve growth factor), czynnik neurotropowy pochodzenia mózgowego (BDNF – brain derived neurothropic factor), neurotropina-3 (NT-3), neurotropina 4/5 oraz neurotropina-6.
Najlepiej poznanym czynnikiem warunkującym przeżycie grzbietowych zwojów zarodkowych oraz większości współczulnych oraz czuciowych, lecz nie przywspółczulnych, neuronów w ich bardzo wczesnym stadium rozwoju jest czynnik wzrostowy nerwów (nerve growth factor – NGF) (41). W każdym nieuszkodzonym nerwie, w niewielkim stężeniu wykrywana jest obecność m-RNA NGF (121). W wyniku uszkodzenia nerwu dochodzi do wzrostu jego stężenia w dystalnym segmencie nerwu. Udowodnione jest znaczenie NGF w podtrzymywaniu funkcji życiowych w neuronach czuciowych, w stymulowaniu wzrostu neurytów, podczas gdy nie zaobserwowano żadnego wpływu tej substancji na neurony ruchowe (6, 86). Jedynie neurony o wysokim powinowactwie do receptora NGF (trkA) są zdolne do odpowiedzi na NGF.
Motoneurony zawierają informację o budowie receptorów trkA i trkC i tym tłumaczy się brak wpływu NGF na nie.
Czynnikiem tropowym dla motoneuronów jest BDNF, który podtrzymuje ich przeżycie w hodowli (86), ogranicza zjawisko naturalnej śmierci komórkowej w rozwijających się motoneuronach oraz podtrzymuje przeżycie neuronów w rogach przednich rdzenia po aksotomii (121). BDNF działa poprzez enzym kinazę tyrozynową receptorów trkA i trkC.
Neurotropina-3 wiąże się z receptorem trkC neuronów czuciowych, ruchowych i parasympatycznych, silnie indukując ich przeżycie oraz różnicowanie (86).
Neurotropina 4/5 ma powinowactwo do receptora trkB motoneuronów, podtrzymuje czynności życiowe motoneuronów oraz zwiększa ich zdolność do inerwacji mięśni szkieletowych w hodowli komórek ludzkich oraz szczurzych.
Neurotropina-6 jest jednym z ostatnio opisanych czynników grupy NGF, wywiera podobne do NGF działanie na neurony czuciowe i sympatyczne kurcząt, jednak jej znaczenie jest nie do końca wyjaśnione.
Molekularne i komórkowe podstawy regeneracji nerwu
O przeżyciu komórki nerwowej decydują komórki docelowego narządu unerwianego przez dany neuron.
Czynniki tropowe (NGF) są transportowane wzdłuż aksonu dzięki mechanizmowi transportu wstecznego do ciała komórki, gdzie podtrzymują jego główne czynności życiowe (84, 121).
NGF jest obecny w niewielkiej ilości w pniu nieuszkodzonego nerwu, jednak jego poziom, jak również poziom m-RNA NGF znacznie wzrasta w wyniku przecięcia nerwu obwodowego (121). Uważa się, iż czynnikiem powodującym uruchomienie produkcji NGF jest interleukina 1-b uwalniana z makrofagów w miejscu uszkodzenia.
Makrofagi są multipotencjalnymi komórkami biorącymi udział nie tylko w degradacji mieliny, ale także w syntetyzowaniu czynników neurotropowych, co ma miejsce po urazie nerwu. Pełnią one pierwszoplanową rolę w regeneracji nerwu, oddziaływując nie tylko na komórki nerwowe ale również na komórki pozanerwowe znajdujące się w jego pniu. Końcowy segment przeciętego włókna nerwowego jest szybko opanowywany przez makrofagi pochłaniające resztki rozpadłej mieliny. Wykazano, iż wzrost aksonów może być stymulowany podażą makrofagów z zewnątrz (121, 134). Udowodniono również, iż wywołanie stanu zapalnego zwojów grzbietowych w warunkach doświadczalnych może zapoczątkować proces regeneracji (110).
Przecięcie nerwu zapoczątkowuje formowanie receptora NGF na powierzchni komórek Schwanna tworzących pasma Bugnera (95, 121). Podczas gdy regenerujące aksony wędrują po powierzchni komórek Schwanna, czynniki stymulujące wzrost nerwu przytwierdzone do receptorów NGF są pobierane do wewnątrz i transportowane do stożków wzrostowych oraz transportem wstecznym do ciała komórki nerwowej. W ten sposób na powierzchni komórek Schwanna powstaje informacja, za którą podążają regenerujące aksony. Komórki Schwanna produkują również inne czynniki wzrostowe takie jak insulinopodobny czynnik wzrostowy-1, CNTF, oraz BNDF (121) (ryc. 1).
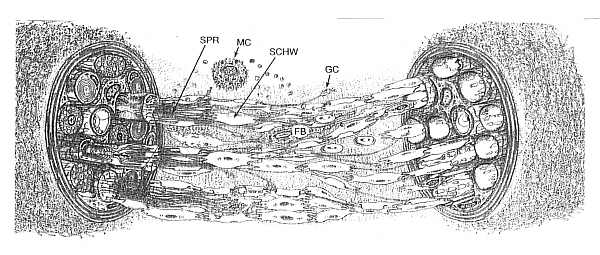
Ryc. 1. Miejscowa reakcja komórkowa na przecięcie pnia nerwu. W kikucie bliższym nerwu widoczne rosnące wypustki z zakończenia aksonu. Wypustki (SPR) wywodzące się ze zmielinizowanego aksonu tworzą jednostkę regeneracji otoczoną wspólną błoną podstawną. Na szczycie każdej wypustki znajduje się stożek wzrostu (GC). Wypustki podążają do przodu pokonując strefę uszkodzenia dzięki towarzyszącym im komórkom Schwanna (SCHW). W strefie uszkodzenia znajdują się makrofagi, fibroblasty (FB), komórki tuczne (MC) oraz elementy komórkowe krwi. Pomiędzy segmentami bliższym i dalszym nerwu tworzą się pasma Bugnera. Częste jest omyłkowe wrastanie regenerujących aksonów w kikut dalszy nerwu.
Podobnie jak w uszkodzonym aksonie, również w ciele komórki zachodzą zmiany funkcjonalne takie jak: obrzęk ciała komórki, przemieszczenie jądra na obwód oraz chromatoliza polegająca na zniknięciu zasadochłonnych ziarnistości z cytoplazmy (72, 121).
Chromatoliza jest związana z reorganizacją szorstkiej siateczki endoplazmatycznej i zmianami w RNA oraz ze wzmożeniem metabolizmu białkowego mającymi na celu wzrost potencjału regeneracyjnego neuronu. Reakcję ciała komórki na uszkodzenie aksonu można wytłumaczyć w wieloraki sposób. Przecięcie oznacza brak dowozu substancji neurotropowych, produkowanych przez komórki narządu docelowego i transportowanych wstecznie wzdłuż aksonu do ciała komórki nerwowej, co jest przyczyną chromatolizy.
Zjawisko chromatolizy wyraża gotowość komórki do regeneracji, ale również wskazuje na ciężki uraz komórki nerwowej z utratą dużej objętości aksoplazmy. Chromatoliza czasami może prowadzić do śmierci i zniszczenia ciała komórki nerwowej, co uniemożliwia regenerację danego neuronu. Wykazano, iż w wyniku urazu nerwu dochodzi do obumarcia od 20 do 50% komórek zwojów grzbietowych (1, 2, 3, 59, 88, 121). U dorosłych kotów i małp odsetek ten jest nieco mniejszy i wynosi odpowiednio 30 i 27% (106, 121).
Po przecięciu nerwu w obwodowej części aksonu zachodzi degeneracja Wallerowska. Neurofilamenty i mikrotubule rozpadają się pod wpływem enzymów proteolitycznych aktywowanych jonami wapnia w aksoplazmie (121). Pozostałości aksonów są pochłaniane przez migrujące makrofagi. Wzrasta aktywność mitotyczna komórek Schwanna. Proliferujące komórki Schwanna szybko układają się w kolumny zwane pasmami Bugnera. Syntetyzują one również liczne czynniki tropowe podtrzymujące czynności życiowe oraz wzrost aksonu. W miejscu uszkodzenia, z bliższego kikuta wyrastają liczne wypustki pokonując miejsce uszkodzenia i wzrastając wzdłuż pasm Bugnera. Na szczycie każdej wypustki znajduje się stożek wzrostowy posiadający liczne mikrorzęski zwane filopodiami. Twory te pozostają w ciągłym ruchu badając nieustannie otoczenie. Aktywność stożka wzrostu odgrywa zasadniczą rolę w wyborze kierunku wzrostu aksonu. Molekularny skład mikrośrodowiska może ułatwiać lub hamować proces wzrastania aksonów. Substancje, które mają właściwości ułatwiające wzrastanie aksonów, to glikoproteiny: laminina i fibronektyna (40, 121).
W ciągu ostatnich 10 lat zauważono iż w procesie wzrastania aksonów równie ważną rolę odgrywają czynniki zapobiegające powstawaniu nieprawidłowej reinerwacji, odpychające aksony z niewłaściwych obszarów (34). Proteiny o działaniu odpychającym to: semaforyny, efryny, netryny oraz wiele innych cząsteczek zlokalizowanych na powierzchni komórek w przestrzeni zew-nątrzkomórkowej (34, 151).
Przedmiotem zainteresowania naukowców stały się również cząsteczki przylegania komórkowego takie jak: N-CAM, L1, glikoproteina związana z mieliną MAG oraz TAG 1 (128, 121). Nazywane są one czasami molekularnymi odciskami palców ponieważ ich niepowtarzalny układ na powierzchni komórek wskazuje specyficzną drogę dla rosnących aksonów w procesie rozwoju i regeneracji. Laminina i fironektyna występują w błonie podstawnej komórek Schwanna i mają bezpośredni wpływ na wydłużanie aksonów (13, 107). Błona podstawna komórek Schwanna ułatwia podążanie do przodu regenerującego aksonu w segmencie dystalnym. W drugiej, trzeciej dobie od urazu nerwu dochodzi do proliferacji komórek innych niż nerwowe, a około 70% tych komórek stanowią komórki Schwanna (121). W obrębie swojej błony podstawnej gromadzą one różnorodne substancje neurotropowe wymienione powyżej (82, 107, 121). Najwcześniej po urazie pojawia się NGF, a w późniejszym okresie BDNF (121).
Czynniki ułatwiające wzrost neurytu, wpływające na kierunek wzrostu aksonu
Na kierunek wzrostu regenerujących aksonów może mieć wpływ kilka czynników: np. polaryzacja struktur znajdujących się pomiędzy zwróconymi do siebie powierzchniami uszkodzonego pnia nerwu. Na specjalną uwagę zasługują podłużne pasma tworzące się w obrębie skrzepu fibrynowego, które zawsze tworzą się pomiędzy końcami przeciętego nerwu. Fizjologiczne napięcie w skrzepie fibrynowym może zapoczątkowywać wzrost aksonu poprzez obszar skrzepu. Nadmierne, niefizjologiczne napięcie ma negatywny wpływ na regenerację aksonu.
Określenie: „neurotropizm” i „chemotaksja” zostało wprowadzone przez Cajala w 1928 roku (25). Zauważył on, że aksony z proksymalnego kikuta nerwu rosną w kierunku przeszczepu nerwu lub kikuta dalszego, pomimo braku jego ciągłości. Jest to związane z powstawaniem w degenerującym dystalnym kikucie nerwu substancji, które mają zdolność przyciągania regenerujących aksonów w kierunku kikuta dalszego. Tym zagadnieniem zajmowali się Weiss i Taylor w 1944 roku (121).W ostatnich 20 latach wzrastało zainteresowanie tym zjawiskiem (21, 100, 101, 102, 121, 144).
Mechanizm regeneracji nerwu jest złożony, wynika z przyciągania na odległość przez kikut dalszy wzrastających w jego kierunku aksonów lub jest efektem losowego wzrastania aksonów do docelowego organu, po wyeliminowaniu włókien posiadających nieprawidłowy wzór reinerwacji. Uważa się iż rosnące włókno nerwowe wykazuje różne rodzaje powinowactwa (22):
1. Tkankowe (podążanie grupy rosnących aksonów do dystalnego kikuta, a nie do otaczających tkanek takich jak ścięgna i mięśnie).
2. Pęczkowe lub pniowe (podążanie aksonów w kierunku pęczków z których się wywodzą: np. unerwienie kikuta piszczelowego przez włókna piszczelowe po rekonstrukcji nerwu kulszowego).
3. Czuciowe lub ruchowe (rozdzielające pęczki czuciowe od ruchowych).
4. Topograficzne (występujące zarówno w układzie neuronów czuciowych, jak i ruchowych przejawiające się w powrocie aksonów do narządów unerwianych przed urazem, np. ponowne unerwienie wskaziciela przez aksony wskaziciela po rekonstrukcji nerwu pośrodkowego).
5. Powinowactwo końcowego organu (reinerwacja docelowego organu przez te same aksony, które unerwiały narząd przed urazem) (22).
Brushart i Seiler (21, 23, 121) opisali zjawisko preferencyjnej reinerwacji motorycznej, które występuje nawet po usunięciu narządu docelowego i nie jest obserwowane we włóknach czuciowych. Najbardziej prawdopodobnym wytłumaczeniem tego zjawiska jest obecność cząsteczek rozpoznawczych obecnych w komórkach Schwanna towarzyszących włóknom motorycznym. Za pomocą przeciwciał zidentyfikowano rodnik węglowodanowy L2, o którym wiadomo, iż jest związany z kilkoma molekułami odpowiedzialnymi za wzajemne przyleganie komórek w układzie nerwowym (103, 128). Wodorowęglan L2 nie występuje w aksonach czuciowych, natomiast jest obecny na powierzchni komórek Schwanna oraz na błonach podstawnych aksonów motorycznych i pozostaje w tej lokalizacji podczas i po degeneracji Wallerowskiej (128). Badania nad oddziaływaniem kikuta dalszego nerwu na kikut bliższy prowadził w modelu in vivo Kufler (102, 121), który badał istotę wczesnego wyboru kierunku wzrastania aksonów do kikuta dalszego, lub narządu docelowego. Badał regenerujące aksony przeciętego nerwu skórnego żaby, które po usunięciu kikuta dalszego wyrastały w sposób przypadkowy, natomiast jeśli pozostawiano obszar unerwienia danego nerwu to aksony wyrastały w jego kierunku. Praca ta potwierdza obecność mechanizmów neurotropowych działających poprzez prostą dyfuzję na akson oraz komórki Schwanna.
Procesy naprawcze nerwu: podstawy eksperymentalne i ich kliniczne zastosowanie
W ciągu ostatnich 25 lat ulegało zmianie czysto techniczne podejście do naprawy i rekonstrukcji nerwu. Zaczęto uwzględniać biologiczne aspekty regeneracji nerwu jako narzędzia manipulacji procesem regeneracji. Pod rozwagę zaczęto brać stosowanie czynników neurotropowych a także świadomie wpływać na ograniczenie obumierania neuronów.
Obumieranie komórek ganglionów korzeni grzbietowych, obserwowane po przecięciu nerwu można znacznie zredukować podając NGF do miejsca uszkodzenia co udowodniono w modelu eksperymentalnym (108, 121). W tych badaniach pomiędzy kikuty przeciętego nerwu wszczepiano fibronektynowe mostki impregnowane NGF. Podobny efekt uzyskano po śródtkankowym podaniu NGF i Neurofiny 3 (160) oraz podaniu miejscowym interleukiny 1 (39).
Z klinicznego punktu widzenia postępowanie pozwalające na podtrzymanie procesów życiowych neuronów poprzez podaż czynników neurotropowych jest bardzo obiecujące. Jak dotąd, obumieranie komórek nerwowych po przecięciu aksonów jest najpoważniejszym czynnikiem tłumaczącym złe wyniki operacji naprawczych nerwów. Uzupełnienie NGF może podtrzymywać czynności życiowe komórek i może znaleźć zastosowanie w leczeniu choroby Parkinsona i Alzheimera (121), a podawanie CNTF jest zalecane w leczeniu stwardnienia sznurów bocznych SLA (121). Podaż czynników wzrostowych nie znalazła zastosowania w leczeniu urazów nerwów.
Suplementacja NGF w warunkach doświadczalnych przyspiesza regenerację nerwu niezależnie od sposobu podaży (nasycone rurkowate protezy (39, 42, 121), podaż miejscowa lub układowa, przez pompę osmotyczną (121), uwalnianie z implantowanego pojemnika silikonowego (161) lub siatki fibronektynowej (161). W 1997 roku Lewin i wsp. (121) udowodnili, iż podanie miejscowe BDNF i CNTF przez układ pompy osmotycznej, przyspiesza powrót funkcji po przecięciu i zszyciu nerwu kulszowego u dorosłego szczura. Wykazali, że podanie zarówno układowe, jak i miejscowe CNTF zwiększa liczbę zmielinizowanych aksonów obwodowo od miejsca naprawy nerwu po 4 do 6 tygodni (121).
Egzogenny insulinopodobny czynnik wzrostowy 1 podany w miejsce uszkodzenia nerwu kulszowego przyspiesza regenerację aksonów i proces ten jest zależny wprost proporcjonalnie do stężenia tego czynnika (96, 121), a działanie jego może być zintensyfikowane przez jednoczesne podanie czynnika wzrostowego płytkowego (121). Przeciwciała przeciwko insulinopodobnemu czynnikowi wzrostu hamują regenerację aksonów czuciowych in vivo.
Czynnik wzrostowy fibroblastów, w pewnych sytuacjach eksperymentalnych ma działanie ułatwiające regenerację aksonalną (47, 36, 63).
Wszystkie te czynniki przyspieszające regenerację aksonalną nie znalazły zastosowania klinicznego. Nie wiadomo w jaki sposób i w jakich dawkach powinno się je podawać, nieznana jest ich toksyczność i kancerogenność. W niedalekiej przyszłości czynniki neurotropowe mogą odegrać znaczącą rolę, mogą być podawane miejscowo lub układowo, można nasączać nimi biosyntetyczne tuby lub filamenty, z których uwalniać się będą powoli do mikrośrodowiska w procesie regeneracji.
Zastosowanie innych czynników poprawiających regenerację nerwu
W ciągu ostatnich dziesięcioleci podejmowano kilka prób poprawy regeneracji nerwów przez stosowanie gangliozydów lub hormonów (m.in. hormonów tarczycy, kortykotropiny, hormonu wzrostu), oraz przez stosowanie różnego rodzaju pól magnetycznych (121).
Substancją, która może znaleźć zastosowanie kliniczne jest nowy lek immunosupresyjny o nazwie FK 506 (takrolimus), który w badaniach eksperymentalnych przyspiesza wzrost aksonów (70).
Publikowano również interesujące doniesienia o pozytywnym wpływie pola magnetycznego na aktywność NGF po przecięciu nerwu kulszowego u szczura (121). Nie ma doniesień o stosowaniu tej techniki w stosunku do człowieka. W modelu zwierzęcym również tlen hiperbaryczny ułatwia regenerację nerwu, jednak nie był stosowany w leczeniu uszkodzeń nerwów u człowieka.
Czas leczenia chirurgicznego
Kilku badaczy udowodniło w badaniu eksperymentalnym, iż jeśli przecięcie nerwu było poprzedzone niewielkim uszkodzeniem nerwu o ok. 1-3 tygodni, to regenerujące włókna rosły szybciej, niż gdy tego uszkodzenia wstępnego nie było (92, 121). Znaczy to, że wraz z uszkodzeniem nerwu do ciała komórki drogą wstecznego transportu przesyłane są sygnały zapoczątkowujące procesy naprawcze. Ciało komórki odpowiada uruchomieniem specjalnego programu wzrostu, szczególnie dotyczącego elementów cytoszkieletu stanowiącego rusztowanie aksonu. Syntetyzowane jest mRNA oraz białka koniecznego do regeneracji, podczas gdy spada ilość produkowanych mRNA nie mających z nią związku. Okres przygotowania aksonu do regeneracji wynosi ok. 2-3 dni (46, 121). Z klinicznego punktu widzenia te obserwacje mają ogromne znaczenie. Dyskusje na temat wyższości wtórnej nad pierwotną rekonstrukcją nerwu opierają się na 2-3-tygodniowym okresie wzmożonego metabolizmu w ciele komórki, który obserwowany jest po przecięciu nerwu (121). W czasie II wojny światowej, w związku z zabrudzeniem ran, leczenie większości uszkodzeń nerwów odraczano o 2-3 tyg. i w związku z tym przez długi czas uważano że opóźnienie naprawy nerwu o 3 tygodnie wyzwala odpowiedni potencjał regeneracyjny. Powstające koncepcje umocniły przekonanie o korzystnym wpływie krótszego, bo wynoszącego 2-3 dni okresu odroczenia naprawy nerwu (121). Jednak doniesienia kliniczne nie podtrzymują teorii o korzystnym wpływie odroczenia rekonstrukcji a szew pierwotny pozostaje nadal „złotym standardem” w chirurgii urazów nerwów obwodowych.
Techniczne aspekty naprawy nerwów
Celem zakładania szwów na nerw jest najdokładniejsze jak tylko możliwe połączenie odpowiadających sobie pęczków kikuta bliższego i dalszego (ryc. 2).

Ryc. 2. Szew epineuralny. Adaptację końców nerwu uzyskuje się poprzez założenie pojedynczych szwów epineuralnych. Doskonałą orientację powierzchowną daje obecność naczyń krwionośnych, jednak orientacja pęczków nerwowych może być niezadowalająca.
Doskonalenie techniki chirurgicznej przechodziło wiele stadiów. Pierwszym z nich było wprowadzenie mikroskopu operacyjnego (104, 121), które umożliwiło identyfikację i manipulowanie strukturami nerwu z coraz większą dokładnością. W 1964 roku Edshage (55) wykazał jednak iż perfekcyjne zeszycie osłonek nerwu nie zapewnia prawidłowej adaptacji wewnętrznej pomiędzy poszczególnymi pęczkami. Badał również różne typy materiału szewnego i podkreślał znaczenie materiałów nie powodujących odczynu zapalnego. Niektórzy chirurdzy stosowali kleje fibrynowe uważając, że to pozwoli zminimalizować uraz tkanek (16, 121). Zwracano uwagę na niekorzystny wpływ napięcia w linii szwów (4, 134, 121), a w sytuacji krytycznej powinien być użyty raczej krótki przeszczep kablowy nerwu niż zeszycie kikutów pod nadmiernym napięciem. Postępowaniem z wyboru jest atraumatyczne zeszycie nerwu z dobrą adaptacją pęczków. Wiadomo jednak, że naprawa nerwu to nie jest problem czysto mechaniczny, a działalność mikrochirurgiczna nie jest jedynym kluczem do sukcesu. Chirurg może zaadaptować poszczególne grupy pęczków, ale zachowanie poszczególnych aksonów wewnątrz poszczególnych pęczków zależy od wielu biologicznych mechanizmów na poziomie komórkowym. Generalnie naukowcy są zgodni, iż jeśli w pniu nerwowym nie jest widoczna topografia pęczków czuciowych i ruchowych, to wystarczające jest proste zbliżenie kikutów. Jeśli zaś widoczne są grupy pęczkowe, to powinien być zastosowany raczej szew pęczkowy (121).
Identyfikacja pęczków czuciowych i ruchowych
Śródoperacyjna identyfikacja pęczków ruchowych i czuciowych może być dokonana pod mikroskopem przez porównanie układu pęczków na przekroju kikuta bliższego i dalszego (ryc. 3).
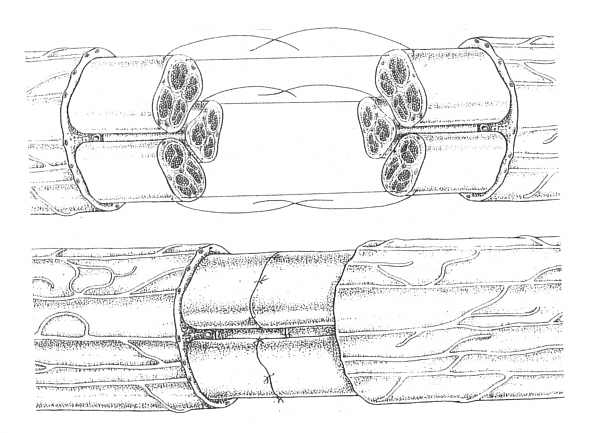
Ryc. 3. Szew odpowiadających sobie grup pęczkowych. Tkanki epineurium wycięte częściowo a poszczególne grupy pęczków zaadaptowane pojedynczymi szwami perineuralnymi.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Aldskogius H., Arvidsson J.: J. Neurocytol., 1978, 7:229.
2. Aldskogius H., Risling M.: Exp Neurol., 1981, 74:597.
3. Aldskogius H., Risling M.: Brain Res., 1983, 289:358.
4. Almguist E.E., Nachemson A.: J Hand Surg., 1984, 9A:792.
5. Al.-Qattan M.M., Al.-Thuynyan A.: Br J Plast Surg. 1998, 51:238.
6. Arakawa Y. et al.: J. Neurosci., 1990, 10:3507.
7. Archibald S.J. et al.: J. Comp Neurol., 1991, 306:685.
8. Archibald S.J. et al.: J. Neurosci., 1995, 15:4109.
9. Bach-y-Rita P.: Neuropsychologia., 1990, 28:547.
10. Bach-y-Rita P.: Neuroreport., 1994, 5:1553.
11. Bach-y-Rita P.: Scand J Rehab Med., 1981, 13:73.
12. Bailey S.B. et al.: J Neurocytol. 1993, 22:176.
13. Baron-Van Evercoren A. et al.: J Neurosci Res 1982, 8:179.
14. Bergman S. et al.: Restor Neurol Neurosci. 1995, 7:165.
15. Bertelli J.A. et al.: J Reconstr Microsurg., 1996, 12:559.
16. Bertelli J.A., Mira J.C.: Microsurgery., 1993, 14:135.
17. Birch R. et al.: Clin Orthop., 1988, 237:96.
18. Brandt J., Dahlin L.B.: J Hand Surg 1999, 24B:284.
19. Braun S. et al.: J Neurol Sci., 1996, 136:17.
20. Breidenbach W.C.: Orthop Clin North Am 1988, 19:81.
21. Brushart T.M., Seiler W.A.: Exp Neurol., 1987, 97:289.
22. Brushart T.M.: J Neurosci., 1988, 8:1026.
23. Brushart T.M.: J Neurosci., 1993, 13:2730.
24. Brunelli G., Monini L.: J Hand Surg., 1985, 10A:993.
25. Cajal R.S.: Vol 1. London: Oxford University Press 1928.
26. Calder J.S., Norris R.W.: Br J Plast Surg., 1993, 46:557.
27. Calder J.S., Green C.J.: J Hand Surg., 1995, 20B:423.
28. Callahan A.D.: w Rehabilitation of the hand., St Louis: CV Mosby, 1995, 701.
29. Carlstedt T.: Clin Neurol Neurosurg., 1993, 95:109.
30. Carlstedt T.: J Neurol Nerosurg Psychiatry., 1993, 56:649.
31. Carlstedt T. et al.: Brain Res Bull., 1993, 30:447.
32. Carlstedt T. et al.: Lancet., 1995, 346:1323.
33. Carson K.A., Terzis J.K.: Clin Plast Surg., 1985, 12:227.
34. Chen H. et al.: Nature Neurosci., 1998, 436.
35. Chiu D.T. et al.: Surgery., 1982, 91:226.
36. Cordeiro P.G. et al.: Plast Reconstr Surg., 1989, 83:1013.
37. Dahlin L.B., Lundborg G.: J Hand Surg., 1998, 3:165.
38. Dahlin LB. et al.: Restor Neurol Neurosci., 1995, 8:199.
39. Da-Silva C.F. et al.: Braz J Med. Biol Res., 1990, 23:981.
40. Davis G.E. et al.: Brain Res., 1987, 430:1.
41. Deckewerth T.L., Johnson E.M.J. Jr.: J Cell Biol., 1993, 123:1207.
42. Derby A. et al.: Exp Neurol., 1993, 119:176.
43. Doolabh V. et al.: Rev Neurosci., 1996, 7:47.
44. Ducker T.B. et al.: J Neurosurg., 1969, 30:270.
45. Danielsen N. et al.: Biomaterials 1993, 14:1180.
46. Danielsen N. et al.: Brain Res., 1994, 669:250.
47. Danielsen N. et al.: J Neurosci Res., 1988, 20:320.
48. Danielsen N., Varon S.: J Reconstr Microsurg., 1995, 11:231.
49. Danielsen N.: Restor Neurol. Neurosci., 1990, 1:253.
50. Dellon A.L., Mackinnon S.E.: Plast Reconst Surg., 1988, 82:849.
51. Deutinger M. et al.: J Neurosurg., 1993, 78:709.
52. Doi K. et al.: J Hand Surg., 1992, 17A:670.
53. Dubernard J.-M. et al.: Lancet., 1999, 353:1315.
54. Dumont C.E., Hentz V.R.: Transplantation 1997, 63:1210.
55. Edshage S.: Acta Chir Scand., 1964, 1, 1, supl 331.
56. Evans P.J. et al.: Prog Neurobiol., 1994, 43:187.
57. Fawcett J.W., Keynes R.J.: J Neurosurg 1986, 65:354.
58. Feneley M.R. et al.: Exp Neurol. 1991, 114:275.
59. Feringa E.R. et al.: Exp Neurol., 1985, 87:349.
60. Fisher D.W. et al.: Neurosurgery. 1985, 17:300.
61. Foidart-Dessale M. et al.: Exp Neurol., 1997, 148:236.
62. Fu S.Y., Gordon T.: Mol Neurobiol., 1997, 14:67.
63. Fujimoto E. et al.: J Neurocytol., 1997, 26:511.
64. Frey M. et al.: J Hand Surg., 1999, 24B, 9 suppl 1.
65. Frostick S.P., Kemp G.J.: Microsurgery., 1998, 18:397.
66. Glasby M.A. et al.: J Neurocytol., 1986, 15:497.
67. Glasby M.A. et al.: J Hand Surg., 1986, 118:347.
68. Glasby M.A. et al.: World J Surg., 1991, 15:501.
69. Glasby M.A. et al.: J Hand Surg., 1992, 17B:526.
70. Gold B.G. et al.: J Neurosci., 1995, 15:7509.
71. Gotz R. et al.: Nature. 1994, 372:266.
72. Grafstein B.: Exp Neurol., 1975, 48:45.
73. Gruber H.: Br J Plast Surg., 1976, 29:70.
74. Gruber H., Zenker W.: Brain Res. 1973, 51:207.
75. Guenard V. et al.: J Neurosc., 1992, 12:3310.
76. Gulati A.K.: J Neurosurg., 1988, 69:117.
77. Gulati AK.: Transplantation 1995, 59:1618.
78. Gulati A.K.: Brain Res., 1996, 742:265.
79. Gulati A.K., Cole G.P.: J. Neurosurg., 1990, 72:114.
80. Haapaniemi T. et al.: Exp Neurol., 1998, 149:433.
81. Hakstian R.W.: J Bone Joint Surg., 1968, 50A:1178.
82. Hall S.: J Anat., 1997, 190:57.
83. Hallin R.G. et al.: Exp Brain Res., 1999, 124:304.
84. Harper G.P., Thoenen H.: J Neurochem., 1980, 34:5.
85. Hebebrand D. et al.: J Hand Surg., 1997, 22B:304.
86. Henderson C.E. et al.: Nature., 1993, 363:266.
87. Hems T.E.J., Glasby M.A.: J Hand Surg., 1993, 18B:165.
88. Himes B.T., Tessler A.: J Comp Neurol., 1989, 284:215.
89. Ide C. et al.: Brain Res., 1983, 288:61.
90. Ide C. et al.: Exp Neurol., 1998, 154:99.
91. Imai H. et al.: J Hand Surg., 1991, 16A:60.
92. Jacob J.M., Croes S.A.: Exp Neurol. 1998, 152:231.
93. Jenkins W.M. et al.: Neuropsychologia. 1990, 28:573.
94. Jenkins W.M. et al.: J Neuropsysiol. 1990, 63:82.
95. Johnson E.M. et al.: Trends Neurosci. 1988, 11:299.
96. Kanje M.: Brain Res., 1989, 486:396.
97. Kerns J.M. et al.: Exp Neurol., 1993, 122:28.
98. Keynes R.J. et al.: Brain Res., 1984, 295:275.
99. Krause T.L., Bittner G.D.: Brain Res., 1991, 561:350.
100. Kuffler D.P.: J Comp Neurol., 1989, 281:416.
101. Kuffler D.P.: J Neurobiol. 1994, 25:1267.
102. Kuffler D.P.: Mol Neurobiol. 1994, 9:233.
103. Kunemund V. et al.: J Cell Biol., 1988, 106:213.
104. Kurze T.: Neurosurg., 1964, 11:128.
105. Lassner F. et al.: Transplantation. 1989, 48:386.
106. Liss A.G. et al.: Scand J Plast Reconstr Hand Surg. 1996, 30:1.
107. Liu H.M.: J Peripheral Nervous System., 1996, 1:97.
108. Ljundberg C. et al.: Neurosi Lett. 1999, 262:29.
109. Lore A.B. et al.: J Neurosci., 1999, 19:2442.
110. Lu X, Richardson P.M.: J Neurosci., 1991, 11:972.
111. Lundborg G., Hanson H.A.: J Hand Surg., 1980, 5:35.
112. Lundborg G. et al.: Brain Res., 1982, 232:157.
113. Lundborg G. et al.: Scand J Plast Reconstr Hand Surg., 1991, 25.
114. Lundborg G. et al.: J Hand Surg. 1994, 19B:277.
115. Lundborg G., Kanje M.: Scand J Plast Reconstr Hand Surg., 1996, 30:105.
116. Lundborg G. et al.: J Hand Surg. 1997, 22A:99.
117. Lundborg G. et al.: J Hand Surg. 1997, 22B:299.
118. Lundborg G. et al.: Neuroreport., 1998, 9:861.
119. Lundborg G.: Br J Hand Ther., 1999, 4:5.
120. Lundborg G. et al.: J Hand Surg. 1999, 24A:219.
121. Lundborg G.: J Hand Surg. 2000, 25A:391.
122. Mackinnon S.E.: J Neurosurg., 1996, 84:671.
123. Mackinnon S.E., Nakao Y.: J Orthop Sci., 1997, 2:357.
124. Mackinnon S.E. et al.: Plast Reconstr Surg., 1987, 79:436.
125. Madison S.E. et al.: Exp Neurol., 1985, 88:767.
126. Madison R.D. et al.: Exp Neurol., 1987, 95:378.
127. Madison R.D. et al.: Brain Res., 1988, 447:325.
128. Martini R., Schashner M.: J Cell Biol., 1988, 106:1735.
129. Merle M., Dautel G.: J Hand Surg., 1991, 16:483.
130. Merzenich M.M. et al.: J Comp Neurol. 1984, 224:591.
131. Merzenich M.M. et al.: J Comp Neurol., 1987, 258:281.
132. Merzenich M.M., Jenkins W.M.: J Hand Ther., 1993, 6:89.
133. Millesi H.: Hand., 1973, 5:157.
134. Millesi H., Terzis J.K.: Clin Plast Surg., 1984, 11:3.
135. Miyauchi A. et al.: Scand J Plast Reconstr Surg Hand Surg. m1997, 31:17.
136. Molander H. et al.: Muscle Nerve 1982, 5:54.
137. Muller H. et al.: Brain Res., 1987, 413:320.
138. Navarro X. et al.: J Periph Nerv Syst., 1996, 1:53.
139. Noah E.M. et al.: J Reconstr Microsurg. 1997, 12:99.
140. Noah E.M. et al.: J Reconstr Microsurg. 1997, 13:317.
141. Norris R.W. et al.: J Bone Joint Surg. 1988, 70B:530.
142. Oppenheim R.W. et al.: Nature. 1992, 360:755.
143. Penn R.D. et al.: Neurosurgery. 1997, 40:99.
144. Politis M.J. et al.: Brain Res., 1982, 253:1.
145. Politis M.J.: Brain Res., 1985, 328:271.
146. Reid R.L. et al.: Hand., 1978, 10:256.
147. Rosen J.M. et al.: Ann Plast Surg., 1990, 25:375.
148. Rosen B. et al.: J Hand Surg., 1994, 19B:452.
149. Santos X. et al.: J Neurosci Methods., 1998, 85:119.
150. Sondell M. et al.: Brain Res. 1998, 795:44.
151. Takahashi T. et al.: Nature Neurosci. 1998, 1:487.
152. Tarasidis G. et al.: Ann Otol Rhinol Laryngol. 1997, 106:506.
153. Tarasidis G. et al.: Otolaryngol Head Neck Surg., 1998, 119:337.
154. Terada N.: Scand J Plast Reconstr Hand Surg. 1997, 31:1.
155. Tham S.K., Morrison W.A.: J Hand Surg., 1998, 23A:844.
156. Tong X.J. et al.: Brain Res., 1994, 663:155.
157. Wall J.T. et al.: J Neurosci., 1986, 6:218.
158. Wall J.T., Kaas J.H.: Brain Res., 1986, 372:400.
159. Wang G.Y. et al.: Brain Res., 1992, 583:216.
160. Whitworth I.H. et al.: J Hand Surg., 1996, 218:514.
161. Wiberg M. et al.: Scand J Plast Reconstr Hand Surg. 1999, m33:387.
162. Wynn Parry C.B., Salter M.: Hand., 1976, 8:250.
163. Viterbo F. et al.: Plast Reconstr Surg., 1994, 94:1038.
164. Viterbo F. et al.: Plast Reconstr Surg., 1994, 94:1038.
165. Viterbo F. et al.: Br J Plast Surg., 1994, 47:75.
166. Yan Q. et al.: Nature, 1992, 360:757.
167. Zamboni W.A. et al.: J Reconstr Microsurg., 1995, 11:27.
168. Zhao Q. et al.: Biomaterials., 1997, 18:75.
169. Zhao J. et al.: J Reconstr Microsurg., 1997, 13:31.



