© Borgis - Medycyna Rodzinna 2/2010, s. 31-38
*Paweł Kowalczyk
Gen p53jako hamulec molekularny przeciwdziałający powstawaniu nowotworów
The p53gen as molecular brake a counteragent of tumor formation
Interdyscyplinarne Centrum Modelowania Matematycznego i Komputerowego Uniwersytetu Warszawskiego
Dyrektor Placówki: prof. dr hab. Marek Niezgódka
Summary
Neoplastic transformation in cancer depends on accumulation of alterations in many families of genes that control signal transduction, cell proliferation and genomic stability. These changes observed in nature generally involve two groups of genes with opposite functions: oncogenes and tumor supressor genes. There are many tumor suppressor genes that are inactivated in almost every type of human cancer, most important being TP53.
The p53protein is involved in the regulation of cell cycle, apoptosis and cell differentiation. p53plays a central role in a complex DNA damage-sensing network which, in response to genotoxic stress such as ionizing radiation, either shunts the cell into a prolonged G1 arrest, presumably to allow for DNA repair and/or directs the cell along the apoptotic pathway. The p53tumour suppressor gene has proven to be one of the genes most often mutated in human cancers (about 50%) what demonstrate their role in the development of cancers.
It involves mainly point mutations leading to amino acid substitutions in the central region of the protein which impair its normal functions. Analysis of the mutational events that target the p53gene has revealed evidence for both exogenous and endogenous mutational mechanisms. More than 90% of the mutations reported so far are clustered between exons 4 and 9. This region is highly conserved throughout evolution and contains the DNA binding domain of the protein which is essential to p53functional activity.

Powstawanie nowotworów
Materiał genetyczny komórek organizmów żywych jest stale narażony na uszkodzenia i modyfikacje, co może w konsekwencji prowadzić do mutacji. Te ostatnie mogą spontanicznie powstawać w wyniku błędów popełnionych podczas replikacji DNA. Są to jednak przypadki niezwykle rzadkie. Częstość mutacji wzrasta, gdy komórki są narażone na działanie mutagenów – czynników chemicznych (np. aldehyd chlorooctowy) lub fizycznych (np. promieniowanie jonizujące i ultrafioletowe), które reagując bezpośrednio z DNA mogą wywoływać różnorodne zmiany w materiale genetycznym, np. modyfikacje zasad, wiązania krzyżowe, przerwy w podwójnym łańcuchu. Również działanie reaktywnych form tlenu (RFT) i azotu (RFA), wytwarzanych podczas procesu zapalnego może powodować uszkodzenie wielu składników komórki w tym lipidów, prowadząc do ich peroksydacji – których głównym składnikiem jest trans -4-hydroxy-2-nonenal (HNE). Wszystkie te czynniki odgrywają istotną rolę w mutagenezie, kancerogenezie oraz w procesie starzenia – powodując rozwój nowotworu. Powstawanie nowotworu zaczyna się od mutacji w obrębie komórek normalnych. Mutacja zwiększa skłonność komórek do namnażania się, podczas gdy sąsiednie komórki pozostają w stanie spoczynku. Zmieniona komórka i jej komórki potomne nadal wyglądają prawidłowo, ale dzielą się nadmiernie – wykazując hiperplazję (nadmierny rozrost). W ciągu kilku lat, jedna na milion tych komórek ulega kolejnej mutacji (pod wpływem czynników endo- lub egzogennych), która może spowodować rozluźnienie kontroli wzrostu komórkowego. Oprócz nadmiernej proliferacji potomstwo tej komórki różni się pod względem kształtu i wyglądu od normalnych komórek, wykazując dysplazję (nieprawidłowy wygląd ograniczony do warstwy nabłonkowej), po pewnym czasie zachodzi kolejna rzadka mutacja, która zmienia zachowanie komórek. Komórki dotknięte mutacjami są coraz bardziej nieprawidłowe pod względem wzrostu i wyglądu, przekształcając się w komórki nowotworowe. Jeśli nowotwór nie naruszył jeszcze granic między tkankami mówimy że jest to rak in situ (rak przedinwazyjny). Nowotwór ten może pozostać w takim stanie bardzo długo, ale w niektórych komórkach czasami zachodzą dodatkowe mutacje. Gdy zmiany genetyczne umożliwiają nowotworowi rozpoczęcie inwazji na sąsiednie tkanki i rozsiewanie komórek do krwi lub limfy – nowotwór jest w pełni złośliwy. Komórki które wymknęły się spod kontroli, mogą doprowadzić do powstawania w organizmie nowych guzów (przerzutów), które mogą zaburzyć biologię komórek jeszcze nie zainfekowanych, prowadząc do ich transformacji nowotworowej, co w konsekwencji prowadzi do śmierci organizmu, wskutek zniszczenia tkanek w różnych narządach.
Wśród genów, których mutacja przyczynia się do rozwoju nowotworu można wyróżnić: protoonkogeny (1), geny supresorowe, zwane także antyonkogenami (2) oraz geny zwiększające częstość mutacji w genomie (3). Na szczególną uwagę zasługuje ludzki gen supresorowy określony jako p53. Mutacja obecna w tym genie jest najczęstszym defektem genetycznym stwierdzonym w ponad połowie wszystkich typów nowotworów. Transformacja nowotworowa wywołana przez defekt genu p53pojawia się w przypadku zadziałania dwustopniowego mechanizmu: inaktywacji białka p53na skutek mutacji punktowej w jednym allelu i utraty drugiego allelu. Produkt genu p53znany jest pod nazwami „białko p53” oraz „białko TP p53”.
Struktura genu p53
W haploidalnym genomie komórek organizmu człowieka, występuje pojedynczy gen p53, który zlokalizowano w chromosomie 17p, w strefach 12-13, 3. Mutacje w tym rejonie genu mogą powodować chorobę genetyczną nazwaną zespołem Li-Fraumeni (2). Gen p53składa się z 11 egzonów o łącznej masie 20 kpz. Strukturę pierwszorzędową białka p53poznano sekwencjonując cDNA (4). Masa cząsteczkowa białka p53człowieka wynosi 53 000 Da (stąd wyprowadzono nazwę genu i jego produktu). Natywne białko p53jest fosfoproteiną o składającą się z 393 aminokwasów zorganizowanych w trzy domeny (ryc. 1). N-końcowa domena (bogata w aminokwasy kwaśne) aktywuje transkrypcję, środkowa (rdzeniowa) wiąże się do specyficznych sekwencji DNA, natomiast C-końcowa (bogata w aminokwasy zasadowe) jest odpowiedzialna na tetrameryzacje białka umożliwiającą wiązanie się do promotorów, które zawierają wiele powtórzeń sekwencji palindromowej złożonej z 10 par zasad. Ta cecha powoduje zwykle aktywację (rzadziej inaktywację) transkrypcji DNA na mRNA. W wiązaniu domeny rdzeniowej p53do DNA kluczową rolę odgrywa sześć aminokwasów: 5 reszt argininy oraz reszta glicyny. Dwie argininy bezpośrednio oddziałują z helisą DNA, a pozostałe pełnią rolę stabilizującą. Aminokwasy te są częstym celem mutagenów, gdyż ich „wyłączenie” uniemożliwia transaktywację genów przez p53.
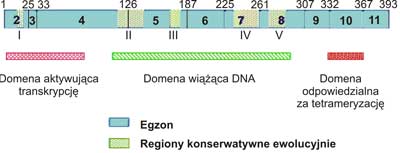
Ryc. 1. Struktura ludzkiego genu p53.
W komórkach myszy również znaleziono gen p53w chromosomie 11. Gen ten składa się z 11 eksonów i zawiera on około 12,5 kpz. W chromosomie 14 zidentyfikowano ponadto bezintronowy pseudogen p53, niezdolny do produkcji pełnej długości białka. Organizacja genu p53 człowieka i myszy jest podobna. Jednakże ludzki gen p53jest większy od funkcjonalnego genu myszy zawiera bowiem 20,3 kpz (Lamb P. 1986). Porównanie sekwencji ludzkiego i mysiego cDNA białka wskazuje na 78% homologię. Największą homologię (92%) stwierdza się w obrębie kodonów 156-288. Przypuszcza się, że ten właśnie region jest szczególnie ważny dla funkcji tego białka. Wykryto polimorficzne formy białka p53człowieka, które wynikały z różnic w strukturze kodonów 72 i 21 (6).
Mutacje w genie p53
W ponad połowie przypadków nowotworów u ludzi stwierdzono mutacje w genie p53 (3). Rozrzut mutacji badany wzdłuż całego genu nie jest równomierny. Mutacje występują głównie w obrębie eksonów 5-8, gdzie znajdują się cztery domeny o wysokiej konserwatywności (HCD II-V). Wyróżnia się 3, 4 lub nawet 5 do 6 gorących miejsc ( hot spot region, HSR), czyli regionów podatnych na mutacje (7) (ryc. 2). W wyszczególnionych pięciu regionach (gorących miejscach) wykrywa się ponad 70% wszystkich mutacji w genie p53. Dla porównania, w genie ras z rodziny protoonkogenów, stwierdzono mutacje transformujące jedynie w dwóch kodonach. Najliczniejsze mutacje w genie p53człowieka znajdowano w trzech kodonach CG(N) kodujących argininę: 175, 248 i 273 (ryc. 2). Może to mieć związek ze znaczną podatnością na spontaniczne mutacje dwunukleotydowej sekwencji CpG. W wymienionych trzech kodonach najczęściej dochodzi do tranzycji C do T lub G do A. W wielu przypadkach różnych typów nowotworów, w których stwierdzono mutacje w genie p53, najczęstsze były mutacje zmiany sensu. Insercje (wstawienia zasad) stanowiły 2%, mutacje nonsensowne 6%. Połowa reszty mutacji polegała na zmianie kodonu CGA w TGA i dotyczyła regionu pomiędzy pozycjami 196 a 213 w białkowym produkcie genu. Mutacje dziedziczne genu p53są rzadkie. Na całym świecie stwierdzono ok. 250 takich mutacji. Są one silnie związane z zespołem Li-Fraumeni oraz Li-Fraumeni-podobnym. Występują również w tzw. zespole wielonowotworowym.
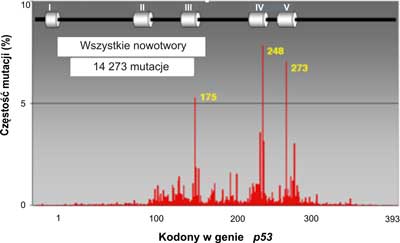
Ryc. 2. Rozrzut mutacji w ludzkim genie p53.
Analiza mutacji wskazuje na pewną współzależność między rodzajem mutacji a narządem, w którym rozwija się nowotwór. Świadczy to o tym, że zachodzi związek przyczynowy między rodzajem zmian mutacyjnych w genie p53a charakterem komórek lub tkanek, w których dochodzi do nowotworzenia oraz czynnikiem uszkadzającym DNA. Jednym z takich czynników jest produkt peroksydacji lipidów, którego głównym najbardziej reaktywnym składnikiem jest trans -4-hydroxy-2-nonenal (HNE). Może on powstawać w wyniku stanów zapalnych w komórkach i reagować bezpośrednio z DNA blokując jego replikacje DNA, tworząc wiązania krzyzowe ( crosslinks) (ryc. 3-5) na obu niciach; transkrybowanej i nietranskrybowanej.
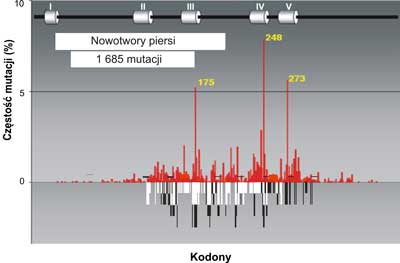
Ryc. 3. Porównanie mutacji w genie p53w nowotworach piersi (szare słupki) do spectrum uszkodzeń indukowanych przez produkt peroksydacji lipidów: trans -4-hydroxy-2-nonenalu (HNE) czarne słupki na nici transkrybowanej i białe słupki na nici nietranskrybowanej egzonach 5-8 p53gene (badania własne). Mutacje w nowotworach piersi wykorzystano z bazy danych (http://perso.curie.fr/Thierry.Soussi/p53_mutation).
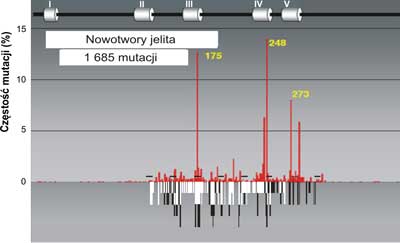
Ryc. 4. Porównanie mutacji w genie p53w nowotworach jelita (szare słupki) do spectrum uszkodzeń indukowanych przez produkt peroksydacji lipidów: trans -4-hydroxy-2-nonenalu (HNE) czarne słupki na nici transkrybowanej i białe słupki na nici nietranskrybowanej egzonach 5-8 p53gene (badania własne). Mutacje w nowotworach jelita wykorzystano z bazy danych (http://perso.curie.fr/Thierry.Soussi/p53_mutation).

Ryc. 5. Porównanie mutacji w genie p53w nowotworach prostaty (szare słupki) do spectrum uszkodzeń indukowanych przez produkt peroksydacji lipidów: trans -4-hydroxy-2-nonenalu (HNE) czarne słupki na nici transkrybowanej i białe słupki na nici nietranskrybowanej egzonach 5-8 p53gene (badania własne). Mutacje w nowotworach prostaty wykorzystano z bazy danych (http://perso.curie.fr/Thierry.Soussi/p53_mutation).
Zauważono, że dość częsta mutacja w obrębie kodonu 175, 248 i 273 spotykana w DNA licznych nowotworów np. piersi, jelita grubego, czy prostaty nigdy nie występuje w DNA raka płuc. Przykłady rozrzutu mutacji dla tych narządów w genie p53człowieka przedstawiają ryciny 3, 4, 5.
Właściwości i rola biologiczna białka p53
Okres połowicznego rozpadu białka p53wynosi około 20 minut. Jego krótka trwałość biologiczna utrudnia prowadzenie badań. Prawidłowe białko p53wykrywane jest w jądrze komórkowym, podczas gdy forma zmutowana – jedynie w cytoplazmie. Funkcjonalną postacią białka p53jest cząsteczka tetrametryczna Sekwencja aminokwasów w pobliżu C – końca cząsteczki białka determinuje możliwość oligomeryzacji i transportu do jądra komórkowego (8). Zasadniczym efektem działania prawidłowego białka p53 jest hamowanie wzrostu i różnicowania hodowanych in vitro komórek myszy i człowieka (9). Białko p53ma zdolność wiąząnia się z białkowymi produktami onkogennych wirusów: wirusa SV40, adenowirusa Eb1, wirusa Papilloma E6, a także z czynnikiem o najwyższej wśród białek aktywności transformacyjnej z produktem genu mdm2. Wykazano że wymienione wyżej białka przyłączają się do cząsteczki białka p53w różnych miejscach (10). Zdolność do wiązania się z białkiem p53wykazują również kinazy białkowe cdc2, kinaza kazeinowa II, a także białka szoku termicznego Hsc 70. Tetramer prawidłowego białka p53może wiązać się z dwuniciowym DNA (1). Charakter wiązania może być zarówno specyficzny, jak i niespecyficzny. Jedno takie miejsce wiązania zidentyfikowano w N – końcowym odcinku białka, w obrębie aminokwasów 1-42, gdzie zgrupowane są aminokwasy kwaśne. W wyniku przebadania wielu genomowych DNA stwierdzono, że prawidłowe białko p53wiąże się z 20-nukleotydowym palindromem występującym w niektórych DNA. Zdolność p53do wiązania się z DNA zanika, gdy białko to jest związane z dużym produktem genu mdm2 – antygenem wirusa SV 40 lub tworzy heterooligomery zawierające w swym składzie zmutowane podjednostki. Wykazano, że białko p53 jeżeli jest w jądrze może działać jako czynnik transkrypcyjny, wiązać się do specyficznych sekwencji DNA, aktywując transkrypcję ponad 60 genów przyległych do miejsca wiązania. Są to białka biorące udział w apoptozie oraz uczestniczące w naprawie DNA lub zatrzymaniu cyklu komórkowego. Natomiast, jeżeli p53 znajdzie się w cytoplazmie – nie ma możliwości regulacji ekspresji genów. Nie jest jednak jasne, gdzie dokładnie w cytoplazmie p53jest przechowywane i w jaki sposób jest transportowany do jądra.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Vogelstein B et al.: A deadly inheritance. Nature (Lond) 1990; 348: 681-682. 2. Oren M et al.: Tumor spressor teaming up to restrain cancer. EMBO J 1992; 3: 2179-2183. 3. Hollstein M et al.: p53Mutations in Human Cancers. Sciense, 1991; Vol. 253: 49-53. 4. Wolf D et al.: In vitro expression of human p53cDNA clones and characterization of the cloned human p53gene. Molecular Cell Biology 1985; 5: 1887-1893. 5. Lamb P et al.: p53, the cellular gatekeeper for growth and division. Mol Cel Biol 1986; 6: 1379-1385. 6. Matlasevski GJ et al.: Telling changes of base. Mol Cel Biol 1987; 7: 961-963. 7. Caron de Fromentel et al.: Rainbow trout p53cDNA doning and biochemical characterization. Genes Chromosomes and Cancer 1992; 4: 1-15. 8. Sidransky D et al.: Identyfication of ras Oncogene Mutations in the Stool of Patients with Curable Colorectal Tumors. Science 1992; 256: 102-105. 9. Chen PL et al.: Genetic mechanisms of Tumor Supression by the Human gene p53. Science 1990; 250: 1576-1580. 10. Barak Y et al.: p53tumor supressor gene of model for investigating human mutagenesis. EMBO J 1992; 11: 2115-2121. 11. Cho Y et al.: Crystal structure of a p53tumor suppressor-DNA complex: understanding tumorigenic mutations. Science 1994; 265: 346-355. 12. Gannon JV, Lane DP: p53and DNA polimerase a compete for binding to SV 40 T antigen. Nature 1987; 329: 456-458. 13. Farmer G et al.: Wild-type p53activates transcription in vitro. Nature 1992; 358: 83-86. 14. Kastan MB et al.: Participation of p53protein in the cellular response to DNA damage. Cancer Reseach 1991; 51: 6034-6311. 15. Zambetti GP et al.: A mutant p53protein is required for maintenance of the transformed phenotype in cells transformed with p53plus ras cDNAs. Proc Natl Acad Sci USA 1992; 89: 3952-3956. 16. Hinds PW et al.: Distribution of DNA damage in chromatin and its relation and its relation to repair in human cells. Mol Cel Biol 1987; 7: 2863-2869. 17. Kriek E et al.: Carcionogenesis by aromatic amines. Biochim Biophys Acta 1984; 738: 181-201. 18. Baker SJ et al.: p53gene mutations occur in combination with 17p allelic deletions as late events in colorectal tumorigenesis. Cancer Reseach 1990; 50: 7717-7722. 19. Harris CC et al.: p53: at the crossroads of molecular carcinogenenesis and molecular epidemiology. N Eng J Med 1993; 329: 1318-1327. 20. Lane DP et al.: p53, gurdian of the genome. Nature 1992; 316: 15-16.





