© Borgis - Postępy Nauk Medycznych s2/2011, s. 50-60
*Zbigniew Zdrojewski
Nerki w chorobach autoimmunologicznych**
The kidney in autoimmune diseases
Katedra i Klinika Chorób Wewnętrznych, Chorób Tkanki Łącznej i Geriatrii Gdańskiego Uniwersytetu Medycznego
Kierownik Katedry i Kliniki: prof. dr hab. med. Zbigniew Zdrojewski
Streszczenie
Zakłócenie mechanizmów tolerancji immunologicznej prowadzi do rozwoju chorób autoimmunologicznych. Nerki są często narządem dotkniętym tymi schorzeniami. Zmiany patologiczne dotyczyć mogą wszystkich struktur nerki: kłębuszków nerkowych, śródmiąższu i cewek nerkowych oraz naczyń wewnątrznerkowych. Stąd wynika bardzo bogata symptomatologia choroby nerek. Najczęstszymi, wczesnymi jej objawami są: białkomocz, krwinkomocz, nadciśnienie tętnicze i/lub zaburzenia funkcji cewek nerkowych. Mogą one prowadzić do ostrego uszkodzenia nerek lub przewlekłej choroby nerek, kończącej się schyłkową niewydolnością tego narządu.
Leczenie immunosupresyjne lub modyfikujące przebieg choroby podstawowej, zapobiega i/lub hamuje rozwój zmian w nerkach. Jednak niektóre stosowane leki wykazują działanie nefrotoksyczne. W artykule przedstawiono zmiany nerkowe w przebiegu niektórych chorób autoimmunologicznych.
Summary
The imbalance of immune tolerance mechanisms leads to development of autoimmune diseases which often affect kidneys. The inflammatory process can involve every morphological structure of the kidney e.g. glomeruli, interstitium, renal tubules, or blood vessels. This results in a wide spectrum of clinical symptoms of renal involvement, such as proteinuria, erythrocyturia, hypertension, or renal tubules dysfunction. The autoimmune inflammatory process causes acute renal impairment or chronic renal disease, leading to the end-stage renal failure.
The immunosuppressive drugs or disease modifying drugs prevent or inhibit the process of renal impairment. However, some of these drugs are proved to be nephrotoxic. In this paper the renal pathologies in the course of autoimmune diseases are described.

Autoimmunizacja reprezentuje końcowy wynik załamania się jednego lub kilku podstawowych mechanizmów regulujących tolerancję immunologiczną, która jest aktywnym procesem regulowanym i podtrzymywanym przez adaptujący się przez całe życie osobnicze układ immunologiczny (1). Warunkiem koniecznym dla zachowania tolerancji immunologicznej jest brak odpowiedzi limfocytów B i T na antygen podczas kontaktu tych limfocytów z antygenami obcymi lub własnymi, przy braku ekspresji cząsteczek kostymulujących na komórce prezentującej antygen. Tolerancja wobec antygenów może być podtrzymywana za pomocą licznych ośrodkowych i obwodowych mechanizmów regulacji układu immunologicznego. Organizm człowieka posiada szereg mechanizmów zapobiegających autoimmunizacji. Zakłócenie tych mechanizmów prowadzi do rozwoju chorób autoimmunologicznych.
Nerki są narządem dotkniętym w większości przypadków chorobami autoimmunologicznymi. Do czynników wpływających na nagły rozwój autoimmunologicznej choroby nerek (przełamania tolerancji) należą:
1. Czynniki genetyczne związane z gospodarzem.
2. Czynniki środowiskowe (infekcje, stres, toksyny, czynniki fizyczne, światło słoneczne).
3. Autoprzeciwciała nefrytogenne (bezpośrednio łączą się z antygenami nerkowymi oraz egzogennymi antygenami znajdującymi się w nerce, wywołującymi zapalenie i uszkodzenie).
4. Zaburzenie funkcji limfocytów T, B i komórek prezentujących antygen (APC).
Wśród najczęstszych układowych chorób autoimmunologicznych dotyczących nerek należy wymienić:
– toczeń rumieniowaty układowy,
– reumatoidalne zapalenie stawów,
– zespół Sjőgrena,
– zespół antyfosfolipidowy,
– twardzinę układową,
– układowe martwicze zapalenie naczyń.
Zmiany nerkowe występujące w przebiegu niektórych z nich, zostaną omówione poniżej.
Nefropatia toczniowa
Nefropatia toczniowa (NT, LN – lupus nephritis) należy do częstych powikłań tocznia rumieniowatego układowego (TRU). Uważa się, że rozwija się ona u około 60-80% chorych z rozpoznaniem tego schorzenia (2).
Zmiany w nerkach dotyczą: kłębuszków nerkowych, cewek nerkowych, śródmiąższu nerek i naczyń wewnątrznerkowych. W etiopatogenezie nefropatii toczniowej zasadniczą rolę odgrywają toksyczne przeciwciała i kompleksy immunologiczne, wywołujące nieprawidłową odpowiedź zapalną (3). Umiejscowienie kompleksów immunologicznych w kłębuszkach nerkowych jest zdeterminowane ich: specyficznością, powinowactwem do tkanek, siłą wiązania, klasą, rozmiarem i wartościowością (4).
W mezangium odkładają się nieliczne i małe kompleksy immunologiczne, uformowane z przeciwciał o wysokim powinowactwie do tkanek. Powodują one migrację komórek zapalnych, które rozpoczynają produkuję różnych cytokin. W konsekwencji prowadzi to do nasilonej proliferacji komórek mezangialnych oraz produkcji macierzy mezangialnej (glomerulopatia mezangialna).
Podśródbłonkowo odkładają się duże kompleksy immunologiczne krążące w znacznej ilości, złożone z przeciwciał o wysokiej sile wiązania. Zwykle przeładowane jest nimi już mezangium. Aktywują one krążące składniki układu dopełniacza i receptory Fc na leukocytach oraz molekuły adhezyjne (ICAM-1). Nasilają również odkładanie DNA w pętlach naczyniowych, wiązanie przeciwciał z DNA i innymi strukturami kłębuszka. Dochodzi do nacieku zapalnego złożonego z limfocytów T, neutrofili i makrofagów, martwicy pętli naczyniowych, szkliwienia i włóknienia (rozlana rozplemowa glomerulopatia).
Lokalizacja podnabłonkowa dotyczy małych, niestabilnych kompleksów immunologicznych, o małym powinowactwie i sile wiązania, które są tworzone przy nadmiarze antygenu (glomerulopatia błoniasta).
Aktywne uszkodzenie kłębuszków nerkowych obejmuje: rozplem endokapilarny z/lub bez nacieku leukocytów i redukcją światła naczynia, kariorrhexis, martwicę włóknikowatą, pęknięcia błony podstawnej, półksiężyce komórkowe, depozyty podśródbłonkowe (pętle drutu) oraz złogi hialinowe w świetle naczyń.
Sklerotyczne uszkodzenie kłębuszków nerkowych charakteryzuje się natomiast ich szkliwieniem (segmentalne, rozlane) i włóknienieniem (półksiężyce włókniste). Zmiany w cewkach i śródmiąższu w okresie aktywnym choroby są wynikiem wchłaniania białek do komórek cewek proksymalnych, tworzeniem komórek piankowatych, naciekiem limfocytów T (tubulitis) i złogami kompleksów immunologicznych na błonie podstawnej cewek, natomiast przewlekłe uszkodzeni charakteryzuje się atrofią cewek oraz włóknieniem cewkowo-śródmiąższowym.
W części bioptatów nerki stwierdza się uszkodzenie naczyń, które może mieć następujący obraz:
– niepowikłane (bez zapalenia) złogi immunologiczne w naczyniach (małe tętnice, arteriole),
– niezapalna martwicza waskulopatia (lupus vasculopathy) – dotyczy tętniczek doprowadzających, tętnic międzypłatowych i charakteryzuje się złogami eozynochłonnego materiału w intimie,
– mikroangioaptia zakrzepowa – dotyczy tętnic międzypłatowych, tętnic doprowadzających, kłębuszków z obecnymi zakrzepami w pętlach naczyniowych kłębuszków nerkowych i mezangiolizą,
– martwicze zapalenie naczyń z naciekiem leukocytów.
Obraz kliniczny nefropatii toczniowej jest różnorodny, od postaci łagodnych z obserwowanymi niewielkimi zmianami w moczu do szybko postępującej niewydolności nerek (5). Najczęściej u pacjentów, głównie płci żeńskiej, będących pod ambulatoryjną opieką reumatologiczną, obserwuje się pojawienie zmian w moczu pod postacią białkomoczu i krwinkomoczu (6). Pierwszym objawem nefropatii toczniowej może być duży białkomocz z klinicznym obrazem zespołu nerczycowego (ZN). Często zespół nerczycowy rozwija się nagle, jako jeden z objawów bardzo aktywnej choroby układowej, nawet u chorych, u których wcześniej nie rozpoznawano nefropatii. Rzadko obserwuje się przypadki gwałtownie postępującego kłębuszkowego zapalenia nerek, obciążone poważnym rokowaniem odnośnie powrotu funkcji nerek (7). U chorych z nefropatią toczniową, u których pomimo leczenia, utrzymuje się białkomocz powyżej 1 g na dobę, obserwuje się powolny postęp przewlekłej choroby nerek, co w końcu doprowadza po wielu latach do konieczności leczenia nerkozastępczego.
Głównym wskaźnikiem aktywności procesu zapalnego w kłębuszku jest erytrocyturia, która wynika z przerwania ciągłości ściany naczyniowej i wytworzenia w niej tzw. dziur. Prawdopodobnie dziury powstają w wyniku reakcji enzymów proteolitycznych, uwalnianych przez komórki zapalne (8). Odkładanie się dużej ilości kompleksów immunologicznych wzdłuż błony podstawnej kłębuszka, prowadzi do jej uszkodzenia, konsekwencją tego jest białkomocz. Inną przyczyną białkomoczu jest uszkodzenie podocyta , zasadniczego składnika bariery filtracyjnej.
W momencie ustalenia rozpoznania choroby układowej, już u około 50% chorych obserwuje się nefropatię, dlatego też American College of Rheumatology (ACR), uważa, że nefropatia stanowi jedno z głównych kryteriów rozpoznania tocznia rumieniowatego układowego.
W celu usystematyzowania zmian biopsyjnych, co ma znaczenie w planowaniu terapii, wprowadzono klasyfikację nefropatii toczniowej opracowaną przez WHO w 1974 roku. Była ona wielokrotnie modyfikowana (9). Na jej podstawie grupa nefrologów i nefropatologów w 2003 roku zaproponowała nową rozszerzoną klasyfikację nefropatii toczniowej (tab. 1) (10). Nadal jednak występują trudności w przypisaniu poszczególnym postaciom morfologicznym konkretnego obrazu klinicznego nefropatii. Przy obecności zmian morfologicznych w nerce opisywanych jako klasa I i II mogą nie być obserwowane żadne zmiany w moczu, jedynie w klasie II może wystąpić niewielki białkomocz, zwykle poniżej 1g na dobę i/lub może być obecna niewielka erytrocyturia, ale nie większa niż od 5 do 10 erytrocytów w polu widzenia. Natomiast zespół nerczycowy może wystąpić zarówno w klasie III, IV, V a nawet VI wg WHO. Dlatego też wątpliwości te wskazują na celowość i konieczność wykonywania biopsji nerki u chorych z nefropatią toczniową (11). Zgodnie z obowiązującymi zaleceniami biopsję nerki wykonuje się u chorych z podejrzeniem nefropatii toczniowej; białkomoczem powyżej 1g na dobę i erytrocyturią.
Tabela 1. Klasyfikacja nefropatii toczniowej według International Society of Nephrology/Renal Pathology Society (ISN/RPS) z 2003 roku.
Klasa I: Minimalne zmiany mezangialne
Prawidłowe kłębuszki w LM
Mezangialne depozyty immunoglobulin w IF |
Klasa II: Zmiany mezangialne proliferacyjne
Rozplem komórek mezangium różnego stopnia, przerost macierzy mezangium w LM, złogi immunoglobulin w mezangium podśródbłonkowe lub podnabłonkowe depozyty, obecne w IF lub EM, lecz bez w LM |
Klasa III: Zmiany ogniskowe
Aktywne (A) lub nieaktywne ogniskowe, segmentalne (S) lub globalne (G) wewnątrz- lub zewnątrzwłośniczkowe KZN, zajmujące poniżej 50% kłębuszków, typowe złogi podśródbłonkowe ogniskowo, z/bez zmianami w mezangium
III (A): Zmiany aktywne: ogniskowe proliferacyjne
III (A/C): Zmiany aktywne i przewlekłe (C): ogniskowe proliferacyjne i stwardnieniowe |
Klasa IV: zmiany aktywne lub nieaktywne rozlane
Segmentalne, globalne wewnątrz- lub zewnątrzwłośniczkowe KZN, zajęte >50% kłębuszków,
rozlane podśródbłonkowe złogi immunoglobulin
obecne lub nie zmiany w mezangium segmentalne lub globalne (IV-S lub IV-G) |
Klasa V: Błoniaste KZN
Globalne lub segmentalne podnabłonkowe złogi immunoglobulin lub
podobnej morfologii zmiany w LM i IF, EM z/bez zmianami w mezangium
Klasa V może występować w kombinacjach z III i IV
Klasa V mogą występować zmiany zaawansowane jak stwardnienie kłębuszków |
Klasa VI:
Zaawansowane zmiany stwardnieniowe w kłębuszkach
> 90% kłębuszków globalnie stwardniałych,
bez cech aktywności |
Objaśnienia: LM – mikroskop świetlny; light microscope
IF – mikroskop immunofluorescencyjny; immunofluorescent microscope
EM – mikroskop elektronowy; electron microscope
KZN – kłębuszkowe zapalenie nerek; chronic glomerulonephritis
LN – nefropatia toczniowa; lupus nephritis
W leczeniu nefropatii toczniowej stosowanych jest kilka leków immunosupresyjnych i jak na razie nie posiadamy jednolitego schematu leczenia. W codziennej działalności klinicznej bardzo użyteczny jest schemat postępowania zaproponowany na rycinie 1, oparty na zaleceniach Bertsiasa i Boumpasa (12).
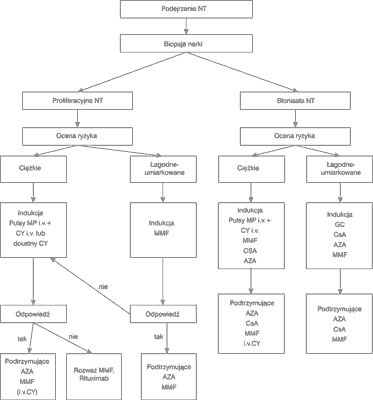
Ryc. 1. Leczenie nefropatii toczniowej (NT) (12).
Nadal otwartym problemem pozostaje czas trwania terapii immunosupresyjnej oraz dawkowanie tych leków. Zasady leczenia nefropatii toczniowej oparte są na doświadczeniach pojedynczych ośrodków oraz kilku opublikowanych badaniach wieloośrodkowych (13-15). Rezultaty leczenia nefropatii toczniowej polegają na ocenie aktywności choroby nerek, co oznacza monitorowanie wydalania białka i krwinek czerwonych z moczem oraz monitorowanie parametrów funkcji nerek, czyli stężenia kreatyniny i/lub wielkości filtracji kłębuszkowej (GFR), liczonej według wzoru MDRD albo oznaczanego jako wielkość klirensu kreatyniny endogennej. Wydalanie białka z moczem można oceniać w dobowej zbiórki moczu albo w porcji rannej i wówczas wydalanie białka z moczem przelicza się na gram kreatyniny w moczu. Dodatkowo monitoruje się zaburzenia gospodarki białkowej i lipidowej, które głównie są wynikiem utraty białek z moczem. Rzadziej wykonuje się kontrolne biopsje nerek po roku leczenia (6, 7).
W ocenie leczenia nefropatii toczniowej bierze się pod uwagę także ocenę aktywności choroby autoimmunologicznej. Monitorowanie to polega na ocenie klinicznej. Najczęściej stosuje się skale, takie jak: SELENA-SLEDAI, BILAG (16). Jedynie przeciwciała przeciw natywnemu DNA (nDNA) lub przeciw dwuniciowemu DNA (dsDNA) są stosunkowo charakterystyczne dla pacjentów z powikłaniami nerkowymi TRU. Niestety u około 30% chorych z aktywną nefropatią toczniową nie stwierdza się obecności tych przeciwciał.
Ze względów zakresu obecnego opracowania możliwe jest odnotowanie kilku uwag dotyczących leczenia NT. W leczeniu tego schorzenia stosuje się co najmniej kilka leków immunosupresyjnych. Podstawowa terapia opiera się na leczeniu glikokortykosteroidami (GC), a wzbogacona jest o takie leki, jak: cyklofosfamid, azatiopryna, cyklosporyna czy mykofenolan mofetilu. Ten klasyczny zestaw leków może być w najbliższych latach zastąpiony lekami stosowanymi w tzw. terapii biologicznej, takimi jak: abatacept, rituksymab, epratuzumab czy ocrelizumab.
Obowiązującym schematem leczenia jest podawanie pulsów dożylnych metylprednizolonu, zwykle w dawce łącznej 3,0 g, a następnie postaci doustnej: prednizonu, prednizolonu czy metylprednizolonu (12). W aktywnej nefropatii toczniowej, kiedy w biopsji nerki stwierdza się zmiany klasy III, IV, Vb wg WHO, należy do GC dołączyć inny lek immunosupresyjny (13, 14). U chorych z rozpoznaniem tocznia rumieniowatego układowego, otrzymujących przewlekle GC i w przypadku pojawienia się nieznacznego białkomoczu, zwiększa się dawkę leków doustnych lub podaje się pulsy steroidowe. Ten schemat leczenia funkcjonuje w wielu ośrodkach. Obecność zmian morfologicznych w biopsji nerki – I lub II klasy wg WHO nie wskazuje na konieczność modyfikacji leczenia i zastosowania cytostatyków.
Cyklofosfamid od wielu lat jest z powodzeniem stosowany w leczeniu aktywnej nefropatii toczniowej. Pozostaje lekiem numer jeden w leczeniu aktywnej nefropatii toczniowej (17, 18). Można go podawać u chorych z prawidłową, jak i z obniżoną funkcją nerek. Podkreśla się wysoką efektywność leku w terapii ciężkich postaci nefropatii, w tym z ciężkim zespołem nerczycowym i postępującą niewydolnością nerek. Po przekroczeniu dawki kumulacyjnej leku, która w przypadku podawania leku parenteralnie wynosi 0,3 g/kg masy ciała, praktycznie dalsze leczenie z użyciem cyklofosfamidu jest przeciwwskazane.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Imoagene-Oyedeji AE, Madaio MP: Pathogenesis of renal disease: Autoimmunity. In Mason JC, Pusey ChD, editors. The kidney in systemic autoimmune disease. First edition. Oxford: Elsevier 2008; 23-42.
2. Cameron SJ: Lupus nephritis. J Am Soc Nephrol 1999; 10: 413-424.
3. Clatworthy MR, Smith KGC: Systemic lupus erythematosus: Mechanism. In Mason JC, Pusey ChD, editors. The kidney in systemic autoimmune disease. First edition. Oxford: Elsevier 2008; 286-309.
4. Cook HT, Lightstone L: Systemic lupus erythematosus: Renal involvement. In Mason JC , Pusey ChD, editors. The kidney in systemic autoimmune disease. First edition. Oxford: Elsevier 2008; 313-321.
5. Andreoli SP: Renal manifestations of systemic diseases. Semin Nephrol 1998; 18: 270-279.
6. Klinger M, Oko A, Mazanowska O, Bułło B: Rozpoznawanie i leczenie nefropatii w przebiegu chorób układowych. [W:] Rutkowski B, Czekalski S (red.): Rozpoznawanie i leczenie chorób nerek – wytyczne, zalecenia i standardy postępowania. Termedia Wydawnictwo Medyczne, Poznań 2008; 82-93.
7. Yu F, Tan Y, Liu G et al.: Clinicopathological characteristics and outcomes of patients with crescentic lupus nephritis. Kidney Int 2009; 76: 307-317.
8. Austin HA: Clinical evaluation and monitoring of lupus kidney disease. Lupus 1998; 7: 618-621.
9. Appel GB, Radhakrishnan J, D’Agati V: Systemic lupus erythematosus. In Brenner BM, editors. The Kidney. Philadelphia: WB Sanders 2000; 1350-1365.
10. Weening JJ, D’Agati VD, Schwartz MM et al.: on behalf of the International Society of Nephrology and Renal Pathology Society Working Group on the Classification of Lupus Nephritis:.The classification of glomerulonephritis in systemic lupus erythematosus revised. Kidney Int 2004; 65: 521-530.
11. Bihl GR, Petri M, Fine DM: Kidney biopsy in lupus nephritis: look before you leap. Nephrol Dial Transplant 2006; 21: 1749-1752.
12. Bertias G, Boumpas D: Update on the management of lupus nephritis: let the treatment fit the patient. Nat Clin Prac Nephrol 2008; 4: 464-472.
13. Boumpas DT, Austin HA, Vaughn EM et al.: Controlled trial of pulse methylprednisolone versus two regiments of pulse cyclophosphamide in severe lupus nephritis. Lancet 1992; 340: 8822, 741-745.
14. Houssiau FA, Vasconcelos C, D’Cruz D et al.: Immunosuppressive therapy in lupus nephritis. The Euro-Lupus Nephritis Trial, a Randomized Trial of Low-Dose Versus High-Dose Intravenous Cyclophosphamide. Arthritis Rheum 2002; 46: 2121-2131.
15. Chan TM: Mycophenolate mofetil in the treatment of lupus nephritis – 7 years on. Lupus 2008; 17: 617-621.
16. Wiland P, Madej M, Szmyrka-Kaczmarek M: Monitorowanie stanu pacjenta w chorobach reumatycznych. Górnicki Wyd Med., Wrocław 2008.
17. Klinger M, Rychlewska B, Czyż W: Comiesięczne dożylne wlewy cyklofosfamidu w leczeniu toczniowego zapalenia nerek. Pol Arch Med Wewn 1994; 92: 70-77.
18. Sesso R, Monteiro M, Sato E et al.: A controlled trial of pulse cyclophosphamide versus pulse methylprednisolone in severe lupus nephritis. Lupus 1994; 3: 107-112.
19. Appel G B, Conteras G, Dooley MA et al. and Aspreva Lupus Management Study Group: Mycophenolate mofetil versus cyclophosphamide for induction treatment of lupus nephritis. J Am Soc Nephrol 2009; 20: 1103-1112.
20. Bułło B, Rutkowski B: Mykofenolan mofetilu w leczeniu nefropatii toczniowej – doświadczenia jednego ośrodka. Nefrol Nadciśnienie Tętnicze 2007; 6: 15-22.
21. Moroni G, Doria A, Ponticelli C: Cyclosporine (CsA) in lupus nephritis: assessing the evidence. Nephrol Dial Transplant 2009; 24: 15-20.
22. Tahir H, Isenberg DA: Novel therapies in lupus nephritis. Lupus 2005; 14: 77-82.
23. Dall’Era M, Wofsy D: Systemic lupus erythematosus clinical trials – an interim analysis. Nature Reviews Rheumatology 2009; 5: 348-351.
24. Isenberg DA: Treating patients with lupus B-cell depletion. Lupus 2008; :17, 400-404.
25. Hughes G: Rituximab in lupus and beyond: the state of the art. Lupus 2009; 18: 639-644.
26. Reynolds JA, Toescu V, Mee CS et al.: Effects of rituximab on resistant SLE disease including lung involvement. Lupus 2009; 18: 7-73.
27. Sabahi R, Anolik JH: B-cell-targeted therapy for systemic lupus erythematosus. Drugs 2006; 66: 1933-1948.
28. Jacobi AM, Goldenberg DM, Hiepe F et al.: Differential effects of epratuzumab on peripheral blood B cells of patients with systemic lupus erythematosus versus normal controls. Ann Rheum Dis 2008; 67: 450-457.
29. Robak E, Robak T: Monoclonal antibodies therapy in the treatment of sytemic lupus erythematosus. Curr Drug Targets 2009; 10: 26-37.
30. Majdan M: Nerki w reumatoidalnym zapaleniu stawów. [W:] Myśliwiec M (red.) Nefrologia Wielka Interna. Warszawa: Medical Tribune Polska 2008; 224-227.
31. Bijlsma JWJ: Optimal treatment of rheumatoid arthritis: EULAR recommendations for clinica practice. Pol Arch Int Med 2010; 120:347-352.
32. Zdrojewski Z: Amyloidoza w chorobach reumatycznych. Ann Acad Med Stet 2010; 56 (suppl 1): 7-15.
33. Dember LM: Amyloidosis-associated kidney disease. J Am Soc Nephrol. 2006; 17: 3458-71.
34. Bergesio F, Ciciani AM, Santostefano M, et al.: Renal involvement in systemic amyloidosis--an Italian retrospective study on epidemiological and clinical data at diagnosis. Nephrol Dial Transplant 2007; 22: 1608-18.
35. Bollée G, Guery B, Joly D et al.: Presentation and outcome of patients with systemic amyloidosis undergoing dialysis. Clin J Am Soc Nephrol 2008; 3: 375-81.
36. Pettersson T, Konttinen YT, Maury CP: Treatment strategies for amyloid A amyloidosis. Expert Opin Pharmacother 2008; 9: 2117-28.
37. Gottenberg JE, Merle-Vincent F, Bentaberry F et al.: Anti-tumor necrosis factor alpha therapy in fifteen patients with AA amyloidosis secondary to inflammatory arthritides: a follow up report of tolerability and efficacy. Arthritis Rheum 2003; 48: 2019-24.
38. Perry ME, Stirling A, Hunter JA: Effect of etanercept on serum amyloid A protein (SAA) levels in patients with AA amyloidosis complicating inflammatory arthritis. Clin Rheumatol 2008; 27: 923-5.
39. Nakamura T, Higashi S, Tomoda K et al.: Efficacy of etanercept in patients with AA amyloidosis secondary to rheumatoid arthritis. Clin Exp Rheumatol 2007; 25: 518-22.
40. Sato H, Sakai T, Sugaya T et al.: Tocilizumab dramatically ameliorated life-threatening diarrhea due to secondary amyloidosis associated with rheumatoid arthritis. Clin Rheumatol 2009; 28: 1113-6
41. Dember LM, Hawkins PN, Hazenberg BP et al.: Eprodisate for AA Amyloidosis Trial Group. Eprodisate for the treatment of renal disease in AA amyloidosis. N Engl J Med 2007; 356: 2349-60.
42. Salama AD. Renal toxicities associated with immunomodulatory drugs. In: Mason JC , Pusey ChD, editors. The kidney in systemic autoimmune disease. First edition. Oxford: Elsevier 2008; 107-122.
43. Cervera R, Piette JC, Font J et al.: Euro Phospholipid Project Group. Antiphospholipid syndrome: clinical and immunologic manifestations and patterns of disease expression in a cohort 1.000 patients. Arthriti Rheum 2002; 446: 1019-1027.
44. Aasarod K, Haga HJ, Berg KJ et al.: Renal involvement in primary Sjogren’s syndrome. QJM 2000; 93: 297-303.
45. Skopouli FN: Kidney injury in Sjogren’s syndrome. Nephrol Dial Transplant 2001; 16 Suppl 6): 63-70.
46. Steen VD: The kidney in systemic sclerosis. In Mason JC, Pusey ChD, editors. The kidney in systemic autoimmune disease. First edition. Oxford: Elsevier 2008; 363-381.
47. Donohoe JF: Scleroderma and the kidney. Kidney Int 1992; 41: 768-770.
48. Helfrich DJ, Banner B, Steen VD: Normotensive renal failure in systemic sclerosis. Arthritis rheum 1989; 32: 1128-1134.
49. Siragy HM, de Gasparo M, El Kersh M et al.: Angiotensin converting enzyme inhibition potentiates angiotensin II type 1 receptor effects on renal bradykinin and cGMP. Hypertension 2001; 38: 1230-1232.
50. Kowal-Bielecka O, Landewe R, Avouac J et al.: EUSTAR Co-Autors. EULAR recommendations for the treatment of systemie sclerosis: a report from the EULAR Scleroderma Trials and Research group (EUSTAR). Ann Rheum Dis 2009; 68: 620-628.

