© Borgis - Postępy Nauk Medycznych s2/2012, s. 1-56
Dr n. med. Sebastian Stec
Ablacja arytmii komorowej u chorych bez organicznej choroby serca
Rozprawa habilitacyjna
Catheter ablation of ventricular arrhythmias in patients without organic heart disease
Klinika Kardiologii Centrum Medycznego Kształcenia Podyplomowego, Oddział Kliniczny Kardiologii, Szpital Grochowski
Streszczenie
Wprowadzenie
Wiedza na temat skuteczności przeskórnej ablacji prądem o częstotliwości radiowej (RFCA) bez systemów mapowania 3-wymiarowego (3D) i charakterystyka chorych z przedwczesnymi skurczami dodatkowymi (PVC) i częstoskurczami komorowymi (VT) bez organicznej choroby serca (IVA) jest ograniczona. Celem pracy jest ocena skuteczności krótko- i długoterminowej, czynników rokowniczych i charakterystyki klinicznej chorych z IVA poddanych długoterminowej obserwacji po zabiegu RFCA.
Materiały i metody
Do prospektywnej obserwacji włączono dane epidemiologiczne i elektrofizjologiczne 243 chorych z IVA (wiek: 46 ± 16lat, 62% kobiet, PVC/24h: 18050±13370, czas obserwacji: 41 miesięcy) poddanych zabiegowi RFCA bez systemu 3D w dwóch, polskich ośrodkach w latach 2005-2010.
Wyniki
Typowe, mnie typowe i nietypowe objawy arytmii wystąpiły u odpowiednio 87,2%, 78,9% i 24,0% chorych. Najczęstszą lokalizacją ognisk arytmii była droga odpływu prawej komory (RVOT – 62,6% PVC/VT). Liczba PVC w badaniu EKG metodą Holtera nie korelowała z nasileniem objawów arytmii (p = NS), ale korelowała odwrotnie z wartością frakcji wyrzutowej lewej komory (p < 0,01). Nie stwierdzono istotnych różnic w przebiegu ablacji i rokowania w podgrupach z PVC lub VT. Kardiomiopatię związaną z arytmią (PVC/VT-DCM) rozpoznano u 8% chorych z IVA, ale w przeważającej liczbie (80%) u chorych z PVC. Ablacja IVA bez systemu 3D i w większości zabiegów z zastosowaniem 1 elektrody była skuteczna u 80% chorych po pierwszym zabiegu. W obserwacji długoterminowej osiągnięto skuteczność 95% po wykonaniu średnio 1,2 ± 0,5 zabiegu bez dużych istotnych powikłań okołozabiegowych. Kilka wskaźników przewidywało niezależnie skuteczność bezpośrednią zabiegu [łączny czas aplikacji ≤ 400 sekund, dwuliterowy kształt potencjału jednobiegunowego, odpowiedź na ablację typu „warm-up” lub nagły zanik arytmii) i lokalizacja arytmii w RVOT], jednak żaden parametr elektrofizjologiczny miał wartości rokowniczej dla przewidywania odległego efektu zabiegu.
Wnioski
RFCA bez systemu 3D w populacji IVA jest skuteczną i bezpieczną metodą w obserwacji długoterminowej. Pozwala ona na uzyskanie remisji wielu typowych i nietypowych objawów arytmii oraz PVC/VT-DCM.
Summary
Introduction
There are limited information of efficacy of radiofrequency catheter ablation (RFCA) without 3D mapping systems and clinical chracteristics of patients with idiopathic ventricular arrhythmias (IVA): premature ventricular complexes (PVC) and ventricular tachycardias (VT). The aim of the study was to evaluate clinical predictors of short and long-term efficacy and clinical characteristics of patients with IVA after RFCA.
Material and methods
Epidemiological and electrophysiological data of 243 consecutive patients with IVA (mean age: 46 ± 16.62% women, PVC/24 h: 18050 ± 13370, mean follow-up: 41 months) were prospectively analysed. Patients were recruited from 2 Polish centers performing RFCA without 3D system between 2005 and 2010.
Results
Typical, less typical and atypical symptoms associated with IVA were documented in 87.2%, 78.9% i 24.0% patients, respectively. Focal origin of IVA was predominantly found in right ventricular outflow tract (RVOT – 62.6% PVC/VT). Number of PVC during Holter monitorings did not correlate with severity of symptoms (p = NS), however inverse correlation was found with left ventricular ejection fraction (p < 0.01). There were not significant differences between ablation parameters and prognosis in patients with PVC only and VT. Arrhythmia-mediated dilated cardiomyopathy (PVC/VT-DCM) was documented in 8% of patients, but in 80% was associated with PVC only. RFCA mainly with the use of single-catheter approach was effective in 80% of patients after single procedure. In long-term follow-up 95% of success rate was achieved after a mean 1.2 ± 0.5 procedures without significant mayor complications. Some electrophysiological parameters were independent predictors of acute success [total aplication time ≤ 400 seconds, complex morphology of unipolar signal, „warm-up” or „sudden dissappearance of PVC” response during application or RVOT arrhythmia origin], however none of them long-term efficacy.
Conclusions
In patients with IVA, RFCA without 3D mapping system is safe and effective curative strategy in long-term follow-up. This may lead to remission of various typical and atypical symptoms as well as PVC/VT-DCM.

Wprowadzenie
Wstęp
Arytmia komorowa bez organicznej choroby serca (zwana idiopatyczną arytmią komorową – idiopathic ventricular arrhythmia – IVA) jest dość często występującym problemem klinicznym. Ocenia się, że przedwczesne pobudzenia komorowe (premature ventricular complexes – PVC) występują u około 1% populacji w przedłużonym standardowym zapisie elektrokardiograficznym (EKG), a liczne PVC lub złożone arytmie komorowe są stwierdzane w 24-godzinnych zapisach EKG metodą Holtera u około 4% populacji ogólnej.(1-3)
Pierwszy opis badania tętna obwodowego i zjawisk związanych z PVC podał w IV wieku przed naszą erą Herofilus z Aleksandrii. W roku 1903 Wenckebach potwierdził pochodzenie przerwy w tętnie tzw. „pulsus intermittens” z serca.(4) Wprowadzenie badania EKG na początku XX wieku umożliwiło rejestrację różnych postaci arytmii. Pierwszy opis IVA przedstawił w roku 1922 Gallavardin.(5) W roku 1969 Rosenbaum określił PVC o morfologii bloku lewej odnogi pęczka Hisa (Left bundle branch block – LBBB) i zwrocie osi elektrycznej skierowanej w dół jako typowe dla zdrowych osób.(6)
U chorych z PVC (> 1000 PVC na dobę) bez cech choroby sercowo-naczyniowej długoterminowe badania w niezbyt dużych populacjach chorych wykazały niskie ryzyko powikłań sercowo-naczyniowych (cardiovascular events – CVE) i nagłej śmierci sercowej (Sudden Cardiac Death – SCD). U większości chorych z IVA nie występują objawy arytmii lub mają one łagodny charakter. W długoterminowej obserwacji bezobjawowe PVC u 20-40% mogą ulec spontanicznej remisji.(7-10) Obserwacje te stały się podstawą dla określania IVA jako arytmii „łagodnej” i związanej z niskim ryzykiem SCD.(11-13)
Pomimo klasyfikacji idiopatycznych PVC i częstoskurczów komorowych (ventricular tachycardia – VT) jako łagodnych arytmii wzrasta liczba badań i obserwacji potwierdzających związek IVA z występowaniem istotnych, ograniczających jakość życia objawów oraz powikłań, decydujących o potrzebie leczenia antyarytmicznego.(11-13) Skuteczne leczenie objawowej IVA prowadzi do usunięcia objawów arytmii i istotnej poprawy wskaźników jakości życia.(14-17) Pojedyncze PVC mogą wpływać na różnorodne parametry aktywności układu współczulnego i przywspółczulnego, wskaźniki hemodynamiczne układu krążenia i serca oraz powodować powstawanie nietypowych odruchów lub uciążliwych objawów.(9, 18-31) Liczne PVC i/lub VT mogą prowadzić do rozwoju kardiomiopatii rozstrzeniowej (DCM), która po skutecznym leczeniu ulega remisji.(32-40) U niektórych chorych pojedyncze PVC mogą indukować zaburzenia elektrofizjologiczne będące przyczyną polimorficznych częstoskurczów komorowych (PMVT) i migotań komór (VF) prowadząc do nagłego zatrzymania krążenia (NZK) lub SCD.(41-49)
W ostatnich 20 latach ablacja prądem o częstotliwości radiowej (RF) lub przy wykorzystaniu innych źródeł energii zrewolucjonizowała postępowanie w leczeniu arytmii. Rozwój elektrofizjologii ablacyjnej dokonał się dzięki wprowadzeniu wielu bardzo nowoczesnych metod diagnostycznych i terapeutycznych pozwalających na bardziej precyzyjne i bezpieczne przeprowadzanie zabiegów ablacji.(11-13, 50-59) Na zwiększającą się populację chorych z IVA kierowaną do leczenia inwazyjnego mogą mieć również wpływ standardy leczenia i rekomendacje publikowane przez europejskcie i amerykańskie towarzystwa kardiologiczne oraz towarzystwa rytmu serca.(11-13, 55-56)
W ostatnich 2 dekadach nastąpił bardzo istotny rozwój wiedzy elektrofizjologicznej, poprawa bezpieczeństwa i skuteczności zabiegów ablacji w IVA. Jednocześnie badania wskazują na ograniczoną odległą skuteczność i tolerancję leczenia farmakologicznego.(11-14, 17, 60-64) Stało się to podstawą dla ekspertów europejskich i amerykańskich towarzystw kardiologicznych do rozszerzenia wskazań do leczenia ablacją nie tylko na populację objawowych chorych bez choroby organicznej serca z VT, ale również na populację objawowych chorych z licznymi PVC, chorych bezobjawowych z bardzo licznymi PVC, lub chorych objawowych wybierających leczenie ablacją jako leczenie pierwszego rzutu bez udokumentowanej nieskuteczności lub nietolerancji leczenia farmakologicznego.(11, 13)
W największym aktualnym narodowym rejestrze ablacji w roku 2006 i 2010 w Hiszpanii IVA stanowiły około 3% ogółu wskazań do wykonania procedur (więcej niż arytmie komorowe pozawałowe), ale liczba chorych z IVA poddanych ablacji wzrosła w tym czasie dwukrotnie.(58, 59)
Charakterystyka i definicja idiopatycznej arytmii komorowej
Pojęcie przewlekłej IVA odnosi się do chorych bez cech choroby serca w wywiadzie, badaniu fizykalnym, spoczynkowym zapisie EKG i prostych badaniach nieinwazyjnych, takich jak echokardiogram serca i test wysiłkowy.(11-14)
Arytmia ta występuje 2-krotnie częściej u kobiet niż u mężczyzn, zwykle w wieku około 30-45 lat. Leczenie arytmii rozpoczyna się po krótszym lub dłuższym okresie występowania słabszych objawów, oczywiście poza chorymi z utrwalonym VT (sVT) i bardzo nasilonymi objawami arytmii. Idiopatyczne arytmie komorowe opisywano również u dzieci, młodzieży i sportowców. Mniej złożone i bezobjawowe formy arytmii skłaniają do obserwacji bez leczenia antyarytmicznego. Występowanie IVA może być zależne od wysiłku i stresu, a u kobiet arytmia może nasilać się w okresie zmian hormonalnych związanych z cyklem miesiączkowym i ciążą.(7, 11-14) Wstępna ocena chorych z IVA polega na: 1) wykluczeniu choroby organicznej serca lub choroby ogólnoustrojowej prowadzącej do arytmii, 2) ocenie nasilenia, rodzaju arytmii i jej objawów, oraz 3) określeniu ryzyka powikłań arytmii i ryzyka SCD. Tabele 1 i 2 zawierają zestawienie chorób i stanów chorobowych, które należy ująć w diagnostyce różnicowej IVA. Szczegółowej analizie poddaje się 12-odprowadzeniowy spoczynkowy EKG z oceną zespołów QRS w rytmie zatokowym i w czasie PVC/VT. Na podstawie oceny wstępnej określa się wskazania do dalszej diagnostyki, leczenia farmakologicznego i/lub inwazyjnego.(11-14)
Tabela 1. Przyczyny organiczne i ogólnoustrojowe arytmii komorowej do różnicowania z arytmiami komorowymi idiopatycznymi.
| Kardiomiopatia, choroba niedokrwienna serca i stan po zawale serca |
| Wady zastawkowe serca, w tym po leczeniu kardiochirurgicznym |
| Wady wrodzone serca, w tym po leczeniu kardiochirurgicznym |
| Choroby metaboliczne i zapalne w przebiegu chorób ogólnoustrojowych (zapalenie mięśnia serca, reumatyczne zapalenie stawów, zapalenie wsierdzia) |
| Kardiomiopatie (sarkoidoza, amyloidoza, hemochromatoza, choroba Fabriego) |
| Zaburzenia endokrynologiczne i cukrzyca (choroby tarczycy, guz chromochłonny nadnerczy, akromegalia, pierwotny hiperaldosteroizm, choroba Addisona, niedoczynność i nadczynność przytarczyc) |
| Schyłkowa niewydolność nerek |
| Otyłość, dieta i anoreksja |
| Choroby osierdzia |
| Nadciśnienie płucne i tętnicze z powikłaniami i przerostem mięśnia serca |
| Przemijające lub odwracalne przyczyny prowadzące do arytmii (ostre infekcje) |
| Kardiomiopatia rozstrzeniowa (z wykluczeniem kardiomiopatii (tachy)arytmicznej) |
| Kardiomiopatia przerostowa |
| Arytmogenna kardiomiopatia prawej komory – AKPK |
| Niewydolność serca z różnych przyczyn |
| Choroby degeneracyjne nerwowo-mięśniowe |
| Genetycznie uwarunkowane zespoły arytmiczne bez strukturalnej choroby serca (zespół krótkiego i długiego QT, zespół Brugadów, katecholaminozależny częstoskurcz komorowy, zespół wczesnej repolaryzacji |
| Uzależnienie (leki, narkotyki, używki) i uboczne działania substancji (ziół, leków) |
Tabela 2. Diagnostyka różnicowa PVC/VT bez organicznej choroby serca.
| Rozpoznanie | Cechy EKG | Wywiad omdleń i rodzinny
Dodatkowe badania |
| Arytmogenna kardiomiopatia prawej komory (początkowy okres bez istotnych zmian w ECHO) | Inwersja T w V1-V3, Fala epsilon w V1-V3, QRS > 110 msek w V1-V2 | Wywiad omdleń i rodzinny SCD, późne potencjały, szczegółowe badanie ECHO, MR, wentrykulografia, biopsja, badania genetyczne |
| Zespół Brugadów | Spontaniczne lub indukowane typowe uniesienie ST w V1-V3 | Wywiad omdleń i rodzinny SCD, badania genetyczne, test wysiłkowy i Holter z oceną zmian w godzinach nocnych i bradykardii, próba prowokacyjna |
| Zespół krótkiego QT | Krótki odstęp QT < 340 msek | Wywiad omdleń, AF i rodzinny SCD, badania genetyczne, Holter |
| Zespół długiego QT | Wydłużony odstęp QT (QTc > 440 msek [mężczyzna] lub > 460 msek [kobieta]) | Wywiad omdleń i rodzinny SCD, badania genetyczne, Holter, test wysiłkowy i próby prowokacyjne |
| Katecholaminowy częstoskurcz komorowy | Wyzwalane stresem lub wysiłkiem dwukierunkowy lub polimorficzny VT | Wywiad omdleń i rodzinny SCD, badania genetyczne, test wysiłkowy, Holter w czasie stresu |
| Torsades de pointes (TdP)/VF po PVC o krótkim sprzężeniu | PVC o krótkim sprzężeniu < 300 msek | Wywiad omdleń, Holter, telemetria |
| Stabilna choroba wieńcowa (CAD) bez zawału serca, interwencji naczyniowych i obniżonej EF | Zmiany ST i inne typowe dla niedokrwienia | Wywiad dławicy, czynników ryzyka i rodzinny CAD i SCD w młodym wieku, test wysiłkowy, Holter (ocena niemego niedokrwienia), nieinwazyjne i inwazyjne badania oceniające CAD |
| Zapalenie mięśnia serca (wsierdzia, osierdzia i sierdzia) | Różnorodne zmiany w EKG i wieloogniskowe PVC w okresie infekcji | Wywiad, badania biochemiczne oceniające infekcje, badania obrazowe nieinwazyjne, w szczególności MRI |
| Choroby nietypowe i pozasercowe przy braku organicznej choroby serca | Różnorodne zmiany w EKG w zależności od etiologii, cechy przerostu w nadciśnieniu tętniczym | Wywiad i objawy innych chorób i stanów chorobowych, badania biochemiczne, obrazowe, badania niekardiologiczne i kardiologiczne wykluczające etiologię sercową |
Wykluczenie organicznej choroby serca u chorych z arytmią komorową jest istotne z uwagi na odmienne ryzyko i odmienną strategię leczenia antyarytmicznego. Często arytmia komorowa, w szczególności złożona, u chorych z organiczną chorobą serca wymaga wszczepienia kardiowertera-defibrylatora (ICD), a dopiero w drugiej kolejności rozważenia wskazań do ablacji. W populacji chorych bez organicznej choroby serca ablacja jest przeważnie leczeniem podstawowym, a ICD zalecane jest wyjątkowo w przypadku istotnych objawów VT bez możliwości skutecznego leczenia antyarytmicznego lub z genetycznie uwarunkowanym wysokim ryzykiem SCD i VF.(11-13)
Odmienne stany wymagające oceny przed leczeniem to: ciąża, starszy wiek, wyczynowe uprawianie sportu, dzieci i młodzież < 18. roku życia, pacjenci po nagłym zatrzymaniu krążenia, pacjenci z ICD, arytmie polekowe, arytmie u chorych z chorobami neurologicznymi i psychiatrycznymi.
U chorych ze średnim ryzykiem choroby wieńcowej (ze względu na wiek, płeć i czynniki ryzyka i niepewnymi wynikami badań nieinwazyjnych) lub podejrzeniem anomalii serca wykonuje się odpowiednie badania dodatkowe wykluczające chorobę organiczną serca, takie jak: koronarografia, wentrykulografia, tomografia komputerowa serca, rezonans magnetyczny serca, oraz ewentualnie biopsja serca (przy podejrzeniu arytmogennej kardiomiopatii prawej komory (AKPK) lub innych chorób mięśnia serca). W celu określenia zależności arytmii od wysiłku wskazane jest wykonanie testu wysiłkowego lub analiza arytmii komorowej w badaniu metodą Holtera w czasie aktywności fizycznej.
Innymi badaniami określającymi ryzyko SCD i skojarzenie arytmii z organiczną chorobą serca mogą być badanie późnych potencjałów, badanie naprzemienności załamków T i odruchu z baroreceptorów.(11) Badania te nie są jednak rutynowo stosowane przed kwalifikacją do leczenia metodą ablacji.
Dodatkowo u chorych z IVA wyklucza się istotne, przewlekłe, niekontrolowane zaburzenia endokrynologiczne i ogólnoustrojowe mogące istotnie wpływać na indukcję i powstawanie arytmii (np. nadczynność tarczycy, niekontrolowane nadciśnienie tętnicze, zaawansowaną niewydolność nerek, wątroby i płuc, zażywanie substancji psychoaktywnych, uzależnienia, niedobory elektrolitowe, dystrofie mięśniowe).(11, 13)
Do grupy chorych z arytmią komorową bez organicznej choroby serca zaliczano również chorych z występowaniem genetycznie uwarunkowanych arytmii komorowych związanych z podwyższonym ryzykiem SCD, które klasyfikowane są obecnie jako kardiomiopatie („kanałopatie”). Zalicza się do nich zespół długiego i krótkiego QT (LQTS i SQTS), zespół Brugadów (BS) i katecholaminozależny częstoskurcz komorowy (CPVT), zespół wczesnej repolaryzacji z VF nazywany zespołem Haisageuerra’a (HS) i idiopatycze VF. Bardzo istotne jest wykluczenie wczesnych postaci AKPK, których prezentacja kliniczna i rodzaj arytmii może być zbliżona do IVA.(11-14, 42-44, 49)
W podsumowaniu, arytmię komorową bez organicznej choroby serca można podzielić następująco: 1) IVA (całkowity brak udokumentowanych przyczyn arytmii i chorób obciążających), 2) arytmię komorową ze współistniejącymi chorobami i stanami ogólnoustrojowymi wpływającymi na arytmię, 3) uwarunkowane genetycznie kanałopatie (z zaburzeniami rytmu wynikającymi z dysfunkcji na poziomie komórkowym, błon komórkowych i kanałów jonowych).(11-13)
Definicja kardiomiopatii arytmicznej i tachyarytmicznej u chorych z IVA
Chociaż IVA należą do łagodnych arytmii, mogą prowadzić do rozwoju DCM. Kardiomiopatię tachyarytmiczną można rozpoznać, jeśli wskaźniki kliniczne i obrazowe pozwalają na stwierdzenie rozpoznania kardiomiopatii rozstrzeniowej (DCM) i niewydolności serca, a po leczeniu antyarytmicznym dochodzi do poprawy lub wyleczenia DCM. Kardiomiopatia tachyarytmiczna jest jedną z odwracalnych form DCM związaną ze zbyt szybką lub niemiarową pracą serca w przebiegu większości znanych arytmii. Kardiomiopatię tachyarytmiczną rozpoznaje się, gdy po skutecznym leczeniu antyarytmicznym frakcja wyrzutowa lewej komory (LVEF) wzrasta o co najmniej 15% w porównaniu do okresu przed leczeniem i do wartości > 45%.(39) W niektórych opracowaniach za wartości uprawniające do wstępnego rozpoznania kardiomiopatii w przebiegu PVC/VT przyjmowane są wyjściowe wartości LVEF < 50%.(40) Według wytycznych podejrzenie dysfunkcji LV w przebiegu tachyarytmii można wysunąć, jeśli występują obiektywne wskaźniki dysfunkcji przy utrzymującej się przez zwykle ponad 7 dni czynności serca powyżej 120/min. Wymagane jest również wykluczenie innych przyczyn i poprawa funkcji po skutecznym leczeniu.(12)
U chorych z IVA opisywane są DCM wynikające z tachykardii z powodu permanentnie nawracających (incessant) VT (tzw. kardiomiopatia tachyarytmiczna, tachycardia-induced cardiomyopathy, tachycardia-mediated cardiomyopathy, tachycardiomyopathy, VT-DCM), których częstość lub średni rytm dobowy przekracza zwykle 120/min. Odmiennym rodzajem kardiomiopatii wydaje się kardiomiopatia z powodu bardzo licznych PVC (kardiomiopatia arytmiczna, arrhythmia-induced cardiomyopathy, AIC, PVC-induced cardiomyopathy, PVC-DCM). Charakterystyczne jest, że średnia dobowa częstotliwość rytmu serca nie przekracza 120/min i brak jest dominujących form złożonych. W niniejszym opracowaniu analizowana będzie częstość kardiomiopatii tachyarytmicznej z VT (VT-DCM) i kardiomiopatii arytmicznej z PVC (PVC-DCM).(12) Coraz więcej danych wskazuje na korelację pomiędzy liczbą PVC, a rozwojem rozstrzeni serca i wyższą częstością wskaźników niewydolności serca. Przyjmuje się, że populacją narażoną na rozwój kardiomiopatii arytmicznej są chorzy z liczbą PVC > 20 000/24 h lub z PVC stanowiącymi ponad 20% liczby zespołów QRS na dobę.(32-38, 40)
Elektrokardiograficzne postaci arytmii komorowej
Za granicę niezbyt licznych, licznych i bardzo licznych PVC stwierdzanych w badaniu metodą Holtera przyjmuje się przedziały kolejno 1000-5000 PVC/24 h, 5000-20 000/24 h i > 20 000 PVC/24 h.(10, 35, 39, 40) Aktualne wytyczne podkreślają podział arytmii komorowej na monomorficzną (o stałej morfologii zespołów QRS w czasie VT i bez zmiany morfologii QRS w kolejnych zespołach QRS), pleomorficzną (o zmieniającej się morfologii QRS w czasie trwania tego samego epizodu VT) i polimorficzną (o zmieniającej się morfologii QRS w kolejnych zespołach QRS). Dla chorych z PVC przyjmuje się podział na PVC monomorficzne i polimorficzne, zwykle odnoszące się do jednego lub kilku ognisk arytmii.(11-13)
Zazwyczaj w opisie badania EKG metodą Holtera podaje się maksymalną liczbę PVC, % zespołów QRS będących PVC (tzw. PVC burden), maksymalną liczbę PVC na godzinę, występowanie par, nieutrwalonych VT (nsVT) i utrwalonych VT. Dominującą postacią arytmii poddawaną zabiegom ablacji są liczne PVC i nsVT. Inne postaci arytmii to monomorficzne permanentnie nawracające VT i utrwalone z pojedynczymi pobudzeniami zatokowymi (incessant) VT. Kolejną prezentacją kliniczną jest występowanie klinicznego VT bez pojedynczych PVC w kolejnych badaniach. Trzepotanie komór spotyka się bardzo sporadycznie.
Celem określenia wyjściowych wartości natężenia arytmii komorowej (przed leczeniem) jest możliwość prowadzenia kontroli skuteczności leczenia i efektu proarytmicznego leków. Z uwagi na dość dużą zmienność dobową (5-40%) występowania PVC u tego samego chorego, a w szczególności napadowych nsVT i VT, za skuteczne leczenie antyarytmiczne przyjmuje się redukcję nsVT/VT o co najmniej 75%.(11-13) W ocenie skuteczności leczenia PVC zalecane jest uzyskanie 80-90% redukcji arytmii w 24-godzinnym badaniu EKG metodą Holtera.(64) Dodatkowe techniki dokumentacji arytmii komorowej i weryfikacji objawów arytmii przedstawiono w tabeli 3.
Tabela 3. Metody diagnostyki elektrokardiograficznej arytmii komorowej i weryfikacji objawów arytmii.
| EKG jedno- lub wieloodprowadzeniowy (kanałowy) |
| Monitor jedno- i wielokanałowy EKG |
| Standardowy 12-kanałowy zapis EKG |
| Telemetria |
| Holter jedno- i wielokanałowy |
| Holter 12-kanałowy |
| Zapis EKG transmitowany przez telefon |
| Zapis EKG z przenośnych rejestratorów zdarzeń |
| Zapis EKG z wszczepionych rejestratorów zdarzeń |
| Zapis EKG z wszczepionych urządzeń (rozrusznik serca, ICD) |
Jednoczasowy zapis EKG (monitor, telemetria lub ciągły zapis 12-kanałowy) skojarzony z innymi metodami diagnostycznymi:
test wysiłkowy, ergospirometria, EKG i inwazyjne pomiary hemodynamiczne, wideobarytografia, EEG, Holter ciśnieniowy, reografia impedancyjna, polisomnografia, wielofunkcyjne
rejestratory czynności życiowych, manometria, Ph-metria,
echokardiografia, USG metodą Dopplera, Angio-CT, MRI, etc. |
Mechanizmy elektrofizjologiczne powstawania arytmii komorowej
Mechanizmami prowadzącymi do arytmii komorowej są zjawiska re-entry, powstawania nieprawidłowego automatyzmu i aktywności wyzwalanej.(11-13)
Arytmie komorowe dzielą się na arytmie ogniskowe (wychodzące z pojedynczego miejsca w sercu) oraz nieogniskowe, związane najczęściej ze zjawiskiem krążącej fali re-entry wokół blizn lub obszarów zwłóknienia miokardium.(11, 13, 49-51, 64-67)
Wiele badań wskazuje, że IVA z obszaru drogi odpływu prawej i lewej komory wykazują cechy arytmii wyzwalanych w mechanizmie potencjałów następczych i reakcji związanych z cyklicznym AMP.(66, 67) Może mieć to istotne znaczenie dla indukcji arytmii podczas zabiegu ablacji i mapowania arytmii. Indukcja IVA może zależeć od przyspieszenia rytmu serca lub stymulacji β-adrenergicznej. Przerywanie IVA za pomocą manewrów zwiększających napięcie nerwu błędnego, podania adenozyny lub blokerów kanałów wapniowych dowodzi zależności tych arytmii od mechanizmu potencjałów następczych.(66) Stanowi to podstawę dla postępowania terapeutycznego w VT (podanie adenozyny, β-adrenolityków, blokerów kanału wapniowego) lub przewlekłego leczenia farmakologicznego arytmii (β-adrenolityki, blokery kanałów wapniowych). Zależność indukcji arytmii od aktywności wyzwalanej może utrudniać wykonywanie zabiegu ablacji poprzez zanik arytmii pod wpływem zmienności napięcia układu przywspółczulnego. Z tego względu wykorzystuje się również mechanizmy indukujące arytmię, takie jak szybka stymulacja przedsionka lub komór, podawanie β-adrenomimetyków (izoproterenol, orcyprenalina), aminofiliny, jonów wapnia, atropiny i innych leków.(11, 13, 49-51)
Reentry jako mechanizm IVA jest spotykany w częstoskurczach wiązkowych (fascicular VT) bardzo sporadycznie w częstoskurczach międzyodnogowych (bundle branch reentry tachycardia – BBR-T) oraz jako mikroreentry.(50, 68-70) W częstoskurczach wiązkowych i odnogowych częścią pętli re-entry są obwodowe włókna Purkinjego przedniej lub tylnej wiązki lewej odnogi pęczka Hisa. Opisano też nieliczne przypadki częstoskurczu z prawej odnogi pęczka Hisa.(68)
Symptomatologia arytmii komorowych
Typowe objawy arytmii komorowej zostały szczegółowo scharakteryzowane w wytycznych z roku 2006 i innych standardach odnoszących się do PVC/VT.(11-13) Idiopatyczne PVC/VT można podzielić na bezobjawowe i objawowe. Istnieje duża grupa zdrowych osób z bezobjawową IVA. Dodatkowo około 40% chorych bezobjawowych i 5-20% chorych objawowych w obserwacji długoterminowej może mieć spontaniczną remisję arytmii komorowej.(9, 10)
Wymienianymi w wytycznych typowymi, podstawowymi objawami arytmii są: kołatania serca, objawy przedomdleniowe, omdlenia, NZK i SCD. Innymi, mniej typowymi objawami potencjalnie związanymi z IVA, są: duszność, ból w klatce piersiowej, zmęczenie, rozwój objawów niewydolności serca i upadki bez utraty przytomności.(12) Przy przetrwałym lub ciągle nawracającym VT może dochodzić do szybkiego rozwoju cech niewydolności serca lub uwolnienia wskaźników uszkodzenia serca (np. troponiny). Powstaje wtedy wtórny do VT zawał serca typu II, podczas którego uwolnienie troponiny następuje nawet przy prawidłowej budowie tętnic wieńcowych (mechanizm wtórny do niedotlenienia i przeciążenia mięśnia lewej komory). VT może prowadzić do ostrej niewydolności serca (hipoperfuzja obwodowa wstrząs, obrzęk płuc) i istotnych zaburzeń hemodynamicznych wymagających kardiowersji lub w przypadku szybkiego VT/VF – natychmiastowej defibrylacji.(11-13)
Ocena rodzaju i nasilenia objawów arytmii oraz jej wpływu na jakość życia jest jednym z podstawowych zadań w postępowaniu z chorymi z IVA. Objawy IVA, a nie jej nasilenie w badaniu Holtera, decydują najczęściej o wskazaniach do leczenia.(11, 13)
Skuteczne leczenie IVA powoduje istotną redukcję lub całkowitą eliminację arytmii ocenianą w badaniu metodą Holtera, poprawę jakości życia i ustąpienie objawów arytmii komorowej.(14-16, 20) Wiele opracowań naukowych wskazuje również na istotny wpływ licznej IVA na kliniczne, echokardiograficzne, biochemiczne, ergospirometryczne i hemodynamiczne wskaźniki wydolności serca.(32-38) Nie wprowadzono standardowych kwestionariuszy oceny jakości życia i objawów arytmii komorowej. W analizie grup chorych wykorzystuje się najczęściej kilka najbardziej typowych objawów oraz analizuje najbardziej uciążliwy objaw. W kilku niewielkich badaniach oceniających jakość życia i analizę objawów posługiwano się kwestionariuszem SF-36 oraz subiektywną skalą nasilenia objawów (Visual Analog Scale – VAS).(15-17, 20)
Wytyczne i zalecenia wskazują na potrzebę weryfikacji objawów arytmii komorowej przez lekarza i pacjenta podczas wywiadu, badania fizykalnego oraz podczas monitorowania EKG.(11-13) Ostatnio opublikowano opisy i serie chorych dokumentujące kilka nowych nietypowych objawów licznych PVC, do których należały: kaszel arytmiczny, dysfagia arytmiczna i chromanie przestankowe zależne od PVC.(20, 21, 23-25, 27, 31)
W opisie powyższych, nowych i nietypowych objawów arytmii wprowadzono interdyscyplinarną diagnostykę i innowacyjne skojarzenie monitorowania EKG z innymi technikami diagnostycznymi (wideobarytografią, manometrią przełykową, polisomnografią, rejestratorami wielofunkcyjnymi, kardiografią impedancyjną, ergospirometrią i USG). Pozwoliło to na obiektywne rozpoznanie lub wykluczenie skojarzenia arytmii komorowej z nietypowymi objawami klinicznymi oraz zastosowanie tych technik do charakterystyki zaburzeń i ich kontroli po leczeniu.(20, 21, 23-25, 27, 31)
Lokalizacja idiopatycznych arytmii komorowych
W ostatnich latach przeprowadzono analizę lokalizacji i charakterystyki EKG, potencjałów wewnątrzsercowych, technik mapowania i ablacji kilkunastu lokalizacji arytmii komorowej, z których najczęstszą arytmią jest IVA z RVOT. Wyróżniono i scharakteryzowano IVA o lokalizacjach prawokomorowych i lewokomorowych oraz IVA epikardialną. Do lokalizacji prawokomorowych zaliczono arytmie z RVOT (w tym głównie z części przegrodowej i ściany wolnej), pnia płucnego, z zastawki trójdzielnej, okolicy przegrodowej przy pęczku Hisa, z prawej komory i okolicy prawej odnogi pęczka Hisa, drogi napływu prawej komory, mięśni brodawkowatych i koniuszka prawej komory.(9, 11, 13, 16, 38, 46, 74-81) Do lokalizacji lewokomorowych zaliczono arytmie z drogi odpływu lewej komory (LVOT), z zatok Valsalvy lewego (LCC), prawego (RCC) i niewieńcowego (NCC) płatka zastawki aortalnej, z ciągłości aortalno-mitralnej (AMC), zastawki mitralnej (MA), włókien Purkinjego przedniej lub tylnej (oraz środkowej) wiązki lewej odnogi pęczka Hisa, z mięśni brodawkowatych i koniuszka lewej komory.(66, 67, 81-101) Dodatkowo, wyróżniono kilka lokalizacji arytmii epikardialnych dostępnych do mapowania i ablacji zarówno z dojścia wewnątrznaczyniowego (tj. poprzez zatoki Valsalvy zastawki aortalnej oraz odgałęzienia epikardialnych żył serca odchodzących od zatoki wieńcowej), jak i z dostępu epikardialnego przezskórnego lub kardiochirurgicznego.(102-106)
Wprowadzono również algorytmy lokalizacji arytmii oparte na analizie standardowego 12-odprowadzeniowego EKG. Wartość ich jednak jest ograniczona z uwagi na preferencyjne przewodzenie pomiędzy przegrodą międzykomorową a zatokami Valsalvy i RVOT oraz bliskością struktur anatomicznych zlokalizowanych przy podstawie serca. Dodatkowo, skręcenie osi serca, budowa klatki piersiowej oraz niezbyt precyzyjne położenie elektrod może ograniczać wartość diagnostyczną kryteriów opartych na odprowadzeniach przedsercowych.(81, 83, 87-90, 97)
Monomorficzna IVA będąca wskazaniem do leczenia może współistnieć z innymi arytmiami. Najczęściej może to dotyczyć występowania innych morfologii PVC/VT (mnogie monomorficzne PVC/VT) lub skojarzenia PVC/VT z arytmiami nadkomorowymi i częstoskurczami przedsionkowo-komorowymi. Dodatkowo w czasie zabiegu ablacji może dojść do zmiany punktu wyjścia (exit site) ogniskowej arytmii komorowej.(75, 76, 107-113)
Leczenie farmakologiczne chorych z objawową IVA
Po wykluczeniu chorób przewlekłych, organicznej i genetycznie uwarunkowanej choroby serca decydujące znaczenie dla strategii leczenia ma ocena postaci arytmii, objawów i ryzyka powikłań.(11-14) Chorych z objawami należy leczyć. U bezobjawowych chorych z niezbyt licznymi PVC lub nsVT istotna jest modyfikacja trybu życia, unikanie czyników wyzwalających arytmię, konsultacja ze specjalistą i jego zapewnienie o braku istotnego zagrożenia SCD. U bezobjawowych chorych z bardzo licznymi PVC (> 20 000 PVC na dobę) lub polimorficznymi VT należy rozważyć leczenie antyarytmiczne.(11)
Leczenie farmakologiczne IVA jest słabo udokumentowane. Największe grupy chorych poddanych leczeniu farmakologicznemu i obserwacji długoterminowej liczą między 50 a 150 chorych.(9, 17, 60-64, 114-116) Zalecane jest stosowanie β-adrenolityków, blokerów kanałów wapniowych, a w pochodzeniu arytmii z RVOT – leków klasy I, np. propafenonu lub flekainidu.(11) W aktualnych wytycznych nie zaleca się stosowania w tej populacji chorych leków antyarytmicznych klasy III, czyli amiodaronu i sotalolu. Nie jest również uzasadnione stosowanie digoksyny i jej pochodnych oraz leków antyarytmicznych klasy IA i IB.(11)
Krótkoterminowa skuteczność leczenia farmakologicznego u objawowych chorych wynosi między 30-50%, przy ograniczonej poprawie jakości życia w porównaniu do placebo. Tylko około 25% chorych w krótkotrwałym leczeniu objawowych PVC atenololem spełniało kryteria skuteczności i tolerancji leczenia (tzw. responders).(17) W opublikowanej przez Steca i wsp. pracy w badaniu otwartym typu krzyżowego w populacji 84 chorych z idiopatycznym PVC krótkoterminowa skuteczność leczenia propafenonem, werapamilem i/lub metoprololem wynosiła 37%. Najczęściej skutecznym i tolerowanym pojedyncznym lekiem był propafenon (29%), następnie metoprolol (5%) i werapamil (4%). W badanej populacji 56% chorych zostało skierowanych na zabieg ablacji z powodu nieskuteczności, nietolerancji lub niechęci chorego do długoterminowego leczenia farmakologicznego.(114) Skuteczność leczenia propafenonem w populacji chorych z idiopatycznymi PVC z nieskutecznym leczeniem β-adrenolitykiem w obserwacji średnioterminowej wynosi około 50%. Wydaje się, że populację chorych z bardzo dobrą reakcją na propafenon można określić na podstawie analizy holterowskiej lub efektu pierwszej dawki.(61, 115)
Podsumowując, u większości objawowych chorych z PVC długoterminowe leczenie farmakologiczne jest niewystarczające, odlegle nieskuteczne, nietolerowane lub nieakceptowane przez chorych. Chorzy ci decydują się również na zabieg ablacji lub są kierowani do leczenia inwazyjnego przez lekarzy z uwagi na pracę w służbach mundurowych, aktywność sportową lub wiek prokreacyjny. Długotrwałe leczenie farmakologiczne niesie ze sobą podwyższone ryzyko wystąpienia działań ubocznych, w tym efektu proarytmicznego i zwiększenia ryzyka SCD, oraz odległej nietolerancji, nieskuteczności lub nieprzestrzegania zaleceń dotyczących leczenia. Należy zaznaczyć, że 5-20% objawowych chorych może mieć spontaniczną remisję PVC, niezależnie od stosowania leczenia faramkologicznego.(9, 10)
Eksperci wymieniają dodatkowe kryteria, które powinny uzasadniać pomijanie leczenia farmakologicznego i wykonanie w trybie pilnym pilnej diagnostyki i leczenia inwazyjnego:
1) występowanie omdleń;
2) bardzo szybki rytm VT (rytm VT > 230/min jest związany z występowaniem polimorficznego VT);
3) bardzo liczne PVC (> 20 000 PVC/24 h) sprzyjające powstawaniu kardiomiopatii arytmicznej;
4) PVC o krótkim sprzężeniu, tzw. short coupling PVC, związanym z ryzykiem polimorficznego VT.(35, 46, 48, 51)
Leczenie ablacją chorych z objawową idiopatyczną arytmią komorową
Nie opublikowano dużych wieloośrodkowych badań porównujących ablację i leczenie farmakologiczne w IVA. W populacji idiopatycznych PVC/VT nie przeprowadzono żadnego dużego, randomizowanego i kontrolowanego badania ani licznych i odpowiednio monitorowanych rejestrów wieloośrodkowych z długoterminową obserwacją po leczeniu, będących podstawowymi elementami „medycyny opartej na faktach”. Jedynie kilka wiodących światowych ośrodków podsumowało na dużych grupach pacjentów skuteczność leczenia inwazyjnego w populacji chorych z szerokim spektrum prezentacji klinicznej i objawów IVA.(9, 11, 13, 20, 59, 75, 101, 117)
Z tego względu prawie wszystkie wytyczne dotyczące leczenia inwazyjnego ablacją RF IVA mają poziom dowodów oznaczony literą „C” (konsensus ekspertów).(11) Aktualne wytyczne podkreślają możliwości wykonywania ablacji RF u chorego preferującego leczenie inwazyjne jako leczenie pierwszego rzutu, bez konieczności wcześniejszego leczenia farmakologicznego.(11) W tabeli 4 przedstawiono podsumowanie na podstawie wytycznych dotyczących wskazań do ablacji IVA.
Należy podkreślić, że kwalifikacja do leczenia ablacją w pierwszej dekadzie stosowania tej techniki dotyczyła głównie chorych z VT i arytmią z RVOT.(11, 13, 50, 51) W największym, opublikowanym w roku 2007, narodowym hiszpańskim rejestrze zabiegów ablacji IVA była poddana leczeniu inwazyjnemu u około 3% (193/7062) chorych kierowanych do ablacji. W okresie 4 lat zaobserwowano wzrost kwalifikacji tej grupy chorych do ablacji. Ablacja IVA była wykonywana w 80% pracowni elektrofizjologicznych w Hiszpanii, ze średnią roczną liczbą 5 chorych w ośrodku (zakres 1-15). Bezpośrednia skuteczność ablacji tej arytmii wyniosła 67% (129/193 chorych). Arytmia zlokalizowana była w RVOT (62%), LVOT (18%), wiązkach lewej odnogi pęczka Hisa (15%) i innych miejscach (5%). Skuteczność bezpośrednia (oceniana podczas zabiegu) ablacji w tych lokalizacjach wyniosła odpowiednio: 76%, 50%, 92% i 63%. Elektrody 4 mm były wykorzystywane w 85% przypadków. Powikłania duże wystąpiły u 3 (2%) chorych i obejmowały: 2 tamponady serca i 1 zawał serca.(58) Zwraca uwagę, że w kolejnym rejestrze opublikowanym w roku 2010 zarejestrowano poprawę skuteczności bezpośredniej do 85% i korzystanie u większości chorych z elektrod typu chłodzonego.(59)
W podsumowaniu ostatnich 8 lat działalności wysokospecjalistycznego ośrodka elektrofizjologicznego w Bostonie u 131 chorych z IVA bezpośrednią skuteczność osiągnięto u 72% chorych. Warto zauważyć, że w populacji tej wywiad poprzedniej nieskutecznej ablacji miało aż 39% chorych.(117)
Analiza piśmiennictwa podsumowującego leczenie inwazyjne i obserwację długoterminową objawowych chorych z IVA dowodzi, że istnieje jedynie kilka prac obejmujących powyżej 200 chorych, a największa badana w obserwacji 3-miesięcznej populacja dotyczy 625 chorych z Japonii.(9, 74, 75, 81, 101, 104, 117)
Tabela 4. Standardowe wskazania do zabiegu ablacji w arytmiach komorowych bez organicznej choroby serca (wytyczne ESC 2006).
| Rozpoznanie | Klasa I | Klasa IIa | Klasa IIb |
| Arytmie komorowe idiopatyczne (gdy leki są nieskuteczne, nietolerowane lub nieakceptowane przez chorego do przewlekłego stosowania | | | |
| Utrwalony objawowy VT | C | | |
| Nieutrwalony objawowy VT | | C | |
| Liczne objawowe PVC | | C | |
| Bardzo liczne (nawet bezobjawowe) PVC w prewencji rozwoju kardiomiopatii | | | B |
Poziom dowodów: A – oparte na badaniach wieloośrodkowych, randomizowanych, B – oparte na pojedynczym badaniu randomizowanym i rejestrach klinicznych, C – oparte nakonsensusie ekspertów.
Metody mapowania i ablacji IVA
Pojęcie „mapowania” (mapping) odnosi się do lokalizacji miejsca pochodzenia arytmii w czasie inwazyjnej diagnostyki. Mapowanie, oprócz badania elektrofizjologicznego, jest podstawową techniką do ustalenia wskazań do wykonania aplikacji z końcówki elektrody ablacyjnej we wszystkich rodzajach arytmii serca i technikach ablacji.(50, 51, 117-139) Zapisy z zabiegu ablacji i techniki mapowania przedstawiono na rycinach 1 A-G.
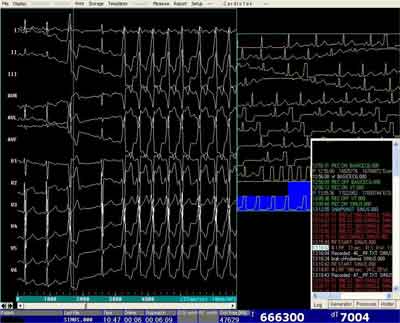
Ryc. 1A. Zapis 12-odprowadzeniowy – spontaniczne, kliniczne PVC (3 pobudzenie) i wyzwolone po isoproterenolu kliniczne VT (5-12 pobudzenie) z drogi odpływu prawej komory. Zapis w systemie elektrofizjologicznym.
Ryc. 1B. Zapis mapowania wewnątrzsercowego – potencjały dwubiegunowe, i jednobiegunowe w bigeminii komorowej z drogi odpływu lewej komory (pierwszy QRS) oraz drogi odpływu prawej komory (trzeci i piąty QRS – widoczny zapis o typie W z wyprzedzaniem -34 msek).
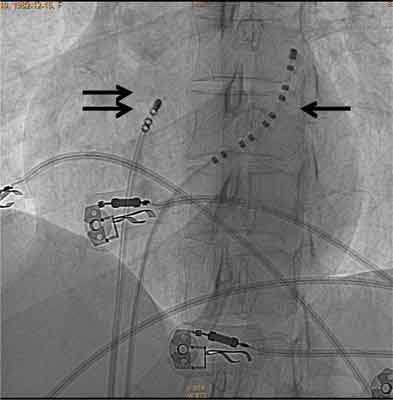
Ryc. 1C. Obraz rtg w projekcji LAO 30, przedstawiający elektrodę 10 polową diagnostyczną w zatoce wieńcowej (strzałka pojedyncza) i elektrodę 4 mm typu złotego (podwójna strzałka) w drodze odpływu prawej komory z dojścia udowego.
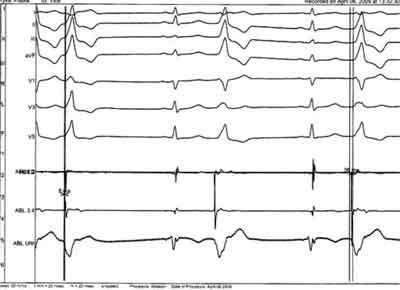
Ryc. 1D. Zapis z mapowania stymulacyjnego – zgodność 12/12. 3 pobudzenie PVC kliniczne, 5 pobudzenie – drugie ognisko lewostronne, 7 i 8 pobudzenie wystymulowane z elektrody mapującej (widoczne iglice stymulacji przed ostatnimi dwoma QRS zgodnymi z QRS 3 – arytmia z RVOT).
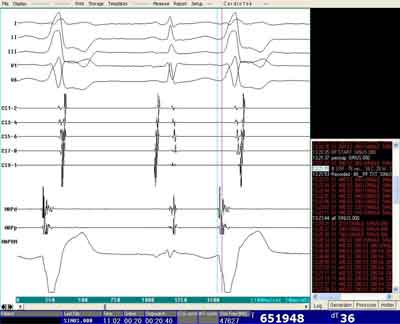
Ryc. 1E. Zapis z mapowania wewnątrzsercowego – mapowanie aktywacyjne z wyprzedzaniem -36 msek (MAPd) i potencjałem jednobiegunowym (UNI) typu V z zazębieniem na ramieniu zstępującym w czasie klinicznych PVC (1 i 3 pobudzenie).
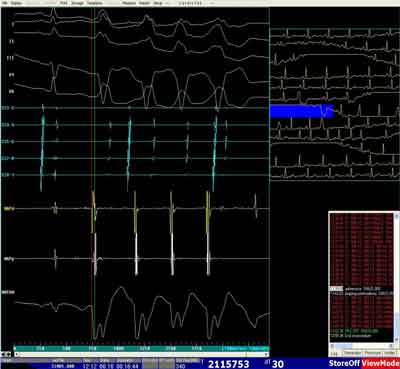
Ryc. 1F. Zapis z mapowania wewnątrzsercowego – mapowanie aktywacyjne z wyprzedzaniem -30 msek (MAPd) i potencjałem jednobiegunowym typu W (MAPUNI) z okolicy zastawki trójdzielnej i RVOT – nsVT (2-5 pobudzenie) – arytmia niekliniczna – mechaniczne drażnienie elektrodą ablacyjną.
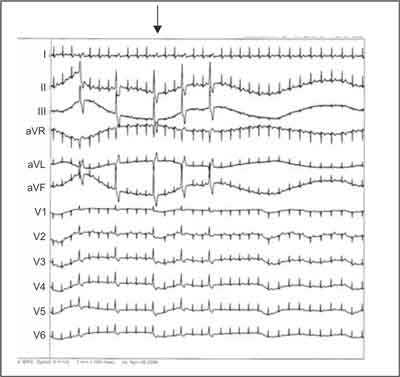
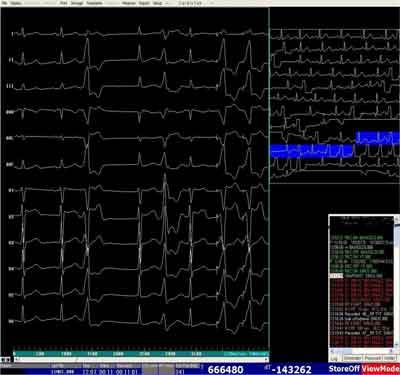
Ryc. 1G. Zapis 12-odprowadzeniowego EKG dokumentujący nagły zanik licznych PVC w lewej zatoce Valsalvy zastawki aortalnej – efekt po 5 sekundach od włączenia aplikacji (strzałka) prądu RF. Podobny efekt może wystąpić przy ucisku mechanicznym.
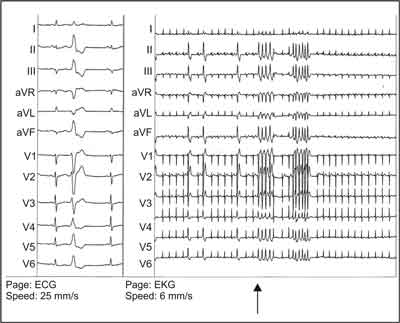
Ryc. 1H. Efekt warm-up: u chorej z udokumentowanymi wyłącznie PVC. Włączenie aplikacji prądu RF (strzałka) powoduje powstanie nsVT zgodnego z PVC z RVOT z następowym zanikiem arytmii w 5 sekundzie aplikacji. Lewa część ryciny zawiera wzorzec klinicznego PVC.
Mapowanie aktywacyjne
Mapowanie zależności czasowych potencjałów wewnątrzsercowych w czasie PVC/VT nazywane jest mapowaniem aktywacyjnym (activation mapping). Jest ono najbardziej rozpowszechnioną metodą mapowania IVA. Do mapowania aktywacyjnego stosuje się rejestrację potencjałów wewnątrzsercowych jedno- i dwubiegunowych z dystalnych pierścieni elektrody mapującej. Przy wykorzystywaniu kilku elektrod, orientacyjne mapowanie aktywacyjne można prowadzić z kilku pierścieni i różnych elektrod.(50, 51) Podczas jednego pobudzenia PVC/VT oceniane są odstępy potencjałów wewnątrzsercowych w stosunku do najwcześniejszego wychylenia zespołu QRS w EKG zewnątrzsercowym (tzw. local activation time – LAT). Wyprzedzanie początku potencjału wewnątrzsercowego w stosunku do początku QRS oznaczane jest ujemną wartością (np. -20 msek), zaś pojawianie się potencjału wewnątrzsercowego za początkiem QRS z wartością dodatnią (np. +20 msek). Przesuwanie końcówki elektrody mapującej w kolejne miejsca i rejestracja potencjałów w czasie PVC/VT pozwala na wykonanie kolejnych pomiarów i sekwencyjne analizowanie miejsca o najwcześniejszej aktywacji wewnątrzsercowej (tj. o najniższej ujemnej wartości). W arytmiach o mechanizmie punktowej, ogniskowej aktywacji mapowanie aktywacyjne pozwala na określenie odśrodkowego rozchodzenia się aktywacji komór w PVC/VT (miejsce o najniższej wartości LAT otoczone jest punktami o wyższych wartościach LAT). Wykonywanie mapowania aktywacyjnego „punkt po punkcie” wymaga z jednej strony umiejętności nawigacji elektrodą mapującą, jak również szybkiej weryfikacji „klinicznego” PVC/VT w stosunku do pojawiających się PVC/VT wynikających z mechanicznego podrażnienia mięśnia serca elektrodą ablacyjną. Dodatkowo miejsca o najwcześniejszej aktywacji potencjałów dwubiegunowych są weryfikowane poprzez analizę charakterystyki kształtu i wyprzedzania potencjału jednobiegunowego. Powszechnie akceptuje się, że kształt potencjału jednobiegunowego z ogniska arytmii powinien odpowiadać załamkowi QS, czyli kształcie dużej litery „V”. Kształt taki potwierdza rozprzestrzenianie się aktywacji od dystalnego pierścienia elektrody. Warto podkreślić, że mapowanie aktywacyjne może potwierdzić wyprzedzanie -20 msek z potencjałem jednobiegunowym o kształcie „V” w szerokim obszarze. Z tego względu w mapowaniu aktywacyjnym preekscytacji (tj. punktowym miejscu najwcześniejszej aktywacji komór lub przedsionków przy mapowaniu dróg dodatkowych) wprowadzono dodatkowe oznaczenia odprowadzenia jednobiegunowego w kształcie „W”.(13, 27, 37, 50, 51, 65-67, 81, 83, 97-104)
Potencjał o kształcie „rQ” lub „rV” odpowiada wychyleniu dodatniemu pierwszej fazy potencjału jednobiegunowego, co odpowiada fali depolaryzacji docierającej do tego miejsca z ogniska arytmicznego. Na uwagę zasługuje fakt, że małe załamki „r” mogą odpowiadać dochodzeniu depolaryzacji z ogniska arytmicznego epikardialnego lub położonego głębiej w endokardium, a wykonywane mapowanie aktywacyjne z endokardialnego położenia elektrody może w tym miejscu odpowiadać najwcześniejszej aktywacji endokardialnej.(50, 51)
W IVA mapowanie aktywacyjne może wskazywać na obszar najwcześniejszej aktywacji o powierzchni 3 cm2.(120) Zastosowanie mapowania elektroanatomicznego wskazuje na możliwość zastosowania aplikacji w oparciu o centralną część strefy najwcześniejszej aktywacji. W IVA mapowanie aktywacyjne może być samodzielną techniką mapowania arytmii przed ablacją lub być skojarzone z mapowaniem stymulacyjnym, stymulacją o typie „entrainment”, mapowaniem ablacyjnym, mapowaniem mechanicznym, mapowaniem cieplnym (kriomapowaniem, thermal mapping) i mapowaniem potencjałowym. Mapowanie potencjałów włókien Purkinjego lub niskonapięciowych potencjałów poprzedzających (przedsystoliczne, diastoliczne) lub następujących po (późne potencjały) typowych potencjałach komorowych należy również do mapowania aktywacyjnego. Oznacza się wtedy potencjały z poprzedzającą „V” literką P (włókna Purkinjego), PP (presystolic), MD (middiastolic) lub LP (late potentials). Oprócz włókien Purkinjego w idiopatycznych arytmiach sporadycznie opisywane są inne potencjały jedno- i dwubiegunowe.(27, 37, 42, 43, 50, 51, 69-71, 75, 76, 88-90, 97, 98, 100, 104, 106,108)
Mapowanie z techniką sprzęgania (entrainment)
W arytmiach o typie reentry w uszkodzonym sercu istotne jest określanie „entrainment”, punktu wyjścia i cieśni. „Entrainment” stosuje się w celu określenia w miejscu stymulacji „przejęcia” częstoskurczu nieznacznie szybszą częstością stymulacji, uzyskania zgodności mapowania stymulacyjnego i sprzężenia pierwszego pobudzenia po stymulacji (post pacing interwal – PPI) odpowiadającego częstości częstoskurczu i odstępowi lokalnego potencjału w miejscu stymulacji. Mapowanie z oceną „entrainment” stanowi szeroki oddzielny element mapowania arytmii u chorych z organiczną chorobą serca i nie jest szeroko stosowana przy ablacjach IVA.(50, 51)
Mapowanie stymulacyjne
Mapowanie stymulacyjne odnosi się do sytuacji, w której stymulacja dystalnego pierścienia elektrody w czasie rytmu zatokowego powoduje powstanie wystymulowanych zespołów QRS. Oceniana jest wtedy zgodność wystymulowanych QRS z kształtem i amplitudą zespołów QRS w klinicznej arytmii w 12 odprowadzeniowym EKG. Mapowanie stymulacyjne opiera się na rejestracji lub dokumentacji klinicznego PVC/VT oraz stymulacji mięśnia komory celem odtworzenia identycznego kształtu zespołów QRS jak w arytmii klinicznej. Mapowanie stymulacyjne oceniane jest pod względem liczby odprowadzeń ze zgodną morfologią wychylenia, szerokości, amplitudy i zazębień na załamkach zespołu QRS. Identyczna morfologia QRS w jednym odprowadzeniu oznacza zgodność mapowania stymulacyjnego 1/12. Jeśli morfologia zespołów QRS jest identyczna dla wszystkich odprowadzeń, oznacza to wartość mapowania stymulacyjnego 12/12. Przyjmuje się, że miejsce zlokalizowane bardzo blisko ogniska arytmii znajduje się w punkcie, w którym uzyskuje się mapowanie stymulacyjne o zgodności 12/12. Akceptowalne są czasem także miejsca o zgodności 11/12 lub nieznaczne odchylenia w zakresie zazębień (w szczególności na ramieniu zstępującym) na QRS przy zgodności 12/12 wychyleń, amplitud i szerokości QRS. Istnieje również możliwość automatycznej komputerowej oceny mapowania stymulacyjnego z określaniem % zgodności kształtów wystymulowanych z wzorcem arytmii klinicznej.(50, 51, 117-123)
Ograniczeniem i przyczyną trudności w pełnym odwzorowaniu zgodności 12/12 w mapowaniu stymulacyjnym jest ruchomość elektrody ablacyjnej, odmienne sprzężenie pobudzeń wystymulowanych i klinicznych oraz zbyt wysoki próg stymulacji lub całkowity brak odpowiedzi po stymulacji (np. w płatkach aortalnych). Czynniki te mogą powodować stymulację szerokiego obszaru miokardium, w szczególności przy stosowaniu stymulacji dwubiegunowej i dużej odległości między pierścieniami elektrody mapującej. Wskazane jest wykonywanie mapowania stymulacyjnego z amplitudą impulsu stymulacji tuż powyżej progu stymulacji, jednak jest to niepraktyczne przy występowaniu różnic w progach stymulacji różnych miejsc. Czasami nie ma możliwości wykonania oceny mapowania stymulacyjnego z uwagi na brak spontanicznej lub indukowanej arytmii zgodnej z arytmią kliniczną podczas badania elektrofizjologicznego.(11, 13, 37, 50, 51, 117-123) W mapowaniu stymulacyjnym można zaobserwować występowanie zjawiska opóźnienia pojawiania się wystymulowanych zespołów QRS i występowania odstępu iglica stymulacji do zespołu QRS (S-QRS). Zjawisko to jest szczególnie często spotykane w arytmiach komorowych z obszarami zwolnionego przewodzenia w obszarach blizn lub w obszarach zwolnionego przewodzenia wynikających z odmiennych właściwości elektrofizjologicznych tkanek (epikardium, zatoki Valsalvy).(80-94, 102-106)
Mapowanie ablacyjne cieplne lub termiczne (thermal mapping)
Ten rodzaj mapowania jest stosowany przy braku aktywności spontanicznej PVC/VT i po potwierdzeniu lokalizacji mapowaniem stymulacyjnym. Podstawą dla jego stosowania jest fakt, że początkowe sekundy aplikacji prądu RF powodują rozgrzanie końcówki elektrody i powstawanie energii nasilającej aktywność ektopową ogniska arytmicznego. Powoduje to charakterystyczne powstanie nsVT/VT zgodnej z morfologią klinicznej arytmii 11-12/12 o szybszym cyklu i zmienności nietypowej dla zarejestrowanej arytmii klinicznej.(37, 124, 125)
Kriomapowanie (cryomapping)
Odwrotną sytuacją od mapowania ablacyjnego cieplnego jest kriomapowanie. Polega ono na ochłodzeniu elektrody ablacyjnej i zaniku PVC/VT w temperaturze -30 stopni. Przy zaniku PVC/VT, stabilnym i bezpiecznym położeniu elektrody wykonuje się dalsze aplikacje (krioablacja) z obniżeniem temperatury elektrody do -80°C.(126)
Mapowanie z uciskiem mechanicznym (mechanical trauma, bump phenomenon)
Mapowanie to opiera się na zjawisku nagłego zaniku aktywności ektopowej lub właściwości przewodzenia wybranych obszarów miokardium arytmii w miejscu ucisku końcówki elektrody ablacyjnej (catheter-induced trauma, mechanical trauma, bumb phenomenon). Zjawisko ucisku mechanicznego występuje w wielu rodzajach arytmii nadkomorowych (zespół WPW, częstoskurcze węzłowe i przedsionkowe) oraz arytmii komorowych z RVOT, z włókien Purkinjego lewej komory i w arytmiach komorowych w organicznej chorobie serca.(50) Mapowanie to wymaga od operatora orientacji przestrzennej i szybkiej analizy wystąpienia zaniku arytmii skojarzonym z odpowiednim położeniem elektrody. Jeśli udaje się zaobserwować to zjawisko w stabilnym położeniu elektrody, należy wykonać pomiary mapowania aktywacyjnego (tuż przed zanikiem arytmii lub z ostatniego zarejestrowanego PVC lub QRS VT) i/lub mapowania stymulacyjnego potwierdzające optymalne parametry dla ablacji. Wskazane jest również zweryfikowanie braku możliwości indukcji spontanicznej arytmii z innej elektrody.(37, 50, 51, 127) Zwykle nagły zanik licznych PVC/VT jest na tyle ewidentny, że po potwierdzeniu parametrów mapowania aktywacyjnego wykonuje się aplikacje RF. Dodatkowo można wykonać rejestrację obrazu RTG lub zaznaczenia w systemie elektroanatomicznym położenia elektrody celem zapamiętania go i wykorzystania jako obrazu referencyjnego. W przypadku przesunięcia się elektrody mapującej i utrzymywania się ucisku mechanicznego wskazana jest analiza „ostatnich” potencjałów wewnątrzsercowych przed wystąpieniem ucisku mechnicznego w pamięci systemu i odtworzenie ich po repozycji elektrody z mapowanieiem stymulacyjnym 12/12.
Ucisk mechaniczny powodujący zanik PVC/VT w czasie mapowania może spowodować zanik arytmii od kilkunastu sekund do kilku godzin. Nie jest to jednak równoznaczne z wyleczeniem arytmii. Może to stanowić ograniczenie dla oceny punktu końcowego ablacji lub ograniczyć skuteczność ablacji przy niedokładnie określonym położeniu elektrody ablacyjnej w momencie wystąpienia bloku mechanicznego.
Mapowanie elektroanatomiczne (electroanatomical mapping – EAM)
Mapowanie elektroanatomiczne polega na rejestrowaniu wartości amplitudy i opóźnienia kolejnych punktów względem stałego punktu referencyjnego (np. potencjału wewnątrzkomorowego na innej stabilnie położonej elektrodzie lub na odpowiednim załamku QRS EKG zewnątrzsercowego) oraz odwzorowaniu danych każdego punktu na trójwymiarowej mapie serca. Pozwala to na bezpośrednią (kontaktową) rejestrację potencjałów wewnątrzsercowych w odniesieniu do anatomii jam (jamy) serca oraz jednoczasowej analizy map potencjałowych (tworzenie kolorowych izometrycznych obszarów wartości amplitudy potencjałów) i propagacyjnych (tworzenie izoczasowych map i odtwarzania ich w formie animacji z rozchodzenia się pobudzenia elektrycznego w jamie serca). Systemy do mapowania elektroanatomicznego aktualnie powszechnie stosowane to system CARTO i system ENSITE. Opierają się one na analizie wytworzonego pola elektromagnetycznego lub różnicy impedancji pomiędzy kilkoma elektrodami przyklejanymi na skórze pacjenta i emitującymi prąd o wysokiej częstotliwości.(11, 13, 50, 51, 81, 107, 128-132)
Przy wykorzystanu elektrod 4 mm z filtrami 10-400 Hz ustalono, że ponad 95% prawidłowych potencjałów lewokomorowych wykazuje amplitudę powyżej 1,53-1,55 mV. Na tych założeniach oparto technikę mapowania blizn potencjałowych z tworzeniem map amplitudy potencjałów. Przyjęto wartości potencjałów dla strefy blizny (poniżej 0,5 mV), strefy granicznej (0,5-1,5 mV) oraz strefy nieuszkodzonego mięśnia serca (powyżej 1,5 mV), co pozwala na stworzenie mapy potencjałowej jamy serca i wyróżnienie obszarów blizn. Obszar poniżej 0,5 mV poddawany jest dodatkowo stymulacjom z amplitudą powyżej 20 mA celem określenia obszarów niepobudliwych elektrycznie, a więc będących obszarami blizny „elektrofizjologicznej” (tzw. „dense or true scar”). Technika ta znalazła szczególne zastosowanie w ablacjach arytmii zależnych od blizn w przebiegu kardiomiopatii.(129-132) Dodatkowo technika ta może być bardzo przydatna w charakterystyce substratu arytmii idiopatycznej w prawej komorze i różnicowaniu ze wstępnymi etapami AKPK. Kolejne badania potwierdzają możliwość wykonywania celowanej biopsji endokardialnej na podstawie mapowania potencjałowego CARTO u chorych bez innych lub z granicznymi cechami AKPK w typowych badaniach obrazowych.(130, 131)
Istnieje również możliwość tworzenia mapy 3D wyników mapowania stymulacyjnego. Można ją stworzyć poprzez nałożenie na mapę anatomiczną (odtworzenie struktury 3D i zaznaczenie kluczowych punktów anatomicznych: zastawki serca, obszar mapowania potencjału pęczka Hisa, etc.) punktów o najlepszej zgodności mapowania stymulacyjnego. Punkty o najlepszej zgodności mapowania stymulacyjnego (11/12-12/12) w porównaniu do punków o mniejszej zgodności (< 11/12) wyznaczają na mapie obszar zainteresowania dla wykonania ablacji.
Zaletą wykorzystania systemów elektroanatomicznych jest skrócenie czasu ekspozycji na promieniowanie rentgenowskie zarówno dla leczonego pacjenta, jak i personelu medycznego, a czasem możliwość całkowitego wyeliminowania skopii rentgenowskiej (np. u kobiet w ciąży). Do elementów ograniczających efektywność systemów elektroanatomicznych należą: zmienność pozycji elektrody przy ruchach oddechowych i podczas pracy serca, ograniczenie komfortu pacjenta (konieczność unikania poruszania się i przesunięć o kilka centymetrów), trudności z odtworzeniem szczegółów anatomicznych (np. mięśnie brodawkowate). Systemy te pochłaniają dodatkowe koszty i wymagają dużego doświadczenia personelu medycznego. Ograniczenia systemów CARTO i ENSITE wynikają także z ograniczeń mapowania aktywacyjnego (brak spontanicznych PVC/VT lub niestabilny hemodynamicznie VT) i mapowania stymulacyjnego (szeroki obszar mapowania 12/12 z możliwością uzyskiwania tych pobudzeń z obszaru poza ogniskiem arytmii). Dodatkowo w systemie CARTO można wykorzystać elektrody ablacyjne tylko jednej firmy.(11, 13, 50, 51)
Inne systemy do mapowania
W nielicznych ośrodkach lub w pracach naukowych wykorzystywane są balony wieloelektrodowe (oceniające potencjały dwubiegunowe) lub balony do mapowania wielopunktowego bezkontaktowego (oceniające potencjały jednobiegunowe). W związku z ich ograniczeniami (wysoka cena, skomplikowane systemy, wydłużenie czasu zabiegu) nie są one powszechnie stosowane. Dostępny w poprzednich latach system LocaLisa do mapowania 3D nie jest obecnie produkowany.
Nawigacja przy pomocy robota (robotic navigation) jest obecnie w fazie wstępnych badań klinicznych. Opiera się ona na wykorzystywaniu robota z przedłużoną koszulką naczyniową lub stosowaniu pola magnetycznego. Systemy te nie są obecnie stosowane w Polsce.(11, 13)
Techniki ablacyjne w IVA
Podstawowym źródłem energii stosowanym przy ablacjach arytmii komorowych jest prąd o częstotliwości radiowej, wykorzystujący zjawisko uszkodzenia cieplnego komórek arytmogennych. W ostatnich latach wzrasta częstość wykonywania zabiegów metodą krioablacji wykorzystującą zamrażanie jako mechanizm uszkodzenia obszarów arytmogennych. Krioablacja jest chętniej stosowana w lokalizacjach arytmii komorowej przy pęczku Hisa i w okolicach naczyń, w sytuacjach, w których istnieje ryzyko nieodwracalnego uszkodzenia tkanek. Dodatkowo w miejscach bardzo bolesnych lub z niestabilnym kontaktem elektrody z endokardium krioablacja może przyczynić się do wykonania zabiegu bezboleśnie i ze stabilnym kontaktem elektrody podczas aplikacji.(11, 13, 50, 51)
Podstawowym materiałem stosowanym w końcówkach elektrod ablacyjnych jest stop irydu i platyny (Ir-Pt). Elektrody o długości końcówki 4 mm są standardowymi elektrodami do klasycznej ablacji. Dodatkowo wprowadzono elektrody 8 mm o dłuższej końcówce, szczególnie przydatne przy ablacjach cieśni trójdzielno-żylnej trzepotania przedsionków.(11, 13, 50, 51, 134-136)
Właściwości przewodnictwa cieplnego i ryzyka wykrzepiania na elektrodzie spowodowały rozwój badań nad zastosowaniem elektrod ze stopu złota (Au). Elektrody 4 mm i 8 mm typu Gold charakteryzują się większym przewodnictwem cieplnym i penetracją energii wgłąb endokardium oraz 8-krotnie mniejszym ryzykiem powstawania skrzeplin i zjawiska zwęglenia tkanek („charring”) na końcówce elektrody. Skuteczność tych elektrod została potwierdzona w ablacjach w trzepotaniu przedsionków i częstoskurczu węzłowym.(134-138) Większa powierzchnia końcówki elektrody ablującej może poprawiać skuteczność aplikacji. Nie przeprowadzono jednak prospektywnej oceny stosowania elektrod typu Gold i 8 mm w arytmiach komorowych.
Od kilku lat stosowane są również elektrody typu chłodzonego (cool-tip, irrigated tip). Za pomocą specjalnej pompy przepływowej połączonej z generatorem prądu stosowany jest stały przepływ (2 ml/min) soli fizjologicznej umożliwiający chłodzenie końcówki elektrody. Dodatkowo w czasie aplikacji prądu przepływ ten zwiększa się (max. do 30 ml/min). Elektrody typu chłodzonego pozwalają na głębszą penetrację prądu i mniejsze ryzyko powikłań zakrzepowo-zatorowych w porównaniu do klasycznych elektrod typu Ir-Pt 4 mm i 8 mm. Elektrody typu chłodzonego pozwalają również na aplikacje prądu w miejscach o wysokiej impedancji ograniczającej energię aplikacji (między beleczkami mięśniowymi, w zatoce wieńcowej, etc.). Elektrody typu chłodzonego stały się standardowymi elektrodami przy ablacji migotania przedsionków i większości arytmii komorowych w chorobie organicznej serca. Przy ich stosowaniu istnieje ryzyko zatoru powietrznego i przeciążenia serca nadmiarem płynu. Ograniczenia te są powodem stosowania automatycznych pomp przepływowych z funkcjami monitorującymi ryzyko tych powikłań.
Najbardziej powszechne techniki ablacji IVA to ablacja endokardialna prądem o częstotliwości radiowej.(11, 13, 50, 51, 137) Dojście endokardialne do ogniska arytmii z prawej komory wymaga nakłucia żyły udowej lub stosowanego sporadycznie nakłucia podobojczykowego lub szyjnego (do lokalizacji w okolicy drogi napływu prawej komory lub RVOT). Dojście endokardialne do ogniska arytmii lewokomorowej uzyskuje się przez nakłucie tętnicy udowej (ze względu na rozmiar elektrod nie jest powszechnie stosowane, ale może być rozważane dojście poprzez tętnicę ramieniową) i mapowania i ablacji z dostępu transaortalnego. Do mapowania lewokomorowego może również służyć dojście transeptalne (przez drożny otwór owalny, ASD oraz nakłucie przegrody międzyprzedsionkowej) i mapowanie lewej komory przez lewy przedsionek.(11, 13, 50, 51, 138, 139)
Dostęp do mapowania i ablacji epikardialnej może wymagać mapowania w zatoce wieńcowej i żyłach serca. Dostęp epikardialny pozanaczyniowy uzyskuje się również przez nakłucie worka osierdziowego pod wyrostkiem mieczykowatym mostka lub torakoskopowo. Mapowanie w odgałęzieniach zatoki wieńcowej jest stosowane dla określenia położenia ogniska arytmii w okolicy pierścienia mitralnego, płatków aortalnych oraz w epikardium znajdującym się pod żyłami serca dostępnymi dla elektrody mapującej od strony wejścia do zatoki wieńcowej. Mapowanie epikardialne z nakłucia worka osierdziowego jest stosunkowo nową techniką, ale rejestr zabiegów z kilku ośrodków potwierdził bezpieczeństwo i wartość tej techniki przy ablacjach arytmii komorowych. Mapowanie epikardialne może być szczególnie przydatne w wybranych arytmiach komorowych z organiczną chorobą serca, z uwagi na wyższą częstość występowania epikardialnych VT w populacjach chorych z zawałem ściany dolnej, kardiomiopatią w przebiegu choroby Chagas’a, AKPK i DCM.(11, 13, 50, 51, 81, 97, 98, 102-106) Jednak, z uwagi na ryzyko powikłań mapowanie i technikę ablacji epikardialnej powinno rozważać się jako leczenie przy bardzo groźnych objawach i nieskuteczności leczenia endokardialnego IVA.
Punkty końcowe dla ablacji IVA
Klasyczne, standardowe punkty końcowe dla oceny bezpośredniej skuteczności zabiegu ablacji IVA to:
– ustąpienie po aplikacji spontanicznej lub indukowanej, klinicznej arytmii;
– nie pojawianie się spontanicznych PVC/VT w bezpośredniej (15-30-minutowej) obserwacji po aplikacjach;
– nieindukowalność – brak PVC/VT po intensywnych protokołach stymulacji komory (do 3 bodźców dodatkowych z jednego lub kilku miejsc prawej lub lewej komory), po podaniu wlewu izoproterenolu i po stymulacji w czasie wlewu tego leku.(11-13, 74)
Powyższe punkty końcowe czasami nie mogą być spełnione podczas ablacji z uwagi na zanik spontanicznych i indukowanych PVC/VT po badaniu elektrofizjologicznym i w trakcie ablacji, oraz pod wpływem zmiany aktywności układu współczulnego i przywspółczulnego wpływającego na pobudliwość miejsca arytmogennego (np. pod wpływem leków sedatywnych i reakcji bólowych po aplikacjach).(11-13)
Nietypowe sposoby oceny skuteczności bezpośredniej PVC/VT obejmują:
– stymulację przedsionka oraz stosowanie innych technik;
– stosowania innych nietypowych technik potwierdzonych przed zabiegiem jako indukujące arytmię kliniczną (handgrip maneuver, próba Valsalvy, adenozyna, chłodzenie górnej połowy ciała, podprogowa stymulacja wysokiej częstotliwości przedsionka, głębokie nabranie oddechu i wstrzymanie go, podanie leku proarytmicznego, podanie alkoholu etylowego).
Minimalna ocena skuteczności bezpośredniej powinna dotyczyć braku występowania i indukowalności poprzednio udokumentowanej, występującej spontanicznie i powtarzalnie indukowanej przed ablacją arytmii klinicznej. U chorych z przetrwałymi, uporczywie nawracającymi w trakcie mapowania arytmiami komorowymi zanik arytmii po aplikacjach jest istotnym punktem końcowym, niezależnie od indukcji krótkich wstawek częstoskurczu komorowego.(11, 13, 67, 138) Protokół badania elektrofizjologicznego po zabiegu ablacji powinien zawierać stymulację programowaną komór z co najmniej 2 miejsc do sprzężenia 200 msek i trzech impulsów dodatkowych. Jeśli indukcja klinicznej arytmii wymagała podania izoproterenolu, należy ponownie wykonać programowaną stymulację komór po podaniu izoproterenolu.(11, 13)
Definicje powikłań dużych (major or serious adverse event, complications)
Powikłania duże ablacji arytmii komorowych są definiowane jako sytuacje prowadzące do przedłużenia pobytu szpitalnego lub dodatkowej hospitalizacji, wymagającej interwencji z powodu powikłania lub istotnego urazu lub śmierci chorego.
Inne powikłania typowe dla wszystkich zabiegów ablacji występują do 1-5% zabiegów w zależności od rodzaju procedury. Duże powikłania występujące przy zabiegach ablacji to: zgon (poniżej 1 na 1000 ablacji), zatorowość płucna i obwodowa (do 1%), blok przedsionkowo-komorowy, udar mózgu, zawał serca, uszkodzenia naczyń wieńcowych i centralnych.
Mogą wystąpić również uszkodzenia naczyń obwodowych (leczone inwazyjnie i wydłużające hospitalizacje: tętniaki rzekome, przetoki, krwiaki – do 2%) i struktur obwodowych (porażenia nerwów, odma, zapalenie śródpiersia, krwawienie pozanaczyniowe) w miejscu wkłucia i przechodzenia elektrod, uszkodzenia zastawek serca, infekcyjne zapalenie wsierdzia, uszkodzenia nerwów przeponowych, ostra niewydolność serca i płuc, krwotoki i konieczności przetaczania krwi, uszkodzenia związane z promieniowaniem rentgenowskim (w szczególności przy jednoczasowych badaniach kontrastowych i koronarografii). Mniejsze powikłania dotyczą reakcji alergicznych na środki stosowane przy ablacji i miejscowe łagodne wybroczyny.(11, 13, 50, 51, 59, 75, 90, 117)
Brakujące informacje dotyczące stanu wiedzy w zakresie leczenia ablacją IVA
Dotychczasowe badania uwzględniają niezbyt liczne grupy chorych z wysokospecjalistycznych ośrodków dysponujących w większości przypadków mapowaniem 3D.
Opublikowano nieliczne badania uwzględniające długoterminową (> 12 miesięcy) ocenę skuteczności i nawrotów po ablacji IVA.
Nie ustalono szczegółowo charakterystyki klinicznej i symptomatologii, w tym objawów nietypowych w populacji chorych z IVA leczonych ablacją.
Nie opublikowano szczegółowej charakterystyki indukowalności PVC/VT, parametrów mapowania i skuteczności ablacji w dużej populacji z IVA.
Nie są dokładnie znane wyniki obserwacji odległej leczenia chorych z podejrzeniem kardiomiopatii tachyarytmicznej (VT-DCM) i arytmicznej (PVC-DCM) w populacji chorych z IVA.
W związku z licznymi ograniczeniami w wiedzy w zakresie leczenia ablacją IVA postanowiono przeprowadzić szczegółową analizę populacji chorych z IVA i dokonać długoterminowej obserwacji po leczeniu ablacją przy wykorzystaniu klasycznego mapowania bez systemu 3D.
Cele badania
Cele główne
Ocena bezpośredniej i odległej skuteczności zabiegów ablacji IVA bez wykorzystania systemu 3D oraz ustalenie czynników przewidujących skuteczność zabiegu.
Szczegółowa charakterystyka kliniczna populacji chorych z IVA.
Cele dodatkowe
Analiza sposobów indukcji arytmii, parametrów klasycznego mapowania i przebiegu ablacji IVA.
Porównanie charakterystyki klinicznej i wyników ablacji u chorych z prostymi (PVC/pary PVC) i złożonymi (nsVT/VT) postaciami IVA.
Ocena częstości występowania i remisji PVC-DCM i VT-DCM w populacji chorych z IVA.
Metodyka badania
Grupa badana
Do badania i obserwacji długoterminowej włączono wszystkich kolejnych chorych zakwalifikowanych do pierwszego zabiegu ablacji z powodu IVA w Klinice Kardiologii CMKP w Warszawie (sierpień 2005-listopad 2010) oraz w Szpitalu Asklepios, Oddziale Kardiologii w Rzeszowie (grudzień 2005-październik 2009). U wszystkich chorych przeprowadzono analizę dokumentacji medycznej, objawów arytmii, charakterystyki klinicznej i elektrofizjologicznej arytmii.
Wszyscy chorzy wyrazili zgodę na udział w badaniu i uzyskano u nich pisemną, świadomą zgodę na użycie danych zebranych w tej analizie do opracowań naukowych. Obserwacje odległe przeprowadzono w okresie październik 2010-listopad 2011 celem uzyskania co najmniej rocznej obserwacji po pierwszym zabiegu ablacji.
Do badania wstępnie zakwalifikowano 265 chorych, jednak do analiz nie włączono 22 chorych z uwagi na brak możliwości uzyskania pełnych danych klinicznych w okresie kilku lat od zabiegu. Kilkunastu chorych miało wykonane 2-3 zabiegi w innych ośrodkach, co nie pozwoliło na pełną analizę zabiegów ponownych.
Kryteria włączenia
Do badania włączono chorych zakwalifikowanych do zabiegu ablacji z powodu objawowej IVA w dwóch ośrodkach elektrofizjologicznych. W okresie przedzabiegowym u wszystkich chorych wykonano 24-godzinne ambulatoryjne badanie EKG metodą Holtera oraz badanie echokardiograficzne. Oprócz chorych z podejrzeniem kardiomiopatii tachyarytmicznej i arytmicznej (wykluczona rodzinna, metaboliczna, niedokrwienna, infekcyjna etiolologia DCM) żaden chory w czasie włączenia do badania nie miał obniżonej LVEF lub objawów organicznej i genetycznie uwarunkowanej choroby serca określanej na podstawie badania EKG i wywiadu. Przed leczeniem chorzy wyrazili zgodę na zabieg.
Ocena nasilenia objawów arytmii
W pracy wykorzystano własny kwestionariusz objawów, w którym oceniano początek objawów, jakość objawów arytmii, nasilenie objawów w skali wizualnej (Visual Analog Scale – VAS) od 0 (brak objawu) do 10 (objaw maksymalnie ograniczający życie). Kwestionariusz (załącznik PDF na płycie CD) zawierał 50 zamkniętych i otwartych pytań dotyczących objawów arytmii i aktualnego stanu zdrowia. W kwestionariuszu znalazły się pytania dotyczące występowania i nasilenia typowych wymienianych w literaturze objawów arytmii. Oceniano podstawowe groźne objawy arytmii (szybkie kołatanie serca, stany przedomdleniowe, omdlenia, konieczność kardiowersji/defibrylacji z powodu zaburzeń hemodynamicznych, reanimacje, podawanie leków dożylnych celem przerwania arytmii) oraz pozostałe objawy arytmii wymieniane w standardach i badaniach (kołatanie serca, uczucie skurczu dodatkowego, uczucie nierównej pracy serca, ból w klatce piersiowej (klp), dławica, duszność, zmęczenie/senność, objawy nietolerancji wysiłku, objawy niewydolności serca). Dodatkowo zadawano pytania dotyczące nietypowych objawów arytmii, do których zaliczono: kaszel, dysfagię, chromanie przestankowe oraz zaburzenia widzenia pod postacią błysków w oczach. Wywiad objawów i ich natężenia kończono otwartym pytaniem o dodatkowy inny objaw związany według chorego z arytmią.
Przed zabiegiem weryfikowano występowanie nietypowych objawów arytmii (kaszlu arytmicznego, dysfagii arytmicznej, chromania, błysków w oczach, senności, zespołu małego rzutu w czasie mechanicznej bradykardii objawiającego się sennością, zmęczeniem, bólami głowy) oraz oceniano ich ustąpienie po skutecznym leczeniu farmakologicznym, w okresach braku PVC/VT lub po skutecznym zabiegu ablacji. Za objaw związany z arytmią uznawano objaw ustępujący po skutecznym leczeniu arytmii według metodyki przedstawionej w poprzednich publikacjach.(20, 21, 23, 24, 27, 28, 31, 94, 113, 125)
W przypadku występowania nietypowych objawów arytmii prowadzono diagnostykę interdyscyplinarną (pulmonologiczną, gastroenterologiczną i okulistyczną) oraz zmodyfikowane techniki skojarzonego monitorowania EKG z innymi technikami badawczymi (EKG+wideobarytografia, EKG+manometria przełykowa, EKG +polisomnografia, EKG+USG naczyniowe, ergospirometria).
Mapowanie, badanie elektrofizjologiczne i ablacja
Po odstawieniu leków antyarytmicznych wykonywano standardowy protokół mapowania wykorzystując techniki klasycznego mapowania bez systemu 3D z elektrodami ablacyjnymi o końcówkach irydowo-platynowych lub złotych o długości 4 mm lub 8 mm. Stosowano elektrody o rozmiarach 7F. W wybranych, powtórnych zabiegach stosowano elektrody typu chłodzonego, elektrody do krioablacji lub system 3D.
Po położeniu pacjenta i podłączeniu systemu elektrofizjologicznego wykonywano w pracowni elektrofizjologicznej rejestrację EKG celem dokumentacji spontanicznej arytmii komorowej, którą porównywano z dostępnymi zapisami z wcześniejszych rejestracji EKG. Przy braku spontanicznych PVC lub VT stosowano próbę Valsalvy (co najmniej 5-sekundowe: fazy nasilonego wdechu, parcia z napięciem mięśni prostowników brzucha przy zamkniętej głośni, nasilony wydech), głębokie oddechy (5-sekundowy maksymalny wdech i wydech) i test ściskania pięści (handgrip maneuvre – co najmniej 1-minutowe oburęczne szybkie ruchy ściskania pięści z napinaniem mięśni przedramion) oraz masaż zatoki szyjnej (10-sekundowe okresy masażu jednostronnego zatok szyjnych).
Następnie przy braku spontanicznej ektopii lub VT stosowano izoproterenol w bolusie (200 μg roztworu izopreterenolu rozpuszczonego do 20 ml 0,9% NaCl, dawka w bolusie 10 μg/ml) celem przyspieszenia rytmu zatokowego do 100-120/min i co najmniej 20% szybszego niż podstawowy rytm zatokowy.
Przy braku klinicznych PVC/VT po wykluczeniu spontanicznej remisji arytmii przed badaniem lub działania leków antyarytmicznych wykonywano standardowe badanie elektrofizjologiczne i programowaną stymulację komór. Podczas niej ponawiano próby indukcji klinicznej arytmii z klasyczną stymulacją przedsionka i komory z i bez wlewu izopreterenolu. Przy braku arytmii spontanicznej stosowano ponownie ćwiczenia izometryczne (handgrip maneuvre), próbę Valsalvy, masaż zatok szyjnych, głębokie oddechy oraz podawanie izoprenaliny w bolusie dożylnym celem przyspieszenia rytmu serca powyżej 120/min lub uzyskania PVC/VT.
U chorych z brakiem możliwości uzyskania spontanicznej lub zgodnej z kliniczną IVA wykonywano szczegółową analizę kliniczną i elektrofizjologiczną celem wykonania indukcji nietypowym protokołem lub czynnikiem indukującym [chłodzenie górnej połowy ciała, stymulacja podprogowa uszka prawego przedsionka, podawanie niewielkich dawek alkoholu etylowego z potwierdzonym w wywiadzie efektem proarytmicznym, podawanie dożylnego roztworu proarytmicznie działającego propafenonu (70 mg) lub adenozyny (12 mg)].
U wszystkich chorych starano się potwierdzić w powtarzalny sposób indukcję PVC/VT i możliwości prowadzenia mapowania aktywacyjnego (uzyskania stałego pojawiania się PVC lub VT). W czasie mapowania endokardialnego przy braku spontanicznej i indukowanej arytmii komorowej decydowano się na zabieg ablacji w oparciu o mapowanie stymulacyjne w arytmiach z prawdopodobieństwem pochodzenia z prawej komory i dokładną dokumentację 12-odprowadzeniowego EKG z PVC. Przy występowaniu spontanicznej arytmii komorowej zgodnej z morfologią zarejestrowanych wcześniej PVC/VT wprowadzano elektrody do jam serca bez wcześniejszych protokółów indukcyjnych poza stymulacją komory.
Elektrody wprowadzano do jam serca pod kontrolą skopii rentgenowskiej (rtg). Prowadzono analizę potencjałów dwubiegunowych z dystalnej i proksymalnej pary elektrod. Potencjały jednobiegunowe analizowano z dystalnego pierścienia elektrody. Elektroda podłączona była do systemu elektrofizjologiczngo Bard (Lowell, MA, USA) lub EP-Tracer CardioTek (Mastricht, Holandia). Stosowano generator prądu EP-Shuttle 70 – Stockert (Freiburg, Niemcy) z automatyczną kontrolą temperatury i mocy oraz ciągłym monitorowaniem impedancji końcówki elektrody.
Stosowano elektrody Alcath Gold 4 i 8 mm (Biotronik, Berlin, Niemcy) lub elektrody typu Cordis 4 mm (Biosense Webster, Bar Diamond, USA).
Wyjściowe ustawienia wynosiły 50°C/50 Watt (pozostawianych dla lokalizacji przy ujściach tętnic wieńcowych i miejscach bolesnych) oraz 60°C/60 Watt dla pozostałych lokalizacji.
Aplikacje rozpoczynano po wykonaniu mapowania aktywacyjnego i stymulacyjnego. Przy wystąpieniu zjawiska ucisku mechanicznego wykonywano analizę potencjałów przed zanikiem arytmii i mapowanie stymulacyjne. Wykonywano aplikacje po 30-60 sekund przedłużane do 90 sekund w zależności od efektu aplikacji i tolerancji ich przez chorego. Aplikacje przerywano przy dyslokacji elektrody, silnej reakcji bólowej na aplikacje, wystąpieniu zjawiska „steam pop” i nieskuteczności aplikacji.
Dla typowej lokalizacji prawostronnej wykonywano mapowanie z dojścia udowego prawego z żyły udowej. W przypadku lokalizacji lewokomorowych wykonywano mapowanie zatoki wieńcowej oraz mapowanie z dojścia udowego i nakłucia tętnicy udowej. Obserwacje po skutecznej aplikacji prowadzono przynajmniej przez 15 minut. W przypadku występowania zespołu podwójnej tachykardii rozpoczynano mapowanie i ablację istotniejszej arytmii lub arytmii łatwiej poddawalnej mapowaniu i ablacji.
W gestii lekarza wykonującego zabieg było wprowadzenie dodatkowej elektrody do mapowania lub stymulacji serca.
U wszystkich chorych wykonywano badanie elektrofizjologiczne składające się z programowanej stymulacji komór (co najmniej 2 cyklami 400, 500 msek do 3 impulsów dodatkowych z RV lub LV) oraz oceny przewodzenia wstecznego i indukowalności arytmii komorowej lub nadkomorowej stymulacją stopniowaną lub programowaną przedsionka (z elektrody ablacyjnej lub dodatkowej elektrody wprowadzonej do przedsionka).
Standardowo u wszystkich chorych nie stosowano intensywnej sedacji i premedykacji. Wszystkich chorych poddawano badaniu elektrofizjologicznemu i ablacji bez wyjściowego znieczulenia ogólnego i bez premedykacji. U chorych z wybitnie nasiloną reakcją lękową lub niepokojem podawano benzodiazepinę (2 mg Midanium i.v.) z utrzymaniem pełnego kontaktu z chorym. Z leków przeciwbólowych stosowano NSLP (pyralgina i ketonal i.v.), a w bardzo bolesnych miejscach lub u chorego z niskim progiem bólowym narkotyczne leki przeciwbólowe (fentanyl lub petydyna).
Do znieczulenia miejscowego w miejscu wkłucia stosowano 2% lignokainę w rozcieńczeniu (1:1) izotonicznym roztworem soli fizjologicznej.
Do przepłukiwania koszulek naczyniowych i mapowania prawostronnego stosowano roztwór heparyny niefrakcjonowanej (5000 jednostek międzynarodowych w 100 ml izotonicznego NaCl).
Stosowano dodatkowe co najmniej 5000 jednostek heparyny niefrakcjonowanej (lub 100 jednostek na 1 kg masy ciała) przy mapowaniu lewokomorowym i w zatokach Valsalvy. Przy przedłużającym się zabiegu podawano dodatkowo heparynę według uznania lekarza wykonującego zabieg.
W czasie zabiegu wykonywano ciągłe monitorowanie standardowego 12-odprowadzeniowego zapisu EKG rejestrowane w systemie elektrofizjologicznym. Prowadzono zapisy potencjałów jednobiegunowych i dwubiegunowych (między 10-400 Hz) wewnątrzsercowych w oparciu o standardowe ustawienia filtrów.
Zabieg wykonywano w zespole składającym się co najmniej z dwóch lekarzy i pielęgniarki lub technika medycznego.
Zabieg uznawano za skuteczny, jeśli osiągnięto następujący punkt końcowy: brak spontanicznej i indukowanej arytmii klinicznej, nie nawracającej w obserwacji 15-minutowej i stymulacji programowanej przedsionka i komory. U wszystkich chorych z indukcją arytmii po bolusie izoproterenolu/orcyprenaliny/adenozyny stosowano prowokację farmakologiczną po zabiegu ablacji.
Zabieg uznawano za nieskuteczny jeśli przy wykorzystaniu opisanych powyżej technik, w oparciu o uzyskiwany optymalny wynik mapowania aktywacyjnego i stymulacyjnego nie udało się uzyskać całkowitej eliminacji arytmii, jak również efekt aplikacji nie wpływał na częstość spontanicznej lub indukowanej arytmii. Zabieg przerywano również w sytuacji braku zgody chorego na jego kontynuowanie z uwagi na przedłużanie się zabiegu lub bardzo silne reakcje bólowe, a także gdy wystąpiły zaburzenia hemodynamiczne.
Efekt zabiegu uznawano za nieokreślony, gdy uzyskiwano w czasie zabiegu modyfikację arytmii (przejściowy zanik po aplikacjach, trudności z indukcją arytmii, zmiana morfologii PVC) ze sporadycznym i trudnym w mapowaniu pojawianiem się klinicznej morfologii PVC/VT. Przy występowaniu zjawiska pojawienia się PVC o nowej morfologii nie stwierdzanej poprzednio stosowano mapowanie i ablację tej arytmii. Ablację taką wykonywano w odległości co najmniej 1 cm od miejsc poprzednio poddawanych aplikacjom lub w innej strukturze anatomicznej, uznawano za ablację drugiego ogniska arytmii.
Lokalizację ogniska PVC/VT oceniano na podstawie EKG, mapowania wewnątrzsercowego i obrazu rtg. Mapowanie aktywacyjne lub inne stosowane w czasie zabiegu potwierdzało najwcześniejszą aktywację endokardialną arytmii przynajmniej z jednobiegunowym potencjałem typu V na dystalnym końcu elektrody i wyprzedzaniem co najmniej 10-15 msek i potencjałem odprowadzenia jednobiegunowego o morfologii o zwrocie ujemnym co najmniej typu „V”. W charakterystyce potencjałów jednobiegunowych wprowadzono dodatkowe złożone morfologie kształtu określane jako „vV”, „wV”, „vW”, „wW”. Mała litera alfabetu oznacza występowanie niskoamplitudowych wychyleń poprzedzających główne wychylenie mogące odpowiadać w zapisie dwubiegunowym pofragmentowanym niskonapięciowym potencjałom poprzedzającym wysokie potencjały komorowe.
Ostatecznym potwierdzeniem lokalizacji arytmii było ustąpienie arytmii w miejscu wykonania aplikacji. Przy braku skuteczności bezpośredniej i odległej weryfikowano lokalizację ogniska arytmii podczas kolejnego zabiegu. W przypadku nieskuteczności zabiegów ablacji lokalizację ustalano w miejscu o najlepszych parametrach mapowania aktywacyjnego i stymulacyjnego.
Charakterystyka poszczególnych lokalizacji arytmii dotyczyła również typowych cech EKG i potencjałów wewnątrzsercowych (tj. włókien Purkinjego). Przy podejrzeniu lokalizacji arytmii w okolicach ujść naczyń (wieńcowych) wykonywano obrazowanie za pomocą echa wewnątrzsercowego lub badania angiograficznego.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Hiss RG, Lamb LE: Electrocardiographic findings in 122,043 individuals. Circulation 1962; 25: 947-961.
2. Bjerregaard P: Premature beats in healthy subjects 40-79 years of age. Eur Heart J 1982; 3: 493-503.
3. Kennedy HL, Whitlock JA, Sprague MK et al.: Long-term follow-up of asymptomatic healthy subjects with frequent and complex ventricular ectopy. N Engl J Med 1985; 312: 193-197.
4. Acierno LJ: The History of Cardiology, 1994; The Parthenon Publishing Group. 9. V.: 348.
5. Gallavardin L: Extrasistolie ventriculaire à paroxysmes tachycardiques prolongés. Arch Mal Coeur 1922; 15: 298-306.
6. Rosenbaum MB: Classification of ventricular extrasystoles according to form. J Electrocardiol 1969; 2: 289-98.
7. Attina DA, Mori F, Falomi PL et al.: Long-term follow-up in children without heart disease with ventricular premature beats. Eur Heart J 1987; 8(Suppl D): 21-23.
8. Gaita F, Giustetto C, Di Donna P et al.: Long-term follow-up of right ventricular monomorphic extrasystoles. J Am Coll Cardiol 2001; 38: 364-70.
9. Ventura R, Steven D, Klemm HU et al.: Decennial follow-up in patients with recurrent tachycardia originating from the right ventricular outflow tract: electrophysiologic characteristics and response to treatment Eur Heart J 2007; 28: 2338-45.
10. Niwano S, Wakisaka Y, Niwano H et al.: Prognostic significance of frequent premature ventricular contractions originating from the ventricular outflow tract in patients with normal left ventricular function. Heart 2009; 95: 1230-37.
11. Zipes DP, Camm AJ, Borggrefe M et al.: ACC/AHA/ESC 2006 guidelines for management of patientswith ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death). Circulation 2006; 114: e385-e484.
12. Buxton AE, Calkins H, Callans CJ et al.: ACC/AHA/HRS 2006 key data elements and definitions for electrophysiology studies and procedures: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Data Standards (ACC/AHA/HRS Writing Committee to Develop Data Standards on Electrophysiology). J Am Coll Cardiol 2006; 48: 2360-96
13. Aliot EM, Stevenson WG, Almendral-Garrote JM et al.: European Heart Rhythm Association (EHRA); Registered Branch of the European Society of Cardiology (ESC); Heart Rhythm Society (HRS); American College of Cardiology (ACC); American Heart Association (AHA). EHRA/HRS Expert Consensus on Catheter Ablation of Ventricular Arrhythmias: developed in a partnership with the European Heart Rhythm Association (EHRA), a Registered Branch of the European Society of Cardiology (ESC), and the Heart Rhythm Society (HRS); in collaboration with the American College of Cardiology (ACC) and the American Heart Association (AHA). Heart Rhythm 2009; 6: 886-933.
14. Ng GA: Treating patients with ventricular ectopic beats. Heart. 2006; 92: 1707-12.
15. Huang CX, Liang JJ, Yang B et al.: Quality of life and cost for patients with premature ventricular contractions by radiofrequency catheter ablation. Pacing Clin Electrophysiol 2006; 29: 343-50.
16. Krittayaphong R, Sriratanasathavorn C, Bhuripanyo K et al.: One-year outcome after radiofrequency catheter ablation of symptomatic ventricular arrhythmia from right ventricular outflow tract. Am J Cardiol 2002; 89: 1269-74.
17. Krittayaphong R, Bhuripanyo K, Punlee K et al.: Effect of atenolol on symptomatic ventricular arrhythmia without structural heart disease: a randomized placebo-controlled study. Am Heart J 2002; 144: e10.
18. Segerson NM, Wasmund SL, Abedin M et al.: Heart rate turbulence parameters correlate with post-premature ventricular contraction changes in muscle sympathetic activity. Heart Rhythm 2007; 4: 284-9.
19. Hayashi H, Fujiki A, Tani M et al.: Role of sympathovagal balance in the initiation of idiopathic ventricular tachycardia originating from right ventricular outflow tract. Pacing Clin Electrophysiol 1997; 20: 2371-7.
20. Stec SM, Grabczak EM, Bielicki P et al.: Diagnosis and management of premature ventricular complexes-associated chronic cough. Chest 2009; 135: 1535-41.
21. Stec S, Dąbrowska M, Zaborska B et al.: Premature ventricular complex-induced chronic cough and cough syncope. Eur Respir J 2007; 30: 391-4.
22. Niimi A, Kihara Y, Sumita Y et al.: Cough reflex by premature ventricular contractions. Int Heart J 2005; 46: 923-926.
23. Stec S, Kulakowski P, Tarnowski W et al.: Radiofrequency ablation for premature ventricular complexes-induced dysphagia. Heart Rhythm 2007; 4: S11: abstract.
24. Stec S, Tarnowski W, Binda A et al.: Videofluoroscopic modified barium swallow study for premature ventricular complexes-associated dysphagia. Circ Arrhythmia Electrophysiol 1: e1, 2008.
25. Stec S, Tarnowski W, Kalin K et al.: High-resolution esophageal manometry with ECG monitoring for management of premature ventricular complexes-associated dysphagia. Dysphagia 2010; 25: 66-9.
26. Malkoff MD, Gomez CR, Myles G et al.: Cerebrovascular hemodynamic inefficiency of premature ventricular contractions. Angiology 1996; 47: 51-6.
27. Stec S, Zaborska B, Pilus A et al.: Intermittent claudication caused by frequent premature ventricular complexes: resolution after radiofrequency ablation. Angiology 2009; 60: 378-81.
28. Zaborska B, Stec S, Flasińska K et al.: Echocardiography and tissue Doppler imaging in assessment of haemodynamics in patients with idiopathic, premature ventricular complexes. Pol Merkur Lekarski 2006; 20: 302-4.
29. Cohn K, Kryda W: The influence of ectopic beats and tachyarrhythmias on stroke volume and cardiac output. J Electrocardiol 1981; 14: 207-18.
30. Lelakowski J, Dreher A, Majewski J et al.: Effects of catheter ablation of idiopathic ventricular ectopic beats on left ventricular function and exercise capacity. Kardiol Pol 2009; 67: 847-55.
31. Stec S, Szmit S, Grabczak EM et al.: Duszność wysiłkowa i przewlekły kaszel zależne od idiopatycznych pojedynczych skurczów komorowych. Kardiologia po Dyplomie 2008; 8: 46-50.
32. Duffee DF, Shen WK, Smith HC: Suppression of frequent premature ventricular contractions and improvement of left ventricular function in patients with presumed idiopathic dilated cardiomyopathy. Mayo Clin Proc 1998; 73: 430-3.
33. Tada H, Ito S, Shinbo G et al.: Significance and utility of plasma brain natriuretic peptide concentrations in patients with idiopathic ventricular arrhythmias. Pacing Clin Electrophysiol 2006; 29: 1395-403.
34. Sekiguchi Y, Aonuma K, Yamauchi Y et al.: Chronic hemodynamic effects after radiofrequency catheter ablation of frequent monomorphic ventricular premature beats. J Cardiovasc Electrophysiol 2005; 16: 1057-63.
35. Takemoto M, Yoshimura H, Ohba Y et al.: Radiofrequency catheter ablation of premature ventricular complexes from right ventricular outflow tract improves left ventricular dilation and clinical status in patients without structural heart disease. J Am Coll Cardiol 2005; 45: 1259-65.
36. Satish OS, Yeh KH, Wen MS et al.: Premature ventricular contraction-induced concealed mechanical bradycardia and dilated cardiomyopathy. J Cardiovasc Electrophysiol 2005; 16: 88-91.
37. Stec S, Płaza P, Dudek K et al.: Intracardiac echocardiography for optimisation of RF ablation for incessant idiopathic ventricular tachycardia originating from the aorto-mitralis continuity in a patient with tachycardia-induced cardiomyopathy. Kardiol Pol 2009; 67: 568-72.
38. Yarlagadda RK, Iwai S, Stein KM et al.: Reversal of cardiomyopathy in patients with repetitive monomorphic ventricular ectopy originating from the right ventricular outflow tract. Circulation 2005; 112: 1092-7
39. Redfield MM, Kay GN, Jenkins LS et al.: Tachycardia-related cardiomyopathy: a common cause of ventricular dysfunction in patients with atrial fibrillation referred for atrioventricular ablation. Mayo Clin Proc 2000; 75: 790-5.
40. Bogun F, Crawford T, Reich S et al.: Radiofrequency ablation of frequent, idiopathic premature ventricular complexes: comparison with a control group without intervention. Heart Rhythm 2007; 4: 863-7.
41. Wolk R, Stec S, Kulakowski P: Extrasystolic beats affect transmural electrical dispersion during programmed electrical stimulation. Eur J Clin Invest 2001; 31: 293-301.
42. Haïssaguerre M, Shoda M, Jaïs P et al.: Mapping and ablation of idiopathic ventricular fibrillation. Circulation 2002; 106: 962-7.
43. Haissaguerre M, Shah DC, Jais P et al.: Role of Purkinje conducting system in triggering of idiopathic ventricular fibrillation. Lancet 2002; 359: 677-8.
44. Knecht S, Sacher F, Wright M et al.: Long-term follow-up of idiopathic ventricular fibrillation ablation: a multicenter study. J Am Coll Cardiol 2009; 54: 522-8.
45. Frolkis JP, Pothier CE, Blackstone EH et al.: Frequent ventricular ectopy after exercise as a predictor of death. N Engl J Med 2003; 348: 781-90.
46. Noda T, Shimizu W, Taguchi A et al.: Malignant entity of idiopathic ventricular fibrillation and polymorphic ventricular tachycardia initiated by premature extrasystoles originating from the right ventricular outflow tract. J Am Coll Cardiol 2005; 46: 1288-94.
47. Viskin S, Antzelevitch C. The cardiologists’ worst nightmare sudden death from “benign” ventricular arrhythmias. J Am Coll Cardiol 2005; 46: 1295-7.
48. Viskin S, Rosso R, Rogowski O et al.: The short-coupled variant of right ventricular outflow ventricular tachycardia. A not so benign form of benign ventricular tachycardia. J Cardiovasc Electrophysiol 2005; 16: 912-6.
49. Srivathsan K, Lester SJ, Appleton CP et al.: Ventricular tachycardia in the absence of structural heart disease. Indian Pacing Electrophysiol J 2005; 5: 106-21.
50. Shoei K, Huang S, Wood M: Catheter Ablation of Cardiac Arrhythmias. Saunders; 2nd edition (October 15, 2010).
51. Lubiński A, Trusz-Gluza M, Walczak F: Podręcznik elektrofizjologii klinicznej. Via Medica, Gdańsk 2007; Wyd. I.
52. Fuster V, Rydén LE, Cannom DS et al.: American College of Cardiology; American Heart Association Task Force; European Society of Cardiology Committee for Practice Guidelines; European Heart Rhythm Association; Heart Rhythm Society. ACC/AHA/ESC 2006 Guidelines for the Management of Patients with Atrial Fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients With Atrial Fibrillation): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Europace 2006; 8: 651-745.
53. European Heart Rhythm Association (EHRA); European Cardiac Arrhythmia Society (ECAS); American College of Cardiology (ACC); American Heart Association (AHA); Society of Thoracic Surgeons (STS), Calkins H, Brugada J, Packer DL et al. HRS/EHRA/ECAS expert Consensus Statement on catheter and surgical ablation of atrial fibrillation: recommendations for personnel, policy, procedures and follow-up. A report of the Heart Rhythm Society (HRS) Task Force on catheter and surgical ablation of atrial fibrillation. Heart Rhythm 2007; 4:816-61.
54. Blomström-Lundqvist C, Scheinman MM, Aliot EM et al.: American College of Cardiology; American Heart Association Task Force on Practice Guidelines; European Society of Cardiology Committee for Practice Guidelines. Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythmias. ACC/AHA/ESC guidelines for the management of patients with supraventricular arrhythmias--executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythmias). Circulation 2003; 108: 1871-909.
55. Task Force for the Diagnosis and Management of Syncope; European Society of Cardiology (ESC); European Heart Rhythm Association (EHRA); Heart Failure Association (HFA); Heart Rhythm Society (HRS), Moya A, Sutton R, Ammirati F et al. Eur Heart J 2009; 30: 2631-71.
56. Task Force for Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of European Society of Cardiology, Dickstein K, Cohen-Solal A, Filippatos G et al.: ESC Committee for Practice Guidelines, Vahanian A, Camm J, De Caterina R, Dean V, Dickstein K, Filippatos G, Funck-Brentano C, Hellemans I, Kristensen SD, McGregor K, Sechtem U, Silber S, Tendera M, Widimsky P, Zamorano JL. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur Heart J 2008; 29: 2388-442.
57. Mason JW, Hancock EW, Gettes LS: Recommendations for the standardization and interpretation of the electrocardiogram: part II: electrocardiography diagnostic statement list: a scientific statement from the American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; the American College of Cardiology Foundation; and the Heart Rhythm Society. Heart Rhythm 2007; 4: 413-19.
58. García-Bolao I, Díaz-Infante E, Gallego AM: Spanish catheter ablation registry. Seventh official report of the Spanish Society of Cardiology Working Group on Electrophysiology and Arrhythmias (2007). Rev Esp Cardiol 2008; 61: 1287-97.
59. Macias Gallego A, Diaz-Infante E, Garcia-Bolao I: Spanish catheter ablation registry. 10th official report of the Spanish Society of Cardiology Working Group on Electrophysiology and Arrhythmias (2010). Rev Esp Cardiol 2011; 64: 1147-53.
60. Capucci A, Frabetti L, Gubelli S et al.: Tocainide and metoprolol: an efficacious therapeutic combination in the treatment of premature ventricular beats. Clin Cardiol 1989; 12: 322-31.
61. Saikawa T, Niwa H, Ito M et al.: The effect of propafenone on premature ventricular contractions (PVC): an analysis based on heart rate dependency of PVCs. Jpn Heart J 2001; 42: 701-11.
62. Paperini L, Davini A, Lattanzi F et al.: Propafenone and flecainide in the therapy of ventricular arrhythmias. Minerva Cardioangiol 1995; 43: 449-57.
63. Babuty D, Cosnay P, Rouesnel P et al.: Comparison of the efficacy/tolerability ratio of cibenzoline and propafenone in the treatment of ventricular arrhythmia. Ann Cardiol Angeiol 1992; 41: 225-34.
64. Facchini M, Bonazzi P, Priori SG et al.: Multiple comparison of several antiarrhythmic agents by acute oral testing in patients with chronic ventricular arrhythmias. Eur Heart J 1988; 9: 462-470.
65. Tsuchiya T, Okumura K, Honda T et al.: Effects of verapamil and lidocaine on two components of the re-entry circuit of verapamil-senstitive idiopathic left ventricular tachycardia. J Am Coll Cardiol 2001; 37: 1415-21.
66. Kim RJ, Iwai S, Markowitz SM et al.: Clinical and electrophysiological spectrum of idiopathic ventricular outflow tract arrhythmias. J Am Coll Cardiol 2007; 49: 2035-43.
67. Stevenson WG, Soejima K: Catheter ablation for ventricular tachykardia. Circulation 2007; 115: 2750-60.
68. Blanck Z, Jazayeri M, Dhala A et al.: Bundle branch reentry: a mechanism of ventricular tachycardia in the absence of myocardial or valvular dysfunction. J Am Coll Cardiol 1993; 22: 1718-22.
69. Ramprakash B, Jaishankar S, Rao HB et al.: Catheter ablation of fascicular ventricular tachycardia. Indian Pacing Electrophysiol J 2008; 8: 193-202.
70. Szumowski L, Walczak F, Przybylski A et al.: Ablation of a catecholaminergic polymorphic VT and VF originating for Purkinje fibers a case report. Kardiol Pol 2007; 65: 319-26.
71. Sanders P, Hsu LF, Hocini M et al.: Mapping and ablation of ventricular fibrillation. Minerva Cardioangiol 2004; 52: 171-81.
72. Marchlinski FE, Deely MP, Zado ES: Sex-specific triggers for right ventricular outflow tract tachycardia. Am Heart J 2000; 139: 1009-13.
73. Tanner H, Wolber T, Schwick N et al.: Electrocardiographic pattern as a guide for management and radiofrequency ablation of idiopathic ventricular tachycardia. Cardiology 2005; 103: 30-36.
74. Tanaka Y, Tada H, Ito S et al.: Gender and age differences in candidates for radiofrequency catheter ablation of idiopathic ventricular arrhtyhmias. Circ. J. 2011; 75: 1585-91.
75. Tada H, Tadokoro K, Miyaji K et al.: Idiopathic ventricular arrhythmias arising from the pulmonary artery: prevalence, characteristics, and topography of the arrhythmia origin. Heart Rhythm 2008; 5: 419-26.
76. Sekiguchi Y, Aonuma K, Takahashi A et al.: Electrocardiographic and electrophysiologic characteristics of ventricular tachycardia originating within the pulmonary artery. J Am Coll Cardiol 2005; 45: 887-95.
77. Szumowski L, Kusnierz J, Walczak F et al.: Recurrent ventricular tachycardia originating from the main trunk of the pulmonary artery effectively treated with RF ablation. Kardiol Pol 2005; 63: 100-4.
78. Yamauchi Y, Aonuma K, Takahashi A et al.: Electrocardiographic characteristics of repetitive monomorphic right ventricular tachycardia originating near the His-bundle. J Cardiovasc Electrophysiol 2005; 16: 1041-8.
79. Navarrete A: Idiopathic ventricular tachycardia arising from the right ventricular apex. Europace 2008; 10: 1343-5.
80. Jastrzebski M, Bacior B: Repetitive monomorphic ventricular tachycardia originating from the inferior tricuspid annulus. Cardiol J 2008; 15: 277-80.
81. Tanner H, Hindricks G, Schirdewahn P et al.: Outflow tract tachycardia with R/S transition in lead V3: Six different anatomic approaches for successful ablation. J Am Coll Cardiol 2005; 45: 418-423.
82. Kumagai K, Fukuda K, Wakayama Y et al.: Electrocardiographic characteristics of the variants of idiopathic left ventricular outflow tract ventricular tachyarrhythmias. J Cardiovasc Electrophysiol 2008; 19: 495-501.
83. Lin D, Ilkhanoff L, Gerstenfeld E et al.: Twelve-lead electrocardiographic characteristics of the aortic cusp region guided by intracardiac echocardiography and electroanatomic mapping. Heart Rhythm 2008; 5: 663-9.
84. Lamberti F, Calo’ L, Pandozi C et al.: Radiofrequency catheter ablation of idiopathic left ventricular outflow tract tachycardia: utility of intracardiac echocardiography. J Cardiovasc Electrophysiol 2001; 12: 529-35.
85. Krebs ME, Krause PC, Engelstein ED et al.: Ventricular tachycardias mimicking those arising from the right ventricular outflow tract. J Cardiovasc Electrophysiol 2000; 11: 45-51.
86. Ouyang F, Fotuhi P, Ho SY et al.: Repetitive monomorphic ventricular tachycardia originating from the aortic sinus cusp: electrocardiographic characterization for guiding catheter ablation. J Am Coll Cardiol 2002; 39: 500-8.
87. Ito S, Tada H, Naito S et al.: Development and validation of an ECG algorithm for identifying the optimal ablation site for idiopathic ventricular outflow tract tachycardia. J Cardiovasc Electrophysiol 2003; 14: 1280-6.
88. Hachiya H, Aonuma K, Yamauchi Y et al.: How to diagnose, locate, and ablate coronary cusp ventricular tachycardia. J Cardiovasc Electrophysiol 2002; 13: 551-6.
89. Kanagaratnam L, Tomassoni G, Schweikert R et al.: Ventricular tachycardias arising from the aortic sinus of valsalva: an under-recognized variant of left outflow tract ventricular tachycardia. J Am Coll Cardiol 2001; 37: 1408-14.
90. Yamada T, McElderry HT, Okada T et al.: Idiopathic left ventricular arrhythmias originating adjacent to the left aortic sinus of Valsalva: electrophysiological rationale for the surface electrocardiogram. J Cardiovasc Electrophysiol 2009; 21: 170-6.
91. Kamakura S, Shimizu W, Matsuo K et al.: Localization of optimal ablation site of idiopathic ventricular tachycardia from right and left ventricular outflow tract by body surface ECG. Circulation 1998; 98: 1525-33.
92. Gonzalez y Gonzalez MB, Will JC, Tuzcu V et al.: Idiopathic monomorphic ventricular tachycardia originating from the left aortic sinus cusp in children: endocardial mapping and radiofrequency catheter ablation. Z Kardiol 2003; 92: 155-63.
93. Stec S, Stanke A, Kryński T et al.: Częstość występowania, przebieg, bezpieczeństwo i skuteczność ablacji arytmii komorowych z opuszki aorty. Circ J 2006; 13: Suplement C:3.
94. Kryński T, Stec S, Szmit S et al.: Impact of radiofrequency catheter ablation on echocardiographic and cardiopulmonary performance in patients with ventricular extrasystolic beats and suspected arrhythmia-induced cardiomyopathy. Eur Heart J 2011; 32: Suplement: abstract 641.
95. Baszko A, Błaszyk K, Waśniewski M et al.: Long-term effects of radiofrequency ablation of ventricular tachycardia originating from the aortic cusps. Kardiol Pol 2005; 62: 289-93.
96. Szumowski Ł, Walczak F, Bodalski R et al.: Incessant monomorphic ventricular tachykardia originating from left aortic sinus cusp. Kardiol Pol 2003; 59: 363-9.
97. Ito S, Tada H, Naito S et al.: Simultaneous mapping in the left sinus of valsalva and coronary venous system predicts successful catheter ablation from the left sinus of valsalva. Pacing Clin. Electrophysiol 2005; 28 Suppl 1: S150-4.
98. Tada H, Naito S, Ito S et al.: Significance of two potentials for predicting successful catheter ablation from the left sinus of Valsalva for left ventricular epicardial tachycardia. Pacing Clin Electrophysiol 2004; 27: 1053-9.
99. Yamada T, Yoshida N, Murakami Y et al.: Electrocardiographic characteristics of ventricular arrhythmias originating from the junction of the left and right coronary sinuses of valsalva in the aorta: the activation pattern as a rationale for the electrocardiographic characteristics. Heart Rhythm 2008; 5: 184-92.
100. Good E, Desjardins B, Jongnarangsin K et al.: Ventricular arrhythmias originating from a papillary muscle in patients without prior infarction: a comparison with fascicular arrhythmias. Heart Rhythm 2008; 5: 1530-7.
101. Yamada T, McElderry HT, Okada T et al.: Idiopathic focal ventricular arrhythmias originating from the anterior papillary muscle in the left ventricle. J Cardiovasc Electrophysiol 2009; 20: 866-72.
102. Berruezo A, Mont L, Nava S et al.: Electrocardiographic recognition of the epicardial origin of ventricular tachycardias. Circulation 2004; 109: 1842-7.
103. Sosa E, Scanavacca M, d’Avila A et al.: A new technique to perform epicardial mapping in electrophysiology laboratory. J Cardiovasc Electrophysiology 1996; 7: 531-6.
104. Daniels DV, Lu YY, Morton JB et al.: Idiopathic epicardial left ventricular tachycardia originating remote from the sinus of Valsalva: electrophysiological characteristics, catheter ablation, and identification from the 12-lead electrocardiogram. Circulation 2006; 113: 1659-66.
105. Szumowski L, Derejko P, Urbanek P et al.: Endocardial and epicardial mapping during RF ablation of left ventricular ectopy. Kardiol Pol 2004; 61: 500-4.
106. Doppalapudi H, Yamada T, Ramaswamy K et al.: Idiopathic focal epicardial ventricular tachycardia originating from the crux of the heart. Heart Rhythm 2009; 6: 44-50.
107. Yamada T, Murakami Y, Yoshida N et al.: Efficacy of electroanatomic mapping in the catheter ablation of premature ventricular contractions originating from the right ventricular outflow tract. J Interv Card Electrophysiol 2007; 19: 187-94.
108. Kaseno K, Tada H, Ito S et al.: Ablation of idiopathic ventricular tachycardia in two separate regions of the outflow tract: prevalence and electrocardiographic characteristics. Pacing Clin Electrophysiol 2007; 30 Suppl 1: S88-93.
109. Kautzner J, Cihák R, Vancura V et al.: Coincidence of idiopathic ventricular outflow tract tachycardia and atrioventricular nodal reentrant tachycardia. Europace 2003; 5: 215-20.
110. Topilski I, Glick A, Viskin S et al.: Frequency of spontaneous and inducible atrioventricular nodal reentry tachycardia in patients with idiopathic outflow tract ventricular arrhythmias. Pacing Clin Electrophysiol 2006; 29: 21-8.
111. Krittayaphong R, Sriratanasathavorn C, Dumavibhat C et al.: Electrocardiographic predictors of long-term outcomes after radiofrequency ablation in patients with right-ventricular outflow tract tachycardia. Europace 2006; 8: 601-6.
112. Washizuka T, Niwano S, Tsuchida K et al.: AV reentrant and idiopathic double tachycardias: complicated interactions between two tachycardias. Heart 1999; 81: 318-320.
113. Stec S, Sikorska A, Kryński T et al.: Double tachycardia. One heart with two arrhythmias. Difficulties in diagnosis and treatment with radiofrequency ablation – case report. Pol Merkur Lekarski 2008; 24: 422-5.
114. Stec S: Sikorska A, Zaborska B et al.: Benign symptomatic premature ventricular complexes: short and long-term efficacy of antiarrhythmic drugs and radiofrequency ablation. Kardiol Pol 2012; 4: 351-8.
115. Stec S, Sikorska A, Pilus A et al.: Single oral dose of propafenone to predict long-term efficacy in symptomatic idiopathic premature ventricular complexes. Eur Heart J 2007; Supplement: poster 2542
116. Gill JS, Blaszyk K, Ward DE et al.: Verapamil for the suppression of idiopathic ventricular tachycardia of left bundle branch block-like morphology. Am Heart J 1993; 126: 1126-33.
117. Sacher F, Tedrow UB, Field ME et al.: Ventricular tachycardia ablation: evolution of patients and procedures over 8 years. Circ Arrhythmia Electrophysiol 2008; 1: 153-61.
118. Kurosaki K, Nogami A, Sakamaki M et al.: Automated template matching to pinpoint the origin of right ventricular outflow tract tachycardia. Pacing Clin Electrophysiol 2009; 32: Suppl 1: S47-51.
119. Yamashina Y, Yagi T, Namekawa A et al.: Distribution of successful ablation sites of idiopathic right ventricular outflow tract tachycardia. Pacing Clin Electrophysiol 2009; 32: 727-33.
120. Azegami K, Wilber DJ, Arruda M et al.: Spatial resolution of pacemapping and activation mapping in patients with idiopathic right ventricular outflow tract tachycardia. J Cardiovasc Electrophysiol 2005; 16: 823-9.
121. Bogun F, Taj M, Ting M et al.: Spatial resolution of pace mapping of idiopathic ventricular tachycardia/ectopy originating in the right ventricular outflow tract. Heart Rhythm 2008; 5: 339-44.
122. Yamada T, Murakami Y, Yoshida N et al.: Preferential conduction across the ventricular outflow septum in ventricular arrhythmias originating from the aortic sinus cusp. J Am Coll Cardiol 2007; 50: 884-91.
123. Kadish AH, Childs K, Schmaltz S et al. Differences in QRS configuration during unipolar pacing from adjacent sites: implications for the spatial resolution of pace-mapping. J Am Coll Cardiol 1991; 17: 143-51.
124. Clyne CA, Athar H, Shah A et al. Thermal mapping of right ventricular outflow tract tachykardia. Pacing Clin Electrophysiol 2007; 30: 343-51.
125. Stec S, Walczak F, Kułakowski P et al.: Ventricular bigeminy originating from right ventricular outflow tract – treated with RF ablation. Kardiol Pol 2003; 58: 505-10.
126. Kirsh JA, Gross GJ, O’Connor S et al.: Cryocath international patient registry. Transcatheter cryoablation of tachyarrhythmias in children: initial experience from an international registry. J Am Coll Cardiol 2005; 45: 133-6.
127. Kühne M, Sarrazin JF, Crawford T et al.: Radiofrequency ablation guided by mechanical termination of idiopathic ventricular arrhythmias originating in the right ventricular outflow tract. J Cardiovasc Electrophysiol 2010; 21: 42-6.
128. Di Biase L, Burkhardt JD, Lakkireddy D et al.: Mapping and ablation of ventricular arrhythmias with magnetic navigation: comparison between 4- and 8-mm catheter tips. J Interv Card Electrophysiol 2009; 26: 133-7.
129. Marchlinski FE, Callans DJ, Gottlieb CD et al.: Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation 2000; 101: 1288-96.
130. Niroomand F, Carbucicchio C, Tondo C et al.: Electrophysiological characteristics and outcome in patients with idiopathic right ventricular arrhythmia compared with arrhythmogenic right ventricular dysplasia. Heart. 2002; 87: 41-7.
131. Corrado D, Basso C, Leoni L et al.: Three-dimensional electroanatomical voltage mapping and histologic evaluation of myocardial substrate in right ventricular outflow tract tachycardia. J Am Coll Cardiol 2008; 51: 731-9.
132. Pruszkowska-Skrzep P, Kalarus Z, Sredniawa B et al.: Effectiveness of radiofrequency catheter ablation of right ventricular outflow tract tachycardia using the CARTO system Kardiol Pol 2005; 62: 138-44.
133. Pytkowski M, Maciąg A, Sterlinski M et al.: Lokalizacja ogniska arytmii u chorych z zaburzeniami rytmu serca pochodzącymi z drogi odpływu prawej komory. Folia Cardiologica 2006; 6: 494-50.
134. D’Avila A, Thiagalingam A, Holmvang G et al.: What is the most appropriate energy source for aortic cusp ablation? A comparison of standard RF, cooled-tip RF and cryothermal ablation. J Interv Card Electrophysiol 2006; 16: 31-8.
135. Sacher F, O’Neill MD, Jais P et al.: Prospective randomized comparison of 8-mm gold-tip, externally irrigated-tip and 8-mm platinum-iridium tip catheters for cavotricuspid isthmus ablation. J Cardiovasc Electrophysiol 2007; 18: 709-13.
136. Stühlinger M, Steinwender C, Schnöll F et al.: GOLDART-Gold alloy versus platinum-iridium electrode for ablation of AVNRT. J Cardiovasc Electrophysiol 2008; 19: 242-6.
137. Schmidt B, Chun KR, Baensch D et al.: Catheter ablation for ventricular tachycardia after failed endocardial ablation – epicardial substrate or inappropriate endocardial ablation? Heart Rhythm 2010; 7: 1746-52.
138. Stevenson WG, Wilber DJ, Natale A et al.: Multicenter Thermocool VT Ablation Trial Investigators. Irrigated radiofrequency catheter ablation guided by electroanatomic mapping for recurrent ventricular tachycardia after myocardial infarction: the multicenter thermocool ventricular tachycardia ablation trial. Circulation 2008; 118: 2773-82.
139. Pluta S, Lenarczyk R, Pruszkowska-Skrzep P et al.: Transseptal versus transaortic approach for radiofrequency ablation in patients with cardioverter-defibrillator and electrical storm. J Interv Card Electrophysiol 2010; 28: 45-50
140. Hosmer Jr DW, Lemeshow S: Applied Survival Analysis. New York. John Wiley & Sons 1999.
141. Kaplan EL, Meier P: Nonparametric estimation from incomplete observations. Journal of the American Statistical Association 1958; 53: 457-81.
142. Hardin, JW, Hilbe JM: Generalized estimating equations. London, UK: Chapman & Hall/CRC Press 2002.
143. Bottoni N, Quartieri F, Lolli G et al.: Sudden death in a patient with idiopathic ventricular outflow arrhythmia. J Cardiovasc Med 2009; 10: 801-3.
144. Szumowski Ł: Włókna Purkinjego – podłoże arytmii komorowych: leczenie ablacją. Rozprawa habilitacyjna. Warszawa: Instytut Kardiologii im. Prymasa Tysiąclecia Stefana Kardynała Wyszyńskiego 2009; 1-127 s.: Biblioteka Kardiologiczna 98, ISBN 83-88566-33-4.
145. Nogami A, Naito S, Tada H et al.: Demonstration of diastolic and presystolic Purkinje potentials as critical potentials in a macroreentry circuit of verapamil-sensitive idiopathic left ventricular tachycardia. J Am Coll Cardiol 2000; 36: 811-23.
146. Pytkowski M, Maciag A, Jankowska A et al.: Quality of life improvement after radiofrequency catheter ablation of outflow tract ventricular arrhythmias in patients with structurally normal heart. Acta Cardiol 2012; 67: 153-9.
147. Yokokawa M, Kim HM, Good E et al.: Relation of symptoms and symptom duration to premature ventricular complex-induced cardiomyopathy. Heart Rhythm 2012; 9: 92-5.
148. Kardos P, Berck H, Fuchs KH et al.: German Respiratory Society for diagnosis and treatment of adults suffering from acute or chronic cough. Pneumologie 2010; 64: 701-11.
149. Shin WS, Lee MY, Jang SW et al.: The significance of repetitive ventricular responses induced by radiofrequency energy application for idiopathic left ventricular tachycardia. J Korean Med Sci 2010; 25: 868-74.
150. Zhou J, Scherlag BJ, Yamanashi W et al.: Experimental model simulating right ventricular outflow tract tachycardia: a novel technique to initiate RVOT-VT. Cardiovasc Electrophysiol 2006; 17: 771-5.
151. Hasdemir C, Alp A, Aydin M et al.: Human model simulating right ventricular outflow tract tachycardia by high-frequency stimulation in the left pulmonary artery: autonomics and idiopathic ventricular arrhythmias. J Cardiovasc Electrophysiol 2009; 20: 759-63.
152. Mitrani RD, Klein LS, Miles WM et al.: Regional cardiac sympathetic denervation in patients with ventricular tachycardia in the absence of coronary artery disease. J Am Coll Cardiol 1993; 22: 1344-53.
153. Huizar JF, Kaszala K, Potfay J et al.: Left ventricular systolic dysfunction induced by ventricular ectopy: a novel model for premature ventricular contraction-induced cardiomyopathy. Circ Arrhythm Electrophysiol 2011; 4: 543-9.
154. Olgun H, Yokokawa M, Baman T et al.: The role of interpolation in PVC-induced cardiomyopathy. Heart Rhythm 2011; 8: 1046-9.
155. Cybulski G, Stec S, Zaborska B et al.: Application of ambulatory impedance cardiography for analysis of ventricular extrasystole beats. IFMBE Proceedings 2009; 25: 712-714.
156. Stec S: Typowe i nietypowe objawy zaburzeń rytmu serca. Postępy Nauk Medycznych 2010; 12: 910-6.








