Krzysztof Różycki1, 2, Jacek Rapacz, Jakub Fichna2, Piotr Kosson3
Obowiązujące i projektowane metody leczenia zaparć będących efektem ubocznym terapii bólu opioidami
Constipations as a side effect of opioid anti-pain therapy – current and future treatment methods
1Laboratorium Syntez Chemicznych, Instytut Medycyny Doświadczalnej i Klinicznej im. M. Mossakowskiego, Polska Akademia Nauk, Warszawa
2Zakład Biochemii, Wydział Lekarski, Uniwersytet Medyczny w Łodzi
3Środowiskowe Laboratorium Badań Toksykologicznych, Instytut Medycyny Doświadczalnej i Klinicznej im. M. Mossakowskiego, Polska Akademia Nauk, Warszawa
Summary
Pain is a serious problem for many patients. Frequently one needs to resort to strong medications to alleviate it. More often than not, however, this leads to further setbacks for the patient. Thus, constipation is reported in the majority of patients who take opioids as analgesics, which may likely herald additional health complications. Consequently, on numerous occasions patients make a decision to reduce the dose of the prescribed opiod, the resulting increase in pain level notwithstanding. The paper offers a thorough review of the currently available traditional and pharmacological methods of treating opiod-related constipations. Present-day research results in the area of innovative medications are also presented, including the PAMORA group, which unlike the previously employed drugs, are unable to interact with the central nervous system. Thanks to a new molecular design they do not have the means to penetrate the intestinal barrier and do not interfere with the pain-relief effects of morphine. Unfortunately, there is a shortage of effective implementation in this area for oncological patients, as current solutions tend to favour non-cancerous pain. The search for new medications in this group is under way.

Efekty uboczne przyjmowania środków przeciwbólowych
Obecnie ból coraz rzadziej traktowany jest jako współwystępująca przypadłość, towarzysząca chorobom czy urazom. Coraz częściej charakteryzowany jest jako oddzielne, niezależne zjawisko, opisywane powszechnie uznawanym zestawem definicji oraz określane przez taksonomię (1). Około 1/5 europejskiej populacji (osoby dorosłe) doświadcza bólu przewlekłego (2). Dane pokazują, że problem ten dotykać może nawet ponad połowy populacji światowej (3). Leczenie bólu w samej Europie kosztuje rocznie 200 mld EUR (1). Mniej niż 2% chorych podejmuje się terapii w ośrodkach specjalistycznych (2), opierając się głównie na podstawowych świadczeniach opieki zdrowotnej (4). Około 2/3 osób doświadczających bólu przewlekłego określa podejmowane działania zaradcze jako niewystarczające, zaś dolegliwości utrzymują się często latami (5). Zgodnie z ogólnie przyjętymi zasadami, w pierwszej kolejności powinny być używane leki najłagodniejsze i najbezpieczniejsze w stosowaniu, dlatego też rekomenduje się paracetamol oraz niesteroidowe leki przeciwzapalne. W przypadku większości osób doświadczających bólu przewlekłego, związki te okazują się jednak niewystarczające (6). Część pacjentów unika ich także ze względu na wyższe ryzyko wystąpienia zaburzeń pokarmowych czy sercowo-naczyniowych (7). W rezultacie przepisywane są opioidy.
Leki opioidowe to liczna klasa analgetyków, obejmująca m.in.: morfinę, tramadol, oksykodon czy kodeinę. Wykazują one wysoką skuteczność w uwalnianiu od doznań bólowych (8) i poprawie jakości życia (9), jednakże ich konsumpcja wiąże się z ryzykiem wystąpienia efektów ubocznych, innych niż te wywołane przez słabe leki przeciwbólowe. Badania sugerują, że skutki uboczne zażywania opioidów są bardzo powszechne. Co więcej, mogą być one bardziej uciążliwe niż dolegliwości, do których zwalczania zostały przepisane (10).
Receptory opioidowe to miejsca wiążące dla endogennie wytworzonych opioidów i egzogennych ligandów (11). Wyróżnia się trzy ich typy: μ, δ oraz κ, przy czym w układzie pokarmowym receptory μ występują głównie w podśluzówce i błonie śluzowej jelita krętego (10), podczas gdy receptory δ i κ ulegają ekspresji przede wszystkim w żołądku i okrężnicy (12). Podawane doustnie opioidy blokują receptory opioidowe μ zarówno centralnie w mózgu, jak i obwodowo (13). Centralna blokada wywołuje efekt analgetyczny, jednakże blokada obwodowa w niewielkim stopniu przyczynia się do zwalczania bólu, prowadząc głównie do rozmaitych skutków ubocznych (10, 11). Agoniści opioidowi wiążą się z receptorami opioidowymi w splotach mięśniowych i podśluzówkowych jelit (14), prowadząc do obniżenia perystaltyki, hamowania wydzielania wody i elektrolitów, stymulacji wchłaniania płynów, zwiększenia napięcia mięśni odbytu i zwieracza odźwiernika, a także zmniejszenia wrażliwości odbytnicy (11, 15). To z kolei prowadzi do zaparć odopioidowych (15), definiowanych jako mniej niż 3 wypróżnienia tygodniowo (16), które mogą być dużo silniejsze niż dolegliwości tego rodzaju niezwiązane z działaniem opioidów (np. słabsza i rzadsza aktywność jelit, twardsze stolce, silniejsze uczucie niepełnego wypróżnienia).
Zaburzenia pracy jelit wywołane przyjmowaniem opioidów
Analiza danych dotyczących pacjentów przyjmujących opioidy dowiodła, że aż ponad 1/3 doświadczała zaparć związanych z zażywaniem leków z tej klasy (ryc. 1). Indukowane opioidami zaburzenia pracy jelit stanowią narastający problem, którego nasilenie związane jest ze zwiększającą się konsumpcją silnych leków przeciwbólowych (17, 18). W większości państw zaleca się stosowanie opioidów wraz ze środkami przeczyszczającymi. Mimo to znaczący odsetek pacjentów doświadcza zaburzeń pracy jelit, które wpływają na obniżenie ich jakości życia. Należy przy tym nadmienić, że wpływ opioidów na funkcje układu pokarmowego może być różny w zależności od leku, dlatego też gdy podawanie leku jest niezbędne, lecz wywołuje on silne efekty uboczne, rozważa się jego zmianę na inny preparat z tej grupy bądź też aplikację inną drogą. Przykładowo, stosowanie morfiny wiąże się z większą częstotliwością występowania zaburzeń żołądkowo-jelitowych niż w przypadku wielu innych opioidów (19). Zarówno kodeina, jak i oksykodon oraz tapentadol wywołują zaparcia, jednak jedynie pierwszy ze wspomnianych związków opóźnia tranzyt jelitowy (20, 21). Tapentadol w mniejszym stopniu powoduje zaparcia, nudności i wymioty, jeśli porównać jego działanie z oksykodonem (22), mimo iż odznacza się podobną skutecznością w zwalczaniu silnego bólu szkieletowego (23). Przezskórna aplikacja fentanylu rzadziej prowadzi z kolei do zaparć niż podawana doustnie morfina w równoważnej dawce (24).
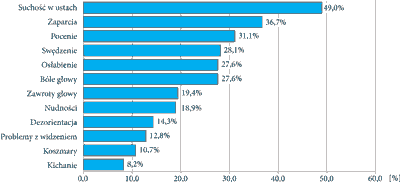
Ryc. 1. Główne skutki uboczne przyjmowania opioidów (59)
Według niektórych raportów zaparcia mogą dotykać nawet 67% osób przyjmujących pojedynczy opioid z różnych wskazań (25), 41-57% pacjentów nienowotworowych (18, 26) oraz nawet 94% chorych na raka (18). Około połowa osób przebywających na oddziałach paliatywnych deklaruje występowanie zaparć, przy czym niemal 80% z nich wymaga stosowania środków przeczyszczających (dotyczy to zwłaszcza pacjentów przyjmujących opioidy) (27). Częstotliwość występowania indukowanych opioidami zaparć zależy od liczby oraz typu przyjmowanych leków (19, 26); szczególnie silne zaparcia wiążą się z leczeniem bólu ostrego (21). W przeciwieństwie do innych skutków ubocznych, jak nudności czy sedacja, pacjenci nie wykształcają tolerancji na zaparcia; nie jest to także dolegliwość zależna od dawki leku (25). Jest jednak na tyle uciążliwa, że pacjenci w zaawansowanych stadiach choroby godzą się niekiedy na doświadczanie bólu, aby uwolnić się od zaparć (10, 15). W międzynarodowym badaniu PROBE (Patient Reports of Opioid-related Bothersome Effects) z udziałem 322 osób z USA i UE zażywających opioidy w celu zwalczania bólu przewlekłego, 1/3 badanych przyznała, że zmniejszała lub zupełnie pomijała dawki leku przeciwbólowego, a nawet całkowicie zaprzestała jego przyjmowania, aby uwolnić się od związanych z nim zaburzeń pracy jelit; 92% badanych doświadczało wówczas silniejszego bólu, zaś 86% raportowało obniżenie jakości życia i spadek codziennej aktywności (25, 26).
Powyższe badanie wyraźnie wykazuje, że zaparcia odopioidowe mogą stanowić poważny problem związany z przyjmowaniem silnych leków przeciwbólowych. Co więcej, wpływać mogą nie tylko na samopoczucie, lecz także prowadzić do niedrożności i perforacji jelit (28). Innymi skutkami mogą być: omdlenia, niedokrwienie wieńcowe lub mózgowe (zwłaszcza u osób starszych) (29), powstawanie żylaków (30), hemoroidów, ból i pieczenie w odbytnicy, a nawet pęknięcie jelita i zgon (31). Związane są ze zwiększoną zapadalnością na inne choroby i nasilonym wykorzystaniem zasobów opieki zdrowotnej (32). Hjalte i wsp. oszacowali, uwzględniając czynniki bezpośrednie (hospitalizacje, terapie, leki, wizyty u specjalistów i in.) i pośrednie (samoleczenie, utrata zarobków, ograniczona aktywność i in.), że ostre zaparcia generują najwyższy koszt, który sięgać może nawet 1525 EUR na osobę miesięcznie; dolegliwości o słabszym natężeniu (łagodne i umiarkowane) wiążą się z kolei z obciążeniem rzędu 1088-1196 EUR/os./mies. (33).
Popularne metody niwelowania zaparć odopioidowych
W pierwszej kolejności do zwalczania zaparć wykorzystywane są metody niefarmakologiczne (odpowiednie nawodnienie, błonnik, naturalne stymulanty, jak suszone śliwki bądź rabarbar) oraz środki przeczyszczające (17). Są to jednak sposoby jedynie częściowo skuteczne, gdyż nie są ukierunkowane na przyczynę problemu, czyli aktywację receptorów μ. Ponadto istnieje niewiele badań ukazujących skuteczność środków przeczyszczających w zwalczaniu zaparć indukowanych opioidami. Nadmierne stosowanie leków z tej grupy może wręcz prowadzić do kolejnych skutków ubocznych, jak: zaburzenia równowagi elektrolitowej, wykształcenie tolerancji lub uzależnienie od leków, powstawanie kamieni nerkowych, zaburzenia pracy nerek (34), a nawet utrata ruchliwości okrężnicy czy nowotwory jelita grubego (35). Ze względu na mechanizm działania wyróżnia się następujące grupy środków przeczyszczających (36):
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Tracey I, Bushnell M: How neuroimaging studies have challenged us to rethink: is chronic pain a disease? J Pain 2009; 10: 1113-1120.
2. Breivik H, Collett B, Ventafridda V et al.: Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment. Eur J Pain 2006; 10: 287-333.
3. Johannes CB, Le TK, Zhou X et al.: The prevalence of chronic pain in United States adults: results of an internet-based survey. J Pain 2010; 11: 1230-1239.
4. Smith B, Torrance N: Management of chronic pain in primary care. Curr Opin Support Pa 2011; 5: 137-142.
5. Elliott A, Smith B, Hannaford P et al.: The course of chronic pain in the community: results of a 4-year follow-up study. Pain 2002; 99: 299-307.
6. Moore A, Derry S, Eccleston C, Kalso E: Expect analgesic failure; pursue analgesic success. BMJ 2013; 346: f2690.
7. Lanas A, Tornero J, Zamorano JL: Assessment of gastrointestinal and cardiovascular risk in patients with osteoarthritis who require NSAIDs: the LOGICA study. Ann Rheum Dis 2010; 69: 1453-1458.
8. Mercadante S: Pain treatment and outcomes for patients with advanced cancer who receive follow-up care at home. Cancer 1999; 85: 1849-1858.
9. Klepstad P, Borchgrevink PC, Kaasa S: Effects on cancer patients’ health-related quality of life after the start of morphine therapy. J Pain Symptom Manag 2000; 20: 19-26.
10. Kurz A, Sessler DI: Opioid-induced bowel dysfunction: pathophysiology and potential new therapies. Drugs 2003; 63: 649-671.
11. Wood JD, Galligan JJ: Function of opioids in the enteric nervous system. Neurogastroent Motil 2004; 16: 17-28.
12. Bagnol D, Mansour A, Akil H, Watson SJ: Cellular localization and distribution of the cloned mu and kappa opioid receptors in rat gastrointestinal tract. Neuroscience 1997; 81: 579-591.
13. Camilleri M, Drossman DA, Becker G et al.: Emerging treatments in neurogastroenterology: a multidisciplinary working group consensus statement on opioid-induced constipation. Neurogastroent Motil 2014; 26: 1386-1395.
14. Sharma A, Jamal MM: Opioid induced bowel disease: a twenty-first century physicians dilemma. Considering pathophysiology and treatment strategies. Curr Gastroenterol Rep 2013; 15: 334-340.
15. Camilleri M: Opioid-induced constipation: challenges and therapeutic opportunities. Am J Gastroenterol 2011; 106: 835-842.
16. Gray JR: What is chronic constipation? Definition and diagnosis. Can J Gastroenterol 2011; 25: 7B-10B.
17. Pappagallo M: Incidence, prevalence, and management of opioid bowel dysfunction. Am J Surg 2001; 182: 11S-18S.
18. Kalso E, Edwards JE, Moore RA, McQuay HJ: Opioids in chronic non-cancer pain: systematic review of efficacy and safety. Pain 2004; 112: 372-380.
19. Cook SF, Lanza L, Zhou X et al.: Gastrointestinal side effects in chronic opioid users: results from a population-based survey. Aliment Pharm Ther 2008; 27: 1224-1232.
20. Prichard D, Norton C, Bharucha AE: Management of opioid-induced constipation. Br J Nurs 2016; 25: S4-S5, S8-11.
21. Gonenne J, Camilleri M, Ferber I et al.: Effect of alvimopan and codeine on gastrointestinal transit: a randomized controlled study. Clin Gastroenterol H 2005; 3: 784-791.
22. Stegmann J-U, Weber H, Steup A et al.: The efficacy and tolerability of multiple-dose tapentadol immediate release for the relief of acute pain following orthopedic (bunionectomy) surgery. Curr Med Res Opin 2008; 24: 3185-3196.
23. Lange B, Kuperwasser B, Okamoto A et al.: Efficacy and safety of tapentadol prolonged release for chronic osteoarthritis pain and low back pain. Adv Ther 2010; 27: 381-399.
24. Tassinari D, Sartori S, Tamburini E et al.: Adverse effects of transdermal opiates treating moderate-severe cancer pain in comparison to long-acting morphine: a meta-analysis and systematic review of the literature. J Palliat Med 2008; 11: 492-501.
25. Bell TJ, Panchal SJ, Miaskowski C et al.: The prevalence, severity, and impact of opioid-induced bowel dysfunction: results of a US and European Patient Survey (PROBE1). Pain Med 2009; 10: 35-42.
26. Holzer P: New approaches to the treatment of opioid-induced constipation. Eur Rev Med Pharmaco 2008; 12: 119-127.
27. Sykes N: Emerging evidence on docusate: commentary on Tarumi et al. J Pain Symptom Manag 2013; 45: 1.
28. Poitras R, Warren DL, Oyogoa S: Opioid drugs and stercoral perforation of the colon: Case report and review of literature. Int J Surg Case Rep 2017; 42: 94-97.
29. Young RW: The problem of fecal impaction in the aged. J Am Geriatr Soc 1973; 21: 383.
30. Lee AJ, Evans CJ, Ruckley CV, Fowkes FGR: Does Lifestyle Really Affect Venous Disease? [In:] Ruckley CV, Fowkes FGR, Bradbury AW (eds.): Venous Disease: Epidemiology, Management and Delivery of Care. Springer-Verlag, London 1999: 32-41.
31. Benyamin R, Trescot AM, Datta S et al.: Opioid Complications and Side Effects. Pain Physician 2008; 11: S105-S120.
32. Dennison C, Prasad M, Lloyd A et al.: The health-related quality of life and economic burden of constipation. Pharmacoeconomics 2005; 23: 461-476.
33. Hjalte F, Berggren A-C, Bergendahl H, Hjortsberg C: The direct and indirect costs of opioid-induced constipation. J Pain Symptom Manag 2010; 40: 696-703.
34. Tack J: Current and future therapies for chronic constipation. Best Pract Res Clin Gastroenterol 2011; 25: 151-158.
35. Dunnick JK, Hailey JR: Phenolphthalein exposure causes multiple carcinogenic effects in experimental model systems. Cancer Res 1996; 56: 4922-4926.
36. Gyawali B, Hayashi N, Tsukuura H et al.: Opioid-induced constipation. Scand J Gastroentero 2015; 50: 1331-1338.
37. Bajwa A, Fellow R, Emmanuel A: The physiology of continence and evacuation. Best Pract Res Clin Gastroenterol 2009; 23: 477-485.
38. Mawe GM, Hoffman JM: Serotonin signaling in the gastrointestinal tract: functions, dysfunctions, and therapeutic targets. Nat Rev Gastro Hepat 2013; 10: 473-486.
39. Meissner W, Schmidt U, Hartmann M et al.: Oral naloxone reverses opioid-associated constipation. Pain 2000; 84: 105-109.
40. Burns E, McWilliams K, Ross C: A cautionary tale of oral naloxone. J Pain Symptom Manag 2014; 47: e1-2.
41. Chey W, Webster L, Sostek M et al.: Naloxegol for opioid induced constipation in patients with noncancer pain. N Engl J Med 2014; 370: 2387-2396.
42. Aurilio C, Pace MC, Pota V, Sansone P: Opioid Induced Constipation. [In:] Catto-Smith AG (ed.): Constipation – causes, diagnosis and treatment. InTech 2012: 81-88.
43. Yuan CS, Foss JF, O’Connor M et al.: Methylnaltrexone for reversal of constipation due to chronic methadone use: a randomized controlled trial. JAMA 2000; 283: 367-372.
44. Yuan CS, Foss JF, O’Connor M et al.: Methylnaltrexone prevents morphine-induced delay in oral-cecal transit time without affecting analgesia: a double-blind randomized placebo-controlled trial. Clin Pharmacol Ther 1996; 59: 469-475.
45. Bee LA, Bannister K, Rahman W, Dickenson AH: Mu-opioid and noradrenergic α(2)-adrenoceptor contributions to the effects of tapentadol on spinal electrophysiological measures of nociception in nerve-injured rats. Pain 2011; 152: 131-139.
46. Candiotti KA, Gitlin MC: Review of the effect of opioid-related side effects on the undertreatment of moderate to severe chronic noncancer pain: tapentadol, a step toward a solution? Curr Med Res Opin 2010; 26: 1677-1684.
47. Hersh EV, Golubic S, Moore PA: Analgesic update: tapentadol hydrochloride. Compend Contin Educ Dent 2010; 31: 594-599.
48. Buynak R, Shapiro DY, Okamoto A et al.: Efficacy and safety of tapentadol extended release for the management of chronic low back pain: results of a prospective, randomized, double-blind, placebo- and active-controlled phase III study. Expert Opin Pharmaco 2010; 11: 1787-1804.
49. Corsetti M, Tack J: Linaclotide: A new drug for the treatment of chronic constipation and irritable bowel syndrome with constipation. United European Gastroenterol J 2013; 1: 7-20.
50. Bryant A, Busby R, Bartolini W et al.: Linaclotide is a potent and selective guanylate cyclase C agonist that elicits pharmacological effects locally in the gastrointestinal tract. Life Sci 2010; 86: 760-765.
51. Hale M, Wild J, Reddy J et al.: Naldemedine versus placebo for opioid-induced constipation (COMPOSE-1 and COMPOSE-2): two multicentre, phase 3, double-blind, randomised, parallel-group trials. Lancet Gastroenterol Hepatol 2017; 2: 555-564.
52. Chen X, Pitis P, Liu G et al.: Structure-activity relationships and discovery of a G protein biased mu opioid receptor ligand, [(3-methoxythiophen-2-yl) methyl]({2-[-(9r)-9-(pyridin-2-yl)-6-oxaspiro-[4.5]decan-9-yl]ethyl})amine (TRV130), for the treatment of acute severe pain. J Med Chem 2013; 56: 8019-8031.
53. Soergel D, Subach R, Burnham N et al.: Biased agonism of the μ-opioid receptor by TRV130 increases analgesia and reduces on-target adverse effects versus morphine: a randomized, double-blind, placebo-controlled, crossover study in healthy volunteers. Pain 2014; 155: 1829-1835.
54. Webster L, Jansen JP, Peppin J et al.: Alvimopan, a peripherally acting mu-opioid receptor (PAM-OR) antagonist for the treatment of opioid induced bowel dysfunction: results from a randomized, double-blind, placebo-controlled, dose-finding study in subjects taking opioids for chronic non-cancer pain. Pain 2008; 137: 428-440.
55. Armstrong S, Campbell C, Richardson C et al.: The in vivo pharmacodynamics of the novel opioid receptor antagonist, TD-1211, in models of opioid-induced gastrointestinal and CNS activity. N-S Arch Pharmacol 2013; 386: 471-478.
56. Vickery R, Li Y, Schwertschlag U et al.: TD-1211 phase 2b study demonstrates increased bowel movement frequency and constipation-related symptom improvement in patients with opioid induced constipation (OIC). Gastroenterology 2013; 144: S159.
57. Fosgerau K, Hoffmann T: Peptide therapeutics: current status and future directions. Drug Discov Today 2015; 20: 122-128.
58. Watson CPN, Watt-Watson J, Chipman M: The long-term safety and efficacy of opioids: A survey of 84 selected patients with intractable chronic noncancer pain. Pain Res Manag 2010; 15: 213-217.
59. Jamison RN, Dorado K, Mei A et al.: Influence of opioid-related side effects on disability, mood, and opioid misuse risk among patients with chronic pain in primary care. PAIN Reports 2017; 2: e589.

