Honorata Marczak, *Agnieszka Strzelak, Teresa Bielecka, Agnieszka Szczukocka-Zych, Marek Kulus
Zastosowanie alteplazy w nebulizacji u pacjenta z plastycznym zapaleniem oskrzeli po operacji sposobem Fontana – opis przypadku
Use of inhaled alteplase in a patient with plastic bronchitis after Fontan procedure – a case report
Klinika Pneumonologii i Alergologii Wieku Dziecięcego, Warszawski Uniwersytet Medyczny
Kierownik Kliniki: prof. dr hab. n. med. Marek Kulus
Summary
Plastic bronchitis (PB) is a rare disorder in children but a known complication of Fontan palliation. It is characterised by the formation of muco-cellular casts inside the tracheobronchial tree, which can cause recurrent life-threatening airway obstruction. Common presentation of PB includes atelectasis and dyspnea with potentially fatal outcome. The pathogenesis of this condition is not thoroughly understood. However, the abnormalities of lymphatic vessels may play a role. Various treatment strategies have been anecdotally reported but only few treatment options have been shown to be effective.
Authors present a case of a five-year-old girl with Fontan physiology who developed plastic bronchitis. Symptoms occurred 15 months after third stage of correction. Treatment with mucoactive agents and inhaled bronchodilatators had no beneficial effect. A trial of inhaled alteplase was administered and resulted in a full symptomatic recovery. This kind of treatment is unregistered in Poland.
The pathophysiology, clinical manifestation and therapeutic opportunities for PB in patients after cardiac surgeries have been reviewed.

Wstęp
Plastyczne zapalenie oskrzeli (ang. plastic bronchitis – PB) jest rzadkim schorzeniem polegającym na tworzeniu się wewnątrz drzewa oskrzelowego śluzowo-komórkowych odlewów. Narastające upośledzenie drożności dróg oddechowych może doprowadzić do niewydolności oddechowej i zgonu. Patomechanizm tworzenia się odlewów drzewa oskrzelowego u pacjentów z chorobą układu krążenia nie został dotąd jednoznacznie wyjaśniony. Postuluje się, że znaczenie mogą mieć zmiany hemodynamiczne, takie jak: zmniejszony rzut serca, zwiększone ciśnienie żylne czy upośledzenie przepływu chłonki w przewodzie piersiowym. Do objawów PB należą: nagła duszność, cechy niewydolności oddechowej oraz kaszel prowadzący do odkrztuszania odlewów oskrzeli. Ich obecność wiąże się ze znaczną śmiertelnością, sięgającą nawet 60%. Niestety do tej pory nie ustalono skutecznego standardu leczenia oraz zapobiegania nawrotom choroby.
Opis przypadku
Niespełna 5-letnia dziewczynka ze złożoną wadą serca pod postacią zespołu heterotaksji (prawostronny izomeryzm, dekstrokardia, niezbalansowana postać ubytku przegrody przedsionkowo-komorowej i całkowity nadsercowy spływ z żył płucnych), po trójetapowym leczeniu kardiochirurgicznym, z asplenią i całkowitym odwróceniem trzewi została przyjęta do Kliniki Pneumonologii i Alergologii Wieku Dziecięcego WUM w trybie ostrym z powodu podejrzenia zapalenia płuc.
Dziewczynka pozostaje pod stałą opieką kardiologiczną z powodu wady serca. Dotychczas była trzykrotnie operowana kardiochirurgicznie: zostało wytworzone zespolenie Blalock-Taussig, następnie dwukierunkowe zespolenie Glenna i ostatecznie, 15 miesięcy przed hospitalizacją w Klinice Pneumonologii i Alergologii Wieku Dziecięcego WUM, zabieg sposobem Fontana. W ostatnio wykonanym badaniu echokardiograficznym stwierdzono dobry wynik korekcji kardiochirurgicznej.
Przy przyjęciu na oddział stan ogólny dziewczynki był średni. Obserwowano nasiloną duszność: tachypnoe 60/min, tachykardię 130/min oraz spadek saturacji krwi tlenem (SO2) do 60%. W badaniu przedmiotowym z odchyleń od stanu prawidłowego stwierdzono zasinienie wokół ust, cechy duszności – zaciąganie dołka jarzmowego i przyczepów przepony. Nad całym lewym polem płucnym stwierdzono stłumienie odgłosu opukowego oraz ściszenie szmeru pęcherzykowego. Wyniki wykonanych badań laboratoryjnych wykazały z nieprawidłowości nieznacznie podwyższone stężenie CRP do 2,4 mg/dl (N < 1), nadpłytkowość 800 tys./mm3 oraz cechy wyrównanej zasadowicy oddechowej. W RTG klatki piersiowej obecne było całkowite zacienienie lewej połowy klatki piersiowej (ryc. 1). W przezklatkowym USG płuc uwidoczniono bezpowietrzne lewe płuco oraz obecność wolnego płynu otaczającego dolne partie płuc z maksymalną szerokością w zachyłku przeponowo-żebrowym do 18 mm. Na podstawie obrazu klinicznego i wyników badań dodatkowych u dziewczynki rozpoznano lewostronne zapalenie płuc z wysiękiem do opłucnej i włączono do leczenia cefalosporynę III generacji oraz klarytromycynę. W kolejnych dobach hospitalizacji obserwowano szybką poprawę stanu ogólnego, ustąpienie duszności oraz całkowite ustąpienie zmian niedodmowych w płucu lewym w badaniu radiologicznym i ultrasonograficznym, nie stwierdzono płynu w lewej jamie opłucnej. Dziewczynkę w dobrym stanie ogólnym wypisano do domu po 12-dniowej hospitalizacji z zaleceniem kontynuowania antybiotykoterapii makrolidem oraz wziewnego leczenia bronchodilatacyjnego. Po 5 dniach dziewczynka została ponownie przyjęta do Kliniki w trybie ostrym z powodu nasilonej duszności. W nocy poprzedzającej hospitalizację u dziecka wystąpiły napadowy kaszel oraz przyspieszenie oddechu, objawom towarzyszyły rejestrowane przez rodziców spadki SO2 do 75%. Nie obserwowano gorączki ani cech infekcji układu oddechowego.
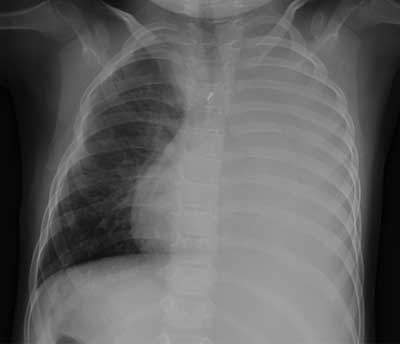
Ryc. 1. Całkowite zacienienie lewej połowy klatki piersiowej. Przełożenie trzewi, dekstrokardia. Cechy niewielkiego przemieszczenia śródpiersia na stronę lewą
Przy przyjęciu na oddział stan ogólny dziecka był średni, obserwowano duszność, tachypnoe 70 oddechów/min, obniżoną SO2 do 75%, HR 134/min, RR 104/77 mmHg. Z istotnych klinicznie odchyleń w badaniu przedmiotowym ponownie stwierdzono zasinienie wokół ust, cechy duszności – zaciąganie dołka jarzmowego i przyczepów przepony, nad całym lewym polem płucnym stwierdzono stłumienie odgłosu opukowego oraz ściszenie szmeru pęcherzykowego. Wątroba była wyczuwalna 2 cm poniżej lewego łuku żebrowego.
W radiogramie klatki piersiowej opisano zagęszczenia miąższowe w polu środkowym płuca lewego (ryc. 2). W badaniach laboratoryjnych z odchyleń od normy wykazano: cechy niewyrównanej kwasicy metabolicznej w gazometrii krwi, nieco podwyższone CRP 1,1 mg/dl (N < 1) oraz niewielką leukocytozę 14,03 tys./ml.
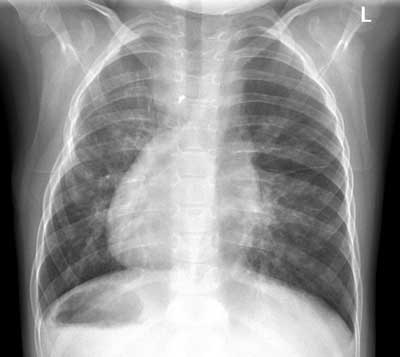
Ryc. 2. Zagęszczenia miąższowe w polu środkowym płuca lewego. Przełożenie trzewi, dekstrokardia
W trakcie wywiadu rodzice pacjentki dodatkowo zgłosili, że podczas poprzedniej hospitalizacji z powodu zapalenia płuc dziewczynka odkrztusiła wydzielinę przypominającą odlew oskrzeli, o czym nie poinformowali wówczas lekarza prowadzącego. Po odkrztuszeniu wydzieliny ustąpiła duszność oraz poprawił się stan ogólny dziecka.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Caruthers RL, Kempa M, Loo A et al.: Demographic characteristics and estimated prevalence of Fontan-associated plastic bronchitis. Pediatr Cardiol 2013; 34(2): 256-261.
2. Seear M, Hui H, Magee F et al.: Bronchial casts in children: a proposed classification based on nine cases and a review of the literature. Am J Respir Crit Care Med 1997; 155(1): 364-370.
3. Larue M, Gossett JG, Stewart RD et al.: Plastic bronchitis in patients with Fontan physiology: review of the literature and preliminary experience with Fontan conversion and cardiac transplantation. World J Pediatr Congenit Heart Surg 2012; 3(3): 364-372.
4. Costello JM, Steinhorn D, McColley S et al.: Treatment of plastic bronchitis in a Fontan patient with tissue plasminogen activator: a case report and review of the literature. Pediatrics 2002; 109(4): e67.
5. Madsen P, Shah SA, Rubin BK: Plastic bronchitis: new insights and a classification scheme. Paediatr Respir Rev 2005; 6: 292-300.
6. Brogan TV, Finn LS, Pyskaty DJ et al.: Plastic bronchitis in children: a case series and review of the medical literature. Pediatr Pulmonol 2002; 34(6): 482-487.
7. Schumacher KR, Singh TP, Kuebler J et al.: Risk factors and outcome of Fontan-associated plastic bronchitis: a case-control study. J Am Heart Assoc 2014; 3(2): e000865.
8. Malec E, Januszewska K: Pacjenci z pojedynczą komorą po operacji Fontana – nowe wyzwanie dla kardiologów. Kardiol Pol 2010; 68(4): 467-471.
9. Quasney MW, Orman K, Thompson J et al.: Plastic bronchitis occurring late after the Fontan procedure: treatment with aerosolized urokinase. Crit Care Med 2000; 28(6): 2107-2111.
10. Do TB, Chu JM, Berdjis F, Anas NG: Fontan patient with plastic bronchitis treated successfully using aerosolized tissue plasminogen activator: a case report and review of the literature. Pediatr Cardiol 2009; 30(3): 352-355.
11. Wakeham MK, Van Bergen AH, Torero LE, Akhter J: Long-term treatment of plastic bronchitis with aerosolized tissue plasminogen activator in a Fontan patient. Pediatr Crit Care Med 2005; 6(1): 76-78.
12. Schultz KD, Oermann CM: Treatment of cast bronchitis with low-dose oral azithromycin. Pediatr Pulmonol 2003; 35(2): 139-143.
13. Chaudhari M, Stumper O: Plastic bronchitis after Fontan operation: treatment with stent fenestration of the Fontan circuit. Heart 2004; 90(7): 801.
14. Wilson J, Russell J, Williams W, Benson L: Fenestration of the Fontan circuit as treatment for plastic bronchitis. Pediatr Cardiol 2005; 26(5): 717-719.
15. Barber BJ, Burch GH, Tripple D, Balaji S: Resolution of plastic bronchitis with atrial pacing in a patient with Fontan physiology. Pediatric Cardiol 2004; 25: 73-76.
16. Tanase D, Ewert P, Eicken A: Plastic bronchitis: symptomatic improvement after pulmonary arterial stenting in four patients with Fontan circulation. Cardiol Young 2015; 25(1): 151-153.
17. Laubisch JE, Green DM, Mogayzel PJ, Reid Thomson W: Treatment of plastic bronchitis by orthotopic heart transplantation. Pediatr Cardiol 2011; 32(8): 1193-1195.
18. El Mallah MK, Prabhakaran S, Chesrown S: Plastic bronchitis: resolution after heart transplantation. Pediatr Pulmonol 2011; 46(8): 824-825.
19. Parikh K, Witte MH, Samson R et al.: Successful treatment of plastic bronchitis with low fat diet and subsequent thoracic duct ligation in child with Fontan physiology. Pediatrics 2014; 134(2): e590-595.
20. Hug MI, Ersch J, Moenkhoff M et al.: Chylous bronchial casts after Fontan operation. Circulation 2001; 103: 1031-1033.
21. Nayar S, Parmar R, Kulkarni S, Cherian KM: Treatment of plastic bronchitis. Ann Thorac Surg 2007; 83: 1884-1886.
22. Dori Y, Keller MS, Rychik J, Itkin M: Successful treatment of plastic bronchitis by selective lymphatic embolization in a Fontan patient. Pediatrics 2014; 134(2): e590-595.
23. Salman S, Shah A: Plastic bronchitis: is thoracic duct ligation a real surgical option? Ann Thorac Surg 2006; 81(6): 2281-2283.


