*Aneta Obcowska-Hamerska1, Jarosław Basaj2
Choroby przenoszone drogą płciową powodujące objawy proktologiczne. Część 1. Choroby o etiologii bakteryjnej
Sexually transmitted diseases causing anorectal symptoms. Part 1. Bacterial infections
1Department of General, Vascular and Oncological. Surgery, Medical University of Warsaw
2Endoscopic Laboratory, Czerniakowski Hospital Sp. z o.o.
Streszczenie
W artykule autorzy omawiają najczęstsze infekcje bakteryjne powodujące objawy proktologiczne przenoszone drogą płciową – STI. Mimo dużego rozpowszechnienia, świadomość występowania tej grupy chorób, trendów w zachowaniach seksualnych i epidemiologii STI jest wśród chirurgów zbyt mała. Autorzy omówili najczęściej występujące infekcje: rzeżączkę, chlamydiozę i kiłę. Wśród patogenów bakteryjnych przyczyną stanów zapalnych w odbytnicy i kanale odbytu mogą być także: Mycoplasma genitalium, Escherichia coli, Salmonella, Campylobacter, Shigella. W pracy z pacjentem podejrzanym o STI istotna, poza wiedzą teoretyczną, jest umiejętność prowadzenia w warunkach intymnych dla chorego rozmowy na temat jego współżycia i preferencji seksualnych, ryzyka infekcji HIV i zasadności przeprowadzania diagnostyki w tym kierunku. Choroby STI mogą mieć także etiologię wirusową, co będzie omówione w drugiej części artykułu.
Summary
The paper discusses the most common bacterial sexually transmitted infections (STIs) causing anorectal symptoms. Despite their high prevalence, the surgeons’ awareness of this group of disorders, trends in sexual behaviours and the epidemiology of sexually transmitted infections is still limited. We discussed the most common infections, i.e. gonorrhoea, chlamydia and syphilis, in this paper. Bacterial pathogens responsible for inflammation of the rectum and anal canal may also include Mycoplasma genitalium, Escherichia coli, Salmonella, Campylobacter, and Shigella. In the case of a patient with suspected sexually transmitted infection, in addition to theoretical knowledge, a conversation about the patient’s sexual history and preferences, the risk of HIV infection and the reasons for performing diagnosis for sexually transmitted infections under intimate conditions is also important. Sexually transmitted infections may also have a viral aetiology, which will be discussed in the second part of the paper.

Wstęp
Liczba pacjentów leczonych z powodu chorób przenoszonych drogą kontaktów seksualnych stale wzrasta. Tylko w krajach UE corocznie notuje się ponad 500 tys. przypadków infekcji przenoszonych drogą płciową (ang. sexually transmitted infections – STI) (1, 2).
Manifestacja miejscowa infekcji nie ogranicza się wyłącznie do narządów płciowych. Prezentowane objawy wynikają z miejsca wniknięcia patogenu i mogą dotyczyć błon śluzowych przewodu pokarmowego, dlatego należy brać pod uwagę takie rozpoznanie również u pacjentów zgłaszających się z powodu objawów zapalenia odbytu i odbytnicy. Mimo dużego rozpowszechnienia świadomość występowania tej grupy chorób, trendów w zachowaniach seksualnych i epidemiologii STI jest wśród chirurgów zbyt mała. Elementy te mają duże znaczenie dla identyfikacji populacji zagrożonych, właściwej diagnostyki, leczenia i ograniczania dalszego rozprzestrzeniania się infekcji. Tło tych działań stanowi wiedza o ludzkim wirusie niedoboru odporności, który charakteryzuje grupę wysokiego ryzyka STI i zarówno w przypadku współzakażenia, jak i nadkażenia może wpływać na obraz kliniczny prezentowany przez pacjenta.
STI objawiające się dolegliwościami proktologicznymi są zwykle wynikiem receptywnego stosunku analnego, co jest praktykowane przez mężczyzn mających kontakty seksualne z mężczyznami (ang. men who have sex with men – MSM), a także osoby heteroseksualne czy kobiety transpłciowe (3). Inną możliwą drogą transmisji patogenów są stosunki oralno-analne, a w przypadku rzeżączki także przeniesienie, np. na przedmiotach zakażonej wydzieliny z pochwy (4-6).
W zależności od zasięgu zmian zapalnych w jelicie różnić się będą relacjonowane objawy. Najczęściej pacjenci zgłaszają poczucie dyskomfortu, ból odbytu, krwawienie świeżą krwią podczas wypróżnień, uczucie bolesnego parcia na stolec czy obecność śluzowej i ropnej wydzieliny w stolcu. Wymienione objawy mogą mieć zmienne nasilenie lub mimo aktywnego zakażenia nie występować wcale (7, 8). Fakt ten wraz z uwspólnianiem z niezakaźnymi chorobami proktologicznymi (takimi jak: nieswoiste zapalenia jelit, choroba hemoroidalna, szczelina odbytu, nowotwory odbytnicy i odbytu) niektórych objawów, bywa przyczyną opóźnionej diagnostyki. Dla poprawnego postępowania terapeutycznego ważna jest też świadomość częstych współzakażeń, które w populacji o dużym ryzyku dotyczą nawet 40% chorych (9).
Specyficzne cechy tej grupy patologii, poza odpowiednią diagnostyką i przy braku powikłań leczeniem zachowawczym, wskazują również na konieczność prowadzenia poradnictwa z zakresu transmisji patogenów i konieczności badania partnerów seksualnych.
W dalszej części artykułu zostaną omówione najczęstsze bakteryjne choroby przenoszone drogą stosunków płciowych, będące przyczyną zgłaszania się pacjentów do proktologa.
Rzeżączka
Rzeżączkowe zapalenie odbytnicy, powodowane przez Gram-ujemną dwoinkę Neisseria gonorrhea (N. gonorrhea), jest jedną z najbardziej rozpowszechnionych STI. Dane epidemiologiczne w Polsce wskazują na znacznie wyższy, niż w innych krajach Unii Europejskiej, stosunek liczby zakażonych mężczyzn do kobiet, wynoszący 14:1 (10). Fakt bezobjawowego przebiegu choroby u co najmniej połowy mężczyzn i nawet 95% kobiet z zapaleniem odbytnicy jest powodem istnienia dużej puli nosicieli i przyczynia się do rosnącego wskaźnika zachorowalności (6).
Objawy, jeśli występują, zazwyczaj pojawiają się w okresie 5-10 dni od zakażenia i obejmują świąd, niekiedy ból odbytu, uczucie niepełnego wypróżnienia oraz śluzowo-ropną wydzielinę. Rzadziej chorzy zgłaszają niewielkie krwawienia podczas wypróżnień. W proktoskopii, w zakresie do 10 cm widoczne mogą być: zatarcie rysunku naczyniowego, przekrwienie i krwawliwość kontaktowa błony śluzowej, w różnym stopniu pokrytej śluzowo-ropną wydzieliną.
Diagnostyka zakażenia opiera się na pobraniu materiału do hodowli na podłożu selektywnym lub do testów wykrywających DNA N. gonorrheae, szczególnie w przypadku rzeżączki skąpo- lub bezobjawowej (11, 12). W grupie MSM wyłącznie anorektalna lokalizacja infekcji jest obserwowana w ponad 70% przypadków, dla odróżnienia wśród kobiet w małym odsetku (6). Dlatego próbki materiału do badań powinny być pobierane z cewki moczowej lub moczu, odbytnicy i gardła, czyli z miejsc, na które wskazują praktyki seksualne (13).
Badanie mikrobiologiczne poza postawieniem rozpoznania daje możliwość oceny lekowrażliwości patogenu, co ma istotne znaczenie wobec rosnącej oporności dwoinki na kolejne antybiotyki (14). Materiał do badania uzyskuje się, wprowadzając wymazówkę na głębokość około 3 cm do kanału odbytu, a następnie pocierając nią o nabłonek na całym obwodzie pierścienia odbytniczego, przez około 10 sekund. Kontrola wzrokowa w anoskopii, podobnie jak pobieranie wymazu z odbytnicy, nie są wymagane (15, 16). Po potwierdzeniu zakażenia dwoinką wskazane jest poszerzenie diagnostyki o badania w kierunku innych chorób przenoszonych drogą płciową (kiła, chlamydioza, HIV, WZW B, WZW C). W ramach prewencji dalszego rozprzestrzeniania się choroby należy zalecić przeprowadzenie testów u osób, które w ciągu miesiąca poprzedzającego rozpoznanie miały stosunki płciowe z chorym (okres ten ulega wydłużeniu do 90 dni u partnerów chorych bezobjawowych). Dodatkowo, pacjentom zaleca się zaprzestanie kontaktów seksualnych od momentu rozpoznania do 14 dni po leczeniu.
Najczęściej stosowany schemat terapeutyczny obejmuje jednorazową iniekcję domięśniową 1 g ceftriaksonu wraz z 2 g azytromycyny podanymi doustnie.
U pacjentów, u których ustąpiły dolegliwości, po 2 tygodniach od podania antybiotyku zaleca się wykonanie testu molekularnego potwierdzającego eradykację, a w przypadku wyniku pozytywnego badanie mikrobiologiczne wraz z oceną lekowrażliwości patogenu. W sytuacji utrzymujących się objawów badanie hodowlane i ocenę lekowrażliwości wykonuje się po krótszym czasie – po 3-7 dniach od zakończenia leczenia (17).
Chlamydioza
Wewnątrzkomórkowa bakteria Chlamydia trachomatis jest przyczyną dwóch jednostek chorobowych, różniących się od siebie m.in. nasileniem objawów. Podobnie jak w przypadku rzeżączki, i tu obserwujemy bezobjawowe zakażenia przyczyniające się do rozprzestrzeniania infekcji. Wspólna jest także droga transmisji obu patogenów.
Serotypy A-K bakterii, poza zapaleniem cewki moczowej i szyjki macicy, są czynnikiem etiologicznym łagodnego zapalenia odbytnicy. Ten typ infekcji jest najczęstszy i zwykle przebiega bezobjawowo. Rzadko zgłaszane przez pacjentów dolegliwości obejmują bóle odbytu, uczucie parcia na stolec i stany gorączkowe. Makroskopowy obraz błony śluzowej może być zmienny – od prawidłowego, do nieswoistych cech świadczących o stanie zapalnym pod postacią przekrwienia i kruchości błony śluzowej (ryc. 1).
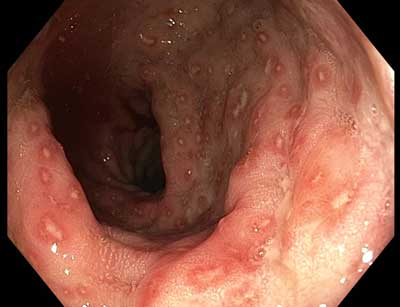
Ryc. 1. Zmiany zapalne w odbytnicy w przebiegu chlamydiozy
Wśród wszystkich lokalizacji chlamydiozy u mężczyzn z grupy MSM infekcja odbytnicy jest odnotowywana u niemal 10%. Podobny odsetek dotyczy kobiet, u których dodatkowo bardzo często współistnieje zakażenie dróg moczowo-płciowych (18, 19).
Znacznie bardziej agresywny przebieg wykazuje infekcja genotypami L1-L3, które poprzez translokację z błony śluzowej do głębszych tkanek przedostają się do regionalnych węzłów chłonnych, będąc przyczyną ziarnicy wenerycznej pachwin (Lymphogranuloma venereum – LGV).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Miles AJ, Mellor CH, Gazzard B et al.: Surgical management of anorectal disease in HIV-positive homosexuals. Br J Surg 1990; 77: 869-871.
2. https://www.ecdc.europa.eu/en/publications-data/infographic-sexually-transmitted-infections-long-standing-and-ongoing-threat.
3. Tian LH, Peterman TA, Tao G et al.: Heterosexual anal sex activity in the year after an STD clinic visit. Sex Transm Dis 2008; 35: 905-909.
4. Wexner SD: Sexually transmitted diseases of the colon, rectum, and anus. The challenge of the nineties. Dis Colon Rectum 1990; 33: 1048-1062.
5. Halperin DT: Heterosexual anal intercourse: prevalence, cultural factors, and HIV infection and other health risks, Part I. AIDS Patient Care STDS 1999; 13: 717-730.
6. Beck D: Sexually transmitted diseases. The ASCRS Textbook of Colon and Rectal Surgery. 2nd ed. Springer, New York 2011: 295-307.
7. Kent CK, Chaw JK, Wong W et al.: Prevalence of rectal, urethral, and pharyngeal chlamydia and gonorrhea detected in 2 clinical settings among men who have sex with men: San Francisco, California, 2003. Clin Infect Dis 2005; 41: 67-74.
8. de Vries HJC, Nori AV, Kiellberg Larsen H et al.: 2021 European Guideline on the management of proctitis, proctocolitis and enteritis caused by sexually transmissible pathogens. J Eur Acad Dermatol Venereol 2021; 35: 1434-1443.
9. Gambotti L, Batisse D, Colin-de-Verdiere N et al.: Acute hepatitis C infection in HIV positive men who have sex with men in Paris, France, 2001-2004. Euro Surveill 2005; 10: 115-117.
10. European Centre for Disease Prevention and Control: Gonorrhoea. [In:] ECDC. Annual epidemiological report for 2017. ECDC, Stockholm 2019.
11. Whiley DM, Garland SM, Harnett G et al.: Exploring ‘best practice’ for nucleic acid detection of Neisseria gonorrhoeae. Sexual Health 2008; 5: 17-23.
12. Bachmann LH, Johnson RE, Cheng H et al.: Nucleic acid amplification tests for diagnosis of Neisseria gonorrhoeae and Chlamydia trachomatis rectal infections. J Clin Microbiol 2010; 48: 1827-1832.
13. Jin F, Prestage GP, Mao L et al.: Incidence and risk factors for urethral and anal gonorrhoea and chlamydia in a cohort of HIV-negative homosexual men: the health in men study. Sex Trans Infect 2007; 83: 113-119.
14. Whiley DM, Goire N, Lahra MM et al.: The ticking time bomb: escalating antibiotic resistance in Neisseria gonorrhoeae is a public health disaster in waiting. J Antimicrob Chemother 2012; 67: 2059-2061.
15. Deheragoda P: Diagnosis of rectal gonorrhoea by blind anorectal swabs compared with direct vision swabs taken via a proctoscope. Br J Vener Dis 1977; 53: 311-313.
16. Kolator B, Rodin P: Comparison of anal and rectal swabs in the diagnosis of anorectal gonorrhoea in women. Br J Vener Dis 1979; 55(3): 186-187.
17. Unemo M, Ross J, Serwin A et al.: 2020 European guideline for the diagnosis and treatment of gonorrhoea in adults. Int J STD AIDS 2020 Oct 29; 956462420949126.
18. van Liere GA, Hoebe CJ, Wolffs PF et al.: High co-occurrence of anorectal chlamydia with urogenital chlamydia in women visiting an STI clinic revealed by routine universal testing in an observational study: a recommendation towards a better anorectal chlamydia control in women. BMC Infect Dis 2014; 14: 274.
19. Pinsky L, Chiarilli DB, Klausner JD et al.: Rates of asymptomatic nonurethral gonorrhea and chlamydia in a population of university men who have sex with men. J Am Coll Health 2012; 60: 481-484.
20. de Barbeyrac B, Laurier-Nadaliè C, Touati A et al.: Observational study of anorectal Chlamydia trachomatis infections in France through the lymphogranuloma venereum surveillance network, 2010-2015. Int J STD AIDS 2018; 29(12): 1215-1224.
21. Tinmouth J, Gilmour MW, Kovacs C et al.: Is there a reservoir of sub-clinical lymphogranuloma venereum and non-LGV Chlamydia trachomatis infection in men who have sex with men? Int J STD & AIDS 2008; 19(12): 805-809.
22. de Vrieze NH, de Vries HJC: Lymphogranuloma venereum among men who have sex with men. An epidemiological and clinical review. Expert Rev Anti Infect Ther 2014; 12: 697-704.
23. de Vries HJC, Shiva Nagi Reddy B, Khandpur S: Lymphogranuloma Venereum. [In:] Gupta S, Kumar B (eds.): Sexually Transmitted Infections. 2nd edn. Elsevier, New Delhi 2012: 506-521.
24. Klint M, Löfdahl M, Ek C et al.: Lymphogranuloma venereum prevalence in Sweden among men who have sex with men and characterization n of Chlamydia trachomatis ompA genotypes. J Clin Microbiol 2006; 44(11): 4066-4071.
25. Lanjouw E, Ouburg S, de Vries HJ et al.: 2015 European guideline on the management of Chlamydia trachomatis infections. Int J STD AIDS 2016; 27: 333-348.
26. Soni S, Srirajaskanthan R, Lucas SB et al.: Lymphogranuloma venereum proctitis masquerading as inflammatory bowel disease in 12 homosexual men. Aliment Pharmacol Ther 2010; 32: 59-65.
27. de Vries HJC, de Barbeyrac B, de Vrieze NHN et al.: 2019 European guideline on the management of lymphogranuloma venereum. J Er Acad Dermatol Venereol 2019; 33(10): 1821-1828.
28. de Vries HJ, Zingoni A, White JA et al.: 2013 European Guideline on the management of proctitis, proctocolitis and enteritis caused by sexually transmissible pathogens. Int J STD AIDS 2013; 25: 465-474.
29. Martin-Iguacel R, Llibre JM, Nielsen H et al.: Lymphogranuloma venereum proctocolitis: a silent endemic disease in men who have sex with men in industrialised countries. Eur J Clin Microbiol Infect Dis 2010; 29(8): 917-925.
30. Cha JM, Choi SI, Lee JI: Rectal syphilis mimicking rectal cancer. Yonsei Med J 2010; 51(2): 276-278.
31. Smith D: Infectious syphilis of the anal canal. Dis Colon Rectum 1963; 6: 7-10.
32. Mindel A, Tovey SJ, Timmins DJ, Williams P: Primary and secondary syphilis. Dis 1994; 18: 358-363.
33. Akdamar K, Martin RJ, Ichinose H: Syphilitic proctitis. Dig Dis Sci 1977; 22: 86.
34. Janier M, Unemo M, Dupin N et al.: 2020 European guideline on the management of syphilis. J Eur Acad Dermatol Venereol 2021; 35(3): 574-588.
35. Workowski KA, Berman S; Centers for Disease Control and Prevention (CDC): Sexually transmitted diseases treatment guidelines, 2010. MMWR Recomm Rep 2010; 59(RR-12): 1-110.
36. Workowski KA, Bachmann LH, Chan PA et al.: Sexually Transmitted Infections Treatment Guidelines, 2021. MMWR Recomm Rep 2021; 23: 1-187.
37. Phipps W, Kent CK, Kohn R, Klausner JD: Risk factors for repeat syphilis in men who have sex with men, San Francisco. Sex Transm Dis 2009; 36: 331-335.
38. Fleming DT, Wasserheit JN: From epidemiological synergy to public health policy and practice: the contribution of other sexually transmitted diseases to sexual transmission of HIV infection. Sex Transm Infect 1999; 75: 3-17.
39. Schwarcz SK, Kellogg TA, McFarland W et al.: Characterization of sexually transmitted disease clinic patients with recent human immunodeficiency virus infection. J Infect Dis 2002; 186: 1019-1022.
40. Kofoed K, Gerstoft J, Mathiesen LR, Benfield T: Syphilis and human immunodeficiency virus (HIV)-1 coinfection: influence on CD4 T-cell count, HIV-1 viral load, and treatment response. Sex Transm Dis 2006; 33: 143-148.


