© Borgis - Medycyna Rodzinna 5/2003, s. 134-137
Lidia Gorzelińska, Jacek Łuczak
Zespół wyniszczenia nowotworowego (kacheksja). Brak łaknienia (anoreksja)
The cancer cachexia syndrome and anorexia
z Kliniki Opieki Paliatywnej, Anestezjologii i Intensywnej Terapii Onkologicznej, Katedry Onkologii, Akademii Medycznej im. K. Marcinkowskiego w Poznaniu
Kierownik Kliniki: prof. dr hab. med. Jacek Łuczak
Summary
Cachexia is a serious oncological problem. It is responsible for decreasing the life expectancy and seriously influences the quality of life. Cancer cachexia is often accompanied by anorexia which make the patients condition further worse. The mechanism of cancer cachexia is unclear. Greates responsibility is assigned to cytokins relased by the host in answer to cancer growth. Megestrol acetate has a positive effect on cachexia acting by decreasing the level of cytokins. Forced feeding should not be used in patients whith advanced cancer.

Kacheksja (wyniszczenie) jest to brak apetytu i spadek masy ciała towarzyszące nieprawidłowościom metabolicznym. Słowo wywodzi się z greckiego kakos (zły) i hexis (kondycja). Costa określił to jako „postępujący fizyczny zanik organizmu” (3).
Anoreksja (jadłowstręt) jest to obniżenie apetytu powodujące zmniejszenie ilości spożywanych pokarmów.
Do charakterystycznych objawów zespołu wyniszczenia nowotworowego należą: brak apetytu, spadek masy ciała, osłabienie, łatwe męczenie się i osłabienie odporności.
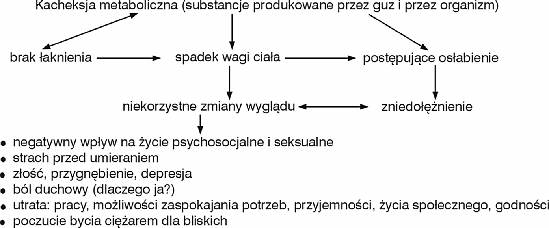
Wyniszczenie najczęściej występuje w przebiegu raka trzustki, żołądka, płuc i chłoniaków nieziarniczych. Ocenia się, że u 33-72% chorych na raka występuje utrata masy ciała, jadłowstręt lub zmniejszenie ilości przyjmowanego pokarmu (10). Około 45% osób hospitalizowanych z powodu raka traci więcej niż 10% wagi sprzed zachorowania, a 25% osób nawet więcej niż 20% wagi (8). Zaobserwowano korelację między utratą masy ciała, a okresem przeżycia. Niekorzystne zmiany w wyglądzie ciała prowadzą u części pacjentów do przewlekłej depresji, ograniczeniu ulega życie seksualne i towarzyskie. Ciało odmawia posłuszeństwa, co prowadzi do coraz większego uzależnienia od pomocy innych i uczucia bycia ciężarem dla rodziny. Te czynniki jeszcze bardziej nasilają niechęć do jedzenia. Rodzi się konflikt między rodziną, która postrzega przygotowywanie wymyślnych potraw i zachęcanie do ich jedzenia jako wyraz miłości i troski, a pacjentem, który „nie docenia” ich wysiłków i nie chce jeść. Często ostatnie dni życia chorego tracone są na bezsensowną „wojnę nad talerzem”. Zrozumienie mechanizmów kacheksji pozwala określić, kiedy leczenie ma szansę powodzenia (zahamowanie spadku masy ciała lub jej zwiększenie), a kiedy należy się poddać i pozwolić choremu spokojnie umrzeć (okres terminalny).
Ryc. 1. Wyniszczenie nowotworowe.
PATOMECHANIZM ZESPOŁU WYNISZCZENIA
Powszechnie uważa się, że za wystąpienie zespołu wyniszczenia nowotworowego odpowiedzialny jest brak apetytu. Tymczasem kacheksja nie jest jedynie efektem zmniejszonego apetytu. Może wyprzedzić stwierdzenie nowotworu, lub wystąpić we wczesnej fazie choroby, kiedy apetyt nie jest jeszcze upośledzony. Głodujące zdrowe osoby tracą głównie tkankę tłuszczową (organizm stara się oszczędzać białko), w przypadku zespołu wyniszczenia nowotworowego tracone jest zarówno białko jak i tłuszcze.
Udowodniono, że w chorobie nowotworowej zwiększony dowóz kalorii nie jest w stanie wyrównać masy ciała u pacjenta ciągle tracącego na wadze. Przyczyną tego faktu wydają się być zaburzenia metaboliczne spowodowane przez cytokiny.
Anorexia występuje u 78% pacjentów w ostatnim roku choroby nowotworowej. W normalnych warunkach apetyt jest stymulowany przez produkowany w podwzgórzu neuropeptyd Y (NPY) łączący się z receptorem Y-5. Istnieją także peptydy hamujące apetyt na drodze połączenia się z tym samym receptorem. Należą do nich leptyna, podobny do glukagonu czynnik 1 oraz urokortina. Przypuszcza się, że u osób chorych na nowotwór dochodzi do zaburzenia równowagi między tymi substancjami (5).
Do w dużej mierze usuwalnych przyczyn anoreksji należy zaliczyć: nudności, wymioty, zmiany w jamie ustnej, zaburzenia smaku i połykania, zaparcie stolca, biegunka, ból, depresja, niektóre leki, chemioterapia i radioterapia.
Dodatkową przyczyną zaburzeń odżywiania może być też miejscowe działanie guza powodujące mechaniczne utrudnienie połykania oraz przyswajania pokarmów i oddawania stolca.
Za wystąpienie kacheksji i tak zwanej „prawdziwej” anoreksji w dużej mierze odpowiedzialne są, produkowane przez komórki nowotworowe substancje, stymulujące organizm gospodarza do produkcji cytokin i limfokin, oraz wywołujące nieprawidłową odpowiedź układu hormonalnego na stres metaboliczny wywołany nowotworem. Substancje te powodują zaburzenia metabolizmu węglowodanów, białek i tłuszczów. Należą do nich:
– uwalniany przez makrofagi w obecności stanu zapalnego, infekcji lub uszkodzenia tkanek czynnik martwicy guza (TNF – tumor necrosis factor) zwany kachektyną. Oddziałuje on zarówno miejscowo, jak i ogólnie wywierając cytotoksyczny wpływ na komórki (12). Czynnik ten zmniejsza aktywność lipazy lipoproteinowej, powodując zmniejszenie produkcji tłuszczów oraz aktywację proteolizy w tkance mięśniowej. W badaniach na zwierzętach wykazano, że TNF podawany w sposób ciągły doprowadza do powstania zespołu wyniszczenia (4),
– produkowane przez guz czynniki indukujące lipolizę (LMFs – lipid mobilizing factors) – działają bezpośrednio na tkankę tłuszczową powodując zwiększone uwalnianie wolnych kwasów tłuszczowych i glicerolu (2),
– czynniki indukujące proteolizę (PMFs protein mobilizing factors) – powodują spadek masy ciała związany głównie ze zmniejszeniem masy mięśni poprzecznie prążkowanych (9).
Pozostałe to interleukina 1 (IL-1), interleukina 6 (IL-6), interferon g i LIF (leukemia – inhibiting factor).
Na powstanie kacheksji wpływ ma także zachwiana gospodarka hormonalna organizmu, wyrażająca się zwiększeniem poziomu glukagonu, epinefryny, adrenaliny i serotoniny we krwi (1).
Wyżej wymienione substancje przyczyniają się do powstania zaburzeń metabolicznych prowadzących do wyniszczenia organizmu.
Metabolizm węglowodanów: większość guzów litych z powodu słabego unaczynienia i związanego z tym niedotlenienia, czerpie energię głównie z beztlenowego spalania glukozy. Ponieważ proces ten jest mało efektywny energetycznie, komórki guza potrzebują bardzo dużo glukozy. W związku z tym w wątrobie występuje wzmożona produkcja glukozy z mleczanów, glicerolu i alaniny. Proces ten przyczynia się do utraty masy ciała. U części pacjentów występuje hipoglikemia związana ze zdolnością niektórych guzów do produkcji substancji podobnych do insuliny (insulinopodobny czynnik wzrostu – IGF II) (7).
Czynnik ten jest odpowiedzialny za wzmożony wychwyt glukozy na obwodzie.
Metabolizm tłuszczów: zwiększona lipoliza powoduje podwyższenie poziomu trójglicerydów i cholesterolu we krwi. Zmniejszona aktywność lipazy lipoproteinowej spowodowana istnieniem produkowanego przez guz czynnika zwanego kachektyną (TNF) prowadzi do spadku lipogenezy.
Metabolizm białek: nieprawidłowy wzmożony metabolizm polega na mobilizacji białka z tkanki mięśniowej i wzmożonej syntezie w wątrobie nowych białek, głównie białek ostrej fazy. W osoczu obserwuje się zmniejszone stężenie aminokwasów.
LECZENIE
Należy zacząć od wyjaśnienia pacjentowi i jego rodzinie, na czym polega zespół wyniszczenia nowotworowego, ze szczególnym podkreśleniem, że zwiększony dowóz pokarmów nie jest w stanie przywrócić dawnej wagi. Zrozumienie tego zapobiegnie w przyszłości karmieniu „na siłę”, co często zdarza się w ostatnich dniach życia pacjentów chorych na nowotwór. Zachęca się bliskich do częstego podawania małych porcji jedzenia na małych talerzach. Należy uwzględnić gust chorego i często zaburzone poczucie smaku (wskazane są potrawy raczej chłodne i dobrze przyprawione). Ponieważ jedzenie jest czynnością społeczną, zachęca się pacjentów do spożywania posiłków przy stole i w towarzystwie innych osób. Często chorzy czują się przygnębieni i zawstydzeni swoim zmienionym wyglądem, co powoduje niechęć do spotykania innych ludzi. Ważne jest, aby dostosowywać rozmiar ubrań i protez dentystycznych (wymiana co 3 miesiące) do zmienionych warunków fizycznych chorego.
Następnie należy usunąć odwracalne przyczyny braku apetytu do których należą:
– suchość i bolesność w obrębie jamy ustnej,
– uboczne efekty leków (opioidy, leki antycholinergiczne, inhibitory serotoniny, antybiotyki) oraz leczenia onkologicznego,
– zła kontrola bólu i innych objawów np. duszności,
– nudności, wymioty,
– ból podczas połykania,
– szybko występujące uczucie sytości (zespół uciśniętego żołądka),
– zaparcie stolca,
– zmieniony smak,
– strach przed umieraniem,
– depresja,
– bezsenność,
– uczucie osamotnienia,
– problemy rodzinne.
Jeśli istnieje mechaniczna przeszkoda, utrudniająca połykanie, a chory jest w dobrym stanie ogólnym wskazane jest rozważenie gastrostomii.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Bartlett D.L. et al.: Reversal of tumor associated hyperglucagonemia as treatment for cancer cachexia. Surgery 1995, 118: 87-91. 2. Costa G., Holand J.F.: Effect of Krebs-2 carcinoma on the lipide metabolism of male Swiss mice. Cancer Res 1962, 22:1081-3. 3. Costa G. Cachexia: The metabolic component of neoplastic diseases. Cancer Research. 1977, 37:2327-2336. 4. Darling G. et al.: Cachectic effects of recombinant human necrosis factor in rats. Cancer Res 1990, 50:4008-13. 5. Gerald C. et al.: A receptor sub-type involved a neuropeptide Y induced food intake. Nature 1996, 382:168-71. 6. Coretz R.L.: Parental nutrition: is it oncologically logical? J. Clin. Oncol. 1984, 2:534-8. 7. Schein P.S. et al.: Cachexia of malignancy. Potential role of insulin in nutritional management. Cancer 1997, 43:2070-6. 8. Shils M.E.: Principles of nutritional therapy. Cancer. 1979, 43:2093-2101. 9. Smith K.L., Tisdale M.J.: Mechanism of muscle degradation in cancer cachexia.Br. J. Cancer 1990, 50:4008-13. 10. Tchekmedyian N.S., et al.: Clinical aspects of nutrition in advanced cancer. Oncology. 1992, 49 (suppl 2):3-7. 11. Twycross R.G., Lack S.A.: Leczenie terminalnej choroby nowotworowej. Warszawa: PZWL, 1991. 12. Tommey D. et al.: Mechanisms mediating cancer cachexia. Cancer 1995, 76:2419-26.

