© Borgis - Nowa Stomatologia 3/2009, s. 59-63
Monika Kozarzewska1, *Marta Daszkiewicz1, Dorota Olczak-Kowalczyk1, 2, Bożenna Dembowska-Bagińska3
Zmiany patologiczne w jamie ustnej u pacjentów poddanych terapii przeciwnowotworowej
Oral pathologic lesions in patients subjected to oncologic treatment
1Zakład Patologii Jamy Ustnej Instytutu „Pomnik-Centrum Zdrowia Dziecka”, Warszawa
Kierownik Zakładu: dr hab. n. med. Dorota Olczak-Kowalczyk
2Zakład Stomatologii Dziecięcej Instytutu Stomatologii Warszawskiego Uniwersytetu Medycznego
Kierownik Zakładu: dr n. med. Aleksander Remiszewski
3Klinika Onkologii Instytutu „Pomnik-Centrum Zdrowia Dziecka”, Warszawa
Kierownik Kliniki: prof. dr hab. n. med. Danuta Perek

Leczenie chorób nowotworowych obejmuje postępowanie chirurgiczne, chemioterapię wielolekową oraz napromienianie. W większości przypadków terapia prowadzona jest w sposób skojarzony. Wybór metody leczenia przeciwnowotworowego uwarunkowany jest rodzajem choroby, stopniem zaawansowania klinicznego procesu chorobowego, dynamiką jego rozwoju, lokalizacją, charakterystyką biologiczną nowotworu oraz stanem ogólnym pacjenta.
Terapia onkologiczna obarczona jest wieloma działaniami niepożądanymi i występowaniem różnie nasilonych, wczesnych i późnych odczynów, które przejściowo lub trwale uszkadzają zdrowe tkanki. Powstałe w przebiegu leczenia zmiany morfologiczne i czynnościowe w obrębie układu stomatognatycznego istotnie pogarszają jakość życia pacjenta.
Najczęściej spotykanymi „stomatologicznymi” powikłaniami terapii przeciwnowotworowej (głównie chemioterapii) są zmiany zapalne błony śluzowej jamy ustnej, określane ogólnie jako mucositis. Poza tym terapia onkologiczna (przede wszystkim radioterapia) może być przyczyną zaburzeń wydzielania śliny z jego następstwami: suchością w jamie ustnej, zaburzeniami smaku, uszkodzeniem tkanek zmineralizowanych zębów, osteoradionekrozy, zwłóknienia mięśni twarzy, zaburzeń odontogenezy i rozwoju twarzoczaszki, opóźnionego wyrzynania zębów, hipoplazji szkliwa i zębiny, mikrodoncji, zaburzeń morfologicznych korzeni zębów (V-kształt) oraz wtórnych infekcji wirusowych, bakteryjnych i grzybiczych (1, 2).
Nasilenie efektów ubocznych leczenia onkologicznego zależy od zastosowanego protokołu leczenia. Istotnymi są: rodzaj i dawka chemioterapeutyków, rodzaj i dawka napromieniania oraz skojarzenie obu metod leczenia. Zmiany zapalne błony śluzowej w czasie chemioterapii pojawiają się u 60% pacjentów, w terapii skojarzonej u 90%, a nawet 100% chorych.
Przyczyną dużej wrażliwości komórek nabłonkowych błony śluzowej na cytotoksyczne działanie chemioterapii i napromieniania jest ich względnie szybkie tempo namnażania się i podziałów w porównaniu z komórkami innych narządów (14 dni) (2, 3, 4, 5).
Wszystkie rodzaje cytostatyków stosowanych w terapii onkologicznej mogą wywołać objawy mucositis. Występuje ono jednak najczęściej po podaniu fluorouracylu, metotreksatu, doksorubicyny, aktynomycyny D, melfalanu, cytarabiny, cyklofosfamidu, bisulfanu, cisplatyny i winblastyny (6).
Popromienne objawy w jamie ustnej pojawiają się już przy dawce 5-10 Gy. Warto podkreślić, że protokoły napromieniania guzów w okolicy głowy i szyi zalecają dawki wielokrotnie większe. Zmiany w obrębie błony śluzowej jamy ustnej jak rumień, obrzmienie pojawiają się między 3. a 15. dniem terapii, zmiany nadżerkowe obserwowane są około 7. dnia napromieniania (1). W napromienianej błonie śluzowej dochodzi do ostrej reakcji naczyniowej, zwiększenia ilości płynu pozanaczyniowego i obrzmienia, martwicy komórek.
Ryzyko wystąpienia niepożądanego działania radioterapii zwiększa się wraz z połączeniem tej metody z chemioterapią ponieważ niektóre cytostatyki nasilają miejscowe działanie promieniowania lub „ujawniają” nieme klinicznie uszkodzenia popromienne.
Skala zmian po napromienianiu wg WHO zawiera 4 stopnie nasilenia objawów: 1 – rumień, 2 – rumień z powierzchownymi nadżerkami, 3 – rumień ze zlewnymi nadżerkami, 4 – rozległe owrzodzenia. W chwili obecnej nadrzędną jest klasyfikacja CTCAE v 3.0 (ang. Common Terminology Criteria Adverse Events version 3.0) uwzględniająca kryteria anatomiczne i patofizjologiczne oraz ujednolicająca sposób oceny działań niepożądanych w różnych metodach leczenia. Podkreśla ona konieczność wdrożenia odpowiedniego postępowania leczniczego w zależności od stopnia nasilenie objawów (1, 6, 7, 8) (tab. 1).
Tabela 1. Stopień nasilenia mucositis wg klasyfikacji CTCAE v 3.0.
| Mucositis | Stopień nasilenia |
| 1 | 2 | 3 | 4 | 5 |
| Objawy kliniczne | zaczerwienienie | pojedyncze owrzodzenia i błony rzekome | zlewające się owrzodzenia i błony rzekome, krwawienia po niewielkich urazach | rozległa martwica tkanek, krwawienia samoistne | śmierć |
| Zaburzenia funkcji | zaburzenia smaku | możliwe odżywianie doustne, konieczna modyfikacja diety | niezdolność do odżywiania doustnego konieczne leczenie szpitalne | zagrożenie życia, konieczna intensywna opieka medyczna | śmierć |
Mucositis określane jest obecnie jako uszkodzenie bariery śluzówkowej (ang. mucosal barier injury – MBI), zlokalizowane w obrębie jamy ustnej – oral MBI (OMBI), w dalszych odcinkach przewodu pokarmowego gut MBI (GMBI) (6, 9).
Występowanie MBI nie tylko wpływa na pogorszenie jakości życia pacjenta ale też znacznie upośledza funkcje życiowe. Sprzyja rozwojowi innych zespołów chorobowych, które stanowią zagrożenie życia (sepsa, ostry zespół niewydolności oddechowej), a także niejednokrotnie uniemożliwia realizację programu leczenia onkologicznego (3, 6, 10).
MBI występuje w kilka dni po rozpoczęciu leczenia przeciwnowotworowego. Przebieg powikłań w obrębie błony śluzowej przewodu pokarmowego podzielono na 4 fazy: zapalną, nabłonkową, wrzodziejąco-bakteryjną i gojenia. W fazie zapalnej istotną rolę odgrywa pogłębiająca się neutropenia, spadek liczby granulocytów i wzrost uwalniania cytokin (interleukina 1- IL-1, czynnik martwicy nowotworów alfa – TNFα, interferon gamma – IFNγ) (6). Podkreśla się także zaburzenia wykorzystania glutaminy jako źródła energetycznego dla komórek nabłonkowych, co zaburza funkcje metaboliczne i czynnościowe komórek nabłonka, prowadząc do wzrostu ich przepuszczalności i zmian morfologicznych (zanik rąbka szczoteczkowego, wygładzenie kosmków, złuszczanie komórek, powstanie grubej ale nie zapewniającej ochrony warstwy mukoidu) (6). W fazie nabłonkowej dochodzi do śmierci komórek warstwy podstawnej i braku regeneracji komórek dojrzałych nabłonka, jego ścieńczenia, martwicy i powstania ubytków w strukturze tkanki oraz nadżerek (6, 11). Pogłębiająca się neutropenia dodatkowo sprzyja wtórnym zakażeniom wirusowym, bakteryjnym i grzybiczym w głębszych warstwach śluzówki (6, 9, 12, 13). Powstają owrzodzenia, które stają się wrotami uogólnionego zakażenia. Sprawcami nadkażeń najczęściej są drobnoustroje fizjologicznej flory jamy ustnej ( Streptoccocus viridans, S. mitis, Candida albicans), a także flora nietypowa dla danego odcinka przewodu pokarmowego ( Staphyloccocus aureus, Pseudomonas aeruginosa, Escherichia coli) (6, 9, 14). W miarę normalizacji liczby leukocytów następuje usprawnienie miejscowych mechanizmów obronnych i gojenie zmian oraz odtworzenie struktury i funkcji nabłonka błony śluzowej. Uważa się, że obraz kliniczny jamy ustnej pacjenta jest wykładnikiem jego stanu ogólnego i nasilenia nieprawidłowości morfologii krwi (6).
Należy zwrócić uwagę na fakt, że oprócz bezpośredniego toksycznego oddziaływania promieni jonizujących na komórki nabłonkowe błony śluzowej radioterapia nasila zmiany patologiczne w obrębie śluzówki pośrednio poprzez uszkodzenie gruczołów ślinowych. Mimo że nabłonek ślinianek wykazuje dużą odporność na promieniowanie to zmiany w ukrwieniu szybko prowadzą do atrofii komórek wydzielniczych. Całkowite zniszczenie tkanki gruczołowej może wystąpić przy dawce wyższej niż 50-60 Gy (1, 3, 15, 17).
Jednocześnie uważa się, że na czynność ślinianek po zakończeniu terapii onkologicznej ma wpływ czynność gruczołów przed leczeniem, wiek, płeć pacjenta oraz wcześniejsze obciążenia ogólne (zdrowotne i nałogowe) (1).
Po radioterapii w okolicy twarzoczaszki ślina wydzielana jest w znacznie mniejszej ilości, jest gęsta, galaretowata. Następuje tym samym utrata zdolności naturalnego oczyszczania jamy ustnej. Zmiany w składzie jakościowym śliny poprzez zmianę ilości elektrolitów powodują obniżenie zdolności buforowej śliny i jej odczynu (obniżenie pH) (1, 18). Dodatkowo dochodzi do obniżenia aktywności przeciwbakteryjnej śliny wskutek zaburzenia wydzielania i działania m.in. lizozymu, laktoferyny, immunoglobulin klasy A, G, M oraz laktoperoksydazy (16). Rośnie skłonność i łatwość przylegania drobnoustrojów do powierzchni szkliwem, a brak związków mineralnych, takich jak jony fluoru i fosforany wapnia, ogranicza znacznie procesy remineralizacji tkanek twardych zębów. Sprzyja to rozwojowi choroby próchnicowej (ryc. 1).
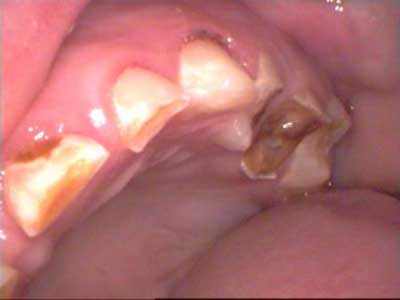
Ryc. 1. Choroba próchnicowa u 6-letniego chłopca po 7 miesiącach od chemio- i radioterapii w okolicy twarzoczaszki.
Suchość w jamie ustnej predysponuje także do powstawania uszkodzeń mechanicznych, nadżerek i owrzodzeń, wtórnych zakażeń wirusowych (wirus opryszczki – HSV-1, wirus Ebsteina-Barra – EBV, wirus cytomegalii – CMV), bakteryjnych, grzybiczych ( Candida albicans, C. krusei). Bardzo często dochodzi do rozwoju kandydozy zanikowej lub rzekomobłoniastej w jamie ustnej o dużej oporności na leczenie przeciwgrzybicze. Zakażenia grzybicze dotyczą 85% pacjentów (ryc. 2, 3).

Ryc. 2. Mucositis (błony rzekome – II° wg klasyfikacji CTCAE v. 3.0) u pacjenta w trakcie chemioterapii.
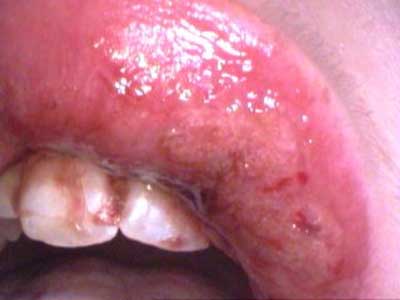
Ryc. 3. Mucositis (owrzodzenie wargi górnej – III° wg klasyfikacji CTCAE v. 3.0) z współistniejącym zakażeniem HSV-1 u pacjenta w trakcie chemioterapii.
Xerostomia zaburza także czucie smaku, pojawia się dysgeusia z przewagą smaku słonego i gorzkiego. Powoduje uciążliwe pieczenie języka i warg, zapalenie kątów ust (1). Trudności w przyjmowaniu pokarmów i mowie (konieczność ciągłego popijania wody) znacząco wpływają na pogorszenie się stanu ogólnego pacjenta.
Do powikłań po radioterapii okolicy głowy i szyi należy również zwłóknienie mięśni żwaczy i zwiększenie ich napięcia oraz zniszczenie elementów stawu skroniowo-żuchwowego, co powoduje czasowe lub trwałe ograniczenie ruchomości żuchwy i szczękościsk, dodatkowo utrudniające odżywianie pacjenta (1, 3).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Dolegacz-Bączkowska A, Bączkowski B, Rolski R: Występowanie zmian w jamie ustnej pacjentów po radioterapii. Nowa Stomatologia 2004; 4(30): 185-188. 2. Olczak-Kowalczyk D et al.: Problemy stomatologiczne u dzieci z chorobami nowotworowymi. Doświadczenia własne. Nowa Stom 2003; 4: 175-179. 3. Sidorowicz K, Sokalski J: Ambulatoryjne postępowanie stomatologiczne u pacjentów leczonych chemio- i radioterapią. Dental Forum 2007; 1(XXXV): 77-80. 4. DiSaia PJ, Creasman WT: Podstawowe zasady chemioterapii. Wydawnictwo Czelej, Lublin 1999; (9): 591-616. 5. Pleova P: Prevention and treatment of chemotherapy and radiotherapy induced oral mucositis: a review. Oral Oncol 1999; 35(5): 453-470. 6. Cioch M: Uszkodzenie bariery śluzówkowej w następstwie intensywnego leczenia cytostatycznego. Onkol Pol 2001; 4(2): 85-88. 7. Sonis ST: Mucositis as a biological process: a new hyphothesis for the development of chemotherapy-induced stomatotoxicity. Oral Oncol 1998; 34: 39-43. 8. Milecki P: Wybrane aspekty objawów ubocznych radioterapii nowotworów głowy i szyi. Postępy w chirurgii głowy i szyi 2004; 1:15-32. 10. Kiernicka M et al.: Powikłania w jamie ustnej po chemioterapii w leczeniu nowotworu – opis przypadku. As Stom 2008; 5: 6-9. 11. Kuklińsky RF: Dental menagement of cancer patients. Chemotherapy consideration. Oncol 2000; 15(4): 29-30. 12. Shaw MT, Spector MH, Ladman AJ: Effects of cancer, radiotherapy and cytotoxic drugs on intestinal structure and function. Cancer Threat Rev 1979; 6: 141-151. 13. Mestecky J, Russel MW, Elson CO: Intestinal IgA: novel views on its function in the defence of the largest mucosal surface. Gut 1999; 44: 2-5. 14. Ganz R, Lehrer RI: Defensins. Pharmacol Ther 1995; 66: 191-205. 15. Gomez L, Martino R, Rolston KV: Neutropenic enterocolitis: spectrum of the disease and comparision of definite and possible cases. Clin Infect Dis 1998; 27: 695-699. 16. Garg AK, Malo M: Manifestations and treatment of xerostomia and associated oral effects secondary to head and neck radiation therapy. J Am Dent Assoc 1997; 128(8): 1128-33. 17. Pochwalski M, Wojtowicz A: Suchość jamy ustnej – kserostomia – przyczyny, objawy, metody leczenia – przegląd piśmiennictwa. Nowa Stom 2003; 4: 211-216. 18. Sonis ST, Fey EG: Oral complications of cancer therapy. Oncology 2002; 16(5): 680-695. 19. Mandel ID: The role of saliva in maintaining oral homeostasis. J Am Dent Assoc 1989; 119: 298-303. 20. Spack CJ, Johnson G: Caries incidence, salivary flow rate and efficiency of fluoride gel treatment in irradiated patiens. Caries res 1994; 28(5): 388-393. 21. Wypych A, Gadomski A, Matysiak M: Zapalenia jamy ustnej u dzieci, z uwzględnieniem pacjentów poddanych terapii przeciwnowotworowej. Nowa Med 2007; 1: 13-17. 22. Nowaczyk MT: Postępowanie z chorymi podczas chemioterapii. Pozn Stom 1997; 24: 27-30. 23. Drabarczyk-Nasińska M: Zapobieganie zmianom w jamie ustnej towarzyszącym chemioterapii nowotworowej i ich leczenie. Mag Stomat 2004; 2(147): 18-20. 24. Pitten FA et al.: Do cancer patients with chemotherapy-induced leukopenia benefit from an antiseptic chlorhexidine-based oral rinse? A double-blind, block-randomized, controlled study. J Hosp Infect 2003; 53: 283-291. 25. Franzen L, Henriksson R, Littbrand B: Effects of sucralfate on mucositis during and following radiotherapy of malignancies in the head and neck region. A double-blind placebo-controlled study. Acta Oncol 1995; 34: 219-223. 26. Capelli D, Santini G, De Souza C: Amifostine can reduce mucosal damage after high-dose melphalan conditioning for peripheral blood progenitor cell autotransplant: a retrospective study. Br J Haematol 2000; 110: 300-307. 27. Brown SA, Goringe A, Fegan C: Parenteral glutamine protects hepatic function during bone marrow transplantation. Bone Marrow Transplant 1998; 22: 281-284. 28. Kanatas AN, Rogers SN, Martin MV: A survey of antibiotic prescribing by maxillofacial consultants for dental extractions following radiotherapy to the oral cavity. Br Dent J 2002; 192(3): 157-160.



