© Borgis - Postępy Fitoterapii 1-2/2002, s. 20-25
Izabela Fecka, Anita Mazur, Wojciech Cisowski
Kwas rozmarynowy, ważny składnik terapeutyczny niektórych surowców roślinnych
Rosmarinic acid, a important therapeutic component of some herbal crude drugs
Katedra i Zakład Farmakognozji, Akademia Medyczna, Wrocław
Summary
The naturally occuring, metabolism and biological properties of rosmarinic acid were reviewed. Especially antiinflammatory, antiviral, antihormonal and antioxidative have been discussed.

Kwas rozmarynowy, ester kwasu kawowego z kwasem a-hydroksydihydrokawowym (ryc.1), uznano na przełomie lat osiemdziesiątych i dziewięćdziesiątych za naturalny czynnik przeciwzapalny pochodzenia roślinnego (3, 9, 16, 31, 35, 63, 64, 65, 74, 76). Związek ten zaliczany jest obecnie do kawotanoidów (6), grupy związków pokrewnych garbnikom, nie wykazujących jednak zdolności garbowania skóry surowej. Jego budowę podał w 1958 roku Scarpati (32), który jako pierwszy wyodrębnił nieopisany wcześniej główny składnik liści rozmarynu lekarskiego. Współczesne badania wykazały obecność wolnego kwasu rozmarynowego w ponad stu gatunkach roślin w ilościach od 0,01 mg do 78 mg w 1 g surowca, głównie jednak w podrodzinie Nepetoideae (Lamiaceae), dla której stanowi wyznacznik chemotaksonomiczny (6, 21, 28, 49).
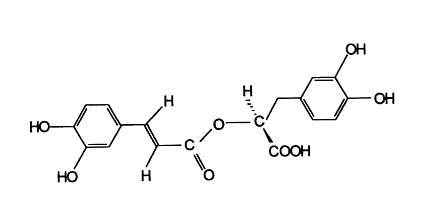
Ryc. 1. Wzór strukturalny kwasu rozmarynowego – kwas a-O-kawoilo-3, 4-dihydroksyfenylomlekowego (66).
Rozpatrując szczegółowo, występowanie kwasu rozmarynowego stwierdzono w następujących taksonach – Lamiaceae: w rodzajach Agastache (21, 28, 34), Coleus (21), Dracocephalum (28), Esholtzia (28), Glechoma (21), Hyptis (44), Hyssopus (28, 38, 59), Lavandula (24, 28), Lycopus (49), Majorana (21), Melissa (1, 10, 21, 28, 37, 49, 68), Mentha (21, 28, 77), Monarda (28), Nepeta (28), Ocimum (21), Origanum (21, 28, 49, 78), Orthosiphon (21, 69), Perilla (21, 53, 60, 76), Prunella (49, 52, 56), Rabdosia (21), Rosmarinus (21, 42, 49), Salvia (11, 21, 26, 28, 30, 49, 51, 70, 71), Satureja (21, 28), Thymus (28, 45, 46, 48); Apiaceae: Sanicula europaea L. (3, 22); Boraginaceae: Anchusa (13), Lithospermum (14, 15), Symphytum (20); Plantaginaceae: Plantago lagopus L. (75); Sterculiaceae: Helicteres isora L. (66).
Wśród wymienionych taksonów relatywnie wysoką koncentrację tego składnika posiada jedynie kilka powszechnie stosowanych w lecznictwie surowców roślinnych, jak: melisa lekarska, szałwia lekarska, lebiodka pospolita oraz rozmaryn lekarski (tab. 1).
Tabela 1. Zawartości kwasu rozmarynowego w wybranych surowcach leczniczych.
| Gatunek | Surowiec | Zawartość
% | Piśmiennictwo |
Lycopus europaeus L.
Melissa officinalis L.
Mentha piperita L.
Perilla frutescens L.
Prunella vulgaris L.
Origanum vulgare L.
Rosmarinus officinalis L.
Salvia officinalis L.
Thymus vulgaris L.
Thymus serpyllum L. | ziele
liście
liście
liście
ziele
ziele
liście
liście
ziele
ziele | 3, 7-4,2
0,12-6,5
0,31
0,1-7,8
6,1-7,4
0,12-6,8
0,2-4,3
0,2-4,2
0,43
0,11-0,45 | 49
10, 24, 28, 49, 68
58
21, 52, 60
49
28, 49
49
24, 28, 30, 49
58
28 |
W świecie roślinnym kwas rozmarynowy występuje w formie wolnej, zestryfikowanej, glikozydowej oraz w formie połączeń o charakterze oligomerów. Niezwiązany kwas rozmarynowy, jego ester metylowy oraz kwasy melitrykowe A i B (ryc. 2) izolowano z liści Melissa officinalis (1). Kwasy melitrykowe wykazują budowę tridepsydową i utworzone są z trzech jednostek fenylopropanowych, a w odniesieniu do kwasu rozmarynowego posiadają dodatkową cząsteczkę kwasu kawowego przyłączoną wiązaniem eterowym. Obecna w Salvia officinalis dalsza pochodna kwasu rozmarynowego, kwas sagerenowy (ryc. 3), jest natomiast dimerem powstałym w procesie fitochemicznej cyklizacji (51). Kolejny związek, kwas salwianolowy K (ryc. 3), wykryto w korzeniach Salvia deserta oraz w Salvia officinalis (51). Podobne produkty dimeryczne występują także w ścianach komórkowych traw tropikalnych (70). Niezmiernie rzadkimi formami są glikozydy kwasu rozmarynowego. Dotychczas opisano zaledwie kilka połączeń tego typu, głównie z udziałem glukozy (66). Należą tu: 4´-O-b-D-glukopiranozyd i 4,4´-O-di-b-D-glukopiranozyd kwasu rozmarynowego, wyodrębnione z owoców indonezyjskiej rośliny leczniczej Helicteres isora L. Oba składniki wykazują właściwości analogiczne z ich aglikonem, a wynikające z obecności w strukturze reszt kawoilowych (66).
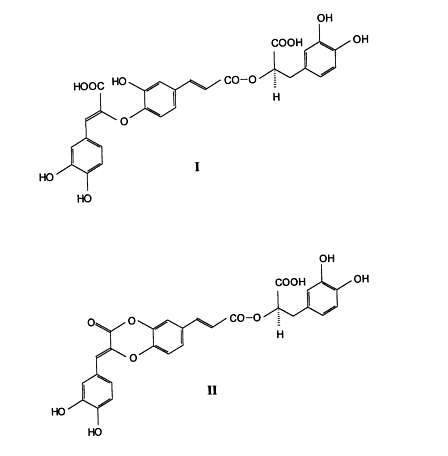
Ryc. 2. Wzory strukturalne kwasów melitrykowych A (I) i B (II).

Ryc. 3. Wzory strukturalne kwasów salwianolowego K (I) i sagerenowego (II).
W wyniku szerokiej gamy właściwości farmakologicznych zioła zawierające w swoim składzie kwas rozmarynowy znalazły zastosowanie w leczeniu i zapobieganiu wielu chorób. Jako substancja naturalnie występująca, kwas rozmarynowy charakteryzuje się dużym potencjałem terapeutycznym wobec organizmów zwierzęcych, potwierdzonym w oparciu o badania przeprowadzone zarówno in vitro jak i in vivo. Stabilizuje on błony biologiczne (50), chroni przed szkodliwym wpływem promieniowania UV i reaktywnych form tlenu, w tym także wolnych rodników (12, 53, 60, 68), działa przeciwutleniająco (2, 4, 17, 24, 49, 55, 80, 71, 72), przeciwzapalnie (2, 9, 16, 31, 35, 36, 63, 65, 74, 76), antyproliferacyjnie (52, 53, 54), przeciwbakteryjnie (44), przeciwwirusowo (3, 7, 25, 34, 57), przeciwhormonalnie (4, 5) i najprawdopodobniej sedatywnie na centralny system nerwowy (8). Posiada ponadto nieznaczne właściwości przeciwalergiczne (27, 76), a pochodne estrowe właściwości żółciotwórcze i żółciopędne (46, 73). Wobec enzymów kwas rozmarynowy wykazuje cechy niespecyficznego inhibitora. W przeprowadzonych testach związek ten obniżał w różnym stopniu aktywność: cyklooksygenazy 1 i 2 (36), lipooksygenazy (35, 76), hialuronidazy, b-heksozaminidazy (27), dekarboksylazy ornitynowej (14), reduktazy aldozowej (33), a-amylazy, karboksypeptydazy A (47), cyklazy adenylowej (39) oraz dejodynazy jodotyroniny (4, 5). W porównaniu z kwasem elagowym, nie posiada jednak zdolności modyfikowania metabolizmu ksenobiotyków i nie zmienia aktywności enzymów obu faz detoksykacji (13). Cechuje go natomiast aktywność immunomodulująca. Pobudza produkcję prostaglandyny E2 oraz obniża syntezę leukotrienów B4 w ludzkich leukocytach różnokształtnojądrowych. Na układ dopełniacza, spełniającego istotną rolę w odczynie zapalnym, działa hamująco (2, 35). Obserwowany pod jego wpływem efekt antytrombinowy powstaje przypuszczalnie w drodze zapobiegania agregacji płytek krwi lub ewentualnej promocji procesu fibrynolizy (79). Wywiera dodatkowo działanie ochronne na lipoproteiny osocza, w tym na frakcję LDL, głównego inicjatora procesu aterogenezy (17, 24, 80). W połączeniu z innymi związkami naturalnymi jak rutyna, kwas ursolowy (72, 73) czy lykopen (17) wykazuje cechy synergistyczne.
U podłoża aktywności przeciwzapalnej kwasu rozmarynowego leży szereg uzupełniających się mechanizmów biologicznych, których suma dostarcza efekty porównywalne z siłą działania stosowanych od lat syntetycznych niesteroidowych leków przeciwzapalnych (65). Z prowadzonych przez zespół amerykański badań nad wpływem na układ dopełniacza wynika, iż kwas rozmarynowy za pośrednictwem funkcji fenolowych łączy się kowalencyjnie z grupą tioestrową łańcucha a czynnika białkowego C3b (IC50 = 34 mM) zapobiegając tym samym jego dalszym przemianom. Znacznie wyższe stężenia (IC50 = 1500 mM) wymagane są dla zahamowania aktywności proteolitycznej konwertazy C5. Nie odnotowano jednak wpływu na konwertazę C3. Ostatecznie kwas rozmarynowy w podobnych koncentracjach inaktywuje układ dopełniacza na obu szlakach, klasycznym (IC50 = 180 mM) i alternatywnym (IC50 = 160 mM) (65, 66), a obserwowany efekt przeciwzapalny jest dodatkowo wynikiem niespecyficznego hamowania enzymów biosyntezy prostanoidów – cyklooksygenaz (36) i lipooksygenazy (76) oraz enzymów uczestniczących w degradacji kwasu hialuronowego – hialuronidazy i b-heksozaminidazy (27). W wyniku przytoczonych właściwości związek ten zmniejsza przepuszczalność naczyń kapilarnych zapobiegając wnikaniu toksyn i drobnoustrojów (44). Obniża także poziom syntezy mediatorów stanu zapalnego (prostaglandyn, prostacyklin i tromboksanu), znosząc ich wpływ na zakończenia czuciowe oraz zapobiega agregacji trombocytów. Powyższe obserwacje jak i wyniki przeprowadzonych dodatkowo licznych badań farmakologicznych sugerują możliwość zastosowania kwasu rozmarynowego lub dostarczających go surowców w profilaktyce i terapii pomocniczej stanów chorobowych przebiegających z odczynem zapalnym, m.in. w astmie oskrzelowej, wrzodach trawiennych, miażdżycy tętnic, chorobie niedokrwiennej serca i zaćmie (2).
Podobnie do innych związków fenolowych, kwas rozmarynowy wykazuje również właściwości przeciwdrobnoustrojowe (dezynfekujące). Aktywność wirusostatyczna skierowana przeciwko wirusom opryszczki typu 1 (HSV-1) (7), a także wirusom ludzkiego niedoboru immunologicznego (HIV-1) (3, 25, 34, 57) powstaje w wyniku interakcji kwasu ze strukturami białkowymi zarówno czynnika zakaźnego jak i gospodarza, co w konsekwencji utrudnia adsorbcję wirusa na powierzchni komórek lub też upośledza jego namnażanie. Jako niespecyficzny inhibitor enzymatyczny, kwas rozmarynowy obniża in vitro aktywność kluczowych enzymów replikacji HIV, odwrotnej transkryptazy (3, 25) i integrazy (25, 34, 57), zapobiegając tym samym syntezie nici komplementarnego wirusowego DNA na matrycy RNA oraz jego połączeniu z chromosomem gospodarza (25, 57). Preparaty zawierające w swoim składzie wyciągi z melisy lekarskiej znalazły zastosowanie m.in. w leczeniu opryszczki czerwieni wargowej (maść Meliherp) (15, 43).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Agata I. et al.: Chem. Pharm. Bull. 1993, 41, 1608. 2. Al-sareiti M.R. et al.: Indian J. Exp. Biol. 1999, 37 (2), 124. 3. Arda N. et al.: J. Nat. Prod.1997, 60 (11), 1170. 4. Auf´mkolk M. et al.: Horm. Metabol. Res. 1984, 16, 188. 5. Auf´mkolk M. et al.: Endocrinology 1985, 116 (5), 1677. 6. Borkowski B., Miłkowska K.: Herba Polonica 1996, 42 (3), 174. 7. Borkowski B. et al.: Herba Polonica 1996, 42 (4), 317. 8. Borkowski B. et al.: Herba Polonica 1999, 45 (3), 192. 9. Bult H. et al.: Br. J. Pharmacol. 1985, 84 (2), 317. 10. Carnat A.P. et al.: Pharm. Acta Helv. 1998, 72 (5), 301. 11. Chen H., Chen F.: J. Agric. Food Chem. 1998, 46 (7), 2651. 12. Chen C.P et al.: Exp. Toxicol. Pathol. 1999, 51, 59. 13. Debersac P. et al.: Food Chem. Toxicol. 2001, 39 (2), 109. 14. Desai-Reddy N. et al.: Proc. Annu. Meet. Am. Assoc. Cancer Res. 1996, 37, 1829. 15. Dimitrova Z. et al.: Acta Microbiol. Bulgar. 1993, 29, 65. 16. Englberger W. et al.: Int. J. Immunopharmacol. 1988, 10 (6), 729. 17. Fuhrman B. et al.: Antioxid. Redox. Signal. 2000, 2, 491. 18. Ganong W.f.: Fizjologia, Pzwl, Warszawa 1994. 19. Gorecki et al.: Herba Polonica 1999, 45 (3), 179. 20. Grabias B. et al.: Pharm. Pharmacol. Lett. 1998, 8 (2), 81. 21. Hegnauer R.: Chemotaxonomie Der Pflanzen, Brikhäuser Verlag, Basel, 1989, Tom 8, 579. 22. Hiller K.: Pharmazie 1965, 20 (9), 574. 23. Hisatomi et al.: Bioorg. Med. Chem. 1998, 6 (7), 1051. 24. Hohmann J. et al.: Planta Med. 1999, 65, 576. 25. Hooker C.W. et al.: J. Virol. 2001, 75 (7), 3095. 26. Huang L. et al.: Zhongcaoyao 1999, 30 (9), 654. 27. Ito H., et al.: Bioorg. Med. Chem. 1998, 6 (7), 1051. 28. Janicsak G. et al.: Biochem. Syst. Ecol. 1999, 27 (7), 733. 29. Janicsak G., Mathe I.: Chromatographia 1997, 46 (5/6), 322. 30. Janicsak G., Mathe I.: Acta Pharm. Hung.1998, 68 (5), 259. 31. Jung K.Y., et al.: Biol. Pharm. Bull. 1998, 21 (10), 1077. 32. Karrer W.: Konstitution Und Vorkommen Der Organischen Pflanzenstoffe, Birkhäuser Verlag, Basel 1985. 33. Kasimu R., et al.: Chem. Pharm. Bull. 1998, 46 (3), 500. 34. Kim H.K., et al.: Arch. Pharm. Res. 1999, 22 (5), 520. 35. Kimura Y. et al.: J. Nat. Prod. 1987, 50 (3), 392. 36. Kelm M.A., et al.: Phytomedicine 2000, 7 (1), 7. 37. Klimek B. et al.: Herba Polonica 1998, 44 (4), 324. 38. Kochan E. et al.: Z. Naturforsch. 1999, 54c, 11. 39. Kohda H. et al.: Chem. Pharm. Bull. 1989, 37, 1287. 40. Kohrle J. et al.: Horm. Metabol. Res. 1984, 16 (4), 188. 41. Koizumi M. et al.: Chem. Pharm. Bull. 1991, 39, 2638. 42. Komali A.S. et al.: Food Biotechnol. 1998, 12 (1-2), 27. 43. Kosalec I. et al.: Farmaceutski Glasnik 1998, 54 (9), 297. 44. Kuhnt M. et al.: Planta Med. 1995, 61, 227. 45. Kulevanova S. et al.: Pharmazie 1997, 52 (11), 886. 46. Kulevanova S. et al.: Anal. Lab. 1998, 7 (2), 103. 47. Kusano G. et al.: Biol. Pharm. Bull. 1998, 21 (9), 997. 48. Kwok D. et al.: J. Food Biochem. 1998, 22 (1), 37. 49. Lamaison J.l. et al.: Pharm. Acta Helv. 1991, 66 (7), 185. 50. Liu G.t. et al.: Biochem. Pharmacol. 1992, 43, 147. 51. Lu Y., Foo L.y.: Phytochemistry 1999, 51 (1), 91. 52. Makino T. et al.: Planta Med. 2001, 67 (1), 24. 53. Makino T. et al.: Planta Med. 1998, 64 (6), 541. 54. Makino T. et al.: Nephrol. Dial. Transplant. 2000, 15 (8), 1140. 55. Malencic D. et al.: Phytother. Res. 2000, 14, 546. 56. Markova H. et al.: Ceska A Slovenska Farmacie 1997, 46 (2), 58. 57. Mazumder A. et al.: J. Med. Chem. 1997, 40 (19), 3057. 58. Mazur A.: Praca Magisterska, Akademia Medyczna we Wrocławiu, Wrocław 2000. 59. Murakami Y. et al.: Plant Cell, Tissue Organ Cult. 1998, 53 (1), 75. 60. Nakamura Y. et al.: J. Agric. Food Chem. 1998, 46 (11), 4545. 61. Nakazawa T., Ohsawa K.: J. Nat. Prod. 1998, 61 (8), 993. 62. Offord E.A. et al.: Carcinogenesis 1995, 16 (9), 2057. 63. Peake P.W. et al.: Int. J. Immunopharmacol. 1991, 13 (7), 853. 64. Ritschel W.A. et al.: Methods Find Exp. Clin. Pharmacol. 1989, 11 (5), 345. 65. Sahu A. et al.: Biochem. Pharmacol. 1999, 57 (12), 1439. 66. Satake T. et al.: Chem. Pharm. Bull. 1999, 47 (10), 1444. 67. Singletary K.W., Nelshoppen J.M.: Cancer Letters 1991, 60 (2), 169. 68. Tagashira M., Ohtake Y.: Planta Med. 1998, 64 (6), 555. 69. Tezuka Y. et al.: Chem. Pharm. Bull. 2000, 48 (11), 1711. 70. Wang M. et al.: J. Agric. Food Chem. 1998, 46 (12), 4869. 71. Wang M. et al.: J. Nat. Prod. 1999, 62 (3), 454. 72. Wilker M. et al.: Sofw J. 1998, 124 (9), 563. 73. Wilker M. et al.: Sofw J. 1998, 124 (9), 566. 74. Verweij-van Vught A.M. et al.: Agents Actions 1987, 22 (3-4), 288. 75. Velazquez Fiz M.P et al.: Z. Naturforsch. 2000, 55 (11- 12), 877. 76. Yamamoto H. et al.: Jpn. Kokai, Tokkyo Jp 10298098, 1998, A2, 10. 77. Yamamura S. et al.: Phytochemistry 1998, 48 (1), 131. 78. Zgórka G. et al.: Pharm. Pharmacol. Lett. 1997, 7 (4), 187. 79. Zou Z.W. et al.: Yao Xue Xue Bao 1993, 28, 241. 80. Zupko I. et al.: Planta Med. 2001, 67 (4), 366.



