© Borgis - Anestezjologia Intensywna Terapia 3/2001, s. 157-161
Waldemar Machała, Wojciech Gaszyński
Wpływ anestetyków wziewnych i propofolu na prędkość przepływu krwi w tętnicach środkowych mózgu oznaczany techniką dopplerowską
Effect of inhalatory anaesthetics and propofol on blood flow velocity in medial cerebral arteries measured with transcranial Doppler ultrasound recording
z Zakładu Medycyny Ratunkowej i Katastrof;
kierownik: dr n. med. W. Machała – WAM w Łodzi;
i z Katedry Anestezjologii i Intensywnej Terapii;
kierownik: prof. dr hab. W. Gaszyński – AM w Łodzi
Streszczenie
Ponieważ anestetyki wziewne powodują wzrost mózgowego przepływu krwi i podwyższają ciśnienie wewnątrzczaszkowe, to zasadniczym zadaniem staje się zatem taki ich dobór, który w najmniejszym stopniu zaburzałby mózgowy przepływ krwi i nie wpływał na ciśnienie wewnątrzczaszkowe. Urządzeniem które w sposób orientacyjny pozwala na ocenę mózgowego przepływu krwi (stan napięcia tętnic mózgowych, prędkości przepływającej przez nie krwi, oporności otaczających naczynie tkanek – mózgu) jest przezczaszkowy monitor dopplerowski. W pracy autorzy ocenili wpływ podtlenku azotu, halotanu, enfluranu i izofluranu oraz propofolu na prędkość przepływu krwi w tętnicach środkowych mózgu u 160 operowanych w trybie planowym pacjentów (usunięcie pęcherzyka żółciowego). Pacjentów wprowadzano propofolem i fentanylem, następnie losowo otrzymywali ciągły wlew propofolu, ciągły wlew propofolu i N2O, halotan, enfluran lub izofluran. Badania prowadzono w 6 przedziałach czasowych: 16 godzin przed anestezją, 5 przed indukcją (po premedykacji petydyną i midazolamem), 2 minuty po indukcji (przed podaniem środka wziewnego), 30 minut od podania anestetyku, 2 minuty po zakończeniu znieczulenia oraz 24 godziny po zakończeniu znieczulenia. Indukcja propofolem powodowała znamienne zmniejszenie prędkości przepływu krwi; podobnie działały anestetyki wziewne (halotan>propofol z N2O lub bez> isofluran>enfluran). Po zakończeniu znieczulenia obserwowano zwiększenie prędkości przepływu krwi w stosunku do wartości wyjściowych (halotan>enfluran>izoluran>propofol z N2O> propofol).
Summary
Because all inhalational anaesthetics increase cerebral blood flow and intracranial pressure, it is important to minimize that phenomenon. We have therefore assessed effects of nitrous oxide, halothane, enflurane, isoflurane and propofol on blood flow velocity in medial cerebral arteries, using transcranial Doppler monitor, in 160 patients scheduled for elective cholecystectomy. Patients were induced with propofol and fentanyl and randomized to receive propofol, N2O + propofol, halothane, enflurane or isoflurane. Maximum and mean blood flow velocity was measured 16 hours before anaesthesia, 5 minutes before induction (but after pethidine-midazolam premedication), 2 minutes after intubation (before start of inhalational anaesthesia), 30 minutes after induction of inhalational anaesthesia, 2 minutes and 24 hours after the end of anaesthesia. Induction with propofol decreased significantly cerebral blood flow velocity (CBFV), so did all inhalational anaesthetics in the following order: halothane> propofol or nitrous oxide/propofol> isoflurane> enflurane. CBFV increased after discontinuation of anaesthesia above baseline values (halothane> enflurane> isoflurane> propofol/N2O> propofol).

Dynamiczny rozwój anestezjologii w ostatnim półwieczu umożliwił syntezę i wprowadzenie do praktyki klinicznej nowych środków znieczulających. Zastosowanie ich w skojarzeniu z nowymi technikami znieczulenia zmniejszyło znacznie śmiertelność okołooperacyjną. Zainteresowanie wywołuje wpływ anestetyków (znieczulenia) na czynność ośrodkowego układu nerwowego i mózgowy przepływ krwi [1,2]. Związane jest to z faktem, że mózg, przepływająca wewnątrz czaszki krew i płyn mózgowo – rdzeniowy zamknięte są w sztywnej (niepodatnej), kostnej strukturze. Zmiana objętości któregokolwiek z ww. składników prowadzi do patologii, związanej najczęściej z podwyższeniem ciśnienia wewnątrzczaszkowego (ICP – intracranial pressure). Niewielkie podwyższenie wartości ciśnienia wewnątrzczaszkowego w czasie znieczulenia (większość anestetyków wziewnych zwiększa bowiem mózgowy przepływ krwi) u zdrowych pacjentów nie mają większego znaczenia i dobrze reagują na właściwe ułożenie operowanego, hiperwentylację itp. Stanowią natomiast poważny problem u pacjentów po urazach głowy operowanych w trybie pilnym, lub nagłym (kiedy towarzyszy temu podwyższone ciśnienie wewnątrzczaszkowe). Badanie mózgowego przepływu krwi w warunkach klinicznych traktowane jest po macoszemu z uwagi na cenę służących do tego celu urządzeń. Większość stosowanych dla jego oceny (mózgowego przepływu krwi) metod pozostaje niestety poza zasięgiem nawet najlepiej wyposażonych ośrodków. W 1982 roku Aaslid i wsp. [3] wprowadzili do praktyki klinicznej monitor dopplerowski oceniający prędkość przepływu krwi w naczyniach wewnątrzczaszkowych (Transcranial Doppler – TCD). Dzięki niemu możliwa się stała nieinwazyjna ocena niedostępnych to tej pory badaniu tętnic mózgowych.
Technika badania wykorzystuje zjawisko Dopplera [4,5], które polega na zmianie częstotliwości fali odbitej od ruchomego przedmiotu w stosunku częstotliwości fali wysyłanej przez głowicę (tutaj 2 MHz). Różnica pomiędzy częstotliwościami jest proporcjonalna do prędkości poruszającego się obiektu (przepływającej w tętnicach krwi).
Ultradźwięki są w stanie pokonać kość o niewielkiej grubości. Aby możliwa była ocena tętnic, głowica powinna być przyłożona do miejsc na głowie, w których grubość pokrywy jest niewielka. Najbardziej wiarygodna do oceny prędkości przepływającej krwi jest tętnica środkowa mózgu, którą wizualizuje się przykładając głowicę do okna ciemieniowego (ryc. 1). Dokładność pomiaru związana jest z kątem, pod jakim wiązka dociera do tego właśnie naczynia (tętnica środkowa mózgu – MCA – Middle Cerebral Artery): jeżeli wynosi on pomiędzy 0 a 30°, to maksymalny błąd pomiaru nie przekracza 15%.
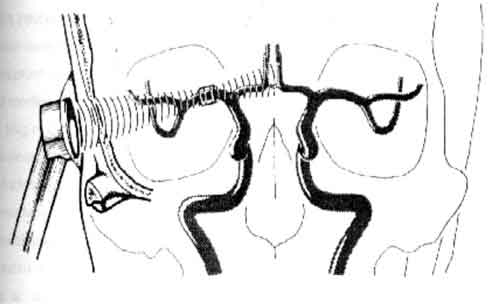
Ryc. 1. Przekrój czołowy uwidaczniający przebieg wiązki dopplerowskiej, zmierzającej do tętnicy środkowej mózgu prawej
W badaniu dopplerowskim tętnic ocenia się: prędkość maksymalną, prędkość średnią, kierunek przepływającej krwi (od/w kierunku głowicy), wskaźnik pulsacji (informuje o oporach otaczających naczynie tkanek) i wskaźnik oporowy [3,6,7].
Początkowo przezczaszkowa diagnostyka dopplerowska wykorzystywana była w wykrywaniu zwężeń i blokad tętnic wewnątrzczaszkowych, ocenie krążenia obocznego, wykrywaniu zespołu wzmożonego ciśnienia wewnątrzczaszkowego, skurczu naczyniowego, malformacji naczyniowych. Od połowy lat osiemdziesiątych technikę tę zaczęli wykorzystywać anestezjolodzy do monitorowania mózgowego przepływu krwi podczas operacji naczyniowych [8], neuro- i kardiochirurgicznych u pacjentów z grupy wysokiego ryzyka. Przezczaszkowa diagnostyka dopplerowska jest badaniem łatwym do wykonania, powtarzalnym i tanim.
Celem pracy było zbadanie wpływu stosowanych obecnie anestetyków wziewnych (podtlenku azotu, halotanu, enfluranu i izofluranu) oraz propofolu na prędkość przepływu krwi w tętnicach środkowych mózgu.
METODYKA
Na wykonanie badań uzyskano zgodę Komisji Bioetyki WAM. Badania przeprowadzono u 160 pacjentów (123 kobiet i 37 mężczyzn, ASA I i II) w wieku od 25 do 55 lat (śr. 43 lata), u których wykonywano cholecystektomię metodą laparoskopową. Pacjenci byli informowani o planowanej technice znieczulenia i wyrazili zgodę na wykonanie badań. Wykluczono pacjentów z nadwagą, cukrzycą, chorobą niedokrwienną serca, nadciśnieniem tętniczym, przewlekłymi chorobami układu oddechowego, urazem głowy w wywiadzie i organicznymi chorobami ośrodkowego układu nerwowego. Pacjentów zakwalifikowano losowo do pięciu grup, 32 chorych w każdej, identycznie wprowadzanych i znieczulanych; grupy różniły się rodzajem zastosowanego anestetyku.
Badanie prędkości przepływu krwi w tętnicach środkowych mózgu wykonywane było przy porównywalnych parametrach oddechowych i krążeniowych (mieszczących się w granicach fizjologicznych), w pozycji na plecach, głowicą 2 MHz, aparatem Tranpect-TCD (Medasonics). W celu wykluczenia zwężeń w tętnicy szyjnej wewnętrznej (w przebiegu pozaczaszkowym) przed pierwszym badaniem jej stan oceniano głowicą 4 MHz. Tętnice środkowe mózgu wizualizowano na głębokości 30 – 50 mm, przykładając głowicę do okna ciemieniowego środkowego lub tylnego. Tętnice środkowe mózgu identyfikowano testem kompresyjnym (kilkukrotne uciśnięcie tętnicy szyjnej po badanej stronie i obserwacja zaburzeń przepływu krwi w naczyniu). Ustalone zostały następujące przedziały badań:
1) 16 godzin przed rozpoczęciem znieczulenia,
2) 5 minut przed rozpoczęciem znieczulenia (po podaniu premedykacji),
3) 2 minuty po indukcji znieczulenia (przed ustaleniem składu mieszaniny oddechowej),
4) 30 minut od czasu rozpoczęcia podawania anestetyku,
5) 2 minuty po zakończeniu znieczulenia,
6) 24 godziny po zakończeniu znieczulenia.
Pacjentów premedykowano domięśniowo na 60 minut przed znieczuleniem petydyną, midazolamem i atropiną. Po podłączeniu monitorowania wprowadzano do żyły przedramienia kaniulę i podłączano wlew krystaloidów. Do przestrzeni zewnątrzoponowej L3 – L4 albo L4 – L5 wprowadzano cewnik, do którego po podaniu dawki próbnej podawano 0,25% bupiwakainę. Następnie chorych wprowadzano atropiną, fentanylem i propofolem. Rozpoczynano monitorowanie przewodnictwa nerwowo-mięśniowego, podawano wekuronium i intubowano przez usta. Oceniano wpływ następujących sposobów znieczulenia na przepływ krwi w tętnicach środkowych mózgu:
I. Wentylacja mieszaniną tlenu i powietrza oraz wlew ciągły dożylny propofolu wg schematu Robertsa (pierwsze 10 minut po indukcji 10 mg kg-1 h-1; kolejne 10 minut 8 mg kg-1 h-1 i do końca znieczulenia 6 mg kg-1 h-1)
II. Wentylacja mieszaniną tlenu i podtlenku azotu w stosunku objętościowym 1:2 i wlew ciągły dożylny propofolu z prędkością 6 mg kg-1 h-1
III. Wentylacja mieszaniną tlenu i powietrza z dodatkiem halotanu (0,8 Vol.% w gazach wydechowych)
IV. Wentylacja mieszaniną tlenu i powietrza z dodatkiem enfluranu (0,8 Vol.% w gazach wydechowych)
V. Wentylacja mieszaniną tlenu i powietrza z dodatkiem izofluranu (0,8Vol% w gazach wydechowych)
Wlew wekuronium przerywano na ok. 20 minut przed końcem znieczulenia, anestetyki wziewne w grupie III, IV i V wyłączano na ok. 15 minut przed końcem znieczulenia, propofol w grupie I i II na ok. 10 minut przed końcem znieczulenia, podtlenek azotu w grupie II na 5 – 7 minut przed końcem znieczulenia. Wszyscy pacjenci oddychali do ekstubacji 100% tlenem. Tuż przed ekstubacją podawano atropinę i neostygminę dożylnie. Po ekstubacji pacjenci oddychali powietrzem.
ANALIZA STATYSTYCZNA
Dla parametrów wyrażonych w skali przedziałowej (ciągłej) podano minimum i maksimum (element największy i najmniejszy), obliczano średnią, odchylenie standardowe i współczynnik zmienności. Przy przyjętym poziomie istotności 0,05 normalność rozkładu dla grup o liczności n<50 sprawdzano testem Shapiro-Wilka opartym na analizie wariancji. Porównania prób niezależnych w przypadku rozkładów normalnych wykonano przy użyciu testu parametrycznego. W celu wybrania odpowiedniego testu zbadano równość wariancji przy pomocy testu Fishera przy przyjętym poziomie istotności 0,05. Jeżeli porównywane wariancje nie różniły się w sposób istotny między sobą, to porównywania średnich przeprowadzano przy pomocy testu t-Studenta dla prób niezależnych, a w przeciwnym przypadku stosowano modyfikację testu t znaną jako test Cochrana-Coxa. W pozostałych przypadkach stosowano test nieparametryczny. Wybrano test rangowanych znaków Wilcoxona dla prób niezależnych. Porównania prób zależnych w przypadku rozkładów normalnych wykonano testem t-Studenta. W pozostałych przypadkach stosowano test rangowanych znaków Wilcoxona dla prób zależnych. Dla parametrów wyrażonych w skali nominalnej zbadano strukturę i częstości występowania danych klas. Porównania między grupami oraz badane zależności przeprowadzono używając testu chi2. Jeśli warunki stosowania testu chi2 nie były spełnione, to w przypadku tablicy czteropolowej porównanie dwóch częstości jak i badanie zależności wykonano testem dokładnym Fishera.
WYNIKI
W pracy oceniano prędkość maksymalną przepływu krwi (Vpeak) przepływu krwi w tętnicach środkowych mózgu prawej i lewej (1RMCA i 1LMCA) oraz prędkość średnią (Vmean) przepływu krwi w ww. tętnicach (2RMCA i 2LMCA).
Podanie premedykacji (przedział czasowy 2) nie wpłynęło w sposób statystycznie istotny na prędkość maksymalną i średnią przepływu krwi w tętnicach środkowych mózgu.
Indukcja znieczulenia wpłynęła w sposób statystycznie istotny na prędkość przepływu krwi, powodując zmniejszenie Vpeak o 20,2% i Vmean o 22,7% w stosunku do wartości wyjściowych.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Matta B.F., Heath K.J., Tipping K., Summors A.C.: Direct cerebral vasodilatory effects of sevoflurane and isoflurane. Anesthesiology 1999, 91, 677-680.
2. Nishiyama T., Matsukawa T., Yokoyama T., Hanaoka K.: Cerebrovascular carbon dioxide reactivity during general anesthesia: a comparison between sevoflurane and isoflurane. Anesthesia and Analgesia 1999, 89, 1437-1441.
3. Aaslid R., Markwalder T.M., Nornes H.: Non-invasive transcranial Doppler ultrasound recording of flow velocity in basal cerebral arteries Journal of Neurosurgery 1982, 57, 769-774.
4. Aaslid A., Lindegaard K., Sorteberg W., Nornes H.: Cerebral autoregulation dynamics in humans. Stroke 1989, 20, 45-52.
5. Aaslid A.: Vissually evoked dynamic blood flow response of human cerebral circulation. Stroke 1987, 18, 771-775.
6. Augustyniak E.: Przezczaszkowa ultrasonografia dopplerowska w ocenie przepływu przez tętnice wewnątrzczaszkowe. Polski Tygodnik Lekarski 1988, 43, 753-755.
7. Augustyniak E.: Ocena krążenia mózgowego u ludzi zdrowych przy użyciu ultrasonografii dopplerowskiej Polski Tygodnik Lekarski 1987, 42, 1421-1424.
8. Waksman H., Aun R., Kauffman P., Puech-Leao P.: Evaluation of middle cerebral artery blood flow velocity with transcranial Doppler in Carotid endarterectomy. Revista Do Hospital Das Clinicas; Faculdade De Medicina Da Universidade De Sao Paulo 1998, 53, 139-145.
9. Lass P., Kryda W., Przedziak M., Słomiński J.: Przezczaszkowa ultrasonografia dopplerowska – nowa technika badania przepływu mózgowego. Wiadomości Lekarskie 1999, 43, 330-335.
10. Małek A., Hilgertner L., Szostek M.: Przezczaszkowe badanie tętnic mózgowych Ultrasonografia Polska 1992, 1, 129-141.
11. Fuji Y., Tanaka H., Tsuruoka S., Toyooka H., Amaha K.: Middle cerebral arterial blood flow velocity increases during laparoscopic cholecystectomy Anesthesia and Analgesia 1994, 78, 80-83.
12. Thong P.H., Lee T.L.: Carbon dioxide absorption and gas exchange during laparoscopic cholecystectomy. 9th European Congress of Anaesthesiology Jerusalem, 1994, Abs. 122.
13. Kehlet H., Möller W.: The effects of regional anesthesia on the endocrine – metabolic response to surgery. Endocrinology 1985, 82, 23-35.
14. Łazowski T.: Psychologiczne aspekty patogenezy bólu. Polski Przegląd Lekarski 1989, 46, 415-419.
15. Traynor C., Hall G.M.: Endocrine and metabolic changes during surgery: anesthetic implication. British Journal of Anaesthesia 1981, 53, 153-160.

