© Borgis - Postępy Nauk Medycznych 3/2012, s. 252-257
*Agata Bogołowska-Stieblich, Marek Tałałaj
Rola witaminy D w chorobach układu sercowo-naczyniowego
The role of vitamin D in the diseases of cardiovascular system
Klinika Medycyny Rodzinnej, Chorób Wewnętrznych i Chorób Metabolicznych Kości Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki: prof. dr hab. med. Ewa Marcinowska-Suchowierska
Streszczenie
Witamina D odgrywa istotną rolę w homeostazie wapniowo-fosforanowej i wywiera wpływ na metabolizm tkanki kostnej. Wykazano, że receptor dla witaminy D oraz 1α-hydroksylaza występują m.in. w mięśniach gładkich naczyń krwionośnych, kardiomiocytach, monocytach i makrofagach. Stwierdzono, że witamina D oddziałuje, bezpośrednio i pośrednio, na układ sercowo-naczyniowy. Aktywny metabolit witaminy D wpływa bezpośrednio na działanie płytek krwi, aktywność układu renina-angiotensyna-aldosteron, układ współczulny, na procesy zapalne i układ krzepnięcia krwi. Pośrednie oddziaływanie witaminy D wynika z wpływu na metabolizm glukozy, ciśnienie tętnicze i gospodarkę lipidową. Wyniki badań sugerują korzystny wpływ witaminy D na układ sercowo-naczyniowy. W większości są to jednak badania doświadczalne, epidemiologiczne i obserwacyjne, które mają mniejszą wiarygodność niż badania interwencyjne, z randomizacją. Przeprowadzone dotychczas badania nie stanowią podstawy, aby zalecać powszechne stosowanie witaminy D w prewencji chorób układu sercowo-naczyniowego.
Summary
Vitamin D plays an important role in calcium-phosphate homeostasis and exerts a significant influence on bone tissue metabolism. It was shown that vitamin D receptor as well as 1α-hydroxylase are located, e.g. in smooth muscle cells of blood vessels, cardiomyocytes, monocytes and macrophages. It was found, that vitamin D influences, both directly and indirectly, cardiovascular system. Active metabolite of vitamin D exerts direct effect on platelets action, on activity of renin-angiotensin-aldosterone and sympathetic nervous systems, on inflammation process and blood clotting. Indirect activity is the result of influence on glucose metabolism, arterial blood pressure and lipid homeostasis. Findings suggest profitable influence of vitamin D on cardiovascular system. The majority of studies, however, are animal, epidemiological and observational studies which are less reliable than interventional, randomized ones. The studies performed as yet are not sufficient to recommend general vitamin D supplementation in the prevention of cardiovascular disorders.

Wstęp
Objawy chorób układu sercowo-naczyniowego ulegają zwykle nasileniu w okresie jesienno-zimowym. W latach 80. XX wieku zasugerowano, że może to być następstwem nie tylko niższej temperatury powietrza i współistnienia chorób układu oddechowego, ale wynikać ze znacznych, sezonowych różnic w natężeniu promieniowania słonecznego. Na szerokości geograficznej Polski promieniowanie ultrafioletowe (UV) zapewniające dostateczną syntezę skórną witaminy D ma miejsce tylko od kwietnia do września (1). Synteza skórna jest źródłem 80-90% witaminy D, a pozostała jej część dostarczana jest z pożywieniem. Powstająca w skórze lub absorbowana z przewodu pokarmowego witamina D jest hydroksylowana w wątrobie, przy udziale 25-hydroksylazy do 25-OH witaminy D (25OHD), następnie, głównie w nerkach, powtórnie hydroksylowana przy udziale 1-α hydroksylazy do 1,25(OH)2 witaminy D [1,25(OH)2D]. Badania przeprowadzone w ostatnich latach dowiodły, że 1-α hydroksylaza znajduje się nie tylko w nerkach, ale także w tkankach pozanerkowych, m.in. w mięśniach gładkich naczyń krwionośnych, kardiomiocytach, monocytach i makrofagach. Powstający tam aktywny metabolit witaminy D – kalcytriol wywiera przede wszystkim działanie lokalne (2).
Stwierdzono, że stężenie 1,25(OH)2D w surowicy krwi jest znacznie niższe od stężenia 25(OH)D, jednakże właśnie kalcytriol charakteryzuje się dużo większym powinowactwem do receptora witaminy D (VDR). Wykazano, że kalcytriol produkowany poza nerkami wykazuje głównie aktywność auto- i parakrynną, podczas gdy 1,25(OH)2 witamina D wytwarzana w komórkach cewek nerkowych wywiera działanie ogólnoustrojowe (ryc. 1).
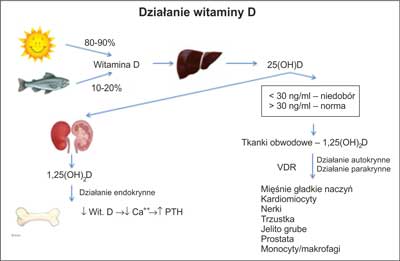
Ryc. 1. Powstawanie i działanie witaminy D.
Witamina D oddziałuje na układ sercowo-naczyniowy zarówno bezpośrednio, jak i pośrednio. Kalcytriol wpływa bezpośrednio na działanie płytek krwi, aktywność układu renina-angiotensyna-aldosteron (RAA), układu współczulnego, na procesy zapalne i układ krzepnięcia krwi. Pośrednie oddziaływanie witaminy D jest następstwem wpływu na metabolizm glukozy i lipidów oraz ciśnienie tętnicze.
Większość informacji dotyczących wpływu witaminy D na układ sercowo-naczyniowy jest oparta na wynikach badań eksperymentalnych, epidemiologicznych i obserwacyjnych. Badania interwencyjne, zaślepione, z randomizacją, charakteryzujące się większą wiarygodnością i mniejszym ryzykiem błędu, są dopiero w trakcie realizacji, a ich wyniki znane będą zapewne w niedalekiej przyszłości.
BEZPOŚREDNI WPŁYW WITAMINY D NA UKŁAD SERCOWO-NACZYNIOWY
Wpływ witaminy D na naczynia krwionośne
Obecność VDR stwierdzono m.in. w komórkach mięśni gładkich naczyń krwonośnych i komórkach śródbłonka. Prawdopodobnie za pośrednictwem tych receptorów kalcytriol wywiera wpływ na proliferację, migrację i kurczliwość komórek mięśni gładkich naczyń krwionośnych oraz na powstawanie zwapnień w ścianach naczyniowych.
Zwiększone wytwarzanie prostacykliny, do którego dochodzi pod wpływem 1,25(OH)2D mogłoby sugerować, że kalcytriol powoduje rozszerzenie naczyń krwionośnych oraz wywiera działanie przeciwmiażdżycowe. Tymczasem wyniki innych badań wskazują, że witamina D zwiększa opór naczyniowy uwrażliwiając ściany naczyń krwionośnych na wpływ czynników wazokonstrykcyjnych (2). Wykazano, że metabolity witaminy D stymulują aktywność Ca-ATP-azy (3), zwiększają stężenie wapnia w cytozolu komórek (4) oraz wpływają na kurczliwość miozyny (5). Kalcytriol indukuje również wytwarzanie prostacyklin (6) oraz wpływa na aktywność trombiny i płytko-pochodnego czynnika wzrostu (7).
W znacznym stopniu niewyjaśniona pozostaje rola 1,25(OH)2D w patogenezie zwapnień tworzących się w ścianach naczyń krwionośnych. Zwapnienia błony wewnętrznej tętnic są elementem procesu prowadzącego do powstania blaszki miażdżycowej, natomiast zwapnienia błony środkowej towarzyszą zaburzeniom homeostazy wapniowo-fosforanowej i przyczyniają się do zwiększonej sztywności tętnic (8).
Wykazano, że witamina D może modyfikować reakcje zapalne przyspieszające proces wapnienia ściany naczyniowej. Zwiększenie grubości błony wewnętrznej oraz tworzenie blaszek miażdżycowych zależne są częściowo od aktywności limfocytów T i makrofagów. Limfocyty Th1, wytwarzają interferon-γ (INF-γ), który aktywuje makrofagi oraz działa hamująco na limfocyty Th2. Komórki Th2 wywierają z kolei działanie przeciwmiażdżycowe stymulując produkcję interleukiny 10 (IL-10) i redukując aktywność makrofagów (9). Wykazano, że aktywacja VDR stymuluje przekształcanie komórek CD4+ w kierunku limfocytów Th2, przyczyniając się do ograniczenia syntezy INF-γ oraz zwiększenia produkcji cytokin przeciwzapalnych (10). Kalcytriol może również zapobiegać rozwojowi blaszki miażdżycowej hamując przekształcanie makrofagów w komórki piankowate (11).
W wysokim stężeniu 1,25(OH)2D stymuluje przekształcanie się komórek mezenchymalnych w komórki osteoblastyczne oraz przyczynia się do tworzenia zwapnień w błonie środkowej tętnic przez podwyższenie stężenia wapnia i fosforanów nieorganicznych w surowicy krwi (12).
Istotną rolę we wczesnym stadium rozwoju miażdżycy odgrywa dysfunkcja śródbłonka. Nieliczne badania, których celem była ocena wpływu witaminy D na funkcje śródbłonka, obejmowały małe grupy pacjentów i w znacznej części prowadzone były bez właściwej randomizacji i bez grupy kontrolnej otrzymującej placebo. W oparciu o wyniki tych badań sugerowano, że 1,25(OH)2D chroni komórki śródbłonka przed uszkadzającym działaniem końcowych produktów glikozylacji. Wykazano również, że kalcytriol zwiększa aktywność śródbłonkowej syntetazy tlenku azotu (2).
W bardziej zaawansowanej fazie miażdżycy dochodzi do zwiększenia grubości kompleksu obejmującego błonę wewnętrzną i środkową tętnic. Badania oceniające związek pomiędzy stężeniem 25(OH)D a grubością warstwy intima-media nie przyniosły jednoznacznych wyników. Wykazano, że niedobór witaminy D, definiowany jako stężenie kalcyfediolu < 15 ng/ml, u pacjentów z cukrzycą typu 2 jest niezależnym czynnikiem zwiększającym grubość kompleksu warstwy wewnętrznej i środkowej (13). Zbliżone wyniki przyniosło przekrojowe badanie, którym objęto 654 dorosłe osoby w wieku powyżej 55 lat. Badanie to dowiodło, że istnieje ujemna korelacji między stężeniem 25(OH)D w surowicy krwi a grubością kompleksu intima-media w tętnicy szyjnej wewnętrznej (14). Zależności tej nie potwierdzono w badaniu, do którego włączono 650-osobową populację Amiszów (15).
Wpływ witaminy D na kardiomiocyty
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Holick MF: Molecular aspects of Medicine 2008; 29: 361-368.
2. Pilz S, Tomaschitz A: Vitamin D status and arterial hypertension: a systematic review. Nat Rev Cardiol 2009; 6: 621-630.
3. Kawashima H: 1,25-Dihydroxyvitamin D3 stimulates Ca-ATPase in a vascular smooth muscle cell line. Biochem Biophys Res Commun 1988; 150: 1138-1143.
4. Shan J, Resnick LM: 1,25-Dihydroxyvitamin D as a cardiovascular hormone. Effects on calcium current and cytosolic free calcium in vascular smooth muscle cells. Am J Hypertens 1993; 6: 983-988.
5. Ishibashi K, Bukoski RD: Myosin isoform expression and force generation in cultured resistance arteries. Am J Physiol 1997; 272: 1144-1150.
6. Wakasugi M, Noguchi T: Vitamin D stimulates the production of prostacyclin by vascular smooth muscle cells. Prostaglandins 1991; 42: 127-136.
7. Mitsuhashi T, Morris RC: 1,25-Dihydroxyvitamin D3 modulates growth of vascular smooth muscle cells. J Clin Invest 1991; 87: 1889-1895.
8. London GM, Guerin AP: Arterial media calcification in end-stage renal disease: impact on all cause and cardiovascular mortality. Nephrol Dial Transplant 2003; 18: 1731-40.
9. Li AC, Glass CK: The macrophage foam cell as a target of therapeutic intervention. Nat Med 2002; 8: 1235-42.
10. Boonstra A, Barrat FJ, Crain C et al.: 1,25-dihydroxyvitamin D3 has a direct effect in na?ve CD4+ cells to enhance the development of Th2 cells. J Immunol 2001; 167: 4974-80.
11. Rader DJ, Pure E: Lipoproteins, macrophage function, and atherosclerosis: beyond the foam cell? Cell Metab 2005; 1: 223-230.
12. Johnson R, Leopold J: Vascular calcification: pathobiological mechanisms and clinical implications. Circ Res 2006; 99: 1044-1059.
13. Targher G, Bertolini R, Padovani R: Serum 25-hydroxyvitamin D3 concentrations and carotid intima-media thickness among type 2 diabetic patients. Clin Endocrinol 2006; 65: 593-597.
14. Reis JP, von Muhlen D: Serum vitamin D, parathyroid hormone levels, and carotid atherosclerosis. Atherosclerosis 2009; 207: 585-590.
15. Michos ED, Streeten EA: Serum 25-hydroxyvitamin D levels are not associated with subclinical vascular disease or C-reactive protein in the old order amish. Calcified Tissue Int 2009; 84: 195-202.
16. Mancuso P, Rahman A: 1,25-dihydroxyvitamin-D3 treatment reduces cardiac hypertrophy and left ventricular diameter in spontaneously hypertensive heart failure-prone (cp/+) rats independent of changes in serum leptin. J Cardiovasc. Pharmacol 2008; 51: 559-564.
17. Pilz S, Marz W: Association of vitamin D deficiency with heart failure and sudden cardiac death in a large cross-sectional study of patients referred for coronary angiography. J Clin Endocrinol Metab 2008; 93: 3924-3935.
18. Witham MD, Crighton LJ: The effects of vitamin D supplementation on physical function and quality of life in older patients with heart failure: a randomized controlled trial. Circ Heart Fail 2010; 3: 195-201.
19. Li YC, Kong J: 1,25-Dihydroxyvitamin D3 is a negative endocrine regulator of the renin-angiotensin system. J Clin Invest 2002; 110: 229-238.
20. Yuan W: 1,25-dihydroxyvitamin D suppresses renin gene transcription by blocking the activity of the cyclic AMP response element in the renin gene promoter. J Biol Chem 2007; 282: 29821-29830.
21. Zhu Y, Mahon BD: Calcium and 1 alpha, 25-dihydroxyvitamin D3 target the TNF-alpha pathway to suppress experimental inflammatory bowel disease. Eur J Immunol 2005; 35: 217-224.
22. Inoue M, Wakasugi M: A synthetic analogue of vitamin D3, 22-oxa-1,25-dihydroxy-vitamin D3, stimulates the production of prostacyclin by vascular tissues. Life Sci 1992; 51: 1105-1112.
23. Gallerani M, Boari B: Seasonal variation in the occurrence of deep vein thrombosis. Med Sci Monit 2004; 10: CR191-196.
24. Nayha S: Cold and the risk of cardiovascular diseases. A review. Int J Circumpolar Health 2002; 61: 373-380.
25. Lindqvist PG, Epstein E: Does an active sun exposure habit lower the risk of venous thrombotic events? A D-lightful hypothesis. J Thromb Haemost 2009; 7: 605-610.
26. Koyama T, Shibakura M: Anticoagulant effects of 1-alpha, 25-dihydroxyvitamin D3 on human myelogenous leukemia cells and monocytes. Blood 1998; 92: 160-167.
27. Scragg RK, Camargo CA: Relation of serum 25-hydroxyvitamin D to heart rate and cardiac work (from the National Health and Nutrition Examination Surveys). Am J Cardiol 2010; 105: 122-128.
28. Puchacz E, Stumpf WE: Vitamin D increases expression of the tyrosine hydroxylase gene in adrenal medullary cells. Brain Res Mol Brain Res 1996; 36: 193-196.
29. Caan B, Neuhouser M: Calcium plus vitamin D supplementation and the risk of postmenopausal weight gain. Arch Intern Med 2007; 167: 893-902.
30. Muray S, Parisi E: Influence of vitamin D receptor gene polymorphisms and 25-hydroxyvitamin D on blood pressure in apparently healthy subjects. J Hypertens 2003; 21: 2069-2075.
31. Krause R, Buhring M: Ultraviolet B and blood pressure. Lancet 1998; 352: 709-710.
32. Pfeifer M, Begerow B: Effects of a short-term vitamin D and calcium supplementation on blood pressure and parathyroid hormone levels in elderly women. J Clin Endocrinol Metab 2001; 86: 1633-1637.
33. Jorde R, Fingschau Y, Emaus N: Serum 25-Hydroxyvitamin D Levels Are Strongly Related to Systolic Blood Pressure But Do Not Predict Future Hypertension. Hypertension 2010; 55: 792-798.
34. The EURODIAB Substudy 2 Study Group. Vitamin D supplement in early childhood and risk for Type I diabetes mellitus. Diabetologia 1999; 42: 51-54.
35. Baz-Hecht M, Goldfine A: The impact of vitamin D deficiency on diabetes and cardiovascular risk. Curr Opin Endocrinol Diabetes Obes 2010; 17: 113-119.
36. Pittas AG, Dawson-Hughes B: Vitamin D and calcium intake in relation to type 2 diabetes in women. Diabetes Care 2006; 29: 650-656.
37. Rajpathak SN, Xue X: Effevt of 5 y of calcium plus vitamin D supplementation on change in circulating lipids: results from the Women’s Health Initiative. Am J Clin Nutr 2010; 91: 894-899.
38. Holick MF: The vitamin D deficiency pandemic and consequences for nonskeletal health: mechanisms of action. Molecular Aspects of Medicine 2008; 29: 361-368.

