© Borgis - Postępy Nauk Medycznych 4/2012, s. 371-386
*Andrzej Borówka1, 2, 3, Jakub Dobruch1, 2, *Piotr L. Chłosta1, 2, 3, 4
Urologia onkologiczna w Polsce**
Urological oncology in Poland
1I. Zespół Dydaktyki Urologicznej Kliniki Urologii Centrum Medycznego Kształcenia Podyplomowego
Kierownik Zespołu: prof. dr hab. med. Andrzej Borówka
2Oddział Urologii Europejskiego Centrum Zdrowia w Otwocku
Kierownik Oddziału: prof. dr hab. med. Andrzej Borówka
3Kliniczny Dział Urologii Świętokrzyskiego Centrum Onkologii w Kielcach
Kierownik Działu: prof. dr hab. med. Piotr L. Chłosta
4Wydział Nauk o Zdrowiu Uniwersytetu J. Kochanowskiego w Kielcach
Streszczenie
Zasadniczą część urologii klinicznej stanowi uro-onkologia. Nowotwory nerki, pęcherza moczowego i stercza odpowiadają za 26% nowych rozpoznań nowotworowych u mężczyzn w Polsce. Poniższy tekst przedstawia krótko ogólną charakterystykę onkologiczną najczęstszych nowotworów układu moczowego i płciowego męskiego, a także opisuje bieżące dylematy, które wiążą się z ich leczeniem.
Summary
Fundamental part of clinical urology constitutes uro-oncology. Kidney, urinary bladder and prostate cancers are responsible for 26% of all newly diagnosed cancers in polish males. Following article describes shortly oncological features of the most frequent urological cancers and refers to current dilemmas associated with their therapy.

Uro-onkologia jest szczególnie ważnym działem urologii, mającym najwyraźniej charakter wielodyscyplinarny. Oparty jest on bowiem nie tylko na urologii, ale także w stopniu zasadniczym na uro-patomorfologii i onkologii w jej pełnym wymiarze, obejmującym zarówno onkologię medyczną, jak i radioterapię. Postępy w uro-onkologii nie byłyby możliwe bez udziału najszerzej pojętych badań podstawowych. Jest wiele powodów, dla których trzeba stale mówić o uro-onkologii, nie tylko w środowisku urologów. Takimi powodami są co najmniej: (i) duży udział chorych na nowotwory układu moczowego i męskich narządów płciowych wśród wszystkich chorych na nowotwory złośliwe (aspekt epidemiologiczny), (ii) dominacja uro-onkologii w codziennej pracy urologa, (iii) nadal niezadowalające wyniki leczenia w uro-onkologii.
Uro-onkologia obejmuje rozpoznanie, leczenie i obserwację po leczeniu chorych na nowotwory złośliwe nerki, dróg moczowych (układ kielichowo-miedniczkowy nerki, moczowody, pęcherz moczowy, cewka moczowa) oraz męskich narządów płciowych, w tym stercza, a także – niekiedy – żeńskich narządów płciowych, jeśli szerzą się w obrębie układu moczowego. Do zakresu uro-onkologii należy ponadto rozpoznanie i leczenie powikłań dotyczących narządów układu moczowego, powikłań powstałych w toku leczenia i po leczeniu nowotworów wywodzących się z innych narządów sąsiadujących z drogami moczowymi – nowotworów stanowiących domenę onko-ginekologii i chirurgii onkologicznej.
Wśród zasadniczych przesłanek, na podstawie których można przedstawić „portret” współczesnej uro-onkologii są te, które wynikają z badań epidemiologicznych. Niestety, gromadzenie danych pozwalających na zbudowanie pełnego wizerunku epidemiologii onkologicznej nadal nie jest zadowalające, a znane kłopoty, z którymi przychodzi zmagać się epidemiologom, będące wynikiem niesprawności systemu ochrony zdrowia w naszym kraju, wyrażające się głównie „niedorejestrowaniem” zachorowań na nowotwory złośliwe oraz zgonów z ich powodu, wymagają pilnie działań naprawczych. Niezadowalające wyniki leczenia w uro-onkologii nie tylko w Polsce są silnym argumentem za koniecznością wprowadzenia istotnych zmian systemowych w ochronie zdrowia w naszym kraju.
Chorzy na nowotwory, które obejmuje uro-onkologia stanowią istotny odsetek wszystkich chorych na nowotwory złośliwe. Liczba nowych rozpoznań nowotworów „uro-onkologicznych” w 2009 roku stanowiła aż 26,3% w populacji męskiej, i „tylko” 4,9% w populacji żeńskiej (ryc. 1), przy czym odsetki kobiet i mężczyzn, u których w 2009 roku rozpoznano nowotwór „uro-onkologiczny” stanowiły odpowiednio 15,7 i 84,3%, co świadczy, że nowotwory te są 5,4-krotnie częściej udziałem mężczyzn niż kobiet. Nowotworami, które charakteryzują największe współczynniki zapadalności, dotyczą: stercza, pęcherza moczowego i nerki (tab. 1).

Ryc. 1. Udział chorych na nowo rozpoznane „urologiczne” nowotwory złośliwe (wycinki białe) w populacji chorych, u których nowotwory złosliwe rozpoznano w Polsce w 2009 roku (według: www.onkologia.org.pl).
Tabela 1. Współczyniki standaryzowane (na 100 tys. osób) zapadalności na nowotwory „uro-onkologiczne” i umieralności z ich powodu w Polsce w 2009 roku (według: www.onkologia.org.pl).
| ICD 10 | Umiejscowienie nowotworu | Zapadalność | Umieralność |
| | Mężczyźni | Kobiety | Mężczyźni | Kobiety |
| C60 | Prącie | 0,7 | | 0,4 | |
| C61 | Stercz | 32,8 | | 13,1 | |
| C62 | Jądro | 5,2 | | 0,6 | |
| C64 | Nerka | 10,3 | 5,5 | 5,5 | 2,3 |
| C65-66 | Górne drogi moczowe | 0,7 | 0,3 | 0,2 | 0,1 |
| C67 | Pęcherz moczowy | 16,7 | 3,6 | 8,4 | 1,4 |
Zabiegi wykonywane u chorych na nowotwory „urologiczne” stanowią od 60% do 80% obciążenia ponad 130 oddziałów i 14 klinik akademickich urologii. Wśród nich były dotychczas tylko 3 ośrodki dedykowane wyłącznie uro-onkologii, umiejscowione w wieloprofilowych, dobrze wyposażonych centrach onkologii, zapewniających możliwość objęcia chorych wielokierunkowym leczeniem, prowadzonym – jeśli to konieczne – z udziałem specjalistów z różnych dziedzin onkologii (Centrum Onkologii – Instytut im. M. Skłodowskiej-Curie w Warszawie, Świętokrzyskie Centrum Onkologii w Kielcach oraz w Centrum Onkologii im. Prof. M. Łukaszczyka w Bydgoszczy). W ostatnim czasie powstały dwa ośrodki uro-onkologii zorganizowane w szpitalach prywatnych („niepublicznych”), mieszczących się niedaleko Warszawy: Mazowiecki Szpital Onkologiczny w Wieliszewie oraz Europejskie Centrum Zdrowia w Otwocku, będące siedzibą Kliniki Urologii Centrum Medycznego Kształcenia Podyplomowego.
Wydaje się, że liczba ośrodków uro-onkologii jest nadal co najmniej dwukrotnie za mała. Trzeba jednak podkreślić, że działalność kliniczna w dziedzinie uro-onkologii prowadzona jest w wielu oddziałach i klinikach urologii na bardzo wysokim poziomie, dzięki mniej lub bardziej sformalizowanej współpracy z odpowiednimi jednostkami onkologii.
Podstawę dobrego poziomu uro-onkologii stanowi wykształcenie urologów w tej dziedzinie, zarówno na etapie odbywania przez adeptów studiów specjalizacyjnych w urologii, jak i na etapie kształcenia ustawicznego specjalistów urologów. Konsultant krajowy w dziedzinie urologii oraz Polskie Towarzystwo Urologiczne (PTU) dokładają wszelkich starań, aby zarówno zakres, jak i poziom wiedzy przekazywanej adeptom i specjalistom były jak najlepsze. Zagadnienia dotyczące uro-onkologii stanowią około 50% „ładunku dydaktycznego” zawartego w Programie Specjalizacji w Urologii (www.cmkp.edu.pl/programy_pdf/Urologia), obowiązującym wszystkich specjalizujących się w naszej dyscyplinie. Program ten uzyskał przed kilkoma laty akceptację European Board of Urology (EBU), instytucji o składzie międzynarodowym (uczestniczą w niej przedstawiciele urologicznych towarzystw naukowych wszystkich krajów stanowiących Unię Europejską), pełniącej rolę „ciała regulatorowego” urologii europejskiej (www.ebu.com). EBU jest współorganizatorem egzaminu specjalizacyjnego z urologii – egzamin przedstawiony jest w innym artykule wydrukowanym w tym numerze „Postępów Nauk Medycznych” (1). Uro-onkologii dotyczy nie mniej niż 20% pytań, zawartych w testowym egzaminie pisemnym oraz nie mniej niż 30% pytań, ujętych w egzaminie ustnym. Adepci, którzy złożą egzamin EBU uzyskują nie tylko tytuł specjalisty urologa, ale także prestiżowy tytuł Fellow of the EBU (FEBU). W 2011 roku liczba FEBUs w Polsce przewyższyła 400. W Unii Europejskiej stanowimy najliczniejszą (15,3%) grupę narodową FEBUs.
Podstawę dydaktyczną i naukową uprawiania urologii w naszym kraju stanowi publikowane co rok przez European Association of Urology (EAU) wydawnictwo (mające charakter swoistego dokumentu) pt.: „EAU Guidelines” (www.uroweb.org/guidelines), obejmujące wszelkie gałęzie urologii, w tym także szeroko rozwiniętą wiedzę dotyczącą uro-onkologii. „EAU Guidelines” mają moc obowiązującą urologów nie tylko dlatego, że przed 10 laty zostały oficjalnie uznane przez PTU za „zalecenia” naszego Stowarzyszenia, ale także dlatego, że zawierają obszerne kompendium stale aktualizowanej, opartej na dowodach naukowych wiedzy obejmującej właściwie całą urologię, przy czym zagadnienia dotyczące uro-onkologii stanowią w nim większość. Powszechnie dostępne w Polsce materiały edukacyjne i naukowe dotyczące uro-onkologii obejmują szereg periodyków rodzimych i zagranicznych oraz wydawnictw książkowych. Oprócz tego, uro-onkologia jest przedmiotem szeregu kursów obowiązkowych i doskonalących organizowanych w ramach programu edukacyjnego CMKP oraz kongresów, sympozjów i innych form przekazu wiedzy, prowadzonych przez PTU.
Uro-onkologię szczegółową przedstawiamy, ograniczając się do najczęściej występujących „urologicznych” nowotworów złośliwych: nerki, pęcherza moczowego oraz gruczołu krokowego (tab. 2).
Tabela 2. Liczby chorych, u których rozpoznano nowotwór układu moczowego lub układu męskich narzadów płciowych oraz liczby zgonów z powodu tych nowotworów w Polsce w 2009 roku (według www.onkologia.org.pl).
| ICD10 | Umiejscowienie nowotworu | Liczby nowych rozpoznań | Liczby zgonów |
| | Mężczyźni | Kobiety | Mężczyźni | Kobiety |
| C60 | Prącie | 201 | | 101 | |
| C61 | Stercz | 9142 | | 4042 | |
| C62 | Jądro | 1111 | | 124 | |
| C63 | Inne nowotwory męskich narządów płciowych | 9 | | 14 | |
| C64 | Nerka | 2733 | 1866 | 1553 | 984 |
| C65-66 | Górne drogi moczowe | 180 | 106 | 34 | 21 |
| C67 | Pęcherz moczowy | 4709 | 1380 | 2499 | 647 |
| C68 | Inne nowotwory układu moczowego | 18 | 9 | 33 | 10 |
| Razem | 18 103 | 3361 | 8400 | 1662 |
| 21 464 | 10 062 |
Rak nerki
W Polsce w 2009 roku zarejestrowano 4599 nowych rozpoznań nowotworów złośliwych nerki oraz 2537 zgonów z powodu tych nowotworów. Ogromną większość stanowią guzy wywodzące się z miąższu nerkowego (95,9%), a wśród nich dominują raki nerkowokomórkowe (RCCs – renal cell carcinomas) – dotyczy ich artykuł wydrukowany w tym numerze PNM (2). Raki wywodzące się z nabłonka przejściowego układu kielichowo-miedniczkowego, a wśród nich głównie rak przejściowonabłonkowy (TCC – transitional cell carcinoma) stanowią tylko 4,1% wszystkich guzów złośliwych nerki, przy czym pod względem etiologicznym i pod względem patomorfologicznym nie różnią się od TCC pęcherza moczowego. Większość guzów litych miąższu nerkowego rozpoznaje się w ostatnim czasie przypadkowo (incidental tumors), dzięki upowszechnieniu ultrasonografii i tomografii komputerowej wykonywanych głównie ze wskazań „pozaurologicznych” (3). Wobec tego stopień zaawansowania tych nowotworów w momencie rozpoznania jest na ogół mniejszy niż nowotworów „objawowych”.
Jedyną metodą radykalnego leczenia RCC jest leczenie operacyjne. W ostatnich latach zmianie uległy zasady tego leczenia – zwiększono wskazania do operacji oszczędzających miąższ nerkowy (NSS – nephron sparing surgery) i ograniczono zakres tzw. nefrektomii radykalnej (RN – radical nephrectomy), rezygnując z rutynowego wykonywania adrenalektomii i limfadenektomii regionalnej, ale nie tracąc przy tym – co oczywiste – skuteczności onkologicznej leczenia. Dzięki rozwojowi w urologii technik laparoskopowych i retroperitoneoskopowych, wprowadzono je do chirurgii nerki zarówno w odniesieniu do RN, jak i NSS. Niemniej, nadal w naszym kraju operacją wykonywaną najczęściej z powodu RCC jest RN – w 2010 roku wykonano ją u 5662 chorych, w tym u 357 (5,3%) z nich metodą laparoskopową. Chorzy ci stanowią 80,9% wszystkich operowanych z powodu RCC (tab. 3). Dane przedstawione w tabeli 3 świadczą, że odsetki chorych poddanych laparoskopowej RN lub NSS są w naszym kraju zaskakująco małe.
Tabela 3. Liczby chorych operowanych z powodu raka nerki w Polsce w 2010 roku (na podstawie danych konsultanta krajowego w dziedzinie urologii).
| Rok | Liczby (odsetki) operowanych chorych |
| ORN | LRN | OPN | LRN | Razem |
| 2010 | 5305 (93,7%) | 357 (6,3%) | 1220 (91,6%) | 112 (8,4%) | 6994 |
| 5662 | 1332 |
| 2009 | 4382 (93,8%) | 288 (6,2%) | 1086 (93,6%) | 74 (6,4%) | 5638 |
| 4670 | 1160 |
| 2008 | 4106 (93,3%) | 295 (6,7%) | 901 (93,1%) | 67 (6,9%) | 5369 |
| 4401 | 968 |
Rytm wykonywania badań kontrolnych w ramach obserwacji po operacji RCC i czas trwania obserwacji są ściśle określone i zależą od cech guza, stanowiących o przypisaniu chorego do odpowiedniej grupy ryzyka (tab. 4).
Tabela 4. Zasady wykonywania badań w ramach obserwacji chorych po operacji z powodu raka nerki (według: EAU Guidelines on Renal Cell Carcinoma – www.uroweb/guidelines/2011).
| Ryzyko | Czas po operacji |
| 6 m-cy | 1 rok | 2 lata | 3 lata | 4 lata | 5 lat | > 5 lat |
| Małe | Rtg kl.p.
USG j.b. | Rtg kl.p.
USG j.b. | Rtg kl.p.
USG j.b. | Rtg kl.p.
USG j.b. | Rtg kl.p.
USG j.b. | Rtg kl.p.
USG j.b. | Stop |
| Umiarkowane | CT kl.p.
CT j.b. | Rtg kl.p.
USG j.b. | CT kl.p.
CT j.b. | Rtg kl.p.
USG j.b. | Rtg kl.p.
USG j.b. | CT kl.p.
CT j.b. | Rtg kl.p.
USG j.b. co rok |
| Duże | CT kl.p.
CT j.b. | CT kl.p.
CT j.b. | CT kl.p.
CT j.b. | CT kl.p.
CT j.b. | CT kl.p.
CT j.b. | CT kl.p.
CT j.b. | Rtg kl.p.
CT j.b. co rok |
Rtg kl.p. – zdjęcie rentgenowskie klatki piersiowej; CT kl.p. – tomografia komputerowa klatki piersiowej;
CT j.b. – tomografia komputerowa jamy brzusznej |
RCC jest niezwykle groźnym nowotworem, bowiem nie mniej niż 30% chorych poddanych RN umiera z powodu przerzutów odległych, pojawiających się po upływie nawet bardzo długiego czasu od operacji wykonanej doszczętnie (tab. 5), przy czym zasadniczym cznnikiem prognostycznym wieloletniego przeżycia bez wznowy RCC jest zaawansowanie guza. Dla określenia rokowania pod względem ryzyka powstania wznowy miejscowej oraz przerzutów odległych i zgonu z powodu RCC opracowano szereg systemów kalkulacyjnych (nomogramów), w których wykorzystuje się wiele czynników prognostycznych (4-7) (ryc. 2).
Tabela 5. Przeżycie 5-letnie chorych operowanych z powodu raka nerkowokomórkowego (RCC) (8).
| Klasyfikacja TNM (2009) | Cechy RCC | Przeżycie 5-letnie |
| T1a N0 M0 | RCC ograniczony do nerki | ? ≤ 4 cm | 90-100% | 70-90% |
| T1b N0 M0 | ? 4-7 cm | 80-90% |
| T2a N0 M0 | ? 7-10 cm | 65-80% |
| T2b N0 M0 | ? > 10 cm | 50-70% |
| T3a N0 M0 | Nacieczenie torebki tłuszczowej lub zatoki nerki | 50-70% |
| Czop nowotworowy w ŻN | 40-60% |
| T3b N0 M0 | Czop w podprzeponowej ŻGD | 30-50% |
| T3c N0 M0 | Czop w nadprzeponowej ŻGD lub nacieczenie ściany ŻGD | 20-40% |
| T4 N0 M0 | Nacieczenie nadnercza | 0-30% |
| Guz nacieka poza torebkę Geroty | 0-20% |
| T ≤ 4 N1 M0 | Zajęcie węzłów chłonych | 0-20% |
| T ≤ 4 N 0-1 M1 | Przerzuty odległe | 0-10% |
| ŻN – żyła nerkowa; ŻGD – żyła główna dolna |
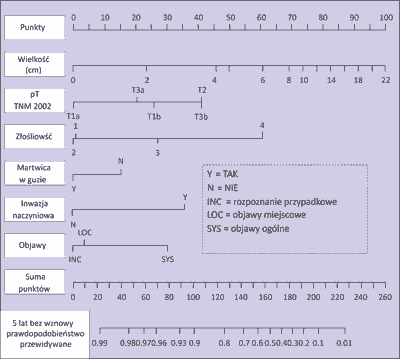
Ryc. 2. Nomogram oparty na danych uzyskanych po wycięciu nerki z powodu raka nerkowokomórkowego, pozwalający określić prawdopodobieństwo przeżycia 5-letniego bez wznowy raka. Wartość liczbową każdej z cech ujętych w nomogramie należy odłożyć pionowo na skali punktowej znajdującej się w jego górnej części. Sumę punktów przypisanych poszczególnym cechom, stwierdzonym u konkretnego chorego, należy zaznaczyć na skali znajdującej się w drugim rzędzie od dołu nomogramu. Sprowadzenie linii pionowej z odpowiedniego punktu na tej skali ku dołowi wskaże wielkość poszukiwanego prawdopodobieństwa (9).
Przejawem agresywności RCC jest zdarzające się niekiedy wystąpienie wznowy miejscowej raka. Postępowaniem zasadniczym w takim przypadku jest jej wycięcie. Ma ono także zastosowanie w odniesieniu do przerzutów odległych, jeśli są „resekcyjne”. W razie uogólnienia choroby, stosuje się leczenie systemowe oddziałujące na układ odpornościowy chorego (Interferon alfa – IFN-α mający obecnie zastosowanie marginalne, wyłącznie u wybranych chorych na „czystego” CCC z przerzutami tylko do płuc; Interleukina 2 – IL-2 obarczona większym ryzykiem działań niepożądanych nić IFN-α, stosowana u starannie dobranych chorych, u których nie występują niekorzystne czynniki prognostyczne) (10) (lub hamujące angiogenezę (11) (np. sunitinib – zalecany do leczenia pierwszej linii chorych „małego lub umiarkowanego ryzyka”, bevacizumab – zalecany do leczenia pierwszej linii w skojarzeniu z IFN-α u chorych „małego lub umiarkowanego ryzyka”, sorafenib – zalecany do leczenia drugiej linii po niepowdzeniu immunoterapii, temsirolimus – zalecany do leczenia pierwszej linii chorych „dużego ryzyka”) (12, 13). Jednak leczenie tego rodzaju, koniecznie poprzedzone operacją cytoredukcyjną, przyczynia się tylko do kilkumiesięcznego przedłużenia przeżycia.
Zasadniczy wpływ na odległy wynik chirurgicznego leczenia RCC ma stopień zaawansowania guza w momencie operacji. Dlatego warto wykonywać okresowo „przeglądową” ultrasonografię przezpowłokową brzucha (TAUS – transabdominal ultrasound), aby stworzyć szansę wczesnego rozpoznania guza nerki, choć obejmowanie populacji badaniami przesiewowymi nie ma uzasadnienia naukowego i nie jest zalecane, niemniej, najważniejsze znaczenie dla zapobiegania wystąpieniu RCC ma zaniechanie palenia tytoniu oraz wyeliminowanie otyłości oraz nadciśnienia tętniczego (14-16).
Rak pęcherza moczowego
Zapadalność na nowotwory złośliwe pęcherza moczowego ocenia się w Polsce na 16,7/100 tys. u mężczyzn i 3,6/100 tys. u kobiet (www.onkologia.org.pl). W 2009 roku rozpoznano je u 6089 chorych, przy czym mężczyźni stanowili 77,3% z nich (ryc. 3 i 4). Najczęstszym wśród raków pęcherza moczowego (BCa – bladder cancer) jest rak przejściowonabłonkowy (TCC). Dotyczy on ponad 95% chorych na BCa. Najważniejszym czynnikiem ryzyka powstania TCC jest palenie tytoniu, do innych czynników należy ekspozycja na pochodne benzenu, np. aminy aromatyczne, a także nadmierne spożycie fenacetyny.
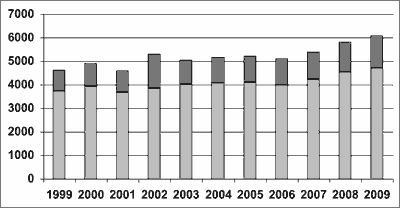
Ryc. 3. Liczby nowych rozpoznań nowotworów złośliwych pęcherza moczowego w Polsce w latach 1999-2009 – kolorem jasnoszarym zaznaczono liczby mężczyzn, kolorem ciemnoszarym zaznaczono liczby kobiet, w ramkach podano liczby globalne (według: www.onkologia.org.pl).
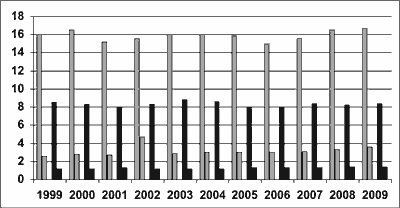
Ryc. 4. Współczynniki zapadalności (słupki szare) na raka pęcherza moczowego i umieralności (słupki czarne) z jego powodu w Polsce w latach 1999-2009 – słupki po lewej odpowiadają mężczyznom, po prawej – kobietom (według: www.onkologia.org.pl).
BCa u większości chorych ma charakter raka „powierzchownego” – nienaciekającego błony mięśniowej pęcherza (N-MIBCa – non-muscle invasive BCa) i tym samym wymagającego jedynie wycięcia miejscowego metodą elektroresekcji przezcewkowej (TURBT – transurethral resection of the bladder tumor), podania bezpośrednio po niej do pęcherza roztworu chemioterapeutyku (17), sprawdzenia jej doszczętności po upływie około 4 tygodni (re-TUR) i ewentualnego leczenia adjuwantowego w postaci dopęcherzowych wlewek szczepionki BCG lub – znacznie rzadziej – wlewek chemioterapeutyku (18). Leczenie to ma na celu ograniczenie ryzyka wznowy BCa.
TURBT jest w Polsce najczęściej wykonywanym zabiegiem w urologii – liczba TURBTs przeprowadzonych w Polsce w 2010 roku wyniosła 23 250. Prawdopodobieństwo wystąpienia wznowy N-MIBCa po TURBT można określić, posługując się swoistym narzędziem kalkulacyjnym, uwzględniającym najważniejsze cechy patomorfologiczne guza (www.eortc.be/bladdercalculator). Niemniej chorzy poddani TURBT wymagają ścisłej obserwacji właściwie przez całe życie, opartej na okresowym wykonywaniu badania cytologicznego osadu moczu, TAUS i cystoskopii.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Borówka A, Chłosta P, Dobruch J et al.: Europejski egzamin z urologii w Polsce. Postępy Nauk Medycznych 2012; 25: 335-342.
2. Piotrowicz S, Dobruch J, Chłosta P et al.: Leczenie chirurgiczne chorych na raka nerki. Postępy Nauk Medycznych 2012; 25: 356-361.
3. Dobruch J, Borówka A, Dzik T et al.: Oncological characteristics of the incidental renal tumors. Pol J Urol 2005; 58 (4): 266-269.
4. Kattan MW, Reuter V, Motzer RJ et al.: A postoperative prognostic nomogram for renal cell carcinoma. J Urol 2001; 166: 63-67.
5. Lam JS, Shvarts O, Leppert JT et al.: Postoperative surveillance protocol for patients with localized and locally advanced renal cell carcinoma based on a validated prognosticated nomogram and risk group stratification system. J Urol 2005; 174: 466-472.
6. Leibovitch BC, Blute ML, Cheville JC et al.: Prediction of progression after radical nephrectomy for patients with clear cell renal cell carcinoma: a stratification tool for prospective clinical trials. Cancer 2003; 97: 1663-1671.
7. Karakiewicz PI, Briganti A, Chun FK et al.: Multi-institutional validation of a new renal cancer-specific survival nomogram. J Clin Oncol 2007; 25: 1316-1322.
8. Campbell SC, Lane BR: Malignant renal tumors. [In:] Wein AJ, Kavoussi LR, Novick AC, Partin AW, Peters CA, editors. Campbell-Walsh Urology 10ed. Philadelphia. Elsevier 2011; 1413-1473.
9. Sobellini M, Kattan MW, Snyder ME et al.: A postoperative prognostic nomogram predicting recurrence for patients with conventional clear celll renal cell carcinoma. J Urol 2005; 173: 48-51.
10. Coppin C, Porzsoft F, Awa A et al.: Immunotherapy for advanced renal cell cancer. Cohrane Database Syst Rev 2005 Jan; (1): CD001425.
11. Linehan WM, Bratslavsky G, Pinto PA et al.: Molecular diagnosis and therapy of kidney cancer. Annu Rev Med 2010; 61: 329-343.
12. Żołnierek J, Szczylik C: Leczenie antyangiogenne chorych na raka nerki. Onkologia w Praktyce Klinicznej 2009; 5 (A): 32-38.
13. Drosik A, Drosik K: Leczenie chorych na przerzutowego raka nerkowokoórkowego – fakty, czy logika poparta faktami? Onkologia w Praktyce Klinicznej 2010; 6 (6): 311-317.
14. Lipworth L, Tarone RE, McLaughlin JK: The epidemiology of renal cell carcinoma. J Urol 2006; 176: 2353-2358.
15. Weikert S, Boeing H, Poischon T et al.: Blood pressure and risk of renal cell carcinoma in the European Prospective Investigation into Cancer and Nutrition. Am J Epidemiol 2008; 167: 438-446.
16. Pischon T, Lahmann PH, Boeing H et al.: Body size and risk of renal cell carcinoma in the European Prospective Investigation into Cancer and Nutrition. Int J Cancer 2006; 118: 728-738.
17. Dobruch J, Herr H: Should all patients receive single chemotherapeutic agent instillation after bladder tumour resection? BJU Int 2009; 104: 170-174.
18. Anastasiadis A, de Reijke TM: Best practice in the treatment of nonmuscle invasive bladder cancer. Ther Adv Urol 2012; 4: 13-32.
19. Chłosta P, Drewa T, Olejniczak P et al.: Laparoscopic radical cystectomy: operative and pathologic outcomes. Postępy Nauk Medycznych 2012; 25: 320-324.
20. Shariat SF, Karakiewicz PI, Palapattu GS et al.: Outcomes of radical cystectomy for transitional celll carcinoma of the bladder: a contemporary series from the Bladder Cancer Research Consortium. J Urol 2006; 176: 2414-24-22.
21. Stein JP, Lieskovsky G, Cote R et al.: Radical cystectomy in the treatment of invasive bladde cancer: long-term results in 1,054 patients. J Clin Oncol 201; 19: 666-675.
22. Skrzypczyk MA, Grotthuss G, Dobruch J et al.: Rak pęcherza moczowego w Polsce. Postępy Nauk Medycznych 2012; 25: 311-319.
23. Sherif A HL, Rintala E, Mestad O et al.: Nordic Urothelial Cancer Group. Downstaging and pathoanatomical outcome following neoadjuvant cisplatinum based combination chemotherapy for muscle-invasive bladder carcinoma: An analysis of selected patients from two combined randomised prospective Nordic trials. Urology 2006; 68 (Suppl 1): 137, MP-1307.
24. Stein JP, Skinner DG: Radical cystectomy for invasive bladder cancer: long-term results of a standard procedure. World J Urol 2006; 24: 296-304.
25. Rődel C, Grabebauer GG, Kűhn R et al.: Combined-modality treatment and selective organ preservation in invasive bladder cancer: long-term results. J Clin Oncol 2002; 20: 3061-3071.
26. Labrie F, Dupont A, Suburu R et al.: Serum prostate specific antigen as pre-screening test for prostate cancer. J Urol 1992; 147: 846-852.
27. Dobruch J, Chłosta P, Borówka A: Badania przesiewowe mające na celu wykrycie raka stercza w XXI wieku. Postępy Nauk Medycznych, 2012; 25: 347-350.
28. Szempliński S, Modzelewska E, Dzik et al.: Gęstość wielomiejscowej biopsji stercza wykonywanej pod kontrolą ultrasonografii przezodbytniczej u mezczyzn, u których podejrzewa się raka jedynie na podstawie podwyższenia stężenia swoistego antygenu sterczowego w surowicy. Przegl Urol 2010; 11 (4): 48-51.
29. Hodge KK, McNeal JE, Terris MK et al.: Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate. J Urol 1989; 142: 71-74.
30. Gleason DF, Mellinger GT: Prediction of prognosis for prostatic adenocarcinoma by combined histological grading and clinical staging. J Urol 1974; 111: 58-64.
31. Nyk Ł, Dzik T, Wysocki M et al.: Badanie stopnia rozbieżności między pierwszą i powtórną oceną złosliwości raka stercza wyrażona w skali Gleasona dokonaną przez dwóch niezależnych patomorfologów. Postępy Nauk Medycznych 2012; 25: 296-305.
32. Borówka A, Dobruch J, Chłosta P: Leczenie hormonalne chorych na raka gruczołu krokowego. Przegl Urol 2011; 12, 1 (65): 23-32.
33. Borówka A, Dobruch J, Chłosta P: Postępowanie w przypadku problemów konstnych u chorych leczonych hormonalnie z powodu raka gruczołu krokowego. Przegl Urol 2011; 1 (65): 23-35.
34. Chłosta P, Drewa T, Jaskulski J et al.: Laparoscopic radical prostatectomy with bladder neck and neurowascular bundles preservation: technique and surgical outcomes. Postępy Nauk Medycznych 2012; 25: 306-310.
35. Eichler K, Hempel S, Wilby J et al.: Diagnostic value of systematic biopsy methods in the investigation of prostate cancer: systematic review. J Urol 2006; 175: 1605-1612.
36. Schrőder FH, Roach 3rd M, Scardino P: Clinical decisions.management of prostate cancer. N Engl J Med 2008; 359: 2605-2609.
37. Walsh PC: Anatomic radical prostatectomy: evolution of the surgical technique. J Urol 1998; 160: 2418-2424.
38. Dobruch J, Chłosta PL, Szopiński T et al.: Laparoskopia w urologii. Postępy Nauk Medycznych 2012; 25: 351-355.
39. Isbarn H, Wanner M, Salomon G et al.: Long-term data on survival of patients with prostate cancer treated with radical prostatectomy in the prostate-specific antigen era. BJU Int 2010; 106: 37-43.
40. Porter CR, Kodama K, Gibbons RP et al.: 25-year prostate cancer control and survival outcomes: a 40-year radical prostatectomy single institution series. J Urol 2006; 176: 569-574.
41. Roehl KA, Han M, Ramos CG et al.: Cancer progression and survival rates following anatomical radical retropubic prostatectomy in 3,478 consecutive patients: long-term results. J Urol 2004; 172: 910-914.
42. Hull GW, Rabbani F, Abbas F et al.: Cancer control with radical prostatectomy alone in 1,000 consecutive patients. J Urol 2002; 167: 528-534.
43. Han M, Partin AW, Pound CR et al.: Long-term biochemical disease-free and cancer specific survival following anatomic radical retropubic prostatectomy. The 15-year Jpohns Hopkins experience. Urol Clin North Am 2001; 28: 555-565.
44. Szopiński T, Dobruch J, Chłosta PL et al.: Leczenie farmakologiczne łagodnego rozrostu stercza. Postępy Nauk Medycznych 2012; 25: 362-370.
45. Szopiński T, Chłosta P, Borówka A et al.: Wyniki leczenia nietrzymania moczu z użyciem sztucznego zwieracza cewki moczowej. Postępy Nauk Medycznych 2012; 25: 325-334.
46. Epstein J, Walsh P, Carmichael M et al.: Pathologic and clinical findings to predict tumor extent of nonpalpable (stage T1c) prostate cancer. JAMA 1994; 271: 368-374.
47. Poissonnier L, Chapelon JY, Rouviere O et al.: Control of prostate cancer by transrectal HIFU in 227 patients. Eur Urol 2007; 51: 381-387.
48. Dybowski B: Degareliks – antagonista LHRH w terapii zaawansowanego raka stercza. Przegl Urol 2011; 12 (5/69): 42-44.
49. Nair B, Wilt T, MacDonald R et al.: Early versus deferred androgen suppression in the treatment of advanced prostatic cancer. Cochrane Database Syst Rev 2002; (1):CD003506.
50. Studer UE, Wheelan P, Albrecht W et al.: Immediate or deferred androgen deprivation for patients with prostate cancer not suitable for local treatment with curative intent. EORTC Trial 30891. J Clin Oncol 2006; 24: 1868-1876.
51. Borówka A, Antoniewicz A, Chłosta P: Leczenie przerzutów nowotworowych do kości u chorych na raka gruczołu krokowego. [W:] Pawicki M (red.): Przerzuty nowotworowe do kości – nowe kierunki leczenia. Bielsko Biała: Alfa Medica Press 2004; 116-160.
52. Smith MR, Egerdie B, Hernández Toriz N et al.: Denosumab HALT Prostat6e Cancer Study Group. Denosumab in men receiving androgen-depriovation therapy for prostate cancer. N Engl J Med 2009; 361: 745-755.




