© Borgis - Postępy Nauk Medycznych 4/2012, s. 311-319
*Michał Andrzej Skrzypczyk1, Gerard Grothuss2, Jakub Dobruch1, Piotr L. Chłosta1, Andrzej Borówka1
Rak pęcherza moczowego w Polsce
Bladder cancer in Poland
1Klinika Urologii Centrum Medycznego Kształcenia Podyplomowego, Oddział Urologii Europejskiego Centrum Zdrowia w Otwocku
Kierownik Kliniki: prof. dr hab. med. Andrzej Borówka
2Oddział Urologii Międzyleskiego Szpitala Specjalistycznego w Warszawie
Ordynator Oddziału: dr med. Artur A. Antoniewicz
Streszczenie
Wstęp. Rak pęcherza moczowego (BCa) zajmuje 3 miejsce u mężczyzn i 15 miejsce u kobiet, pod względem zapadalności wśród wszystkich nowotworów złośliwych w Polsce. Koszty postępowania diagnostycznego i leczenia oraz koszty obserwacji po leczeniu BCa są większe od kosztów rozpoznania, leczenia i obserwacji chorych dotkniętych innymi nowotworami. Bezpośredni wpływ na niezadowalające wyniki leczenia BCa ma zbyt późne rozpoznanie choroby, spowodowane nierzadko upływem nadmiernie długiego czasu od wystąpienia objawów do momentu zidentyfikowania guza. Wobec braku danych dotyczących stopnia zaawansowania BCa w momencie rozpoznania w Polsce oraz czasu, jaki upływa od wystąpienia pierwszych objawów choroby do rozpoczęcia leczenia, podjęliśmy badania mające na celu choćby częściowe wyjaśnienie tej kwestii.
Materiał i metody. Analizowno retrospektywnie dane 576 chorych, poddanych leczeniu z powodu pierwotnego raka pęcherza moczowego w latach 2003-2009 w Klinice Urologii CMKP oraz w roku 2009 w Dziale Urologii Świętokrzyskiego Centrum Onkologii w Kielcach, Klinice Urologii Collegium Medicum w Bydgoszczy Uniwersytetu Mikołaja Kopernika w Toruniu i Oddziału Urologii Szpitala im. Dr. Biziela w Bydgoszczy.
Wyniki. U 444 (77%) chorych stwierdzono raka nieprzekraczającego błony podśluzowej (N-MIBCa – ≤ T1), u pozostałych 132 (23%) – guz naciekał błonę mięśniową (MIBCa – ≥ T2). Krwiomocz był objawem wiodącym u 410 (71%) chorych. U 62 (11%) chorych zwiastunem BCa były dolegliwości dyzuryczne, zupełne zatrzymanie moczu, ból w dole brzucha lub cechy biochemiczne przewlekłej niewydolności nerkowej, bądź cechy laboratoryjne niedokrwistości. U 104 (18%) guz pęcherza rozpoznano przypadkowo. Mediana czasu, jaki upłynął od wystapienia pierwszych objawów do rozpoznania raka wyniosła odpowiednio 60; 60 i 90 dni dla grup niskiego, pośredniego i wysokiego ryzyka NMIBC. W grupie MIBC wyniosła 90 dni. U 181 (41%) chorych z NMIBC i 78 (59%) MIBC, raka rozpoznano po upływie ponad 12 tygodni od wystąpienia pierwszych objawów. U 52 (11,7%) chorych na NMIBC i 35 (26,5%) na MIBC raka rozpoznano po upływie ponad 6 miesięcy od wystąpienia pierwszych objawów.
Wnioski. Czas upływający od wystąpienia objawów sugerujących istnienie raka pęcherza moczowego do momentu rozpoznania nowotworu jest w naszym kraju zbyt długi.
Summary
Introduction. Bladder cancer (BCa) is 3rd most common cancer in men and 15th in women in Poland. The costs of bladder cancer treating from diagnosis until the death of patient is highest among all cancers. Prolonged time from the moment of first symptoms occurrence to the diagnosis of BCa probably negatively influent treatment results. The lack of evidence concerning the length of time from first BCa symptoms occurrence to diagnosis in Poland inspired us to investigate this problem.
Matherial and methods. The data of 576 patients (pts) treated due to primary BCa in 2003-2009 in our department and in 2009 in Department of Urology Holly Cross Oncological Centre; Clinical Dep. of Urology in Collegium Medicum in Bydgoszcz and in Dep. of Urology Biziel’s Hospital in Bydgoszcz.
Results. Non-muscle invasive bladder cancer(NMIBC) was diagnosed in 444 (77%) pts while muscle invasive bladder cancer(MIBC) in 132 (23%) pts. Hematuria was the main symptom of BCa in 410 (71%) pts. Other symptoms like dysuria, urinary retention, pain, biochemical features of renal insufficiency or anemia were primary symtoms in 62 (11%) pts. In 104 (18%) pts BCa was diagnosed incidentally. Median time from first symptoms occurrence to diagnosis for NMIBC of low, medium and high groups of progression and recurrence were 60; 60 and 90 days respectively. For pst diagnosed with MIBC it was 90 days. In 181 (41%) NMIBC pts and 78 (59%) MIBC pts BCa was diagnosed after 12 weeks since first symptoms. 52 (11,7%) NMIBC pts and 35 (26,5%) MIBC pts were diagnosed with BCa after 6 months since first symptoms occurrence.
Conclusions. The time passing since first symptoms of BCa reveled until the final diagnosis in Poland is definitely too long.

Wstęp
Dominującą postacią patomorfologiczną raka pęcherza moczowego (BCa – bladder cancer) jest rak przejściowonabłonkowy (TCC – transitional cell carcinoma). Stanowi on około 85% wszystkich raków pęcherza. Pozostałymi są rak płaskonabłonkowy (SCa – squamous carcinoma) oraz rak gruczołowy (ACa – adenocarcinoma). Czynnikami usposabiającymi do wystąpienia TCC są: ekspozycja na aminy aromatyczne (1), palenie tytoniu (2), przy czym zaniechanie palenia tytoniu przez osoby, u których wykryto BCa przyczynia się do zmniejszenia ryzyka zgonu z powodu tego nowotworu (3). Do czynników ryzyka o charakterze jatrogennym zalicza się chemioterapię systemową z użyciem cyklofosfamidu (4) oraz radioterapię obejmującą narządy miednicy (5), jednak okres od czasu jej zakończenia do czasu wystąpienia BCa wynosi od 15 do 30 lat (6). Najczęstszym, choć nierzadko bagatelizowanym objawem guza pęcherza jest krwiomocz, zwłaszcza ze skrzepami, któremu na ogół nie towarzyszą inne objawy ani dolegliwości ze strony dolnych dróg moczowych. Niekiedy istnieniu guza pęcherza towarzyszy dyzuria. Zapadalność na BCa w różnych obszarach Europy jest odmienna (ryc. 1) (7). Liczba nowych rozpoznań raka pęcherza moczowego (BCa – bladder cancer) w Polsce w 2008 roku wyniosła 5,820. Nowotwór ten pod względem zapadalności zajmuje 3 miejsce u mężczyzn i 15 miejsce u kobiet wśród wszystkich nowotworów złośliwych (tab. 1) (8).
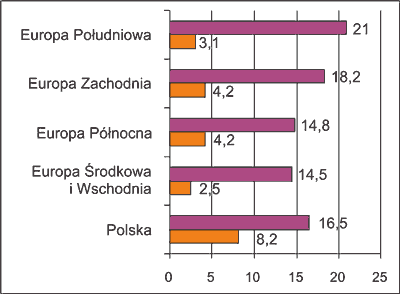
Ryc. 1. Współczynniki standaryzowane zapadalności mężczyzn (słupki ciemnoszare) i kobiet (słupki jasnoszare) na raka pęcherza moczowego w Polsce na tle danych dotyczących różnych części Eruropy (7).
Tabela 1. współczynniki standaryzowane zapadalności mężczyzn na najczęściej występujące nowotwory złośliwe w Polsce w 2008 roku (8).
| Rak | Współczynnik standaryzowany zapadalności/100 tys. |
| Płuca | 52,2 |
| Stercza | 29,9 |
| Pęcherza moczowego | 16,5 |
| Okrężnicy | 15,7 |
| Skóry | 14,7 |
| Żołądka | 12,0 |
| Odbytnicy | 11,8 |
| Nerki | 9,6 |
W tym samym roku zarejestrowano 3,007 zgonów z powodu BCa. Liczba chorych na ten nowotwór stanowi w naszym kraju 6% wszystkich chorych dotkniętych nowotworami złośliwymi oraz około 30% chorych na nowotwory układu moczowego i męskich narządów płciowych. Zapadalność mężczyzn na BCa jest 4-krotnie większa od zapadalności kobiet (9). Koszty postępowania diagnostycznego i leczenia oraz koszty obserwacji po leczeniu BCa są większe od kosztów rozpoznania, leczenia i obserwacji chorych dotkniętych rakiem jelita grubego, rakiem piersi, rakiem stercza lub rakiem płuca (10). Analizy przeprowadzone w USA wykazały, że średni roczny koszt leczenia raka pęcherza moczowego u jednego chorego wynosi około 65 tys. USD, co w połączeniu ze wzrostem liczby zachorowań (ryc. 2) o ponad 80% w latach 1991-2008 sprawia, że rak pęcherza moczowego jest coraz większym obciążeniem dla systemu opieki zdrowotnej (11).
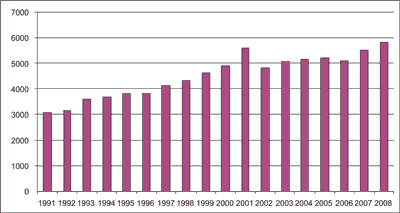
Ryc. 2. Liczby nowych rozpoznań raka pęcherza moczowego w Polsce w latach 1991-2008.
Według (8) oraz www.onkologia.org.pl
Zasadniczym czynnikiem warunkującym wybór sposobu leczenia BCa jest stopień klinicznego zaawansowania guza w chwili rozpoznania (tab. 2). Pod tym względem odróżnia się raka nienaciekającego błony mięśniowej pęcherza, zwanego dawniej rakiem powierzchownym (N-MIBCa – non muscle invasive BCa) oraz raka naciekającego błonę mięśniową pęcherza (MIBCa – muscle invasive BCa), przy czym pierwszy z nich stanowi nie mniej niż 75% wszystkich nowo rozpoznanych TCCs pęcherza (7).
Tabela 2. Klasyfikacja stopnia zaawansowania (T) guza pęcherza moczowego (TNM – WHO, 2009 r.).
| Guzy nienaciekające błony mięśniowej pęcherza |
| Ta | Nieinwazyjny rak brodawkowy |
| Tis | Rak śródnabłonkowy („guz płaski”) |
| T1 | Guz nacieka podnabłonkową tkankę łączną |
| Guzy naciekające błonę mięśniową pęcherza |
| T2a | Guz nacieka błonę mięśniową powierzchownie |
| T2b | Guz nacieka błonę mięśniową głęboko |
| T3a | Guz nacieka tkankę okołopęcherzową (naciekanie ma charakter mikroskopowy) |
| T3b | Guz nacieka tkankę okołopęcherzową (naciekanie ma charakter makroskopowy) |
| T4a | Guz nacieka stercz lub macicę, bądź pochwę |
| T4b | Guz nacieka ścianę miednicy lub ścianę brzucha |
Niezwykle istotną cechą BCa jest jego złośliwość (G – grade), określana tradycyjnie według kryteriów WHO z 1973 r., lub ostatnio również według kryteriów WHO z 2004 r. (ryc. 3).
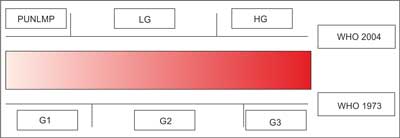
Ryc. 3 Porównanie stopni złośliwości TCC pęcherza moczowego określanych według kryteriów WHO z 1973 r. i z 2004 r. (PUNLMP – papillary urothelial neoplasm of low malignant potential/nowotworzenie o małym potencjale złośliwości w obrębie nabłonka przejściowego/dawniej: brodawczak; LG – low grade/mała złośliwość; HG – high grade/duża złośliwość; G1 – mała złośliwość, G2 – umiarkowana złośliwość, G3 – duża złośliwość).
Rak naciekający błonę mięśniową pęcherza stanowi wskazanie do radykalnego wycięcia pęcherza (RC – radical cystectomy). Zasadniczą metodą leczenia N-MIBCa jest elektroresekcja przezcewkowa guza (TURBT – transurethjral resection of the bladder tumor), polegająca na wycięciu kolejno egzofitycznej części guza oraz tkanek z dna i obrzeża resekcji. Jeśli badanie histopatologiczne materiału tkankowego pochodzącego z „frakcjonowanej” TURBT wykazuje guz umiarkowanego lub dużego ryzyka, bądź jeśli wynik tego badania pod względem oceny stopnia zaawansowania nowotworu nie jest pewny, po upływie 4-6 tygodni od pierwszej TURBT wykonuje się ponowną resekcję przezcewkową obszaru objętego resekcją pierwotną (re-TUR). Kolejna cystoskopia wykonana w ramach re-TUR ujawnia, że pierwsza TURBT była niedoszczętna aż u 35-55% chorych (12-14), zaś badanie H-P materiału pochodzącego z re-TUR ujawnia większe zaawansowanie miejscowe guza aż 4-25% chorych (15-18). Ryzyko nawrotu i progresji po przezcewkowym wycięciu N-MIBCa można ocenić na podstawie cech guza pierwotnego (19) (tab. 3), stosując jeden z systemów kalkulacyjnych dostępnych w Internecie. W Europie najpowszechniej wykorzystuje się „bladder calculator” (http://www.eortc.be/tools/bladdercalculator).
Tabela 3. Podstawy systemu kalkulacyjnego (EORTC bladder calculator) stosowanego do szacowania ryzyka nawrotu i progresji po przezcewkowym wycięciu guza nienaciekającego błony mięśniowej pęcherza moczowego.
| Cecha | Liczba punktów |
| Nawrót | Progresja |
| Liczba guzów | Pojedynczy | 0 | 0 |
| 2-7 | 3 | 3 |
| > 7 | 6 | 3 |
| Średnica guza | < 3 cm | 0 | 0 |
| ≥ 3 cm | 3 | 3 |
| Wcześniejsze nawroty | Guz pierwotny | 0 | 0 |
| ≤ 1/rok | 2 | 2 |
| > 1/rok | 4 | 4 |
| Kategoria T | Ta | 0 | 0 |
| T1 | 1 | 4 |
| Współistnienie CIS | Nie | 0 | 0 |
| Tak | 1 | 6 |
| Stopień złośliwości | G1 | 0 | 0 |
| G2 | 1 | 0 |
| G3 | 2 | 5 |
| Suma punktów | 0-17 | 0-23 |
| Stopień ryzyka | Mały | 0 | 0 |
| Umiarkowany | 2-4 | 2-6 |
| Duży | ≥ 5 | > 7 |
Występowanie nawrotów i progresji N-MIBCa, uzależnione od stopnia ryzyka guza pierwotnego oraz guzów nawrotowych, stwarza konieczność ścisłego obserwowania chorych po pierwotnej TURBT. Obserwacja oparta jest na sekwencyjnym wykonywaniu cystoskopii, badań obrazowych, badania cytologicznego osadu moczu, z czym wiążą się duże nakłady finansowe. Do progresji N-MBCa dużego ryzyka, zmuszającej do zastosowania radykalnego leczenia chirurgicznego, dochodzi w ciągu pierwszego roku po TURBT u 17% chorych, w ciągu 5 lat u 45% chorych. Raka zaawansowanego miejscowo (MIBCa) w momencie rozpoznania stwierdza się u ≤ 30% (20). Przeżycie 5-letnie chorych poddanych cystektomii radykalnej wynosi prawie 60% (21, 22).
Bezpośredni wpływ na niezadowalające wyniki leczenia BCa ma zbyt późne rozpoznanie choroby, spowodowane nierzadko upływem nadmiernie długiego czasu od wystąpienia objawów do momentu zidentyfikowania guza. Wobec braku danych dotyczących stopnia zaawansowania BCa w momencie rozpoznania w Polsce oraz czasu, jaki upływa od wystąpienia pierwszych objawów choroby do rozpoczęcia leczenia, podjęliśmy badania mające na celu choćby częściowe wyjaśnienie tej kwestii.
Cel
Celem badania jest określenie typu patomorfologicznego, stopnia zawansowania i złośliwości raka pęcherza moczowego, a także określenie czasu, jaki upływa od wystąpienia pierwszych objawów nowotworu do ustalenia rozpoznania i zastosowania leczenia.
Materiał i metody
Badanie przeprowadzono w czterech ośrodkach urologii (tab. 4). Polegało ono na analizie retrospektywnej danych 576 „kolejnych” chorych leczonych z powodu pierwotnego BCa.
Tabela 4. Chorzy objęci analizą.
| Ośrodek | Okres, w którym rozpoznano BCa | Liczba chorych | Odsetek (%) |
| 1. | 2003 r.-2009 r. | 414 | 72 |
| 2. | 2009 r. | 38 | 6,5 |
| 3. | 2009 r. | 53 | 9,2 |
| 4. | 2009 r. | 71 | 12,3 |
| Razem | | 576 | 100 |
1. Klinika Urologii CMKP, I. Zespół Dydaktyki Urologicznej – Oddział Urologii Międzyleskiego Szpitala Specjalistycznego;
2. Dział Urologii Świętokrzyskiego Centrum Onkologii w Kielcach;
3. Klinika Urologii Collegium Medicum w Bydgoszczy Uniwersytetu Mikołaja Kopernika w Toruniu;
4. Oddział Urologii Szpitala im. Dr. Biziela w Bydgoszczy. |
Cechy patomorfologiczne raków nienaciekających błony mięśniowej (N-MIBCa) określono na podstawie retrospektywnej analizy wyników badania histopatologicznego materiału tkankowego pochodzącego z TURBt. Ostateczna ocena stopnia zaawansowania i złośliwości BCa u chorych, u których wykonano re-TUR oparta była na wynikach zarówno pierwszej, jak i drugiej elektroresekcji, przy czym jeśli po re-TUR stwierdzono większe zaawansowanie i złośliwość guza, uwzględniono je w ocenie ostatecznej. Do oceny T i G raka pęcherza zaawansowanego miejscowo (MIBCa) wykorzystano wyniki badań patomorfologicznych materiału pochodzącego z cystektomii radykalnej. Jednak, jeśli badanie specymenu operacyjnego nie wykazało istnienia guza pęcherza lub jeśli chory nie był poddany cystekomii radykalnej, ocenę T i G raka oparto na wyniku badania wykonanego po TURBT.
Wyniki
Grupę chorych stanowiło 447 (78%) mężczyzn i 129 (22%) kobiet. Mediana ich wieku wynosiła 69 (29--102) lat. Pierwotny BCa miał charakter raka przejściowonabłonkowego (TCC) u 568 (98,6%) chorych. Raka płaskonabłonkowego lub gruczołowego rozpoznano u 8 (1,4%) chorych.
Dominującym objawem BCa był krwiomocz. Wystąpił on jednorazowo lub miał charakter ciągły, bądź nawracający u 410 (71%) chorych. U 62 (11%) chorych zwiastunem BCa były dolegliwości dyzuryczne, zupełne zatrzymanie moczu, ból w dole brzucha lub cechy biochemiczne przewlekłej niewydolności nerkowej, bądź cechy laboratoryjne niedokrwistości. U 104 (18%) guz pęcherza rozpoznano przypadkowo na podstawie badań obrazowych (zwykle ultrasonografii) przeprowadzonych z powodu dolegliwości lub objawów nie sugerujących choroby układu moczowego (tab. 5)
U 444 (77%) chorych stwierdzono raka nieprzekraczającego błony podśluzowej (N-MIBCa – ≤ T1), u pozostałych – w tym u wszystkich chorych na raka płaskonabłonkowego lub gruczołowego – guz naciekał błonę mięśniową (MIBCa – ≥ T2).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Delclos GL, Lerner SP: Occupational risk factors. Scand J Urol Nephrol 2008; 218 (suppl): 58-63.
2. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Tobacco smoke and involuntary smoking. IARC Monogr Eval Carcinog Risks Hum 2004; 83: 1-1438.
3. Bjerregaard BK, Raaschou-Nielsen O, S?rensen M et al.: Tobacco smoke and bladder cancer--in the European Prospective investigation into Cancer and Nutrition. Int J Cancer 2006; 119(10): 2412-6.
4. Nilsson S, Ullén A: Chemotherapy-induced bladder cancer. Scand J Urol Nephrol Suppl. 2008; 218: 89-92.
5. Yee DS, Shariat SF, Lowrance WT et al.: Impact of previous radiotherapy for prostate cancer on clinical outcomes of patients with bladder cancer. J Urol 2010; 183: 1751-6.
6. Brenner DJ, Curtis RE, Hall EJ et al.: Second malignancies in prostate carcinoma patients after radiotherapy compared with surgery. Cancer 2000; 88(2): 398-406.
7. Colombel M, Soloway M, Akaza H et al.: Epidemiology, Staging, Grading, and Risk Stratification of Bladder Cancer Eur Urol Suppl 2008; 7 (618-626).
8. Wojciechowska U, Didkowska J, Zatoński W: Nowotwory złośliwe w Polsce w 2008 roku. Warszawa, Krajowy Rejestr Nowotworów 2010; p. 44-45.
9. Borówka A: Rak pęcherza moczowego w Polsce. Przegl Urol 2011; 2 (66): 6-9.
10. Hong M, Loughlin KR: Economic impact of tumor markers In bladder cancer surveillance. Urology 2008; 71: 131-5.
11. Avritscher EBC, Cooksley CD: Clinical model of lifetime cost of treating bladder cancer and associated complications. Urology 2006; 68: 549-53.
12. Brausi M, Collette L, Kurth K et al.: EORTC Genito-Urinary Tract Cancer Collaborative Group. Variability in the recurrence rate at first follow-up cystoscopy after TUR in stage Ta T1 transitional cell carcinoma of the bladder: a combined analysis of seven EORTC studies. Eur Urol 2002; 41: 523-31.
13. Miladi M, Peyromaure M, Zerbib M et al.: The value of a second transurethral resection in evaluating patients with bladder tumours. Eur Urol 2003; 43(3): 241-5. Review.
14. Divrik RT, Yildirim U, Zorlu F et al.: The effect of repeat transurethral resection on recurrence and progression rates in patients with T1 tumors of the bladder who received intravesical mitomycin: a prospective, randomized clinical trial. J Urol 2006; 175: 1641-4.
15. Dalbagni G, Vora K, Kaag M et al.: Clinical outcome in a contemporary series of restaged patients with clinical T1 bladder cancer. Eur Urol 2009; 56: 903-10.
16. Fritsche HM, Burger M, Svatek RS et al.: Characteristics and outcomes of patients with clinical T1 grade 3 urothelial carcinoma treated with radical cystectomy: results from an international cohort. Eur Urol 2010; 57: 300-9.
17. Herr HW: The value of a second transurethral resection in evaluating patients with bladder tumors. J Urol 1999; 162: 74-6.
18. Husiatyński W: Znaczenie wczesnej, ponownej elektroresekcji guza pęcherza moczowego (re-TURbt) dla prawidłowego rozpoznania stopnia zaawansowania miejscowego i leczenia powierzchownego raka pęcherza grupy średniego ryzyka. Urol Pol 2005; 58: Suplement 1.
19. Sylvester RJ, van der Meijden AP, Oosterlinck W et al.: Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol 2006;49: 466-5.
20. Vaidya A, Soloway MS, Hawke C et al.: De novo muscle invasive bladder cancer: is there a change in trend? J Urol 2001; 165: 47-50.
21. Shariat SF, Karakiewicz PI, Palapattu GS et al.: Outcomes of radical cystectomy for transitional cell carcinoma of the bladder: a contemporary series from the Bladder Cancer Research Consortium. J Urol 2006; 176: 2414-22.
22. Millan-Rodriguez F, Chechile-Toniolo G, Salvador-Bayarri J et al.: Primary superficial bladder cancer risk groups according to progression, mortality and recurrence. J Urol 2000;164: 680-4.
23. Lee R, Droller MJ: The natural history of bladder cancer; implications for therapy. Urol Clin North Am 2000; 27: 1-13.
24. World Health Organization. World cancer report, 2003. Lyon, France: IARC Press 2003; p. 229.
25. Jones JS, Larchian WA: Non-muscle invasive bladder cancer (Ta, T1, and CIS). [In:] Campbell’s-Walsh Urology 2011; 2335-2354.
26. Babjuk M, Oosterlinck W, Sylvester R et al.: Guidelines on non-muscle invasive bladder cancer (TaT1 and CIS). European Association of Urology Guidelines 2011.
27. Sobin DH, Wittekind Ch: TNM Classification of Malignant Tumours. New York, Wiley-Liss 2002; 199-202.
28. Heney NM: Natural history of superficial bladder cancer: prognostic features and long-term disease course. Urol Clin North Am 1992; 19: 429-33.
29. Kirkali Z, Chan T, Manoharan M et al.: Bladder cancer: epidemiology, staging and grading, and diagnosis. Urology 2005; 66 (Suppl. 6A): 4-34.
30. Sylvester RJ, Oosterlink W, van der Meijden AP et al.: A single immediate postoperative instillation of chemotherapy decreases the risk of recurrence in patients with stage TaT1 bladder cancer: a metaanalysis of published results of randomized clinical trials. J Urol 2004; 171: 2186-90.
31. Dobruch J, Herr H: Should all patients receive single chemotherapeutic agent instillation after bladder tumour resection? BJU Int 2009; 104 (2): 170-174.
32. Gudjónsson S, Adell L, Merdasa F et al.: Should all patients with non-muscle-invasive bladder cancer receive early intravesical chemotherapy after transurethral resection? The results of a prospective randomised multicentre study. Eur Urol 2009; 55: 773-80.
33. Morales A, Eidinger D, Bruce AW: Intracavitary Bacillus Calmette-Guerin in the treatment of superficial bladder tumors. J Urol 1976; 116: 180-3.
34. Gore JL, Lai J, Setodji CM et al.: Urologic Diseases in America Project: Mortality increases when radical cystectomy is delayed more than 12 weeks: results from a Surveillance, Epidemiology, an End Results-Medicare analysis. Cancer 2009; 115: 988-96.
35. Vaidyanathan S, Soni BM, Singh G et al.: Delay in diagnosis of cancer as a patient safety issue – a root cause analysis based on a representative case report. Patient Saf Surg 2011; 29: 19-24.
36. Hautmann RE: Delay of cystectomy: for whom does it really matter? Curr Urol Rep 2007; 8: 425-6.
37. Svatek RS, Avritscher EB, Elting L et al.: High risk population and cystectomy outcomes. J Urol 2009; 182: 10-1.



