Niedobór witaminy D wydaje się być powszechny i szacowany jest na 30% do 50% populacji ogólnej w krajach Europy i USA (1, 2). Tradycyjnie, hipowitaminozę D wiąże sie z krzywicą u dzieci oraz osteomalacją i osteoporozą u dorosłych. Jednakże obecność receptorów dla witaminy D wykazano w szeregu innych komórek i tkanek poza układem kostnym, w tym w komórkach układu immunologicznego, nerwowych, komórkach beta trzustki, komórkach endotelium naczyniowego i miocytach, w tym komórkach mięśnia sercowego (1, 4). Istnieje także coraz większa liczba dowodów wskazujących na potencjalny niekorzystny wpływ niedoboru witaminy D na ryzyko rozwoju szeregu chorób, w tym niektórych nowotworów, a także chorób metabolicznych i układu sercowo-naczyniowego, co w konsekwencji wiąże stan zaopatrzenia w witaminę D ze wskaźnikami przeżywalności ogólnej (1, 2, 5-7).
Witamina D, zarówno pochodząca z pożywienia, jak syntetyzowana w skórze, jest następnie hydroksylowana w wątrobie do 25-hydroksywitaminy D (25OHD), która z kolei stanowi substrat do syntezy aktywnej biologicznie 1,25-dwuhydroksywitaminy D (kalcitriol, 1,25(OH)2D) (1, 2, 4). Jednocześnie, chociaż 1,25(OH)2D stanowi aktywną biologicznie formę witaminy D, jej stężenie w surowicy nie koreluje ze stanem rzeczywistego zaopatrzenia organizmu w witaminę D, które znacznie lepiej odzwierciedlane jest przez stężenie 25OHD w surowicy (8). Chociaż witamina D była przez dekady klasyfikowana jako witamina, nie budzi obecnie wątpliwości, że kalcitriol jest aktywnym hormonem, przenoszonym drogą krwi i działającym jako ważny czynnik transkrypcyjny w szeregu komórek, tkanek i układów, w tym znacząco oddziałującym na funkcje układu sercowo-naczyniowego (4, 10). Witamina D pośrednio lub bezpośrednio oddziałuje regulacyjnie na szereg genów, w tym na produkcję reniny przez nerki, insuliny przez komórki β trzustki, wzrost i proliferację mięśni gładkich naczyń i serca, a także na czynność limfocytów i makrofagów oraz aktywność układu immunologicznego.
Optymalne zaopatrzenie w witaminę D, określane jako stężenie 25OHD w surowicy, nie zostało dotychczas jednoznacznie określone, jednak wydaje się, że poniżej stężenia 30 ng/ml (75 nmol/l) częstość niekorzystnych zdarzeń zdrowotnych, takich jak upadki, złamania kości czy zapadalność na raka jelita grubego, zaczyna znamiennie wzrastać (5). Jednocześnie, zwraca się obecnie uwagę, że zależność różnorodnych wskaźników zdrowotnych od stężenia 25OHD nie musi być liniowa, a raczej „U-kształtna”, zaś zbyt wysokie stężenie 25OHD może wiązać się ze wzrostem zagrożenia niektórymi nowotworami (zwłaszcza rakiem trzustki), upadkami, złamaniami kości, a także wzrostem ryzyka sercowo-naczyniowego i śmiertelności ogólnej (7). Dane pochodzące z badania epidemiologicznego The Third National Health and Nutrition Survey (NHANES III) wykazały u około 5% mieszkańców USA ciężki niedobór witaminy D (< 10 ng/ml), a u około 60% niedostateczne zaopatrzenie w witaminę D (< 25 ng/ml) (11).
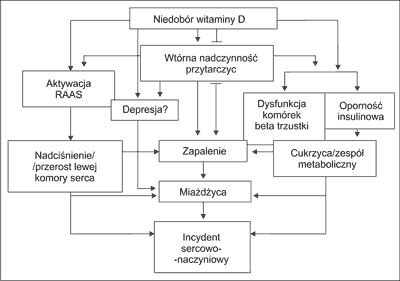
Zaburzenia czynności układu renina-angiotensyna--aldosteron (RAAS) leżą u podstaw patogenezy większości chorób sercowo-naczyniowych (1, 2, 10, 20). Witamina D pełni istotną rolę w regulacji układu RAAS, zaś jej niedobór predysponuje do wzrostu aktywności RAAS, a także przerostu mięśniówki gładkiej naczyń i lewej komory serca (ryc. 1) (10, 21, 22). U ludzi, 1,25(OH)2D hamuje wydzielanie reniny i prawdopodobnie może obniżać ciśnienie krwi; w pojedynczym badaniu wykazano, że naświetlania UVB do niewielkiego rumienia, 3 x w tygodniu przez 3 miesiące, spowodowały blisko 200% wzrost stężenia 25OHD w surowicy i skorelowany z nim spadek ciśnienia skurczowego i rozkurczowego średnio o 6 mmHg (23). Ponadto, witamina D bezpośrednio wpływa na czynność komórek endothelium naczyniowego, powodując wazodilatację (24-26). W badaniu NHANES III średnie ciśnienie skurczowe było o 3 mm niższe u osób, u których stężenie 25OHD surowicy zawierało się w najwyższym kwartylu, w porównaniu z grupą ze stężeniami 25OHD z najniższego kwartyla (27).
Ryc. 1. Potencjalne mechanizmy oddziaływania niedoboru witaminy D na układ sercowo-naczyniowy (wg American College of Cardiology Foundation, 2011).
1. Lee JH, O’Keefe JH, Bell D et al.: Vitamin D deficiency: an important, common, and easily treatable cardiovascular risk factor? J Am Coll Cardiol 2008; 52: 1949-1956.
2. Abuannai M, O’Keefe JH: Vitamin D and cardiovascular health Primary Care Cardiovasc J 2011; 4: 59-62.
3. Looker AC, Johnson CL, Lacher DA et al.: Vitamin D status: United States, 2001-2006 NCHS Data Brief 2011; (59): 1-8.
4. Holick MF: Vitamin D deficiency N Engl J Med 2007; 357: 266-281.
5. Bischoff-Ferrari HA, Giovannucci E, Willett WC et al.: Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes Am J Clin Nutr 2006; 84: 18-8.
6. Gandini S, Boniol M, Haukka J et al.: Meta-analysis of observational studies of serum 25-hydroxyvitamin D levels and colorectal, breast and prostate cancer and colorectal adenoma Int J Cancer 2011; 128: 1414-1424.
7. Helzlsouer KJ: VDPP Steering Committee Overview of the Cohort Consortium Vitamin D Pooling Project of Rarer Cancers Am J Epidemiol 2010; 172: 4-9.
8. Mosekilde L: Vitamin D requirement and setting recommendation levels: long-term perspectives Nutr Rev 2008; 66(Suppl 2): 170-177.
9. Holden JM, Lemar LE: Assessing vitamin D contents in foods and supplements: challenges and needs Am J Clin Nutr 2008; (Suppl. 88): 551-553.
10. Zittermann A: Vitamin D and disease prevention with special reference to cardiovascular disease Prog Biophys Mol Biol 2006; 92: 39-48.
11. Looker AC, Dawson-Hughes B, Calvo MS et al.: Serum 25-hydroxyvitamin D status of adolescents and adults in two seasonal subpopulations from NHANES III Bone 2002; 30: 771-777.
12. Clemens TL, Adams JS, Henderson SL, Holick MF: Increased skin pigment reduces the capacity of skin to synthesise vitamin D3 Lancet 1982; 1: 74-76.
13. Blum M, Dolnikowski G, Seyoum E et al.: Vitamin D(3) in fat tissue Endocrine 2008; 33: 90-94.
14. Cheng S, Massaro JM, Fox CS et al.: Adiposity, cardiometabolic risk, and vitamin D status: the Framingham Heart Study Diabetes 2010; 59: 242-248.
15. Rajakumar K, Fernstrom JD, Holick MF et al.: Vitamin D status and response to vitamin D(3) in obese vs. non-obese African American children Obesity (Silver Spring) 2008; 16: 90-95.
16. Binkley N, Novotny R, Krueger D et al.: Low vitamin D status despite abundant sun exposure J Clin Endocrinol Metab 2007; 92: 2130-2135.
17. Fiscella K, Franks P: Vitamin D, race, and cardiovascular mortality: findings from a national US sample Ann Fam Med 2010; 8: 11-18.
18. Wang TJ, Zhang F, Richards JB et al.: Common genetic determinants of vitamin D insufficiency: a genome-wide association study Lancet 2010; 376: 180-188.
19. Pittas AG, Chung M, Trikalinos T et al.: Systemic review: vitamin D and cardiometabolic outcomes Ann Intern Med 2010; 152: 307-314.
20. Li YC, Kong J, Wei M et al.: 1,25-Dihydroxyvitamin D(3) is a negative endocrine regulator of the renin-angiotensin system J Clin Invest 2002; 110: 229-238.
21. Milani RV, Lavie CJ, Mehra MR et al.: Left ventricular geometry and survival in patients with normal left ventricular ejection fraction Am J Cardiol 2006; 97: 959-963.
22. Artham SM, Lavie CJ, Milani RV et al.: Clinical impact of left ventricular hypertrophy and implications for regression Prog Cardiovasc Dis 2009; 52: 153-167.
23. Krause R, Buhring M, Hopfenmuller W et al.:. Ultraviolet B and blood pressure Lancet 1998; 352: 709-710.
24. Sugden JA, Davies JI, Witham MD et al.: Vitamin D improves endothelial function in patients with type 2 diabetes mellitus and low vitamin D levels Diabetes Med 2008; 25: 320-325.
25. Borges AC, Feres T, Vianna LM, Paiva TB: Effect of cholecalciferol treatment on the relaxant responses of spontaneously hypertensive rat arteries to acetylcholine Hypertension 1999; 34: 897-901.
26. Borges AC, Feres T, Vianna LM, Paiva TB: Recovery of impaired K+ channels in mesenteric arteries from spontaneously hypertensive rats by prolonged treatment with cholecalciferol Br J Pharmacol 1999; 127: 772-778.
27. Scragg R, Sowers M, Bell C: Serum 25-hydroxyvitamin D, ethnicity, and blood pressure in the Third National Health and Nutrition Examination Survey Am J Hypertens 2007; 20: 713-719.
28. Pittas AG, Lau J, Hu FB, Dawson-Hughes B: The role of vitamin D and calcium in type 2 diabetes. A systematic review and meta-analysis. J Clin Endocrinol Metab 2007; 92: 2017-2029.
29. Hyppönen E, Läärä E, Reunanen A et al.: Intake of vitamin D and risk of type 1 diabetes: a birth-cohort study Lancet 2001; 358: 1500-1503.
30. Zipitis CS, Akobeng AK: Vitamin D supplementation in early childhood and risk of type 1 diabetes: a systematic review and meta-analysis Arch Dis Child 2008; 93: 512-517.
31. Pittas AG, Dawson-Hughes B, Li T et al.: Vitamin D and calcium intake in relation to type 2 diabetes in women Diabetes Care 2006; 29: 650-656.
32. von Hurst PR, Stonehouse W, Coad J: Vitamin D supplementation reduces insulin resistance in South Asian women living in New Zealand who are insulin resistant and vitamin D deficient: a randomized, placebo-controlled trial Br J Nutr 2010; 103: 549-555.
33. Ogard CG, Engelmann, MD, Kistorp C et al.: Increased plasma N-terminal pro-B-type natriuretic peptide and markers of inflammation related to atherosclerosis in patients with primary hyperparathyroidism Clin Endocrinol (Oxf) 2005; 63: 493-498.
34. Andersson P, Rydberg E, Willenheimer R: Primary hyperparathyroidism and heart disease a review. Eur Heart J 2004; 25: 1776-1787.
35. Soubassi LP, Chiras TC, Papadakis ED et al.: Incidence and risk factors of coronary heart disease in elderly patients on chronic hemodialysis. Int Urol Nephrol 2006; 38: 795-800.
36. Bjorkman MP, Sorva AJ, Tilvis RS: Elevated serum parathyroid hormone predicts impaired survival prognosis in a general aged population. Eur J Endocrinol 2008; 158: 749-753.
37. Libby P, Ridker PM, Hansson GK: Leducq Transatlantic Network on Atherothrombosis. Inflammation in atherosclerosis: from pathophysiology to practice. J Am Coll Cardiol 2009; 54: 2129-2138.
38. Lavie CJ, Milani RV, Verma A, O’Keefe JH: C-reactive protein and cardiovascular disease: is it ready for primetime? Am J Med Sci 2009; 338: 486-492.
39. Lavie CJ, Church TS, Milani RV, Earnest CP: Impact of physical activity, cardiorespiratory fitness, and exercise training on markers of inflammation. J Cardiopulm Rehabil Prev 2011; 31: 137-145.
40. Schleithoff SS, Zittermann A, Tenderich G et al.: Vitamin D supplementation improves cytokine profiles in patients with congestive heart failure: a double-blind, randomized, placebo-controlled trial. Am J Clin Nutr 2006; 83: 754-759.
41. Milani RV, Lavie CJ, Cassidy MM: Effects of cardiac rehabilitation and exercise training programs on depression in patients after major coronary events. Am Heart J 1996; 132: 726-732.
42. Lavie CJ, Milani RV: Adverse psychological and coronary risk profiles in young patients with coronary artery disease and benefits of formal cardiac rehabilitation. Arch Intern Med 2006; 166: 1878-1883.
43. Milani RV, Lavie CJ. Impact of cardiac rehabilitation on depression and its associated mortality. Am J Med 2007; 120: 799-806.
44. Oudshoorn C, Mattace-Raso FU, van der Velde N et al.: Higher serum vitamin D3 levels are associated with better cognitive test performance in patients with. Alzheimer’s disease. Dement Geriatr Cogn Disord 2008; 25: 539-543.
45. Kalueff A, Minasyan A, Keisala T et al.: The vitamin D neuroendocrine system as a target for novel neurotropic drugs. CNS Neurol Disord Drug Targets 2006; 5: 363-371.
46. Ganji V, Milone C, Cody MM et al.: Serum vitamin D concentrations are related to depression in young adult US population: the Third National Health and Nutrition Examination Survey. Int Arch Med 2010; 3: 29-36.
47. May HT, Bair TL, Lappé DL: Association of vitamin D levels with incident depression among a general cardiovascular population. Am Heart J 2010; 159: 1037-1043.
48. Jorde R, Sneve M, Figenschau Y et al.: Effects of vitamin D supplementation on symptoms of depression in overweight and obese subjects: randomized double blind trial. J Intern Med 2008; 264: 599-609.
49. Hoogendijk W, Lips P, Dik M et al.: Depression is associated with decreased 25-hydroxyvitamin D and increased parathyroid hormone levels in older adults. Arch Gen Psychiatry 2008; 65: 508-512.
50. Schneider B, Weber B, Frensch A et al.: Vitamin D in schizophrenia, major depression and alcoholism. J Neural Transm 2000; 107: 839-842.
51. Martiny K, Lunde M, Unden M et al.: Adjunctive bright light in non-seasonal major depression: results from clinician-rated depression scales. Acta Psychiatr Scand 2005; 112: 117-125.
52. Wang TJ, Pencina MJ, Booth SL et al.: Vitamin D deficiency and risk of cardiovascular disease. Circulation 2008; 117: 503-511.
53. Melamed ML, Michos ED, Post W, Astor B: 25-hydroxyvitamin D levels and the risk of mortality in the general population. Arch Intern Med 2008; 168: 1629-1637.
54. Dobnig H, Pilz S, Scharnagel H et al.: Independent association of low serum 25-hydroxyvitamin D and 1,25-dihydroxyvitamin D levels with all-cause and cardiovascular mortality. Arch Intern Med 2008; 168: 1340-1349.
55. Anderson JL, May HT, Horne BD et al.: Intermountain Heart Collaborative (IHC) Study Group Relation of vitamin D deficiency to cardiovascular risk factors, disease status, and incident events in a general healthcare population. Am J Cardiol 2010; 106: 963-968.
56. Giovannucci E, Liu Y, Hollis BW, Rimm EB: 25-hydroxyvitamin D and risk of myocardial infarction in men. Arch Intern Med 2008; 168: 1174-1180.
57. Lee JH, Gadi R, Spertus JA et al.: Prevalence of vitamin D deficiency in patients with acute myocardial infarction. Am J Cardiol 2011; 107: 1636-1638.
58. Autier P, Gandini S: Vitamin D supplementation and total mortality: a meta-analysis of randomized controlled trials. Arch Intern Med 2007; 167: 1730-1737.
59. Shapses SA, Manson JE: Vitamin D and prevention of cardiovascular disease and diabetes: why the evidence falls short JAMA 2011; 305: 2565-2566.
60. Elamin MB, Nisrin O, Abu E et al.: Vitamin D and cardiovascular outcomes: a systematic review and meta-analysis. J Clin Endocrinol Metab 2011; 96: 1931-1942.