© Borgis - Postępy Nauk Medycznych 4b/2015, s. 34-41
*Marta Wróblewska1, 2, 3, 4, Katarzyna Pancer5
Wirus Ebola – aktualne zagrożenia i perspektywy kontroli zakażeń
Ebola virus – current threats and perspectives for control of infections
1Zakład Mikrobiologii Stomatologicznej, Warszawski Uniwersytet Medyczny
P.o. Kierownika Zakładu: dr hab. n. med. Marta Wróblewska
2Zakład Mikrobiologii, Samodzielny Publiczny Centralny Szpital Kliniczny, Warszawa
P.o. Kierownika Zakładu: dr hab. n. med. Marta Wróblewska
3Zespół Kontroli Zakażeń Szpitalnych, Instytut Hematologii i Transfuzjologii, Warszawa
Przewodniczący Zespołu: dr hab. n. med. Marta Wróblewska
4Zespół Kontroli Zakażeń Szpitalnych, Samodzielny Publiczny Kliniczny Szpital Okulistyczny, Warszawa
Przewodniczący Zespołu: dr hab. n. med. Marta Wróblewska
5Laboratorium BSL3, Zakład Wirusologii, Narodowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny, Warszawa
Kierownik Laboratorium: dr n. med. Katarzyna Pancer
Streszczenie
W Afryce Zachodniej wirus Ebola wywołuje aktualnie epidemię trwającą już ponad rok. Przypadki choroby wywołanej przez wirus Ebola (ang. Ebola virus disease – EVD) ciągle notowane są w Gwinei, Sierra Leone i Liberii. W dniu 17.10.2014 r. Światowa Organizacja Zdrowia ogłosiła wygaszenie epidemii w Senegalu, a 19.10.2014 r. – w Nigerii. Niestety, w tym samym czasie zanotowano przypadki EVD w kolejnym kraju w tym regionie – w Mali. Zachorowania zarejestrowano też w Europie i w USA. Jednocześnie w Demokratycznej Republice Konga miała miejsce kolejna, odrębna epidemia EVD, której wygaszenie ogłoszono 21.11.2014 r.
Aktualnie liczba przypadków EVD w Afryce Zachodniej wynosi ponad 25 500, w tym ponad 10 600 zgonów (śmiertelność 41,4%). Liczba nowych zachorowań spada w Sierra Leone i Liberii, lecz w Gwinei w marcu b.r. ponownie zanotowano tendencję zwyżkową. W walce z epidemią konieczna jest znajomość patogenezy i epidemiologii tych infekcji, właściwych metod postępowania z osobami, u których zakażenie jest podejrzewane lub potwierdzone, jak również skuteczna dekontaminacja ich otoczenia. W trakcie opracowania są leki i szczepionki przeciw wirusowi Ebola.
Summary
At present the Ebola virus in West Africa is causing an epidemic lasting for over a year. Ebola virus disease (EVD) cases are being recorded in Guinea, Sierra Leone and Liberia. On October 17, 2014 the World Health Organization (WHO) declared the end of an epidemic in Senegal and on October 19, 2014 – in Nigeria. Unfortunately, at the same time cases of EVD were reported in yet another country in the region – Mali. Several cases have been reported also in Europe and the USA. In the Democratic Republic of Congo another, separate EVD epidemic took place, but ended on November 21, 2014.
At present the number of EVD cases reported in West Africa exceeds 25 500, including over 10 600 deaths (mortality rate 41.4%). To contain the epidemic it is necessary to understand the pathogenesis and epidemiology of these infections, proper methods of management of patients suspected of or diagnosed with EVD, as well as effective decontamination of their environment. Antiviral agents and vaccines against the Ebola virus are under development.

Wstęp
Od grudnia 2013 r. w Afryce Zachodniej trwa epidemia zakażeń wywoływanych przez wirus Ebola – początkowo w Gwinei, a następnie w Sierra Leone i Liberii (ryc. 1) (1). W dniu 17.10.2014 r. Światowa Organizacja Zdrowia ogłosiła wygaszenie epidemii w Senegalu, a 19.10.2014 r. – w Nigerii. Niestety, w tym samym czasie (23.10.2014 r.) zanotowano pierwszy przypadek choroby wywołanej przez wirus Ebola (ang. Ebola virus disease – EVD) w kolejnym kraju w tym regionie – w Mali (1). Zachorowania zarejestrowano też w Europie i w USA. Jednocześnie w Demokratycznej Republice Konga miała miejsce kolejna, odrębna epidemia EVD (2).
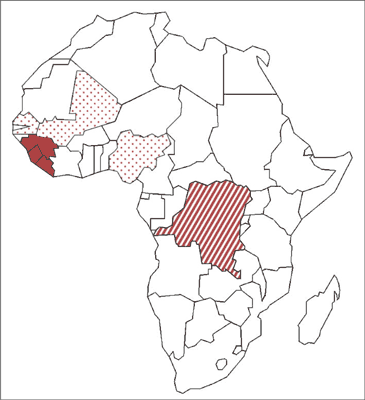
Ryc. 1. Epidemia zakażeń wirusem Ebola w 2014 r. i w 2015 r. w Afryce Zachodniej (lity kolor – ogniska zakażeń, kropki – epidemia wygaszona) i w Demokratycznej Republice Konga (paski) – epidemia wygaszona.
Źródło: opracowanie własne
Ryzyko wystąpienia zachorowania na EVD w Polsce jest znikome, jednak nie niemożliwe (3). W czasie zbierania wywiadu od chorego lub jego rodziny konieczne jest więc ustalenie, czy pacjent nie przebywał w regionie epidemii w okresie 21 dni przed wystąpieniem objawów chorobowych. Zasady postępowania z pacjentem podejrzanym o taką infekcję oraz diagnostyka laboratoryjna tego zakażenia zostały szczegółowo omówione w odrębnej publikacji (4).
Klasyfikacja wirusa Ebola
Wirus Ebola sklasyfikowany jest w obrębie rodziny Filoviridae, której nazwa pochodzi od łacińskiego słowa filus oznaczającego nić lub włókno. Wirusy te charakteryzują się unikatowym wydłużonym, „nitkowatym” kształtem cząstki o wymiarach 80 x 800-1400 nm (ryc. 2). Ich genom stanowi pojedyncza nić RNA (ssRNA) o ujemnej polarności, a nukleokapsyd otoczony jest osłonką.
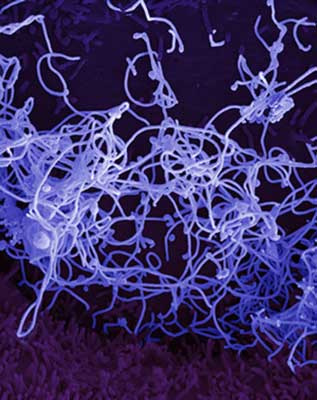
Ryc. 2. Wirus Ebola wyizolowany w listopadzie 2014 r. w laboratorium BSL-4 NIAID (National Institute of Allergy and Infectious Diseases) z próbki krwi pobranej od pacjenta w Mali.
Źródło: NIAID (National Institute of Allergy and Infectious Diseases)
Do rodziny Filoviridae zaliczane są wirusy sklasyfikowane w 3 rodzajach: Ebolavirus – EBOV, Marburgvirus – MARV (także wywołujący zakażenia u ludzi) oraz Cuevavirus (wirus Lloviu – LLOV – wyizolowany od nietoperzy w Hiszpanii, niepatogenny dla człowieka).
Pierwsza opisana epidemia wywołana przez wirus Ebola miała miejsce w 1976 r. w Zairze (obecnie: Demokratyczna Republika Konga), w pobliżu rzeki o tej nazwie. Obecnie wyróżnia się 5 gatunków wirusa Ebola: wirus Ebola-Zair (ZEBOV), wirus Ebola-Sudan (SUDV), wirus Ebola-Bundibugyo (BDBV), wirus Ebola-Ta? Forest (TAFV) – poprzednio zwany wirusem Ebola-Wybrzeże Kości Słoniowej, a także wirus Ebola-Reston (RESTV) (5). W przeciwieństwie do wirusa Ebola-Reston, który występuje w Azji i nie wywołuje objawów chorobowych u ludzi, pozostałe gatunki wirusa Ebola są chorobotwórcze dla ludzi i występowały dotąd wyłącznie w Afryce (6, 7).
Choroba wywołana przez wirus Ebola (EVD) – obraz kliniczny i epidemiologia
Choroba wywołana przez wirus Ebola, podobnie jak inne wirusowe gorączki krwotoczne (ang. viral haemorrhagic fever – VHF), cechuje się okresem wylęgania od 2 do 21 dni. W ubiegłym roku pojawiło się doniesienie o tym, że u niektórych pacjentów okres ten może być dłuższy niż 21 dni, jednak wymaga to potwierdzenia (8). Nie zmienia to zasady, że ognisko zakażeń wirusem Ebola uznaje się za wygaszone, gdy od ostatniego przypadku minie okres 42 dni (równy podwójnemu najdłuższemu okresowi wylęgania tej choroby).
Objawy chorobowe EVD najczęściej pojawiają się po upływie około 4-8 dni (9-11). Początkowo są one nieswoiste i mogą przypominać grypę, grypopodobne zakażenie górnych dróg oddechowych lub malarię powszechnie występującą na tym terenie (tab. 1) (9, 10). Choroba ma często przebieg dwufazowy – po kilku dniach pacjent może poczuć się lepiej, jednak wkrótce potem mogą dołączyć się objawy zajęcia wielu narządów wewnętrznych, a także krwawienia wewnętrzne i zewnętrzne (tab. 2).
Tabela 1. Występowanie RNA wirusa Ebola w materiałach klinicznych.
– krew
– mocz
– kał, wymaz z odbytu
– wymiociny
– ślina, plwocina
– skóra
– sperma
– pot
– wymaz ze spojówek
– łzy
– mleko kobiece
– wymaz z pochwy |
Źródło: opracowanie własne
Tabela 2. Objawy kliniczne choroby wywołanej przez wirus Ebola (EVD).
| Objawy wczesne | – podwyższona ciepłota ciała
– bóle głowy
– bóle mięśni
– znaczne osłabienie
– wymioty
– biegunka
– bóle brzucha |
| Objawy późne | – krwawienia z nosa
– krwotoczne zapalenie spojówek
– wymioty z krwią
– krew w kale
– krwawienia z miejsc wkłuć
– krwawienia z dróg rodnych
– petechie lub wynaczynienia na skórze
– wysypka skórna
– zaburzenia świadomości
– nadal trwające wymioty i biegunka |
Źródło: opracowanie własne
Wirus Ebola należy do wirusów pantropowych, zakażających śródbłonek naczyń krwionośnych oraz wiele narządów wewnętrznych. W przebiegu infekcji mogą pojawić się: zespół wykrzepiania wewnątrznaczyniowego, niewydolność wielonarządowa, wstrząs i zgon pacjenta. Śmiertelność w dotychczasowych 24 epidemiach zakażeń wirusem Ebola wahała się od 25 do 90% (7, 12).
Należy podkreślić, iż zakaźność pacjenta wzrasta w miarę trwania choroby i jest największa w terminalnej fazie oraz po śmierci chorego (13, 14). W czasie epidemii w Afryce wiele osób ulega zakażeniu w trakcie opieki nad chorym, a także w czasie rytuałów pogrzebowych osób zmarłych na EVD. Wykazano, iż miano wirusa u osób, które przeżyły, było około 100 razy niższe niż u pacjentów, którzy zmarli (15).
Uważa się, że naturalnym rezerwuarem wirusa Ebola są owocożerne nietoperze, gdyż ulegają one zakażeniu, nie wykazując objawów chorobowych (16). Od nich zakażają się zwierzęta – antylopy, małpy i gryzonie. Ludzie mogą ulec zakażeniu wskutek kontaktu z chorymi lub padłymi zwierzętami, a także w trakcie przygotowywania ich mięsa do spożycia (ang. bush meat). W warunkach epidemii dominują zakażenia człowiek-człowiek (17). Głównymi drogami szerzenia się infekcji jest kontakt błon śluzowych lub uszkodzonej skóry z krwią (np. zakłucie igłą) lub innymi płynami ustrojowymi pacjenta, jego wydalinami lub wydzielinami (13, 18, 19). Obecnie podkreśla się, że droga oddechowa (np. inhalacja skażonego aerozolu) jest w pewnych warunkach możliwa (zależy od wilgotności względnej, temperatury powietrza oraz czasu ekspozycji), szczególnie w warunkach szpitalnych (20, 21). Kontakt z przedmiotami w otoczeniu pacjenta (pościel, sprzęt) odgrywa mniejszą rolę w transmisji wirusa niż opisane wyżej główne drogi szerzenia się infekcji (19).
Wielkość dawki zakaźnej wirusa Ebola jest niska – choć nie została do tej pory jednoznacznie określona. Jedni badacze (22, 23) uważają, że wynosi ona tylko 1-10 cząstek wirusa, inni w badaniach na zwierzętach wykazali, że do zakażenia wymaganych jest co najmniej 400 zakaźnych cząstek wirusa (ang. plaque forming unit – PFU) (24). Jest to nadal bardzo niska dawka zakaźna. Obecność wirusa w płynach ustrojowych i wydalinach, a tym samym zakaźność pacjenta dla innych osób pojawiają się wraz z wystąpieniem objawów chorobowych EVD. W miarę rozwoju choroby wzrasta miano wirusa. W celu ograniczenia szerzenia się zakażeń należy dążyć do jak najszybszej hospitalizacji pacjenta i izolacji w sali z własnym węzłem sanitarnym. Wskazane jest umieszczenie chorego w izolatce z podciśnieniem oraz z filtrami, tak aby skażone powietrze nie wydostawało się do innych pomieszczeń na oddziale.
Obecność RNA wirusa Ebola wykazano w wielu materiałach klinicznych pobranych od osób chorych lub rekonwalescentów (tab. 1) (20). Należy podkreślić, że tak jak w przypadku wirusa Marburg, wirus Ebola może być obecny w spermie ozdrowiciela nawet 1,5-3 miesiące po zachorowaniu na EVD, choć jak dotąd nie wykazano przeniesienia wirusa Ebola na inną osobę przez kontakt płciowy (19, 20).
Za pierwszy przypadek, który zapoczątkował obecną – już 25. epidemię zakażeń wirusem Ebola – uważa się zachorowanie 2-letniego dziecka w Gwinei w grudniu 2013 r. (25). Aktualnie (08.04.2015 r.) liczba przypadków wynosi 25 591, w tym 10 602 zgony (1, 26). W miarę trwania epidemii zaobserwowano jednak stopniowe obniżanie się śmiertelności – z ponad 60 do 41%. Niepokojącym zjawiskiem jest notowanie dużej liczby zakażeń wśród pracowników medycznych. Do 15.03.2015 r. zarejestrowano zakażenie 852 pracowników medycznych, z których 492 zmarło (57,7%).
Spośród trzech najbardziej dotkniętych obecną epidemią krajów Afryki Zachodniej najwięcej zakażeń i zgonów zarejestrowano w Liberii (26). Ostatnio zaobserwowano w tym kraju i w Sierra Leone zmniejszanie się liczby nowych zachorowań i przypadków potwierdzanych laboratoryjnie, jednak w Gwinei liczba ta ma tendencję wzrostową. W ostatnim tygodniu (dane: 18.03.2015 r.) najwięcej nowych przypadków zachorowań (95 spośród 150) zgłoszono właśnie w tym kraju. Obecnie za kraje wolne od epidemii EVD uznano Nigerię, Senegal, Mali, a także USA, Hiszpanię i Wielką Brytanię.
W Demokratycznej Republice Konga (DRK) bilans tej odrębnej epidemii EVD w dniu 20.11.2014 r. wynosił 66 przypadków, w tym 49 zgonów (śmiertelność 74,2%). Liczba ta obejmuje 8 pracowników medycznych (wszyscy zmarli) (26). W dniu 21.11.2014 r., gdy minęły 42 dni od drugiego ujemnego testu RT-PCR ostatniego pacjenta wypisanego ze szpitala, ogłoszono wygaszenie epidemii EVD w DRK.
Jednoczesne występowanie ognisk EVD
Wystąpienie dwóch różnych ognisk EVD w tym samym lub zbliżonym okresie, ale w różnych regionach, nie jest nowym zjawiskiem. Analiza danych z poprzednich epidemii EVD wskazuje na dwa istotne zagadnienia epidemiologiczne dotyczące tej choroby:
1. rozprzestrzenianie się zachorowań wywołanych przez ten sam wirus, nawet na odległość wielu kilometrów,
2. równoległe występowanie zachorowań wywołanych przez różne gatunki lub typy wirusa Ebola.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Centers for Disease Control and Prevention (CDC). 2014 Ebola Outbreak in West Africa. http://www.cdc.gov/vhf/ebola/outbreaks/2014-west-africa/index.html.
2. Centers for Disease Control and Prevention (CDC). 2014 Ebola Outbreak in Democratic Republic of the Congo. http://www.cdc.gov/vhf/ebola/outbreaks/drc/2014-august.html.
3. Główny Inspektorat Sanitarny (GIS). Komunikat w sprawie epidemii gorączki krwotocznej Ebola w Gwinei i krajach sąsiadujących. http://www.gis.gov.pl/?go=news&id=155.
4. Wróblewska M, Pancer K: Zakażenia wirusem Ebola – epidemiologia, postępowanie z pacjentem i diagnostyka laboratoryjna zakażeń. Zakażenia 2014; 4: 19-29.
5. International Committee on Taxonomy of Viruses (ICTV). Virus taxonomy: 2013 Release. http://ictvonline.org/virusTaxonomy.asp.
6. Centers for Disease Control and Prevention (CDC). Outbreaks chronology: Ebola hemorrhagic fever. http://www.cdc.gov/vhf/ebola/resources/outbreak-table.html.
7. Leroy EM, Gonzalez JP, Baize S: Ebola and Marburg haemorrhagic fever viruses: major scientific advances, but a relatively minor public health threat for Africa. Clin Microbiol Infect 2011; 17: 964-976.
8. Haas CN: On the quarantine period of Ebola. PLoS Current Outbreaks 2014; Oct 14.
9. Bah EI, Lamah M-C, Fletcher T et al.: Clinical presentation of patients with Ebola virus disease in Conakry, Guinea. New Eng J Med 2014; Nov 5.
10. Schieffelin JS, Shaffer JG, Goba A et al.: Clinical illness and outcomes in patients with Ebola in Sierra Leone. N Eng J Med 2014; Oct 29.
11. Centers for Disease Control and Prevention (CDC). Interim guidance for Emergency Medical Services (EMS) systems and 9-1-1 Public Safety Answering Points (PSAPs) for management of patients with known or suspected Ebola virus disease in the United States. http://www.cdc.gov/vhf/ebola/hcp/interim-guidance-emergency-medical-services-systems-911-public-safety-answering-points-management-patients-known-suspected-united-states.html.
12. World Health Organization (WHO). Ebola virus disease. Fact sheet No 103. http://www.who.int/mediacentre/factsheets/fs103/en.
13. Dowell SF, Mukunu R, Ksiazek TG et al.: Transmission of Ebola hemorrhagic fever: a study of risk factors in family members, Kikwit, Democratic Republic of the Congo, 1995. Commission de Lutte contre les Epidèmies à Kikwit. J Infect Dis 1999; 179 (suppl. 1): S87-S91.
14. World Health Organization (WHO). Practical guidelines for infection control in health care facilities, 2004. www.wpro.who.int/.../docs/practical_guidelines_infection_control.pdf.
15. Towner JS, Rollin PE, Bausch DG et al.: Rapid diagnosis of Ebola hemorrhagic fever by reverse transcription-PCR in an outbreak setting and assessment of patient viral load as a predictor of outcome. J Virol 2004; 78(8): 4330-4341.
16. Leroy EM, Kumulungui B, Pourrut X et al.: Fruit bats as reservoirs of Ebola virus. Nature 2005; 438: 575-576.
17. Centers for Disease Control and Prevention (CDC). Ebola hemorrhagic fever. http://www.cdc.gov/vhf/ebola.
18. World Health Organization (WHO). WHO risk assessment. Human infections with Zaïre Ebolavirus in West Africa, 24 June 2014. www.who.int/.../ebola/EVD_WestAfrica_WHO_ RiskAssessment _201406.
19. Bausch DG, Towner JS, Dowell SF et al.: Assessment of the risk of Ebola virus transmission from bodily fluids and fomites. J Infect Dis 2007; 196 (suppl. 2): S142-S147.
20. Centers for Disease Control and Prevention (CDC). Review of human-to-human transmission of Ebola virus. http://www.cdc.gov/vhf/ebola/transmission/human-transmission.html.
21. Center for Infectious Disease Research and Policy (CIDRAP). Commentary: Health workers need optimal respiratory protection for Ebola. http://www.cidrap.umn.edu.
22. Franz DR, Jahrling PB, McClain DJ et al.: Clinical recognition and management of patients exposed to biological warfare agents. Clin Lab Med 2001; 21(3): 435-473.
23. Bray M, Davis K, Geisbert T et al.: A mouse model for evaluation of prophylaxis and therapy of Ebola hemorrhagic fever. J Infect Dis 1999; 179 (suppl. 1): S248-258.
24. Johnson E, Jaax N, White J, Jahring P: Lethal experimental infections of rhesus monkeys by aerosolised Ebola virus. Int J Exp Pathol 1995; 76: 227-236.
25. Baize S, Pannetier D, Oestereich L et al.: Emergence of Zaire Ebola virus disease in Guinea – preliminary report. New Eng J Med 2014; 371: 1418-1425.
26. World Health Organization (WHO). Situation Reports: Ebola response roadmap. http://www.who.int/csr/disease/ebola/situation-reports/en.
27. European Centre for Disease Prevention and Control (ECDC). Algorithm for laboratory diagnosis of Ebola virus disease. http://www.ecdc.europa.eu/en/healthtopics/ebola_marburg_fevers/algorithm-evd-diagnosis/Pages/default.aspx.
28. Wang Y-P, Zhang X-E, Wei H-P: Laboratory detection and diagnosis of filoviruses. Virol Sin 2011; 26: 73-80.
29. Gire SK, Goba A, Andersen KG et al.: Genomic surveillance elucidates Ebola virus origin and transmission during the 2014 outbreak. Science 2014; 14: 1369-1372.
30. Muyembe-Tamfum JJ, Kipasa M, Kiyungu C, Colebunders R: Ebola outbreak in Kikwit, Democratic Republic of the Congo: discovery and control measures. J Infect Dis 1999; 179 (suppl. 1): S259-S262.
31. World Health Organization (WHO). Lassa fever. Fact sheet. http://www.cdc.gov/ncidod/dvrd/spb/mnpages/dispages/Fact_Sheets/Lassa_Fever_Fact_Sheet.pdf.
32. Centers for Disease Control and Prevention (CDC). Ebola virus disease information for clinicians in U.S. healthcare settings. http://www.cdc.gov/vhf/ebola/hcp/clinician-information-us-healthcare-settings.html.
33. Bray M, Geisbert TW: Ebola virus: the role of macrophages and dendritic cells in the pathogenesis of Ebola hemorrhagic fever. Int J Biochem Cell Biol 2005; 37:1560-1566.
34. de La Vega MA, Wong G, Kobinger GP, Qiu X: The multiple roles of sGP in Ebola pathogenesis. Viral Immunol 2014; 28: 1-7.
35. Mahanty S, Bray M: Pathogenesis of filoviral haemorrhagic fevers. Lancet Infect Dis 2004; 4: 487-498.
36. Geisbert TW, Hensley LE, Larsen T et al.: Pathogenesis of Ebola hemorrhagic fever in cynomolgus macaques: evidence that dendritic cells are early and sustained targets of infection. Am J Pathol 2003; 163: 2347-2370.
37. Bray M: Epidemiology, pathogenesis, and clinical manifestations of Ebola and Marburg virus disease. http://www.uptodate.com/contents/epidemiology-pathogenesis-and-clinical-manifestations-of-ebola-and-marburg-virus-disease.
38. Hensley LE, Young HA, Jahrling PB, Geisbert TW: Proinflammatory response during Ebola virus infection of primate models: possible involvement of the tumor necrosis factor receptor superfamily. Immunol Lett 2002; 80: 169-179.
39. Hutchinson KL, Rollin PE: Cytokine and chemokine expression in humans infected with Sudan Ebola virus. J Infect Dis 2007; 196 (suppl. 2): S357-S363.
40. Villinger F, Rollin PE, Brar SS et al.: Markedly elevated levels of interferon (IFN)-gamma, IFN-alpha, interleukin (IL)-2, IL-10, and tumor necrosis factor-alpha associated with fatal Ebola virus infection. J Infect Dis 1999; 179 (suppl. 1): S188-S199.
41. Sanchez A, Lukwiya M, Bausch D et al.: Analysis of human peripheral blood samples from fatal and nonfatal cases of Ebola (Sudan) hemorrhagic fever: cellular responses, virus load, and nitric oxide levels. J Virol 2004; 78: 10370-10377.
42. Baize S, Leroy EM, Georges-Courbot MC et al.: Defective humoral responses and extensive intravascular apoptosis are associated with fatal outcome in Ebola virus-infected patients. Nat Med 1999; 5: 423-426.
43. Bradfute SB, Swanson PE, Smith MA et al.: Mechanisms and consequences of Ebolavirus-induced lymphocyte apoptosis. J Immunol 2010; 184: 327-335.
44. Geisbert TW, Young HA, Jahrling PB et al.: Pathogenesis of Ebola hemorrhagic fever in primate models: evidence that hemorrhage is not a direct effect of virus-induced cytolysis of endothelial cells. Am J Pathol 2003; 163: 2371-2382.
45. Geisbert TW, Young HA, Jahrling PB et al.: Mechanisms underlying coagulation abnormalities in Ebola hemorrhagic fever: overexpression of tissue factor in primate monocytes/macrophages is a key event. J Infect Dis 2003; 188: 1618-1629.
46. Public Health Agency of Canada (PHAC). Ebolavirus. Pathogen safety data sheet – infectious substances. http://www.phac-aspc.gc.ca/lab-bio/res/psds-ftss/ebola-eng.php.
47. Prescott J, Bushmaker T, Fischer R, et al.: Postmortem stability of Ebola virus. Emerg Infect Dis 2015; 21(5): [In print].
48. Advisory Committee on Dangerous Pathogens (ACDP), Department of Health (UK). Management of Hazard Group 4 viral haemorrhagic fevers and similar human infectious diseases of high consequence – Appendix 10. August 2014. http://www.hpa.org.uk/webc/HPAwebFile/HPAweb_C/1194947382005.
49. World Health Organization (WHO) Infection Prevention and Control (IPC) guidance summary. Ebola guidance package. August 2014. WHO_EVD_Guidance_IPC_14.1_eng.pdf.
50. Centre for Health Protection (CHP). Interim recommendations on infection control for Ebola virus disease (EVD) in healthcare settings. 24 Oct 2014. www.chp.gov.hk/files/pdf/ic_recommendations_for_evd.pdf.
51. Sagripanti JL, Lytle CD: Sensitivity to ultraviolet radiation of Lassa, vaccinia, and Ebola viruses dried on surfaces. Arch Virol 2011; 156(3): 489-494.
52. Feldmann H: Ebola – a growing threat? N Engl J Med 2014; 371: 1375-1378.
53. Geisbert TW, Daddario-DiCaprio KM, Williams KJ et al.: Recombinant vesicular stomatitis virus vector mediates postexposure protection against Sudan Ebola hemorrhagic fever in nonhuman primates. J Virol 2008; 82(11): 5664-5668.
54. Fauci AS, Collins FS: NIH Ebola update: working toward treatments and vaccines. http://directorsblog.nih.gov/2014/10/14/nih-ebola-update-working-toward-treatments-and-vaccines.
55. Richardson JS, Yao MK, Tran KN et al.: Enhanced protection against Ebola virus mediated by an improved adenovirus-based vaccine. PLoS ONE 2009; 4(4): e5308.
56. Choi JH, Jonsson-Schmunk K, Qiu X et al.: A single dose respiratory recombinant adenovirus-based vaccine provides long-term protection for non-human primates from lethal Ebola infection. Mol Pharm 2014; Nov 1.
57. Triazoverin. http://ebolavaccine.com/vaccine6.htm.
58. Mupapa K, Massamba K, Kibadi K et al.: Treatment of Ebola hemorrhagic fever with blood transfusions from convalescent patients. J Infect Dis 1999; 179 (suppl. 1): S18-S23.
59. WHO. Use of convalescent whole blood or plasma collected from patients recovered from Ebola virus disease for transfusion, as an empirical treatment during outbreaks. Interim guidance for National Health Authorities and Blood Transfusion Services. September 2014. WHO_HIS_SDS_2014.8_eng.pdf.
60. Qiu X, Wong G, Audet J et al.: Reversion of advanced Ebola virus disease in nonhuman primates with ZMapp. Nature 2014; 514(7520): 47-53.
61. Geisbert TW, Lee ACH, Robbins M et al.: Postexposure protection of non-human primates against a lethal Ebola virus challenge with RNA interference: a proof-of-concept study. Lancet 2010; 375(9729): 1896-1905.
62. Tekmira. TKM-Ebola: about investigational TKM-Ebola therapeutic. http://www.tekmira.com/pipeline/tkm-ebola.php.
63. Chimerix. Chimerix announces emergency investigational new drug applications for brincidofovir authorized by FDA for patients with Ebola virus disease. http://ir.chimerix.com/releasedetail.cfm?releaseid=874647.
64. Wong G, Qiu X, Olinger GG, Kobinger GP: Post-exposure therapy of filovirus infections. Trends Microbiol 2014; 22(8): 456-463.
65. Warren TK, Wells J, Panchal RG et al.: Protection against filovirus diseases by a novel broad-spectrum nucleoside analogue BCX4430. Nature 2014; 508(7496): 402-405.
66. Huggins J, Zhang ZX, Bray M: Antiviral drug therapy of filovirus infections: S adenosylhomocysteine hydrolase inhibitors inhibit Ebola virus in vitro and in lethal mouse model. J Infect Dis 1999; 179: S240-S247.
67. Oestereich L, Lüdtke A, Wurr S et al.: Successful treatment of advanced Ebola virus infection with T-705 (favipiravir) in a small animal model. Antiviral Res 2014; 105: 17-21.
68. Basu A, Li B, Mills D et al.: Identification of a small-molecule entry inhibitor for filoviruses. J Virol 2011; 85(7): 3106-3119.
69. Warren TK, Warfield KL, Wells J et al.: Antiviral activity of a small-molecule inhibitor of filovirus infection. Antimicrob Agents Chemother 2010; 54(5): 2152-2159.
70. Sihuan Pharma Company. Collaboration agreement with Academy of Military Medical Sciences for development of anti-Ebola drug jk-05. http://www.sihuanpharm.com/index.php?a=index&m=Page&id=102&l=en.
71. World Health Organization (WHO). Interim infection prevention and control guidance for care of patients with suspected or confirmed filovirus haemorrhagic fever in health-care settings, with focus on Ebola August 2014. http://www.who.int/csr/bioriskreduction/filovirus_infection_control/en/.


