© Borgis - Postępy Nauk Medycznych 8/2015, s. 588-596
Agnieszka Styczeń, *Tomasz Zapolski, Andrzej Wysokiński
Leczenie uzupełniające (upstream therapy) w prewencji pierwotnej i wtórnej migotania przedsionków – obiecująca perspektywa czy fałszywe nadzieje?
Upstream therapy in primary and secondary prevention of atrial fibrillation – a promising prospect or false hopes?
Katedra i Klinika Kardiologii, Uniwersytet Medyczny, Lublin
Kierownik Kliniki: prof. dr hab. med. Andrzej Wysokiński
Streszczenie
Migotanie przedsionków (AF) jest najczęściej występującym zaburzeniem rytmu serca w populacji ogólnej. Obecność arytmii wiąże się ze znacznie zwiększoną chorobowością i śmiertelnością. AF jest postępującą chorobą wtórną do strukturalnego remodelingu przedsionków z powodu migotania samego w sobie, zmian związanych z procesem starzenia oraz pogorszeniem podstawowej choroby serca.
Leczenie uzupełniające (ang. upstream therapy) polega na stosowaniu leków pozbawionych działania antyarytmicznego, które modyfikują substrat arytmii lub celowane mechanizmy AF, co zapobiega wystąpieniu i nawrotowi arytmii. Terapia ta obejmuje następujące grupy leków: inhibitory enzymu konwertującego angiotensynę (ACEIs), blokery receptora angiotensyny (ARBs), statyny, n-3 wielonienasycone kwasy tłuszczowe oraz opcjonalnie kortykosteriody i tiazolidinediony.
Kluczowymi celami upstream therapy są zmiany morfologiczne przedsionków, takie jak włóknienie, przerost, zapalenie i stres oksydacyjny; ewentualnie nieprawidłowości w pracy kanałów jonowych przedsionków, połączeń komórkowych oraz przeładowanie jonami wapnia.
Badania kliniczne łącznie z danymi eksperymentalnymi wykazały, że leczenie uzupełniające może być wartościową strategią terapeutyczną w prewencji pierwotnej AF u wybranych pacjentów. Podobnych prawidłowości nie odnotowano w przypadku prewencji wtórnej, dlatego kwestia ta nadal wymaga prowadzenia randomizowanych analiz badawczych.
Poniższa praca przedstawia rolę leczenia uzupełniającego w terapii migotania przedsionków w odniesieniu do profilaktyki pierwszo- i drugorzędowej wystąpienia arytmii.
Summary
Atrial fibrillation is the most common heart rhythm disturbance in general population. Occurrence of arrhythmia is connected with notably greater morbidity and mortality. AF is a progressive disorder referential to its presence itself, age-associated changes and exacerbation of underlying heart disease.
Upstream therapy in atrial fibrillation draws on the use of non-arrhythmic agents which alter the substrate of arrhythmia or targeted mechanisms of AF to obviate the occurence or recurrence of the heart rhythm disturbance. Such drugs comprise angiotensin-converting enzyme inhibitors (ACEIs), angiotension receptor blockers (ARBs), statins, n-3 polyunsaturated fatty acids; optionally corticosteroids and thiazolidinediones.
The key targets in upstream therapy constitute atrial morphological changes, such as fibrosis, inflammation, hypertrophy and oxidative stress; alternatively effects on atrial ion channels, gap junctions and calcium ions handling.
Clinical reports altogether with experimental data implied that upstream treatment can be rewarding therapeutical strategy for primary prevention of AF in chosen patients. However, similar results have not been observed in case of secondary prevention, as a consequence further randomized researches concerning that issue are required.
This review presents the role of upstream therapy pertained to first and second degree prophylaxis of arrhythmia occurrence.

Wstęp
Migotanie przedsionków (ang. atrial fibrillation – AF) jest najczęściej występującą arytmią i dotyczy 1-1,5% osób na świecie (1). W Stanach Zjednoczonych liczba pacjentów z arytmią wzrasta i prognozuje się, że do 2050 przekroczy 10 mln (2). Podobny wzrost liczby populacji z AF prawdopodobnie wystąpi również w Europie Zachodniej (3). AF predysponuje do występowania powikłań zakrzepowo-zatorowych w wielu mechanizmach. Najistotniejszą rolę w etiopatogenezie udaru mózgu odgrywają skrzepliny uwalniane z lewego przedsionka (ang. left atrium – LA), uformowane w wyniku zastoju krwi w obrębie pozbawionego czynności hemodynamicznej, najczęściej powiększonego LA (4).
AF wzrastająco wiąże się z: nadciśnieniem tętniczym, zastoinową niewydolnością serca, chorobą niedokrwienną serca oraz cukrzycą, spośród których wszystkie są uznanymi czynnikami ryzyka wystąpienia arytmii (5). Wśród stanów sprzyjających pojawieniu się migotania przedsionków dodatkowo można wymienić: niewydolność nerek, zaburzenia funkcji tarczycy, choroby nowotworowe, niedokrwistość oraz depresję (6).
AF jest wynikiem ciągłego remodelingu przedsionków, który obejmuje transformację elektryczną i strukturalną, zmieniony metabolizm (remodeling neurohormonalny i biochemiczny), zmiany autonomiczne wtórne do procesu starzenia, progresji podstawowej choroby serca oraz czynników genetycznych i środowiskowych. Włóknienie jest głównym elementem strukturalnego (i funkcjonalnego) remodelingu oraz zbieżnym wynikiem naprawy tkankowej i reaktywnych odpowiedzi na zapalenie, stres oksydacyjny, starzenie i apoptozę. Transformacja strukturalna przedsionków obejmuje wiele patomechanizmów, spośród których układ renina-angiotensyna II-aldosteron (ang. renin-angotensin-aldosterone system – RAAS) odgrywa centralną rolę w wywoływaniu zespołu odpowiedzi tkankowych na poziomie elektrycznym i strukturalnym.
Aktualnie coraz większy nacisk kładzie się na poszukiwanie substratu arytmii oraz oddziaływanie terapeutyczne na ewentualną przyczynę AF (7). Idea leczenia uzupełniającego (ang. upstream therapy), którego celem jest prewencja i spowalnianie procesu przebudowy miokardium, jest interesująca, ponieważ leczenie to jest skierowane zarówno na hamowanie rozwoju arytmii de novo (profilaktyka pierwotna), jak i na redukcję częstości nawrotów oraz progresję choroby do utrwalonego AF (profilaktyka wtórna).
Praca nad różnorodnymi modelami zwierzęcymi w sposób powtarzalny prezentowała związek pomiędzy AF a włóknieniem przedsionków, zapaleniem i stresem oksydacyjnym, jak również pomiędzy ochronnymi właściwościami leczenia inhibitorami układu renina-angiotensyna-aldosteron oraz lekami o właściwościach przeciwzapalnych i przeciwoksydacyjnych, takimi jak statyny i wielonienasycone kwasy tłuszczowe (ang. polyunsaturated fatty acids – PUFAs). Terapia upstream, która obejmuje: inhibitory enzymu konwertującego (ang. angiotensin-converting enzyme inhibitors – ACEIs), blokery receptora dla angiotensyny II (ang. angiotension receptor II blockers – ARBs), antagonistów aldosteronu, statyny, n-3 wielonienasycone kwasy tłuszczowe, kortykosteroidy oraz tiazolidinediony ma potencjał zapobiegania wystąpieniu świeżego AF (profilaktyka pierwszorzędowa), jak i arytmii o charakterze nawrotowym (profilaktyka drugorzędowa). W miarę zbierania dowodów klinicznych, wydaje się oczywistym, że upstream therapy może mieć zróżnicowany wpływ na prewencję pierwotną i wtórną. Podczas gdy przeważająca większość analiz profilaktyki pierwotnej z wykorzystaniem statyn i inhibitorów RAAS wykazała stałą redukcję wystąpienia epizodu AF de novo, badania profilaktyki wtórnej okazały się mniej imponujące. Dlatego dane dotyczące prewencji pierwotnej i wtórnej w różnych podgrupach pacjentów rozważane są oddzielnie (8). Dotychczas opublikowano jedynie kilka badań randomizowanych dotyczących leczenia uzupełniającego AF: J-RHYTHM II (Japanese Rhythm Management Trial of Atrial Fibrillation), ANTIPAF Trial (Angiotensin II-Antagonist in Paroxysmal Atrial Fibrillation), GISSI-AF (Gruppo Italiano per lo Studio della Sopravvivenza nell’Insufficienza Cardiaca Atrial Fibrillation), ARMYDA-3 (Atorvastatin for Reduction of Myocardial Dysrhythmia After Cardiac Surgery) oraz CARAF (Canadian Registry of Atrial Fibrillation).
Inhibitory konwertazy angiotensyny oraz antagoniści receptora dla angiotensyny II
Najistotniejszym mechanizmem działania ACEIs jest hamowanie arytmogennego wpływu angiotensyny II, które obejmuje stymulację włóknienia przedsionków i ich przerostu wtórnego do aktywowanych mitogenem kinaz białkowych, tworzenia połączeń międzykomórkowych typu gap junction, zaburzeń gospodarki jonami wapniowymi, zmian w dynamice kanałów jonowych, aktywacji mediatorów stresu oksydacyjnego oraz nasilenia procesów zapalnych (ryc. 1) (7, 9-11).
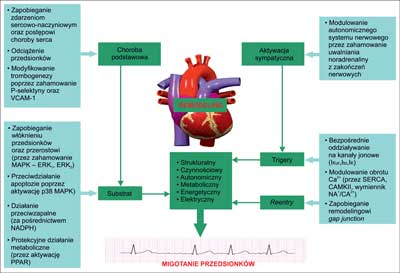
Ryc. 1. Procesy patofizjologiczne związane z remodelingiem lewego przedsionka, potencjalnie modyfikowalne przez ACEIs oraz ARBs: wielofunkcyjna zależna od Ca2+/kalmoduliny kinaza II (ang. Ca2+/calmodulin-dependent protein kinase – CaMKII), kinaza regulowana przez sygnały zewnątrzkomórkowe (ang. extracellular signalregulated kinase – ERK), kinazy białkowe aktywowane mitogenami (ang. mitogen-activated protein kinases – MAPK), zredukowany fosforan dwunukleotydu nikotynamidoadeninowego (ang. nicotinamide adenine dinucleotide phosphate – NADPH), receptory aktywowane przez proliferatory peroksysomów (ang. peroxisome proliferator-activated receptor – PPAR), sarkoplazmatyczna adenozynotrójfosfataza transportująca wapń (ang. sarcoendoplasmic reticulum Ca2+-adenosine triphosphatase – SERCA), cząstka adhezyjna śródbłonka naczyniowego (ang. vascular cell adhesion molecule – VCAM) (zmodyfikowano wg 7, 9).
Profilaktyka pierwotna
1. Zastoinowa niewydolność serca
W kilku randomizowanych badaniach o charakterze retrospektywnym dotyczących zaburzeń funkcji lewej komory i niewydolności serca dowiedziono mniejszą częstość występowania AF de novo u chorych przyjmujących ACEIs lub ARBs, w porównaniu z grupą pacjentów otrzymujących placebo. Metaanalizy przedstawiające dane z powyższych badań wykazały istotną redukcję ryzyka AF (średnio o 38-40%) w przypadku terapii lekami blokującymi RAAS (ACEIs i ARBs) (12-14). Korzyści ze stosowania tej grupy leków nie są tak oczywiste w przypadku chorych z objawami niewydolności serca i zachowaną frakcją skurczową (9).
2. Nadciśnienie tętnicze
Dotychczas statystycznie istotne 25% obniżenie ryzyka względnego wystąpienia AF wykazano w jednej metaanalizie (15). U chorych leczonych losartanem (ARB) znacząco obniżyła się częstość występowania AF de novo w porównaniu z pacjentami przyjmującymi atenolol (badanie LIFE) (16). Analizy kolejnych badań (tj. VALUE) sugerowały, że terapia nadciśnienia tętniczego za pomocą ACEIs i ARBs może opóźnić wystąpienie arytmii również w codziennej praktyce klinicznej (17).
3. Czynniki ryzyka sercowo-naczyniowego
W przypadku obciążenia wieloma czynnikami ryzyka, w tym: nadciśnieniem tętniczym, chorobą wieńcową, cukrzycą, chorobą naczyń mózgowych lub obwodowych, hipercholesterolemią (badania HOPE i TRANSCEND), wpływ przyjmowanych leków nie jest jednoznaczny. W czasie tych badań nie dowiedziono ochronnego wpływu leku z grupy ACEIs (ramiprylu) oraz z grupy ARBs (telimsartanu) na występowanie AF de novo (15, 18).
Profilaktyka wtórna
W kilku randomizowanych, kontrolowanych badaniach klinicznych o względnie niewielkich rozmiarach udowodniono, że terapia ACEIs lub ARBs, stosowana łącznie z terapią lekami antyarytmicznymi, głównie amiodaronem (klasa III antyarytmików), dodatkowo korzystnie wpływa na ryzyko nawrotu AF po kardiowersji w porównaniu z leczeniem tylko przeciwarytmicznym – na podstawie metaanalizy danych pochodzących z powyższych badań stwierdzono istotne obniżenie ryzyka względnego nawrotu arytmii (45-50%). Przeciwnie, w czasie badania CAPRAF nie wykazano korzyści w postaci utrzymania rytmu zatokowego po kardiowersji, wynikających z leczenia lekiem z grupy ARBs (kandesartanem) (19, 20).
Analiza badania GISSI-AF, którym objęto 1442 chorych obciążonych czynnikami ryzyka sercowo-naczyniowego (u 85% nadciśnieniem tętniczym) i napadowym AF lub po niedawnej rewersji arytmii do rytmu zatokowego, nie udowodniła wpływu walsartanu stosowanego jako uzupełnienie klasycznej terapii (21).
Wstępne wyniki badania J-RHYTHM II, przeprowadzonego na grupie 318 pacjentów z nadciśnieniem tętniczym oraz AF o charakterze napadowym, nie wykazały korzyści z leczenia lekiem z grupy ARBs (kandesartanem) w porównaniu z lekiem z grupy blokerów kanału wapniowego (amlodypiną), w odniesieniu do częstości i czasu trwania nawrotów arytmii (22).
Reasumując, u pacjentów obciążonych chorobą układu sercowo-naczyniowego (np. przerostem i dysfunkcją lewej komory serca), poddawanych terapii ACEIs lub ARBs, potwierdzono redukcję częstości występowania AF stwierdzanego de novo, ale dane dotyczące chorych z chorobą serca o umiarkowanym nasileniu i nawracającą arytmią są mniej oczywiste. Nie udowodniono przewagi korzyści ze stosowania którejkolwiek klasy leków blokujących RAAS nad inną (8).
Antagoniści aldosteronu
Wzrastająca ilość dowodów, pochodząca zarówno z teoretycznych, jak i eksperymentalnych badań naukowych wskazuje, że terapia podtrzymująca z użyciem antagonistów aldosteronu (spironolaktonu i eplerenonu) może redukować szkodliwy wpływ nadmiernej sekrecji aldosteronu, a następnie modyfikować uwarunkowania wystąpienia AF, obejmujące włóknienie mięśniówki przedsionków. Odnosi się to do pacjentów z różnymi rodzajami arytmii, włączając grupę chorych z AF o charakterze utrwalonym (23).
Aldosteron wzmacnia działanie angiotensyny II na drodze zwiększonej transkrypcji receptora AT-1 oraz enzymu konwertującego angiotensynę (ACE), a także indukuje proliferację komórkową (24). W analizach eksperymentalnych, oprócz działania hypertensyjnego, aldosteron znacząco wpływał na promocję przerostu, włóknienia i martwicy kardiomiocytów, endothelium oraz komórek ściany naczyń. Aldosteron stymuluje syntezę kolagenu typu I i III, jak również fibroblastów przez aktywację lokalnych receptorów mineralokortykosteroidowych (25-27). Promuje procesy zapalne, stres oksydacyjny, dysfunkcję układu autonomicznego oraz uszkodzenie naczyń. Inne potencjalne mechanizmy arytmogenne aldosteronu obejmują: hamowanie zwrotnego wychwytu noradrenaliny, osłabienie aktywności baroreceptorów, wzrost ich wrażliwości na katecholaminy oraz redukcję zmienności rytmu serca (HRV). Znaczenie ma również istotna utrata potasu i magnezu (25).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Chen LY, Shen WK: Epidemiology of atrial fibrillation: a current perspective. Heart Rhythm 2007; 4: 1-6.
2. Miyasaka Y, Barnes M, Gersh B et al.: Secular trends in incidence of atrial fibrillation in Olmsted County, Minnesota, 1980-2000, and implications on the projections for future prevalence. Circulation 2006; 114: 119-125.
3. Naccarelli GV, Varker H, Lin J et al.: Increasing prevalence of atrial fibrillation and flatter in the United States. Am J Cardiol 2009; 104: 1534-1539.
4. Wolf PA, Abbott RD, Kannel WB: Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991; 22: 983-988.
5. Camm AJ, Kirchhof P, Lip GYH et al.: Atrial fibrillation. [In:] Camm AJ, Lusher TF, Serruys PW (eds.): The ESC Textbook of Cardiovascular Medicine. Blackwell Publishing Ltd, Oxford 2009: 1069-1132.
6. Dąbrowski R: Upstream therapy w migotaniu przedsionków i innych zaburzeniach rytmu serca – u kogo może być skuteczna? W Dobrym Rytmie 2012; 1(22): 1-7.
7. Savelieva I, Camm I: Is there any hope for angiotensin-converting enzyme inhibitors in atrial fibrillation? Am Heart J 2007; 154: 403-406.
8. Savelieva I, Kakouros N, Kourliouros A et al.: Upstream therapies for management of atrial fibrillation: review of clinical evidence and implications for ESC guidelines. Part II: Secondary prevention. Europace 2011; 13: 610-625.
9. Savelieva I, Kakouros N, Kourliouros K et al.: Upstream therapies for management of atrial fibrillation: review of clinical evidence and implications for European Society of Cardiology guidelines. Part I: Primary prevention. Europace 2011; 13: 308-328.
10. Goette A, Lendeckel U: Electrophysiological effects on agiotensin II. Part I: Signal transduction and basic electrophysiological mechanisms. Europace 2008; 10: 238-241.
11. Cardin S, Li D, Thorin-Trescases N et al.: Evolution of the atrial fibrillation substrate in experimental congestive heart failure: angiotensin-dependent and -independent pathways. Cardiovasc Res 2003; 60: 315-325.
12. Healey JS, Baranchuk A, Crystal E et al.: Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol 2005; 45: 1832-1839.
13. Anand K, Mooss AN, Hee TT et al.: Meta-analysis: inhibition of renin-angiotensin system prevents new-onset atrial fibrillation. Am Heart J 2006; 152: 217-222.
14. Jibrini MB, Molnar J, Arora RR: Prevention of atrial fibrillation by way of abrogation of the renin-angiotensin system: a systematic review and meta-analysis. Am J Ther 2008; 15: 36-43.
15. Salehian O, Healey J, Stambler B et al.: Impact of ramipril on the incidence of atrial fibrillation: results of the Heart Outcomes Prevention Evaluation study. Am Heart J 2007; 154: 448-453.
16. Watchtell K, Lehto M, Gerdts E et al.: Angiotensin II receptor blockade reduces new-onset atrial fibrillation and subsequent stroke compared to atenolol: the Losartan Intervention for End Point Reduction in Hypertension (LIFE) Study. J Am Coll Cardiol 2005; 45: 712-719.
17. Schmieder RE, Kjeldsen SE, Julis S et al.: Reduced incidence of new-onset atrial fibrillation with angiotensin II receptor blockade: the VALUE trial. J Hypertens 2008; 26: 403-411.
18. Yusuf S, Teo K, Anderson C et al.: Effects of the angiotensin-receptor blocker telmisartan on cardiovascular events in high-risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomized control trial. Lancet 2008; 372: 1174-1183.
19. Tveit A, Grundovold I, Olufsen M et al.: Candesartan in the prevention of relapsing atrial fibrillation. Int J Cardiol 2007; 120: 85-91.
20. Van Noord T, Crijns HJ, van den Berg MP et al.: Pretreatment with ACE inhibitors improves acute outcome of electrical cardioversion in patients with persistent atrial fibrillation. BMC Cardiovasc Disord 2005; 5: 3.
21. Disertori M, Latini R, Barlera S et al.: Valsartan for prevention of recurrent atrial fibrillation. N Engl J Med 2009; 360: 1606-1617.
22. Yamashita T, Inoue H, Okumura K et al.: Randomized trial of angiotensin II-receptor blockers vs. dihydropiridine calcium channel blocker in the treatment of paroxysmal atrial fibrillation with hypertension (J-RHYTHM II Study). Europace 2011; 13: 473-479.
23. Dąbrowski R, Szwed H: Antiarrhythmic potential of aldosterone antagonists in atrial fibrillation. Cardiol J 2012; 19: 223-229.
24. Goette A, Staack T, Rocken C et al.: Increased expression of extracellular signal-regulated kinase and angiotensin-converting enzyme in human atria during atrial fibrillation. J Am Coll Cardiol 2000; 35: 1669-1677.
25. Struthers AD: Aldosterone: Cardiovascular assault. Am Heart J 2002; 144: S2-S7.
26. Schmidt BMW, Schmmieder RE: Aldosterone-induced cardiac damage: focus on blood pressure independent effects. Am J Hypertens 2003; 16: 80-86.
27. Harada E, Yoshimura M, Yasue H et al.: Aldosterone induces angiotensin-converting enzyme gene expression in cultured neonatal rat cardiocytes. Circulation 2001; 104: 137-139.
28. Goette A, Hoffmanns P, Enayati W et al.: Effect of successful electric al cardioversion on serum aldosterone in patients with persistent atrial fibrillation. Am J Cardiol 2001; 88: 906-909.
29. Pei DA, Li L, Xu ZY et al.: Expression of mineralocorticoid receptor and 11-betahydroxysteroid dehydrogenase type 2 in human atria during chronic atrial fibrillation: study of 25 cases. Zhonghua Yi Xue Za Zhi 2007; 87: 816-819.
30. Spach MS, Boineau JP: Microfibrosis produces electrical load variations due to loss of side-to-side cell connections: A major mechanism of structural heart disease arrhythmias. Pacing Clin Electrophysiol 1997; 20: 397-413.
31. Milliez P, Girerd X, Plouin PF et al.: Evidence for an increased rate of cardiovascular events in patients with primary aldosteronism. J Am Coll Cardiol 2005; 45: 1243-1248.
32. Casaclang-Verzosa G, Gersh BJ, Tsang TSM: Structural and functional remodeling of the left atrium: clinical and therapeutic implication for atrial fibrillation. J Am Coll Cardiol 2008; 51: 1-11.
33. Zannad F, McMurray J, Krum H et al.: EMPHASIS-HF Study Group. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med 2011; 364: 11-21.
34. Nakano S, Kobayashi N, Yoshida K et al.: Cardioprotective mechanisms of sipronolactone associated with the angiotensin-converting enzyme/epidermal growth factor receptor/extracellular signal-regulated kinases, NADP(H) oxidase/lectin-like oxidized low-density lipoprotein receptor-1, and Rho-kinase pathways in aldosterone/salt-induced hypertensive rats. Hypertens Res 2005; 28: 925-936.
35. Modena MG, Aveta P, Menozzi A et al.: Aldosterone inhibition limits collage synthesis and progressive left ventricular enlargement after anterior myocardial infarction. Am Heart J 2001; 141: 41-46.
36. Zannad F, Alla F, Dousset B et al.: Limitation of excessive extracellular matrix turnover may contribute to survival benefit of spironolactone therapy in patients with congestive heart failure: Insights from the Randomized Aldactone Evaluation Study (RALES). Circulation 2000; 102: 2700-2706.
37. Ezekowitz JA, McAlister FA: Aldosterone blockade and left ventricular dysfunction: a systemic review of randomized clinical trials. Eur Heart J 2009; 30: 469-477.
38. Shoroshita-Takeshita A, Brundel BJ, Lavoie J et al.: Prednisone prevents atrial fibrillation promotion by atrial tachykardia remodeling in dogs. Cardiovasc Res 2006; 69: 865-875.
39. Mrik PE, Fromm R: The efficacy and Osage effect of corticosteroids for the prevention of atrial fibrillation after cardiac surgery; a systematic review. J Crit Care 2009; 24: 458-463.
40. Aviles RJ, Martin DO, Apperson-Hansen C et al.: Inflammation as a risk factor for atrial fibrillation. Circulation 2003; 108: 3006-3010.
41. Zacks ES, Okin PM, Min J et al.: Association of markers of inflammation with New onset atrial fibrillation in a population-based sample: the Strong Heart Study. Circulation 2006; 114: II-678 (Abstract).
42. Marcus GM, Whooley AM, Glidden DV et al.: Interleukin-6 and atrial fibrillation in patients with coronary artery disease: data from the Heart and Soul Study. Am Heart J 2008; 155: 303-309.
43. Liu T, Li L, Korantzopoulos P et al.: Association between C-reactive protein and recurrence of atrial fibrillation after successful electrical cardioversion: a meta-analysis. J Am Coll Cardiol 2007; 49: 1642-1648.
44. Savelieva I, Kourliourous A, Camm J: Primary and secondary prevention of atrial fibrillation with statins and polyunsaturated fatty AIDS: review of evidence and clinical relevance. Naunyn Schmiedebergs Arch Pharmacol 2010; 381: 1-13.
45. Kumagai K, Nakashima H, Saku K: The HMG-CoA reductase inhibitor atorvastatin prevents atrial fibrillation by inhibiting inflammation in a canine sterile pericarditis model. Cardiovasc Res 2004; 62: 105-111.
46. Shiroshita-Takeshita A, Schram G, Lavoie J et al.: The effect of simvastatin and antioxidant vitamins on atrial fibrillation – promotion by atrial tachycardia remodeling in dogs. Circulation 2004; 110: 2313-2319.
47. Shiroshita-Takeshita A, Brundel BJ, Burstein B et al.: Effects of simvastatin on the development of the atrial fibrillation substrate in dogs with congestive heart failure. Cardiovasc Res 2007; 74: 75-84.
48. Tsai CT, Lai LP, Hwang JJ et al.: Atorvastatin prevents atrial fibrillation in patients with bradyarrhythmias and implantation of an atrial – based or dual – chamber pacemaker: a prospective randomized trial. Am Heart J 2008; 156: 65-70.
49. Santangeli P, Ferrante G, Pelargonio G et al.: Usefulness of statins in preventing atrial fibrillation in patients with permanent pacemaker: a systematic review. Europace 2010; 12: 649-654.
50. Pati G, Chello M, Candura D et al.: Randomized trial of atorvastatin for reduction of postoperative atrial fibrillation in patients undergoing cardiac surgery: results of the ARYDMA-3 (Atorvastatin for Reduction of MYocardial Dysrhythmia After cardiac surgery) study. Circulation 2006; 114: 1455-1461.
51. Sanfilippo AJ, Abascal VM, Sheehan M et al.: Atrial enlargement as a consequence of atrial fibrillation: a prospective echocardiographic study. Circulation 1990; 82: 792-797.
52. Savelieva I, Camm J: Statins and polyunsaturated fatty AIDS for treatment of atrial fibrillation. Nat Clin Pract Cardiovasc Med 2008; 5: 30-41.
53. Ninio DM, Murphy KJ, Howe PR et al.: Dietary fish oil protects against stretch – induced vulnerability to atrial fibrillation in a rabbit model. J Cardiovasc Electrophysiol 2005; 16: 1189-1194.
54. Li GR, Sun HY, Zhang XH et al.: Omega-3 polyunsaturated fatty AIDS inhibit transient outward and ultra-rapid delayed rectifier K currents and Na current in human atrial myocytes. Cardiiovasc Res 2009; 81: 186-193.
55. Boland LM, Drzewiecki MM: Polyunsaturated fatty acid modulation of voltage – gated Ion channel. Cell Biochem Biophys 2008; 52: 659-684.
56. Xiano YF, Ke Q, Chen Y et al.: Inhibitory effect of n-3 fish oil fatty AIDS on cardiac Na/Ca Exchange currents in HEK293t cells. Biochem Biophys Res Commun 2004; 321: 116-123.
57. Mozaffarian D, Psaty BM, Rimm EB et al.: Fosh intake and risk of incident atrial fibrillation. Circulation 2004; 110: 368-373.
58. Virtanen JK, Mursu J, Voutilainen S et al.: Serum long-chain n-3 polyunsaturated fatty acids and risk of hospital diagnosis of atrial fibrillation in men. Circulation 2009; 120: 2315-2321.
59. Berry JD, Prineas RJ, van Horn L et al.: Dietary fish and incident atrial fibrillation (from the Women’s Health Initiative). Am J Cardiol 2010; 105: 844-848.
60. Heidt MC, Vician M, Stracke SK et al.: Beneficial effects of intravenously administered N-3 fatty AIDS for the prevention of atrial fibrillation after coronary artery bypass surgery: a prospective randomized study. Thorac Cardiovasc Surg 2009; 57: 276-280.
61. Okin PM, Watchell K, Devereux RB et al.: Regression of electrocardiographic left ventricular hypertrophy and decreased incidence of new-onset atrial fibrillation in patients with hypertension. JAMA 2206; 296: 1242-1248.
62. Halvorsen P, Raeder J, White PF et al.: The effect of dexamethazone on side effects after coronary revascularisation procedures. Anesth Analg 2003; 96: 1578-1583.
63. Prasongsukarn K, Abel JG, Jamieson WR et al.: The effects of steroids on the occurrence of postoperative atrial fibrillation after coronary bypass grafting surgery: a prospective randomized trial. J Thorac Cardiovasc Surg 2005; 130: 193-198.
64. Yared JP, Bakri MH, Erzurum SC et al.: Effect of dexamethasone on atrial fibrillation after cardiac surgery: prospective, randomized, double-blind, placebo-controlled trial. J Cardiotorac Vasc Anesth 2007; 21: 68-75.
65. Halonen J, Halonen P, Jarvinen O et al.: Corticosteroids of the prevention of atrial fibrillation after cardiac surgery: a randomized control trial. JAMA 2007; 297: 1562-1567.
66. Ho KM, Tan JA: Benefits and risks of corticosteroid prophylaxis in adult cardiac surgery: a dose-response meta-analysis. Circulation 2009; 119: 1853-1866.
67. Baker WL, White CM, Kluger J et al.: Effect of perioperative corticosteroid use on the incidence of postcardiothoracic surgery atrial fibrillation and length of stay. Heart Rhythm 2007; 4: 461-468.
68. Humphries KH, Lee M, Sheldon R et al.: CARAF Investigators. Statin use and recurrence of atrial fibrillation after successful cardioversion. Am Heart J 2007; 154: 908-913.
69. Dernellis J, Panaretou M: Relationship between C-reactive protein concentrations during glicocorticosteroid therapy and recurrent atrial fibrillation. Eur Heart J 2004; 25: 1100-1107.
70. Krishnan GM, Sood NA, Coleman CI et al.: Intravenous corticosteroid use is associated with reduced early recurrence of atrial fibrillation following radiofrequency catheter ablation. J Am Col Cardiol 2010; 55: 1136-1150.
71. Camm AJ, Kirchhof P, Lip GY et al.: Guidelines for the management of atrial fibrillation: the task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Europace 2010; 12: 1360-1420.
72. Shimano M, Tsuji Y, Inden Y et al.: Pioglitazone, a peroxysome proliferator-activated receptor-gamma activator, attenuates atrial fibrosis and atrial fibrillation promotion in rabbits with congestive heart failure. Heart Rhythm 2008; 5: 451-459.
73. Takahashi N, Kume O, Teshima Y et al.: Pioglitazone attenuates inflammatory atrial fibrosis and vulnerability to atrial fibrillation induced by pressure overload in rats. Circulation 2010: abstract 10983.
74. Camm AJ, Lip GYH, De Caterina R et al.: Wytyczne ESC dotyczące postępowania w migotaniu przedsionków na 2012 rok. Uaktualnienie wytycznych Europejskiego Towarzystwa Kardiologicznego (ESC) dotyczących postępowania w migotaniu przedsionków z 2010 roku opracowane przy współpracy z European Heart Rhythm Association (EHRA). Kardiol Pol 2012; 70 (supl. IV): 197-234.

