Maria Juszkiewicz-Borowiec
Miejscowa sterydoterapia w chorobach skóry
Topical steroid treatment in skin diseases
z Katedry i Kliniki Dermatologii, Wenerologii i Dermatologii Dziecięcej Akademii Medycznej w Lublinie
Kierownik Katedry: prof. dr hab. n. med. Barbara Lecewicz-Toruń
Streszczenie
Summary
Glucocorticosteroid preparations are highly important in the treatment of inflammatory, proliferative and autoimmune skin diseases. In the paper the mechanism is described of the action of glucocorticosteroids on receptors and direct action of the receptor/steroid complex on transcription factors. The principles of safe steroid treatment are discussed with reference to adverse effects.

Kora nadnerczy wydziela hormony, których substancją macierzystą jest cyklopentanoperhydrofenantren, zwany układem sterydowym (ryc. 1). Mają one tradycyjną nazwę glikokortykosteroidy, ponieważ początkowo dostrzegano jedynie ich wpływ na przemianę glukozy. W 1855 roku Tomasz Addison opisał objawy kliniczne spowodowane niewydolnością kory nadnerczy. Jednak dopiero w latach 1940-1948 ustalono ich budowę chemiczną i dokonano syntezy. W 1949 roku Hench i współpracownicy zastosowali po raz pierwszy syntetycznie otrzymany kortyzon u pacjenta z reumatoidalnym zapaleniem stawów (7). Autorzy opisali korzystny, przeciwzapalny efekt leczenia. W 3 lata później Sulzberger i Witten zastosowali miejscowo hydrocortison w terapii chorób skóry (15). Prof. Howard Maibach żartobliwie proponuje podzielenie historii dermatofarmakologii, podobnie jak dzielony bywa kalendarz, na dwa okresy: BC (ang. before corticoids) – przed kortykoidami i AC (ang. after corticoids) – po kortykoidach (9).
Stosowane współcześnie w terapii glikokortykosteroidy są syntetycznymi pochodnymi hormonów kory nadnerczy (kortyzonu, kortyzolu, kortykosteronu). W porównaniu do związków naturalnych wykazują one znacznie silniejsze działanie przeciwzapalne i immunosupresyjne oraz mniej zaznaczone objawy uboczne.
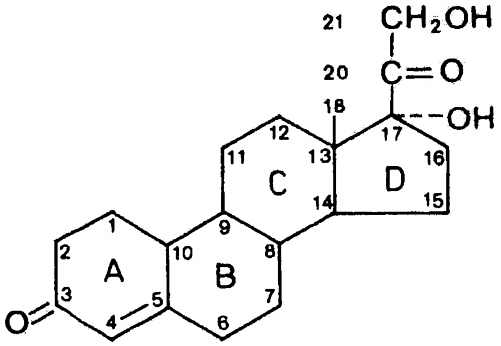
Ryc. 1. Rdzeń strukturalny glikokortykosteroidów.
W leczeniu chorób skóry glikokortykosteroidy podawane są zarówno ogólnie jak i miejscowo. Wykorzystywany jest ich efekt przeciwzapalny, a także immunosupresyjny. Ważnym komponentem aktywności glikokortykosteroidów jest działanie antyproliferacyjne. Po zastosowaniu na powierzchnię skóry zwężają one naczynia krwionośne, co zostało wykorzystane w teście zwężania naczyń (wazokonstrikcji), według McKenzie i Stoughtona (10) dla oceny siły działania tej grupy leków.
Glikokortykosteroidy są lekami z wyboru w szeregu dermatozach zapalnych, hiperproliferacyjnych i autoimmunologicznych (tab. 1).
Tabela 1. Choroby skóry leczone glikokortykosteroidami stosowanymi miejscowo (wg A. Ahluwalia (1)).
| Dermatozy |
| Glikokortykosteroidy są lekami z wyboru | Wyprysk
wyprysk kontaktowy
atopowe zapalenie skóry
Liszaj płaski
Liszaj przewlekły
Ukąszenia owadów i stawonogów
Oparzenia
Keloidy
|
| Glikokortykosteroidy są alternatywnymi lub dodatkowymi lekami | Łuszczyca
Łojotokowe zapalenie skóry
Toczeń rumieniowaty
Łysienie plackowate
Trądzik
|
| Glikokortykosteroidy mogą być zastosowane z korzystnym efektem terapeutycznym | Pemfigoid pęcherzowy
Mastocytoza skórna
Bielactwo
|
Podane na skórę są aktywne dopiero po połączeniu się z odpowiednimi receptorami. Receptor dla glikokortykosteroidów jest białkiem, zbudowanym z łańcucha polipeptydowego, składającego się z 777 aminokwasów (ryc. 2). W obrębie receptora wyróżnia się 3 główne obszary (domeny) (5). Domena A, pomiędzy aminokwasami 528 a 762, odpowiada za wiązanie receptora z cząsteczką hormonu sterydowego. Środkowa część pomiędzy aminokwasami 421 a 486, domena B, odpowiedzialna jest za wiązanie DNA. Dla tej części charakterystyczne są także tzw. palce cynkowe, będące kompleksami reszt cysteinowych z cynkiem, ułatwiają one dodatkowo połączenie z DNA. Natomiast domena C (aminokwasy 1-421), to nośnik immunogenności. Nieaktywny receptor dla glikokortykosteroidów jest połączony w komórce z dwoma monomerami białek szoku termicznego Hsp70 i 90 (heat shock protein). Pokrywają one miejsce wiążące DNA w domenie B. Odpowiadają za prawidłową konformację receptora, która warunkuje powinowactwo receptora do leku oraz zapobiega jego wiązaniu z DNA (13).
Receptory zlokalizowane są wewnątrzkomórkowo. Większość badaczy przyjmuje, że są to receptory cytoplazmatyczne, czego implikacją jest koncepcja dwustopniowego działania glikokortykoidów („two steps model”). Pierwszy etap to utworzenie aktywnego kompleksu hormon/receptor, a następnie przeniesienie powstałego kompleksu do jądra i połączenie z chromatyną jądrową (4). W modelu alternatywnym receptory opisywane są zarówno w cytoplazmie jak i jądrze komórkowym. Są także badania sugerujące istnienie receptora analogicznego do receptora estrogenowego lub androgenowego, czyli występowanie receptora wewnątrz jądra komórkowego (3).

Ryc. 2. Model receptora glikokortykosteroidowego (wg A. Grzanki i wsp. (5)).
A – domena wiążąca glikokortykosteroid, B – domena odpowiedzialna za wiązanie kompleksu hormon-receptor z DNA, C – domena, będąca nonikiem immunogennoci i innych cech biologicznych receptora.
Glikokortykosteroidy, po przeniknięciu przez błony komórkowe, wewnątrz komórki łączą się z receptorem. Prowadzi to do odłączenia protein Hsp i zmiany konformacji przestrzennej receptora. Następstwem jest związanie się białka receptorowego z DNA. Wykazano, że wiązanie to ma miejsce do określonych, swoistych sekwencji DNA, nazwanych GREs (glucocorticoid response elements). Wynikiem interakcji aktywnego receptora z GRE jest zmiana w transkrypcji genetycznej. Może być ona pozytywna, gdy synteza mRNA dla białek uczestniczących w odpowiedzi na bodziec glikokortykosteroidowy jest pobudzana lub negatywna, jeśli efektem jest hamowanie transkrypcji genów.
Związanie aktywnego kompleksu steryd/receptor z DNA indukuje przede wszystkim syntezę lipokortyny-1. Jest to białko przeciwzapalne z rodziny anneksyn. Lipokortyny wiążą się z fosfolipidami błon komórkowych, uniemożliwiając fosfolipazie A uwolnienie z nich kwasu arachidonowego. W konsekwencji ulega przerwaniu szlak wytwarzania lipidowych mediatorów zapalenia (prostaglandyn, leukotrienów).
Glikokortykosteroidy hamują indukcję syntazy tlenku azotu (izoforma indukowana syntazy tlenku azotu, iNOS), zmniejszając w ten sposób syntezę ważnego mediatora zapalenia, jakim jest tlenek azotu (2).
Powodują one także zmniejszenie liczby i aktywności komórek tucznych w skórze (8).
Najnowsze badania potwierdzają znaczenie innego, wcześniej nie opisywanego mechanizmu działania. Polega on na bezpośrednim hamującym oddziaływaniu aktywnego kompleksu steryd/receptor na czynniki transkrypcyjne. Czynniki transkrypcyjne, a wśród nich białko aktywatorowe AP-1 (activator protein-1) i jądrowy czynnik kappaB (NFkB) są modulatorami aktywności wielu genów odpowiedzialnych za rozwój zapalenia. Regulują one ekspresję cytokin zapalnych i cząsteczek adhezyjnych. Aktywny receptor wiąże się z AP-1, blokując ekspresję genów AP-1-zależną. Oddziaływanie kompleksu steryd/receptor z innymi czynnikami transkrypcyjnymi nie jest do końca wyjaśnione, ale prawdopodobnie przebiega w podobny sposób. Konsekwencją jest zmniejszona ekspresja cząsteczek adhezyjnych, co blokuje migrację leukocytów do ognisk zapalnych. Zmniejsza się aktywność cytokin prozapalnych (Il-1, Il-2, Il-6, TNFa) i liczba ich receptorów.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Ahluwalia A.: Topical glucocorticoids and the skin – mechanisms of action: an update. Mediators of inflammation 1998, 7:183-193. 2. Appleton I. et al.: Induction of cyclo-oxygenase and nitric oxide synthase in inflammation. Adv. Pharmacol. 1996, 35:27-79. 3. Brink M. et al.: The unliganded glucocorticoid receptor is localized in the nucleus, not in the cytoplasm. Endocrinology 1992, 130:3575-3581. 4. Gorski J. et al.: Just where are the steroid receptors anyway? Endocrine J. 1994, 2:99-100. 5. Grzanka A. i wsp.: Molekularny mechanizm działania glikokortykosteroidów. Pol. Arch. Med. Wewn. 1996, 95:375-382. 6. Hench P.S. et al.: The effect of the adrenal cortex (17-hydroxy-11-de-hydrocortisone: compound E) and of the pituitary adrenocorticotropic hormone on rheumatoid arthritis; preliminary report. Proc. Staff. Meet Mayo Clin. 1949, 24:181-197. 7. Langner A., Stąpór W.: Hormony glikokortykosteroidowe w lecznictwie dermatologicznym, w: Współczesne leczenie wybranych chorób skóry, red. A. Langner, W. Stąpór, Ośrodek Informacji Naukowej „Polfa”, Warszawa 1998, 22-34. 8. Lavker R.M., Schechter N.M.: Cutaneous mast cell depletion results from topical corticosteroid usage. J. Immunol. 1985, 135:2368-2373. 9. Maibach H.I.: In vivo percutaneous penetration of corticoids in man and unresolved problems in their efficacy. Dermatologica 1976, 152 (Suppl. 1):11-25. 10. McKenzie A.W., Stoughton R.B.: Method for comparing percutaneous absorption of steroids. Arch. Derm. 1962, 86:608-610. 11. Miller J.A., Munro D.D.: Topical corticosteroids: clinical pharmacology and therapeutic use. Drugs 1980, 19:119-134. 12. Ortonne J.P.: Safety aspects of topical methylprednisolone aceponate (MPA) treatment. J. Dermatol. Treatment, 1992, 3 (Suppl. 2):21-25. 13. Piotrowska B., Droszcz W.: Glikokortykosteroidy, w: Farmakoterapia chorób alergicznych, red. S. Chyrek-Borowska, K. Wiśniewski, PZWL, Warszawa 1993, 72-83. 14. Podstawowa broszura naukowa (Advantan – steryd do leczenia zmian wypryskowych) wyd. Schering AG Oddział w Warszawie (1998). 15. Sulzberger M.B., Witten V.H.: The effect of topically applied compoud F in selected dermatoses. J. Invest. Dermatol. 1952, 19:101-102. 16. Töpert M. et al.: New developments in corticosteroid research. J. Dermatol. Treatment. 1990, 1 (Suppl. 3):S5-S9. 17. Zaumseil R.P. et al.: Methylprednisolone aceponate (Advantan) an effective topical corticoid therapy with few side effects. Jahrbuch der Dermatologie, Hrsg. E. Macher, G. Kolde, E.B. Bröcker, Biermmann Verlag, Zülpich 1992/93:247-263.


