Adam Borzęcki, Wojciech Cielica
Zastosowanie lasera CO2 w praktyce dermatologicznej
The use of CO2 laser in dermatological practice
z Oddziału Dermatologicznego I Szpitala Wojskowego w Lublinie
Ordynator Oddziału: dr n. med. Adam Borzęcki
Streszczenie
Summary
A few hundred papers on the application of different types of laser in many fields of medicine have been published recently. In this paper we tray to present the action and application of CO2 – laser in the treatment of skin diseases in the past. We also discuss new therapeutic methods of treatment of some dermatological diseases, which were considered to be incurable 40 years ago. These new methods were introduced in therapy together with development of laser surgery.

W ostatnich latach w Polsce gwałtownie rośnie zastosowanie laserów w leczeniu różnych schorzeń dermatologicznych. Pierwsze lasery produkowane w latach 60-tych zostały ulepszone i zmodyfikowane, co pozwoliło na lepsze zastosowanie w leczeniu laserochirurgicznym, a powstałe nowe typy poprawiły w sposób zdecydowany możliwości terapeutyczne w dermatologii.
Ostatnio opublikowano kilkaset prac na temat zastosowania laserów różnych typów w licznych dziedzinach medycyny. W niniejszym artykule staramy się przedstawić działanie i zastosowanie lasera CO2 w chorobach skóry w przeszłości, jak też omówić nowe sposoby leczenia schorzeń dermatologicznych uznanych jeszcze 40 lat temu za nieuleczalne, a które zostały wprowadzone do terapii wraz z rozwojem laserochirurgii.
Lasery zostały wprowadzone do medycyny niemal od chwili ich skonstruowania, czyli od początku lat sześćdziesiątych. Po raz pierwszy w maju 1960 roku Theodor Harold Maiman (17) zastosował laser rubinowy, który stymulował emisję światła czerwonego o długości fali 694 nm. Od tej pory próbuje się wykorzystywać postępy w badaniach nad mechanizmami odpowiedzi skóry na światło laserowe zarówno pod kątem klinicznym jak i histologicznym w leczeniu chorób skóry. Za ojca laserowej dermatochiurgii na świecie został uznany Leon Goldman, który jako pierwszy opublikował efekty działania lasera rubinowego w chorobach skóry (15). Następnie w tym samym roku wraz ze wsp. donieśli o wyleczeniu raka podstawnokomórkowego za pomocą lasera rubinowego. W 1964 r. skonstruowano nowe typy laserów argonowy i CO2 i dotychczas są to lasery najczęściej stosowane w leczeniu tą metodą także i w Polsce. W pierwszych latach laseroterapii zmian skórnych najpoważniejszym powikłaniem było bliznowacenie po zabiegu, ostatnie postępy w konstrukcji laserów doprowadziły do zminimalizowania tego powikłania.
Budowa lasera
Każdy typ lasera zbudowany jest z trzech podstawowych części: ośrodka czynnego, układu wzbudzającego i rezonatora optycznego:
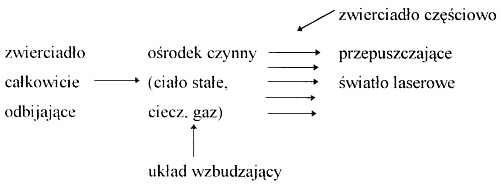
W ośrodku czynnym jest źródło promieniowania laserowego, którym może być gaz, ciecz lub ciało stałe i od właściwości tego ośrodka zależy długość fali i inne parametry światła laserowego. Układ wzbudzający lasera, przekazujący do ośrodka czynnego energię elektryczną, cieplną lub optyczną, powoduje wzbudzenie elektronów atomów środowiska w ośrodku czynnym na wyższy poziom energetyczny. Wraz z powrotem elektronów na wyjściowy poziom energetyczny dochodzi do emisji kwantów fali elektromagnetycznej, która zostaje odbita z powrotem do ośrodka czynnego wywołując stymulowaną emisję drugiej generacji kwantów promieniowania.
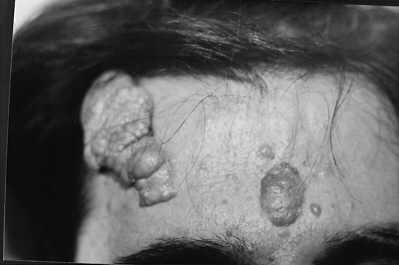
Ryc. 1. Choroba Bourneville´a-Pringle´a.
Ryc. 2. Choroba Bourneville´a-Pringle´a – 2 tygodnie po 1 zabiegu laserem CO2.
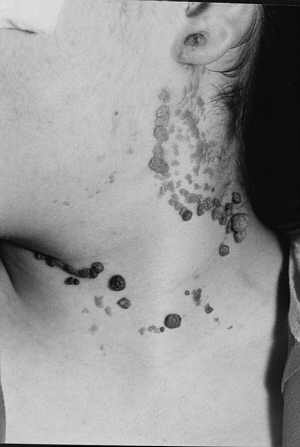
Ryc. 3. Brodawkowate znamię naskórkowe szyi.
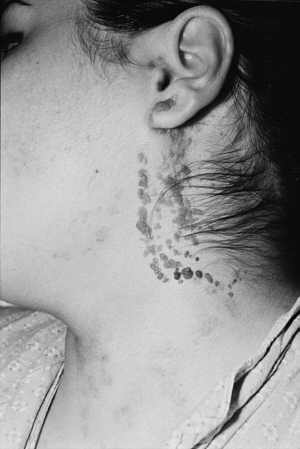
Ryc. 4. Brodawkowate znamię naskórkowe po częciowym usunięciu laserochirurgicznym CO2.
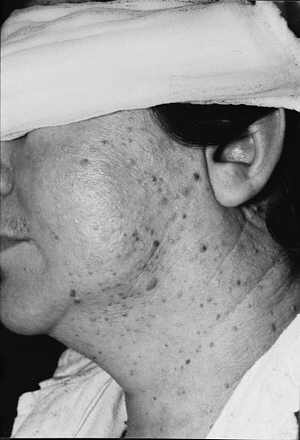
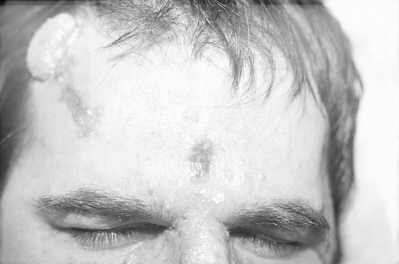
Ryc. 5. Rozsiane brodawki łojotokowe twarzy.
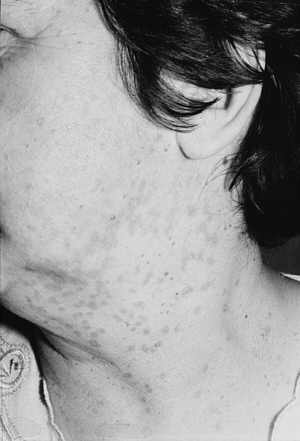
Ryc. 6. Rozsiane brodawki łojotokowe w dwa tygodnie po zabiegu laserem CO2. Widoczne zaczerwienienia skóry w miejscu zmian ustępują po 2-3 miesiącach.

Ryc. 7. Guzowatość nosa przed leczeniem.
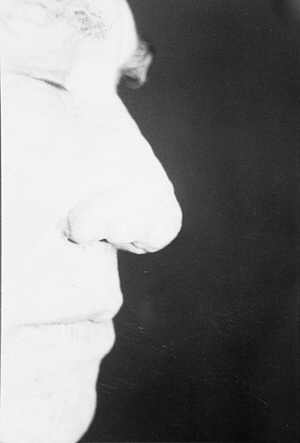
Ryc. 8. Guzowatość nosa po dwóch turach naświetlań laserem CO2.
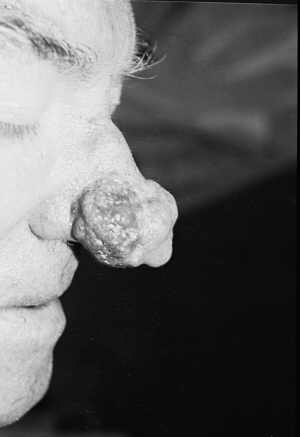
Ryc. 9. Guzowatość nosa przed leczeniem.
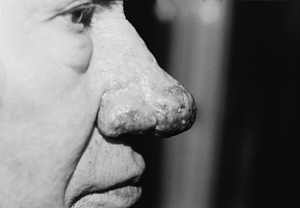
Ryc. 10. Guzowatość nosa – 7 dni po drugim zabiegu laserowym.
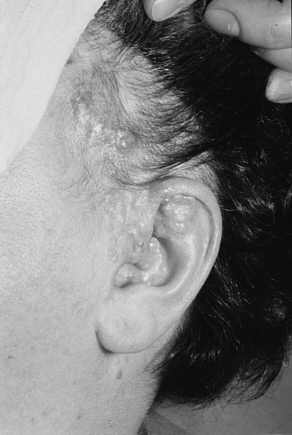
Ryc. 11. Mnogie nabłoniaki gruczolakowato-torbielowe u 45-letniej kobiety.
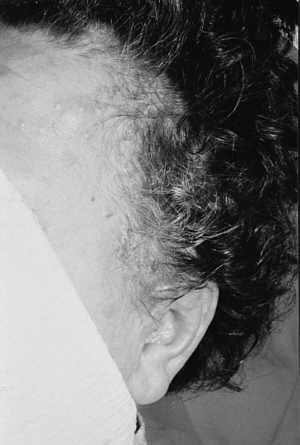
Ryc. 12. Mnogie nabłoniaki gruczolakowato-torbielowe – 3 miesiące po zabiegu laserem CO2.
Rezonator optyczny składa się z dwóch zwierciadeł, jednego całkowicie odbijającego oraz drugiego wyjściowego częściowo przepuszczającego fotony światła, dzięki czemu dochodzi do powstania wiązanki promieniowania o wysokiej energii.
Obszar widma i długość fali powszechnie stosowanych laserów w Polsce:
| laser | obszar widma | długość fali |
| helowo-neonowy | czerwone | 632,8 nm |
| rubinowy | czerwone | 694,3 nm |
| argonowy | niebiesko-zielony | 488-514,5 nm |
| Nd: YAG | bliska podczerwień | 1060 nm |
| CO2 | daleka podczerwień | 10 600 nm |
Promieniowanie emitowane przez wszystkie typy lasera ma trzy istotne właściwości: monochromatyczność, spójność czasową i przestrzenną oraz nieznaczną rozbieżność. Monochromatyczność ma szczególne znaczenie w zabiegach dermatologicznych, ponieważ kolor światła dobiera się w zależności od koloru tkanki napromiennej. Wiązka światła laserowego wykazuje nieznaczną rozbieżność, co powoduje, że jej gęstość energii jest duża i względnie stała w przestrzeni.
Ważną cechą światła laserowego jest tzw. plamka, jest to powierzchnia o kształcie koła, którego częścią centralną jest oś wiązki promieniowania i w którym przenoszone jest ok. 90% energii wiązki. W miarę jak odsuwana jest końcówka lasera od skóry, średnica plamki maleje lub powiększa się lub jest zogniskowana. Zjawisko to zostało wykorzystane w leczeniu laserem CO2, gdzie zogniskowany strumień służy do cięcia, a strumień rozproszony powoduje niszczenie i usuwanie tkanek.
Oddziaływanie światła laserowego CO2 na skórę
Warunkiem koniecznym do powstania efektu działania światła laserowego na skórę jest jego pochłonięcie przez wodę tkankową (1). Interakcja między światłem laserowym i tkanką jest procesem złożonym i zależy od wielu czynników. Kiedy wiązka promienia laserowego zostanie skierowana na skórę, energia elektromagnetyczna zostaje natychmiast zamieniona na energię cieplną, co powoduje gwałtowny wzrost temperatury w niewielkiej objętości tkanki obejmującej okolicy plamki (14). W przypadku kiedy temperatura tkanki po naświetlaniu wynosi od 50 do 100°C dochodzi do martwicy termicznej. Natomiast gdy temperatura przekracza 100° dochodzi do wyparowania wody z tkanki co powoduje rozerwanie komórek i zniszczenie struktury tkanek (3). Aby uniknąć nadmiernego uszkodzenia tkanek, związane jest to w konsekwencji z ewentualnym najczęstszym powikłaniem po zabiegu czyli zbliznowaceniem, czas naświetlania powinien być wystarczająco krótki (11, 16).
Intensywna reakcja cieplna powoduje zniszczenie tkanek absorbujących światło. To specyficzne zniszczenie tkanek docelowych nazwane zostało przez Andersona i Parrisha w 1983 r. selektywną fototermolizą. Teoria głoszona przez tych autorów zakłada, że selektywna absorpcja światła laserowego przez tkankę powoduje wybiórcze zniszczenie, może być to wykorzystane do selektywnego usuwania zmian skórnych przez odpowiednio dobrany typ lasera (3, 13).
Charakterystyka pochłaniania światła przez składniki tkanek
Laser CO2 emituje falę elektromagnetyczną o długości 10 600 nm, która jest niewidzialna dla oka i jest absorbowana przez płyn wewnątrz- i zewnątrztkankowy. Absorpcja ta nie jest selektywna i powoduje uszkodzenie tkanek do głębokości 0,6 mm (6). Po naświetlaniu następuje martwica zakrzepowa sięgająca 0,4-0,5 mm w głąb warstwy siateczkowatej skóry oraz strefa termicznego uszkodzenia powstająca wokół strefy wyparowania (11, 16), która może powodować nawet znaczne bliznowacenie w miejscu usuwanej zmiany. Tak więc korzystny efekt związany z działaniem promieniowania laserowego CO2, polegający na odparowaniu tkanek zmienionych chorobowo, może być powikłany oszpeceniem.
Pomimo przedstawionych wad i wprowadzenia innych typów lasera do leczenia zmian skórnych nadal laser CO2 jest najbardziej popularnym w praktyce dermatologicznej.
Do głównych zalet tego typu leczenia należy:
1. Możliwość precyzyjnego usuwania tkanek poprzez odparowanie i cięcie.
Jak już wspomniano na wstępie, laser CO2 w zależności od odległości końcówki od powierzchni skóry i posiadanego ogniska może dawać promień zogniskowany i nieznacznie rozproszony. Jeżeli końcówka przylega do powierzchni skóry plamka promienia laserowego jest zogniskowana, powoduje to duże nagromadzenie energii w małym punkcie i wówczas można dokonać zabieg poprzez cięcie. Jeżeli odsuniemy końcówkę od powierzchni skóry plamka ulega poszerzeniu, promień fali elektromagnetycznej jest rozproszony i wtedy mniejsza ilość energii przypada na powierzchnię, co w konsekwencji pozwala na bardziej powierzchowne usuwanie zmian. Zmieniając moc i czas ekspozycji możemy precyzyjnie usuwać zmiany chorobowe (20).
2. Zabiegi laserem CO2 są bezkrwawe. Zogniskowanym strumieniem promieniowania nie tylko można wykonać cięcie, ale także doprowadzić do zamknięcia naczyń krwionośnych do średnicy o 0,5 mm, małych naczyń limfatycznych oraz zakończeń nerwowych (20).
3. Możemy kontrolować głębokość strefy termicznego uszkodzenia tkanek. Promieniowanie w sposób ciągły doprowadza do powstawania trzech stref uszkodzenia. Pierwsza strefa to strefa odparowania, która pozwala nam na usunięcie zmian chorobowych bez powikłań, następna termicznego uszkodzenia i strefa koagulacji. W celu uniknięcia dużej powierzchni uszkodzenia termicznego, impuls lasera powinien być wystarczająco krótki, by tkanka napromieniowana uległa ochłodzeniu (thermal relation time) i wynosi około 1 ms (2, 3). Skonstruowano lasery, w których ciągły strumień światła został pocięty na odcinki 0,1-1-sekundowe, co pozwala w przerwach pomiędzy impulsami na ochłodzenie się tkanek zmniejszając w ten sposób strefę termicznego uszkodzenia. Lasery CO2 nowej generacji, modele superpulsacyjny i ultrapulsacyjny wytwarzają impulsy trwające od 250 µ:s do 1 ms i pozwalają na nakładanie w tym samym miejscu zabiegu 2-3-krotne impulsy laserowe. Umożliwia to kontrolę głębokości odparowania skóry, bez uszkodzenia okolicznych tkanek (11, 16). Strefa uszkodzenia termicznego przy użyciu lasera ultrapulsacyjnego jest 4-krotnie mniejsza niż przy zastosowaniu lasera z emisją ciągłą (10, 18).
4. Regeneracja włókien kolagenowych.
Pod wpływem promieniowania wytwarzanego przez laser CO2 następuje skracanie się włókien kolagenowych o 1/3 długości, co z kolei powoduje pogrubienie skóry oraz jej wygładzenie. To przemodelowanie włókien wykorzystano przy usuwaniu zmarszczek oraz blizn potrądzikowych (10). Jakkolwiek należy zauważyć, że kalogen ma niewielki zakres tolerancji na wysoką temperaturę i np. temperatura do 58°C powoduje skracanie i pozaginanie włókien, natomiast temp. 61°C powoduje nieodwracalne zniszczenie.
Przygotowanie do zabiegu
Celem uniknięcia powikłań po leczeniu laserochirurgicznym należy:
1. Dokładnie przeprowadzić wywiad ze szczególnym uwzględnieniem występowania opryszczek nawrotowych, skłonności do bliznowaceń, występowania przebarwień skóry oraz chorób ogólnoustrojowych (padaczka, cukrzyca).
2. Określenie rodzaju skóry.
Pacjenci, którzy są skłonni do ciężkich oparzeń słonecznych, powinni unikać tej metody leczenia, natomiast z I, II i III typem skóry najlepiej nadają się do laseroterapii.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Absten G., Joffe S.: Lasers in Medicine. An Introductory Guide. Cambridge University Press, Cambridge, 1985. 2. Anderson R., Pamsh J.: The optics of human skin. J. Invest. Dermatol., 1981, 70:9-13. 3. Anderson R., Parrish J.: Selective photothermolysis precise microsurgery by selective absorption of pulsed radiation. Science, 1983, 220:524-7. 4. Apfelberg D. et al.: CO2 laser resection for gigant perineal condylomata and verrucous carcinoma. Ann. Plast. Surg. 1983, 11:417-22. 5. Baggisk M. et al.: Presence of human immunodeficiency virus DNA in laser smoke. Laser Surg. Med. 1991, 11:197-203. 6. Ben-Bassat M. et al.: A study of the ultrastructural feature of the cut margin of skin and mucous membrane specimens excised by carbon dioxide laser. J. Strug. Res., 1976, 21:77-84. 7. Baldwin H., Geronemus R.: The treatment of Zoon´s balanitis with the carbon dioxide laser. J. Dermatol. Surg. Oncol., 1989, 15:491-4. 8. Ferenczy A.: Laser therapy of genital condylomata acuminata. Obstet. Gynecol., 1984, 63:703-707. 9. Fitzpatrick R., Goldman M.: Advences in carbon dioxide laser. Surgery Clin. Dermatol., 1995, 13:35-47. 10. Fitzpatrick R. et al.: Clinical adventage of the CO2 laser superpulsed mode treatment of verruca vulgaris, seborrhoic keratosis, lentigines and actinic cheilitis. J. Dermatol. Surg. Oncol., 1994, 20:449. 11. Fitzpatrick R. et al.: The depth of thermal necrosis using the CO2 laser: a comparison of the superpulsed mode and conventional mode. J. Dermatol. Surg. Oncol., 1991, 9:297-316. 12. George J. et al.: Lasers in Dermatology. Arch. Dermatol., 1993, 129:136-145. 13. Gibson K., Kernohan W.: Laser in Medicine. Journal of Medical Engineering, 1993, 17:51-57. 14. Goldman L. (ed.): The Biomedical Laser. Technology and Clinical Applications. Springer-Verlag, New York, 1981. 15. Goldman L. et al.: Effect of the laser beam on the skin: preliminary report. J. Invest. Dermatol., 1963, 40:121-2. 16. Hobbs E. et al.: Superpulsed lasers: minimizing thermal damage with short duration, high irradiance pulses. J. Dermatol. Surg. Oncol., 1987, 13:955-64. 17. Maiman T.: Stimulated optical radiation in ruby. Nature, 1960, 187:493-4. 18. Kauvar A. et al.: Char-free tissue ablation: a comperative histopathological analysis of new carbon dioxide (CO2) laser systems (Abstract). Laser surg. Med., 1995, 15 (suppl.7):50. 19. Ratz J.: Carbon dioxide laser treatment of balanitis xeritica obliterans. J. Am. Acad. Dermatol., 1984, 10:925-8. 20. Reid R.: Physical and surgical principles goveming carbon dioxide laser surgery on the skin. Dermatol. Clin., 1991, 9:297-316. 21. Rosenbach A., Alster T.: Multiple trichoepitheliomas successfully treated with a high-energy, pulsed carbon dioxide laser. Dermatol. Surg., 1997, 23:708-710. 22. Sawchuk W. et al.: Infections papillomavirus in the vapor of warts treatment with carbon dioxide laser or electrocoagulation: detection and protection. J. Am. Acad. Dermatol., 1989, 21:41-9. 23. Woodruff J.: Carcinoma in situ of the vulve. Clin. Obstet. Gynecol. 1985, 28:230-9. 24. Woźniak J. et al.: Use of CO2 laser in treatment of condylomata acuminata anogenital region in pregnent women. Ginek. Pol., 1995, 66, 2:103-7. 25. Zelickson B., Roenigk R.: Actinic cheilitis. Treatment with the carbon dioxide laser. Cancer, 1990, 65(6):1307-11.














