© Borgis - Nowa Stomatologia 4/2000, s. 33-39
Piotr Wieczorek, Marcin Pochwalski, Andrzej Wojtowicz
Inżynieria tkankowa III.
Możliwości sterowania procesami regeneracji nerwów obwodowych – przegląd piśmiennictwa
Tissue engineering III. Opportunities of guided peripheral nerve regeneration – literature review
z Zakładu Chirurgii Stomatologicznej, Katedry Chirurgii Szczękowo-Twarzowej Instytutu Stomatologii Akademii Medycznej w Warszawie
Kierownik Zakładu: dr hab. n. med. Andrzej Wojtowicz

WSTĘP
Dynamiczny rozwój badań w zakresie technik i procedur neurochirurgicznych nastąpił w okresie II wojny światowej, w związku z olbrzymią liczbą obrażeń, przebiegających z uszkodzeniem nerwów obwodowych. Celem postępowania leczniczego jest odtworzenie ciągłości nerwu i jego funkcji. Możliwości leczenia chirurgicznego to: naprawa nerwu, przeszczep nerwu, przeniesienie z sąsiedztwa (transfer), przeszczep unerwionego mięśnia (np. w przypadku uszkodzenia nerwu twarzowego) oraz stworzenie kanału dla wrastających zakończeń nerwowych z wykorzystaniem materiałów auto- i allogennych np. żył, ścięgien czy rurek z kwasu poliglikolowego itp.
KLASYFIKACJA USZKODZEŃ OBWODOWYCH ZAKOŃCZEŃ NERWOWYCH
Najczęściej ulegają urazom w obrębie twarzy i jamy ustnej:
– nerw zębodołowy dolny,
– nerw językowy,
– nerw podoczodołowy,
– nerw twarzowy,
– nn. oko-ruchowe.
Przyczynami uszkodzeń tych nerwów są urazy zewnętrzne i jatrogenne. Uszkodzenie nerwu zębodołowego dolnego może towarzyszyć złamaniu żuchwy, ekstrakcji zębów mądrości, pogrążeniu implantu zębowego, leczeniu kanałowemu zębów trzonowych dolnych, cystektomii, usuwaniu guzów żuchwy, osteotomii trzonu żuchwy.
Nerw językowy, przebiegający wzdłuż okostnej na językowej powierzchni żuchwy, ulega urazom podczas zabiegu usuwania zębów mądrości, najczęściej gdy zachodzi konieczność odwarstwienia okostnej od strony językowej. Inne częste przyczyny jatrogennego uszkodzenia nerwu językowego to: iniekcje, sialodektomie, osteotomie. Nerw podoczodołowy najczęściej ulega uszkodzeniu przy urazach szczęki i osteotomii typu Le Fort I oraz podczas zabiegów chirurgicznych w obrębie oczodołu. Przyczynami porażenia nerwu twarzowego mogą być m.in.: infekcja wirusowa, urazy, niewłaściwie zaplanowane nacięcie powłok, operacje chirurgiczne na podstawie czaszki i śliniankach przyusznych. Porażenie nerwu VII winno być leczone możliwie najszybciej ze względu na zależną od czasu utratę funkcji mięśni mimicznych twarzy. Diagnoza uszkodzenia nerwu jest stosunkowo prosta. Uraz nerwu czuciowego objawia się drętwieniem, parestezjami i bólem w obszarze unerwienia najczęściej w przypadku wytworzenia się nerwiaka. Uszkodzenie nerwu ruchowego powoduje paraliż mięśni. Bardzo ważne w diagnostyce porażeń nerwów są obiektywne pomiary czucia i funkcji ruchowych nerwu, wykonywane tuż po urazie, a także w trakcie leczenia jako badanie kontrolne. Porażenia nerwu V i VII są przyczyną poważnych subiektywnych i obiektywnych zaburzeń funkcji i estetyki. Jatrogenne uszkodzenia bywają nierzadko podstawą spraw sądowych wytaczanych przeciw lekarzom. Również w związku z tym niezmiernie ważne jest szybkie podjęcie leczenia i prowadzenie szczegółowej dokumentacji.
W 1943 r. Seddon opisał 3 kliniczne postacie uszkodzeń nerwów (41):
– neuropraksja (neurapraxia),
– aksonotmeza (axonotmesis),
– neurotmeza (neurotmesis).
Neuropraksja cechuje się blokiem przewodnictwa nerwu. Histologicznie zaburzenia te charakteryzują się segmentową demielinizacją. Nie opisuje się uszkodzeń aksonu. Neuropraksja zwykle szybko ustępuje i nerw wraca do swej prawidłowej funkcji.
Aksonotmeza to uszkodzenie aksonu, objawy degeneracji nerwu ujawniają się dystalnie od miejsca uszkodzenia. Możliwe jest całko-wite samoistne przywrócenie funkcji pod warunkiem, że czas odnerwienia mięśnia nie przekracza 12 miesięcy. Umownie przyjmuje się rok za okres, po którym odnerwiony mięsień nie powraca do swej funkcji (27).
Neurotmeza to całkowite przecięcie nerwu. Nie jest możliwa samoistna regeneracja nerwu. Ten rodzaj urazu stanowi największe wyzwanie dla chirurgii rekonstrukcyjnej.
W 1951r. Sunderland rozszerzył klasyfikację dodając dwa stopnie uszkodzeń nerwów pomiędzy aksonotmezą i neurotmezą (46) (tab.1). III i IV stopień uszkodzenia nerwów wg Sunderlanda nie ma swojego odpowiednika w skali Seddona. I, II, III typ uszkodzeń nie wymaga leczenia chirurgicznego, IV i V typ powinien być leczony chirurgicznie poprzez naprawę nerwu lub jego przeszczepienie.
Tabela. 1. Klasyfikacja uszkodzenia nerwów (wg Seddona i modyfikacji Sunderlanda).
| Stopień uszkodzenia | Regeneracja | Czas regeneracji | Leczenie chirurgiczne |
| I neuropraksja | całkowita | szybki, kilka dni do 12 tyg. | nie wymaga |
| II aksonotmeza | całkowita | wolny, 1 miesiąc | nie wymaga |
| III | możliwa | wolny, 1 miesiąc | nie wymaga lub neuroliza |
| IV | brak | brak regeneracji | naprawa nerwu, przeszczep |
| V neurotmeza | brak | brak regeneracji | j.w. |
REGENERACJA NERWU PO URAZIE
W części proksymalnej nerwu w wyniku urazu dochodzi głównie do wzrostu aktywności procesów regeneracyjnych, natomiast w części dystalnej dominują procesy degeneracyjne. Część proksymalna ulega również degeneracji, lecz na ograniczonym obszarze i zależy to od dwóch czynników: rodzaju urazu oraz miejsca, w którym on zadziałał (odległość od ciała komórki nerwowej). Im silniejszy uraz i im bliżej komórki nerwowej, tym gorsze rokowanie (włącznie z obumarciem komórki nerwowej) (18, 39). Ostatnie badania dowodzą, iż śmierć komórki nerwowej może być związana z miejscowym wzrostem aktywności cytokin o działaniu katabolicznym (3). Badania prowadzone na zwierzętach dowodzą lepszej regeneracji nerwów u młodych osobników. Potwierdza to zależność procesów naprawczych od wieku i aktywności nerwowej uszkodzonych tkanek (40).
Już w 24 godziny po przecięciu nerwu rozpoczynają się procesy regeneracji. Każde włókno nerwowe tworzy na swoim końcu wiele małych włókienek, które przyczepiają się do blaszki podstawowej komórek Schwanna. Według Tinela nerw regeneruje się z szybkością 1 mm dziennie, natomiast według Seddona 1,5 ± 0,2 mm dziennie (7, 44).
Po przecięciu nerwów czuciowych w części dystalnej dochodzi do procesów zwyrodnieniowych, ponadto w receptorach czuciowych dochodzi do powstania zmian morfologicznych (14).
Badania nad powrotem czucia przeprowadzono na wolnych przeszczepach skóry (10,12). Regeneracja wówczas postępuje od części proksymalnej do dystalnej, co daje powrót czucia bólu, temperatury i dotyku (32). Przywrócenie tych funkcji może, w przypadku nerwu czuciowego, trwać nawet kilka lat. Mięsień po przecięciu nerwu ruchowego staje się niewrażliwy na reinerwację po około 12 miesiącach. Jest to prawdopodobnie związane z postępującym nieodwracalnym zwłóknieniem (50), a nie z morfologicznymi zmianami w końcowych płytkach motorycznych. Początkową reakcją płytki motorycznej na odnerwienie jest wytworzenie wielu receptorów acetylocholinowych wokół synapsy. Receptory te lokalizują się wzdłuż całej długości włókna nerwowego (17). W chwili gdy wzrastające proksymalne kikuty aksonów dotrą do tych receptorów, zanim nastąpi nieodwracalne zwłóknienie mięśni, powstają nowe synapsy, a funkcja powraca, choć nie w pełnym zakresie. Ze względu na fizjologiczne ograniczenia w przypadku uszkodzonego nerwu twarzowego, niezwykle istotne jest możliwe szybkie wdrożenie właściwego postępowania chirurgicznego, polegającego na przywróceniu ciągłości nerwu.
ROLA TKANKI ŁĄCZNEJ OTACZAJĄCEJ NERWY
Tkanka łączna towarzysząca nerwom pełni nie tylko rolę podpo-rową, ochronną oraz spajającą włókna nerwowe w pęczki, ale też tworzy swoiste środowisko, dla szeregu czynników wzrostowych i cytokin (m.in. BMP-6 białko morfogenetyczne kości), niezbędnych w procesie regeneracji i wrastania włókien nerwowych w różne tkanki np. efektorowe. Tkanka łączna "okrywa" składowe nerwów obwodowych (ryc.1) (36). Schemat przedstawia morfologiczne relacje tkanki łącznej w stosunku do włókien nerwowych. Każdy akson jest zamknięty bezpośrednio w cienkiej pochewce (śródnerwie, endoneurium), zwanej też tubą, zbudowanej z kolagenu typu I. Ta bardzo cienka warstwa zawiera nieliczne fibroblasty. Kolejną warstwę, pomiędzy pochewkami (onerwie, perineurium) tworzy luźna struktura zbudowana z kolagenu i innych składników macierzy pozakomórkowej. Wreszcie najbardziej zewnętrzną warstwą tkanki łącznej (nanerwie, epineurium) stanowią skoncentrowane włókna kolagenu typu I z licznymi fibroblastami (43). Uraz epineurium powoduje aktywację procesów naprawczych (gojenia rany), z początkową fazą naciekania komórkami zapalenia (neutrofile i makrofagi), które produkują TGFb. Fibroblasty epineuronalne odpowiadają na TGFb proliferacją i syntezę prokolagenu typu I, co w efekcie prowadzi do powstania blizny składającej się głównie z kolagenu typu I w obrębie tkanki nerwowej (38).

Ryc. 1. Klasyczne zespolenie nerw-przeszczep.
Nerwiaki pourazowe (Neuroma)
Uszkodzony nerw goi się poprzez regenerację aksonu. Jak już wspomniano fibroblasty pochodzące z najbardziej zewnętrznej warstwy pochewki nerwu (epineurium), reagują na uraz produkcją zwiększonej ilości kolagenu typu I. Synteza ta bywa na tyle intensywna, iż może spowodować zahamowanie skutecznej odnowy ciągłości aksonu w skutek wrastania pomiędzy jego uszkodzone fragmenty. Mimo to "wzrost" aksonu postępuje i w efekcie zostaje on wmieszany w bliznę kolagenową, tworząc nerwiaka pourazowego (neuroma)(37). Ta zdezorganizowana mieszanina włókien kolagenowych i włókna nerwowego (aksonu), występująca w formie guza, jest przyczyną silnych dolegliwości bólowych odczuwanych przez chorego, a jednocześnie przyczyną zahamowania odbudowy ciągłości i funkcji nerwu.
Postępowanie lecznicze polega wówczas na doszczętnej resekcji zmienionego odcinka nerwu wraz z guzem z równoczesną rekonstrukcją anatomicznej ciągłości nerwu np. przeszczepem (nerve graft). Z kolei regenerujące się włókna nerwowe w kontakcie z przeszczepem, nie wytwarzają nerwiaka i przeważnie skutecznie przerastają przeszczep dochodząc do dystalnej części nerwu. Jeżeli przeszczepienie nerwu nie jest możliwe, preferuje się wycięcie nerwiaka z następowym przemieszczeniem proksymalnego kikuta nerwu w obręb mięśni lub głęboko w tkanki miękkie. Postępowanie takie, zapobiega powstaniu nerwiaka, jednak odbywa się to kosztem odnowy funkcji nerwu. Czasem stosuje się przemieszczenie sąsiednich nerwów (nerv transfer) do dystalnego kikuta przerwanego nerwu, co pozwala na częściowe przywrócenie funkcji (13) .
ROZWÓJ TECHNIK CHIRURGICZNYCH
Dwa najistotniejsze osiągnięcia w neurochirurgii to studia anatomiczne Sunderlanda (47) oraz metody naprawy chirurgicznej nerwów bez napięcia tkanek zaproponowane przez Highet i Sandersa (20), a spopularyzowane przez Millesi (34). Pierwsze autogenne przeszczepy fragmentów nerwów wykonywano w 1870 roku, później zostały one upowszechnione przez Seddona w 1940 r. i 1950 r. (42) (ryc. 2). Langley i Anderson (22) na początku XX wieku, wprowadzili pojęcie przemieszczania nerwu (nerv transfer), jako alternatywę dla długich przeszczepów. To przemieszczanie nerwów (neurotyzacja) dało np. podstawę technikom przemieszczania nerwu podjęzykowego do nerwu twarzowego.
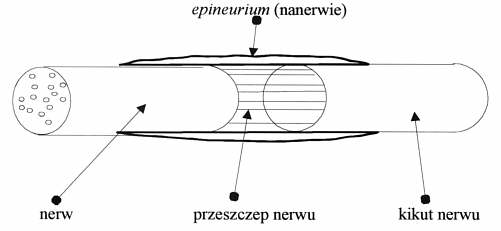
Ryc. 2. Morfologiczne relacje tkanki łącznej w stosunku do włókien nerwowych.
Podstawową metodą naprawy uszkodzeń nerwów jest szycie epineuronalne czyli takie, w którym szwy zakładane są jedynie na zewnętrzną pochewkę nerwu (nanerwie, epineurium) (24). Preferowane są nylonowe mikronici 9-0,10-0 (16). Początkowo stosuje się szew 8-0 na epineurium jako zbliżający (stabilizujący kikuty), który następnie usuwa się po zakończeniu szycia nićmi 9-0, 10-0. Nici 8-0 służą także do wstępnej oceny napięcia tkanek naprawianego nerwu. Preferuje się szwy węzełkowe. Rekonstrukcja, a także gojenie, winny przebiegać bez napięcia nerwu, oraz bez napięcia tkanek otaczających nerw. Przebadano wpływ występowania napięcia tkanek przy zabiegach naprawczych nerwów. Wyniki wskazują na to, iż wydłużenie nerwu o 15% powoduje spadek przepływu krwi przez napięte tkanki o 78% (20). Ma to oczywiste skutki kliniczne. Z drugiej strony, z punktu widzenia osiągnięcia powrotu funkcji nerwu, bezpośrednia, pierwotna naprawa nerwu jest lepsza od naprawy z wykorzystaniem przeszczepu. Istnieją prace opisujące wykorzystanie kleju fibrynowego. Jednak postępowanie takie niesie za sobą ryzyko przeniesienia chorób zakaźnych (33).
Opisano także kilka technik naprawy uszkodzonych nerwów przy pomocy lasera (21). Wiąże się z tym jednak ryzyko przegrzania tkanek, jak również możliwość powikłania w postaci rozejścia się rany. Lasery średniej mocy zmniejszają uraz termiczny nerwu, nie zapewniają jednak właściwej odporności na rozciąganie, natomiast lasery wysokiej mocy zmniejszają prawdopodobieństwo rozejścia się rany powodując jednocześnie niekorzystną termokoagulację włókien nerwowych.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Badalamente M.A. et al.: Neuropmuscular recovery after peripheral nerve repair: Effects of an orally-administrated peptide in aprimate model. J. Reconstr. Microsurg. 1995, 11: 429-437. 2. Badalamente M.A. Stracher A.: Delay of muscle degeneration and necrosis in mdx mice by calpain inhibition. Muscle & Nerve. 23(1):106-11, 2000 Jan. 3. Baranowski A.P. et al.: Substance P in cutaneous primary sensory neurons-a comparison of models of nerve injury that allow varying degrees of regeneration. Neuroscience 1993: 55: 1025-1036. 4. Bunge R.P. Bunge MB.: Evidence that contact with connective tissue matrix is required for normal interaction between Schwann cells and nerve fibers. J Cell Biol 1978, 78:943-950. 5. Chen L.E. et al.: Denaturated muscle as a nerve conduit: A functional, morphologic, and electrophysiologic evaluation. J. Reconstr Microsurg. 1994, 10: 137-144. 6. Chiu DTE, et al.: Autogenous vein graft as a conduit for nerve regeneration. Surgery 1982, 91: 226-233. 7. Clark D.: Jules Tinel and Tinel´s sign. Clin. Plast. Surg 1983, 10:627-628. 8. Collin W. Donoff R.B.: Nerve regeneration across collagen tubes. J. Dent. Res. 1984, 63:987-993. 9. Crawley W.A. Dellon A.L.: Inferior alveolar nerve reconstruction with a polyglycolic acid bioabsorbabale nerve conduit. Plast Reconstr. Surg. 1992, 90: 300-302. 10. Davis L.: The return of sensation to transplanted skin. Surg. Gynecol. Obstet. 1934, 59: 533-543. 11. DeLeon M.,et al.: Identification of transcriptionally regulated genes after sciatic nerve injury. J Neurosci Res 1991, 29:437-448. 12. Dellon AL.: Sensory recovery in replanted digits and transplanted toes. A. review. J. Reconstr . Microsurg. 1986, 2:123-129. 13. Dellon A.L., et al.: Implantation of sensory nerve into muscle: Preliminary, clinical and experimental observations on neuroma formation Ann Plast. Surg. 1984, 12:30-40. 14. Dellon Al., Witebsky FG.: The denervated Meissner corpuscle. A sequential histologic study following nerve division in the Rhesus monkey. Plast Reconstr. surg. 1975, 56:182-193. 15. Francel P.C. et al.: Enhancing nerve regeneration across a silicone tube conduit using interposed short-segment nerve grafts. J. Neurosurg 1997, 87: 887-892. 16. Giddens G.E. et al.: Primary nerve repair: Strength of repair with different gauges of nylon suture material. J. Hand Surg. (Br) 1989, 14(B): 301-302. 17. Gorio A. Carmignoto G.: Reformmation, maturation and stabilization of neuromuscular junctions in peripheral nerve regeneration. In: Gorio A, Millesi H, Mingrino S (eds). Posttraumatic Peripheral Nerve Regeneration. New York: Raven Press, 1981: 481-492. 18. Graeber M.B., Mehraein P.: Synaptic stripping in the human facial nerve nucleus. Acta Neuropathol., 1993; 86:179-181. 19. Harding D.I. et al.: Stabilizing neuromuscular contacts reduces motoneuron death caused by paralysis of muscles in neonatal rats.Neuroscience. 93 (3): 1141-6, 1999. 20. Highet W.B., Sanders FK.: The effects of stretching nerves after suture. Br. J. Surg. 1943, 30: 355-369. 21. Korff M. et al.: An investigationof the potential for laser nerve welding. Otolaryngol. Head Neck Surg. 1992, 106:3455-350. 22. Langley J.N., Anderson H.K.: The union of different kinds of nerve fibers, J. Physiol. 1904, 31:365-391. 23. Laquerriere A. et al.: Effect of basic fibroblast growth factor and alpha-melanocytic stimulating hormone on nerve regeneration through a collagen channel. Microsurgery 1994, 15:203-210. 24. Levithal R.: Comparison of fascicular, interfascicular and epineurial suture techniques in the repair of simple nerve lacerations. J. Nerosurg. 1977, 47:744-750. 25. Lyon M.F. et al.: A gene affecting Walerian degeneration maps distally on mouse chromosome 4. Proc. Natl. Acad. Sci. USA 1993, 90: 9217-9220. 26. Mackel R. et al.: Reinnervation of mechanoreceptors in the human glabrous skin following peripheral nerve repair. Brain Res 1983, 268:49-53. 27. Mackinon S.E., Dellon A.L.: Surgery of the Peripheral Nerve. New York: Thieme, 1988, 28. Mackinnon S.E., Dellon A.L.: A study of nerve regeneration across synthetic (Maxon) and biologic (collagen) nerve conduits for nerve gaps up to 5 cm in the primate. J. Reconstr. Microsurg. 1990, 6: 117-121. 29. Mackinnon S.E., Dellon A.L.: Clinical nerve reconstruction with a bioabsorbable polyglycolic acid tube. Plast. Reconstr. Surg. 1990, 85:419-425. 30. Mackinnon S.E. et al.: Comparison of regeneration across a sural nerve graft and a vascularized pseudoseath. J. Hand. Surg. (Am) 1988, 13(A):935-942. 31. Mackinnon S.E. et al.: A primate model for chronic nerve compression. J. Reconstr. Microsurg. 1985, 1:185-194. 32. Mannerfelt L.: Evaluation of functional sensation of skin grafts in the hand area. Br. J. Plast. Surg. 1962, 15:136-154. 33. Medders G, et al.: Effects of fibrin glue on rat facial nerve regeneration. Otolaryngol. Head Neck. Surg. 1989,100;106-109. 34. Millesi H.: Healing of nerves. Clin. Plast. Surg. 1977;4:459-473. 35. Molander H, et al.: Regeneration of peripheral nerve through a polyglactin tube. Muscle Nerve 1982, 5:54-59. 36. Nath R.K, et al.: Spatial pattern of type 1 collagen expression in injured peripheral nerve. J. Neurosurg. 1982, 10: 268-276. 37. Petropoulos P.C, Stefanko S.: Experimental studies of posttraumatic neuroma under various experimental conditions. J. Surg. Res. 1961, 1:235-241. 38. Rufer M. et al.: Presence and regulation of transforming growth factor beta mRna and protein in the normal and lesioned rat sciatic nerve. J. Neurosci. Res. 1994, 39: 412-423. 39. Schoen S.W, et al.: 5´- nucleotidase immunoreactivity of perineural microglia responding to facial nerve axotomy. Glia 1992, 6:314-317. 40. Schmalbruch H.: The effect of peripheral nerve injury on immature motor and sensory neurons and on muscle fibers. Rev. Neurol. 1988, 144:721-729. 41. Seddon H.J.: Surgical disorders of the peripheral nerves. New York: Churchill-Livigstone, 1975. 42. Seddon H.J.: The use of autogenous grafts for the repair of large gaps in peripheral nerves. Br. J. Surg. 1947, 35:151-156. 43. Siironen J. et al.: Collagen type I and III and fibronectin expression after transection of peripheral nerve: Reinnervation compared to denervation. Lab. Invest 1992, 67:80-87. 44. Smith B.H, Komblith P.L.: Axonoplasmic transport and neurological surgery. Neurosurgery 1982,10:268-276. 45. Spector J.G., Derby A.: Facial nerve regeneration through semipermeable chambers in the rabbit. Laryngoscope 1992, 102: 784-796. 46. Sunderland S.: Nerve injuries and their repair. New York Churchill-Livigstone, 1991. 47. Sunderland S.: Nerves and Nerve Injuries. Edinburgh: Churchill Livingstone, 1978. 48. Sunderland S., Ray L.J.: Denervation changes in mammalian stiated muscle. J. Neurol. Neurosurg Psychiatry 1950, 13: 156-165. 49. Szal G.J. Miller T.: Surgical repair of facial nerve branches: An analysis of differenrt sheating and suturing techniquess. Acta. Otolaryngol. (Stockh) 1975, 101: 160-165. 50. Tews D.S. et al.: Morphology of experimentally denervated and reinnervated rat facial muscle. Histochemical and histological findings. Euro. Arch. Otorhinolaryngol. 1994, 251:36-40. 51. Whitworth I.H. et al.: Nerve growth factor enhances nerve regeneration through fibronectin grafts. J. Hand. Surg. (Br) 1996, 21 (B):514-522. 52.Wingertzahn M.A.: Ochs R.S. Calcium mediated proteolysis enhances calcium release in skinned L6 myotubes. Receptors & Signal Transduction. 7(4):221-30, 1977


