© Borgis - Nowa Pediatria 1/2004, s. 3-12
Małgorzata Paul
Masowe badania serologiczne noworodków w kierunku obecności swoistych przeciwciał IgA i IgM anty-Toxoplasma gondii we krwi obwodowej pobranej na bibułę*
Serological screening of newborns for Toxoplasma gondii-specific IgA and IgM antibodies in peripheral blood collected on filter-papers.
z Katedry i Kliniki Chorób Tropikalnych i Pasożytniczych Akademii Medycznej
im. Karola Marcinkowskiego w Poznaniu
Kierownik Katedry i Kliniki: prof. AM dr hab. n. med. Jerzy Stefaniak
Streszczenie
Introduction: The strategic approach for preventing congenital toxoplasmosis is strictly related to the incidence of primary Toxoplasma gondii infection during pregnancy in a studied population. The aims of the regional neonatal screening programme were to detemine (i) the prevalence of congenital T. gondii infection at birth in the Wielkopolska region, (ii) the value of the serological examination of filter-paper blood specimens collected at birth for the diagnosis of congenital toxoplasmosis, and (iii) the duration of T. gondii-specific immunoglobulin A and immunoglobulin M antibodies in infants, untreated prenatally. Materials and methods: The neonates born in the obstetric clinics of the University Hospital in Poznań and in the maternity wards of the 10 main district hospitals from the Wielkopolska Province were systematically screened for congenital T. gondii infection. Peripheral blood from newborns was collected by a low invasive heel-stick puncture, absorbed onto Guthrie cards and analysed for anti-T. gondii specific IgM (1996-1998) or both IgA and IgM antibodies (1998-2000). Non-commercial immunodiagnostic tests were based on ultrasonicated Tx12 antigen of T. gondii tachyzoites from in vitro culture and monoclonal antibody anti-SAG1. Results: From June 1996 to April 2000, 45, 169 filter-paper specimens from liveborn neonates were screened: 27,516 samples were tested for specific IgM and the next 17,653 Guthrie cards were analysed by the combined IgA/IgM assay, elaborated for the first time. The prevalence of anti-Toxoplasma IgM in filter-paper eluates at birth was 1 per 2,117 liveborn neonates (0.47/1,000) or 1 per 1,185 infants (0.84/1,000) born to seronegative women with a potential risk of primary T. gondii infection during pregnancy. For the joint detection of IgA and IgM, these values significantly increased to 1 per 929 neonates (1.08/1,000) and 1 per 520 pregnancies at risk (1.92/1,000) respectively, comparing to the seropositivity rate of 43.7% in the pregnant women population of the studied area. Conclusions: (i) The neonatal screening for anti-Toxoplasma IgA or IgM antibodies is a good sensitivity method for an early postnatal diagnosis of congenital toxoplasmosis in newborns untreated prenatally. (ii) In the absence of obligatory nation-wide screening during pregnancy followed by an early prenatal treatment, this valuable technique may be considered a preventive option in areas with a high seroprevalence of T. gondii infection.

WSTĘP
Częstość występowania pierwotnego zarażenia Toxoplasma gondii w populacji kobiet ciężarnych w danym rejonie geograficznym, a także lokalne ryzyko przezłożyskowej transmisji inwazji, mają istotne znaczenie w wyborze racjonalnych metod zapobiegania wrodzonej toksoplazmozie u płodów i noworodków. Aktualnie na świecie stosowane są trzy zorganizowane formy prewencji toksoplazmozy wrodzonej, w zależności od okresu życia dziecka, w którym się je zaleca: 1) narodowy program serologicznych badań skryningowych wykonywanych przed planowaną ciążą oraz u pozbawionych przeciwciał kobiet ciężarnych, połączony z diagnostyką prenatalną przypadków podejrzanych o zarażenie (1, 2), 2) nieinwazyjne przesiewowe badania okołoporodowe przy użyciu krwi pępowinowej (3) oraz 3) badania skryningowe noworodków z zastosowaniem krwi obwodowej pobranej na bibułę filtracyjną (noworodkowe karty Guthriego) (4-7). Regularna kontrola poziomu swoistych przeciwciał u kobiet, które były seronegatywne w kierunku toksoplazmozy przed ciążą lub w pierwszym badaniu wykonanym na początku I trymestru, jest przeprowadzana obowiązkowo od lat siedemdziesiątych jedynie w Austrii i we Francji jako jeden z elementów kompleksowej opieki prenatalnej nad matką i dzieckiem, natomiast aktualnie jest ona jedynie zalecana w pozostałych krajach europejskich (8-12). Skojarzenie skryningowych badań serologicznych w okresie przedkoncepcyjnym z edukacją zdrowotną ciężarnych nt. zaleceń sanitarno-żywieniowych i sposobów uniknięcia zarażenia T. gondii, wydaje się być w chwili obecnej najbardziej skuteczną formą prewencji wrodzonej toksoplazmozy, jednakże w praktyce bardzo trudno jest uzyskać motywację u kobiet do wykonywania badań przed planowaną ciążą. Istnieją doniesienia, iż przestrzeganie prostych zaleceń sanitarno-higienicznych podczas ciąży może zmniejszyć ryzyko zarażenia T. gondii nawet o 60% (13).
Do niedawna, częstość występowania toksoplazmozy wrodzonej w populacji polskiej była ustalana jedynie szacunkowo, w oparciu o liczbę rejestrowanych w kraju zgonów w najcięższych przypadkach uogólnionej parazytemii i postacie objawowe choroby (14-16), które jak wiadomo, stanowią tylko nieznaczny odsetek zarażonych płodów (17, 18). Większość zachorowań pozostawało nie zdiagnozowanych lub były one rozpoznawane bezpodstawnie (19). Również pośrednie określanie częstości występowania wrodzonego zarażenia T. gondii w Polsce, poprzez porównywanie z krajami Europy Zachodniej o podobnych zwyczajach higienicznych i żywieniowych (np. Francja), okazuje się nie być wystarczające, ze względu na istniejące różnice w patogenności szczepów i izolatów T. gondii, w zależności od rejonu geograficznego (20), a także szeroko stosowaną prewencję Rowamycyną u zarażonych kobiet ciężarnych, która może ograniczać inwazyjność krążących w środowisku toksoplazm (21).
Dotychczasowe badania na obecność przeciwtoksoplazmowych przeciwciał IgM we krwi pępowinowej, wykonane metodą immunoadsopcji ISAGA (ang. Immuno Sorbent Agglutination Assay) u 2200 noworodków urodzonych przez seropozytywne matki w wybranych 4 oddziałach położniczych szpitali wielkopolskich, wykazały jedynie wyniki fałszywie dodatnie w 7 przypadkach, a u żadnego z 4311 noworodków nie stwierdzono objawów klinicznych mogących wskazywać na wrodzoną toksoplazmozę (22). Przeprowadzone badania sugerowały, iż częstość wrodzonego zarażenia T. gondii w Polsce jest znacznie mniejsza od oczekiwanej i wynosi prawdopodobnie mniej niż 1 na 1000 żywych urodzeń (22, 23). Stąd też nie podjęto się wówczas wprowadzenia w Polsce narodowego programu serologicznych badań przesiewowych u kobiet ciężarnych (16).
Wobec braku obowiązkowych, masowych badań przesiewowych ciężarnych w kierunku toksoplazmozy w naszym kraju, Ośrodek Akademicki w Poznaniu wprowadził w 1996 roku regionalny, serologiczny program pilotażowy, którego zadaniem była ocena aktualnej sytuacji epidemiologicznej w zakresie toksoplazmozy wrodzonej, oszacowanie stopnia ryzyka pierwotnego zarażenia w populacji kobiet ciężarnych oraz zwiększenie wczesnej wykrywalności wrodzonego zarażenia T. gondii na obszarze makroregionu Wielkopolski. Celem przedstawianej pracy była 1) ocena częstości występowania wrodzonego zarażenia T. gondii u wielkopolskich noworodków, 2) określenie wartości diagnostycznej własnych testów serologicznych wykrywających przeciwtoksoplazmowe przeciwciała IgA i IgM we krwi pobranej na bibułę w pierwszych dniach życia oraz 3) ocena długości utrzymywania się we krwi obwodowej nie przechodzących przez łożysko przeciwciał IgA i IgM u pacjentów nie leczonych w okresie życia płodowego, istotna dla ustalenia praktycznych możliwości laboratoryjnego potwierdzenia zarażenia w okresie pourodzeniowym.
Masowe badania przesiewowe noworodków na obecność swoistych immunoglobulin IgM przeciwko T. gondii we krwi pobranej na bibułę były dotychczas szeroko stosowane jedynie w stanach Massachusetts i New Hampshire (USA) oraz w Danii, w krajach, w których roczna liczba porodów nie jest wysoka (5, 7, 24). Wykrywanie immunoglobulin klasy IgA we krwi eluowanej z krążków noworodkowych kart Guthriego za pomocą nowej, łączonej metody immunoenzymatycznej analizy przeciwciał (IgA/IgM ELISA) zostało zastosowane po raz pierwszy w świecie (25).
MATERIAŁY I METODY
Badaniami serologicznymi w kierunku wrodzonej toksoplazmozy objęto noworodki urodzone w latach 1996-2000 w Klinikach Położniczych Klinicznego Szpitala Ginekologiczno-Położniczego Akademii Medycznej w Poznaniu oraz w 10 wybranych szpitalach rejonowych makroregionu Wielkopolski. Krew włośniczkową pobierano do badań w ciągu pierwszych 3 dni życia na oddziałach noworodkowych lub w domu przez pielęgniarki środowiskowe, wykorzystując mało inwazyjny sposób nakłucia pięty dziecka, a następnie nakrapiano na bibule filtracyjnej (Schleicher & Schuell, Dassel, Niemcy), podobnie jak w przypadku obowiązujących w kraju badań przesiewowych noworodków w kierunku fenyloketonurii i wrodzonej niedoczynności tarczycy. Noworodkowe karty Guthriego zawierały datę pobrania materiału, dane identyfikacyjne dziecka (imię i nazwisko matki, płeć dziecka, adres zamieszkania) wraz z podstawowymi informacjami o przebiegu ciąży i porodu (wiek ciążowy, data porodu, urodzeniowa masa ciała), a w laboratorium były one zaopatrywane w kolejny numer badania wraz z symbolem szpitala, w którym próbka została pobrana (ryc. 1). Karty bibuły były przekazywane do laboratorium serologicznego Kliniki drogą pocztową lub za pośrednictwem kuriera co najmniej jeden raz w tygodniu. Wszystkie próbki krwi pobrane od noworodków były badane w ciągu kilku dni od momentu dostarczenia ich do laboratorium. Do chwili wykonania badania były one przechowywane w temperaturze +4°C, w której swoiste przeciwciała zachowują swoją aktywność przez okres co najmniej 12 miesięcy. Po wykonaniu badania skryningowego próbki krwi były przechowywane w temperaturze – 20°C przez okres 2 lat, umożliwiając każdorazowo przeprowadzenie weryfikacji wyniku badania. O wyborze bibuły filtracyjnej, jako jedynej metody zaakceptowanej do badań przesiewowych noworodków, zadecydowała: 1) mała inwazyjność sposobu pobierania materiału do badań, 2) możliwość umieszczenia istotnych danych identyfikacyjnych oraz dotyczących porodu bezpośrednio na pobranej próbce przy łóżeczku noworodka (brak ryzyka pomylenia pacjentów), 3) łatwość transportu i przechowywania pobranych w ten sposób próbek krwi (temperatura pokojowa), 4) wysoka trwałość przeciwciał we krwi pobranej na bibułę oraz 5) ochrona krwi przed dodatkowym zakażeniem (filtr przeciwbakteryjny).

Ryc. 1. Wzór bibuły stosowanej do badań przesiewowych noworodków w kierunku wrodzonej toksoplazmozy na obszarze województwa wielkopolskiego.
* Przeciwciała "naturalne" (7).
** Przekazane biernie przeciwciała IgA lub IgM, obecne tylko w pierwszych dniach życia dziecka (porody operacyjne, patologia łożyska) (24).
Oznaczenie poziomu swoistych immunoglobulin IgM (1996-2000) lub obu klas IgA i IgM (1998-2000) w 3,2 mm krążkach bibuły filtracyjnej pobranej od noworodków przeprowadzano za pomocą własnych, niekomercyjnych testów immunoenzymatycznych opartych na zasadach odwróconej techniki ELISA typu immunocapture (ang. Enzyme-Linked ImmunoSorbent Assay), przy użyciu ultrasonikowanego antygenu Tx12 uzyskanego z hodowli komórkowej in vitro szczepu RH T. gondii na komórkach VERO oraz przeciwciała monoklonalnego, skierowanego przeciwko najbardziej immunogennej proteinie powierzchniowej SAG1 (P30) (Statens Seruminstitut, Kopenhaga) (7, 25, 26). Swoiste immunoglobuliny IgM (IgM ELISA) lub IgA i IgM (IgA/IgM ELISA) były wychwytywane przez wtórne przeciwciało królicze znakowane fosfatazą alkaliczną (DAKO), a barwny produkt reakcji był uwidaczniany po dodaniu roztworu enzymatycznego substratu – fosforanu p-nitrofenylu (Sigma), rozpuszczonego w buforze zawierającym dwuetanolaminę i MgCl2. Nowa, skojarzona technika IgA/IgM ELISA, dostosowana do analizy immunoglobulin w eluatach krążków bibuły filtracyjnej, pozwalała na łączne wykrywanie aktywnie syntetyzowanych przez noworodka przeciwciał IgA i IgM w postaci pojedynczego oznaczenia próbki krwi. Wprowadzona metoda immunoenzymatyczna o podwyższonej czułości diagnostycznej, okazała się niezwykle pomocna w wykrywaniu trudnych przypadków wrodzonego zarażenia T. gondii, cechujących się granicznymi lub słabo dodatnimi poziomami przeciwciał IgA lub IgM, trudno wykrywalnymi w klasycznych technikach serologicznych (25). W przypadku uzyskania dodatniego lub wątpliwego (granicznego) wyniku bibułowego testu skryningowego w kierunku swoistych przeciwciał IgA i/lub IgM, badanie było powtarzane w kolejnej serii testu w postaci podwójnego oznaczenia oraz próbka eluatu z bibuły była dodatkowo badana na obecność przeciwtoksoplazmowych przeciwciał klasy IgG. Potwierdzenie dodatniego lub granicznego wyniku dla przeciwciał IgA i/lub IgM była podstawą do wezwania dziecka oraz jego matki na badanie kontrolne surowicy krwi obwodowej, celem pełnej oceny profilu immunologicznego przeciwciał IgA, IgM, IgG anty-T. gondii i potwierdzenia czynnej syntezy przeciwciał u noworodka (ryc. 2).
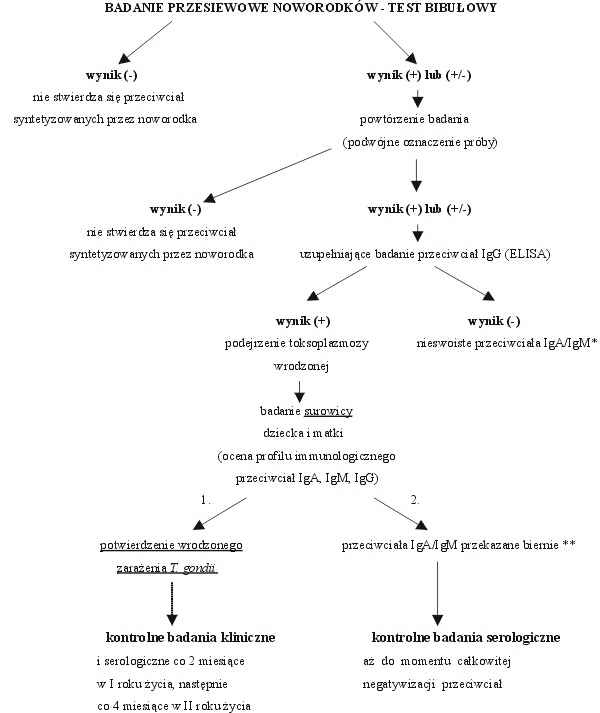
Ryc. 2. Schemat diagnostyczny wielkopolskiego programu badań przesiewowych noworodków w kierunku toksoplazmozy wrodzonej.
Rozpoznanie wrodzonej toksoplazmozy potwierdzano ostatecznie na podstawie 1) wykazania obecności nowo syntetyzowanych, nie przechodzących przez łożysko, swoistych immunoglobulin IgA lub IgM we krwi obwodowej techniką ELISA lub ISAGA (bioMérieux) po ukończeniu przez noworodka 10 doby życia oraz 2) wykrycia noworodkowych, przeciwtoksoplazmowych przeciwciał klasy IgG o innej swoistości antygenowej lub syntetyzowanych w wyższym stężeniu niż przeciwciała matki lub stwierdzenia czynnej produkcji przeciwciał IgM z zastosowaniem analizy profilu immunologicznego porównawczego surowicy krwi matki i dziecka referencyjną techniką immunoblottingu (IgG-IgM Western blot). W przypadku potwierdzenia wrodzonego zarażenia T. gondii, poziom swoistych przeciwciał oceniano co 2 tygodnie do czasu całkowitej negatywizacji immunoglobulin IgA i IgM, a następnie co 2 miesiące w pierwszym roku życia i co 4 miesiące w latach późniejszych (PLATELIA TOXO IgA, IgM, IgG, BIO-RAD; VIDAS TOXO IgM i IgG oraz ISAGA PLUS IgA/IgM, bioMérieux, Francja).
U noworodków z rozpoznanym zarażeniem T. gondii dokonywano pełnej oceny klinicznej inwazji pasożytniczej (przezciemiączkowe USG głowy, RTG czaszki, badanie oftalmoskopowe, ocena potencjałów słuchowych wywołanych) oraz prowadzono swoiste leczenie przeciwtoksoplazmowe, dobierane indywidualnie w zależności od postaci klinicznej zarażenia i stopnia ciężkości objawów, zgodnie z aktualnie obowiązującymi zaleceniami Europejskiej Sieci ds. Wrodzonej Toksoplazmozy. Dzieci z bezobjawową formą zarażenia T. gondii otrzymywały leczenie skojarzone pirymetaminą (Daraprim) z sulfadiazyną (Sulfadiazin) w kursach 4-tygodniowych naprzemienne ze spiramycyną (Rovamycine), natomiast w przypadkach objawowej toksoplazmozy stosowano leczenie pirymetaminą z sulfadiazyną w sposób ciągły przez okres 12-24 miesięcy pod stałą osłoną kwasu folinowego (Lederfolat) i ścisłą kontrolą parametrów morfologii krwi obwodowej.
WYNIKI
Od czerwca 1996 roku do kwietnia 2000 roku, przebadano łącznie 45 169 próbek krwi w kierunku obecności czynnie syntetyzowanych przeciwciał anty-T. gondii, pobranych od noworodków na bibułę filtracyjną w pierwszych dniach życia. 27 516 krążków bibuły było badanych na obecność swoistych przeciwciał IgM (czerwiec 1996-październik 1998), natomiast kolejnych 17 653 noworodkowych kart Guthriego było analizowanych za pomocą opracowanego po raz pierwszy testu, wykrywającego łącznie przeciwciała IgA i IgM (grudzień 1998 – kwiecień 2000). Liczbę przebadanych noworodków w poszczególnych oddziałach szpitali województwa wielkopolskiego przedstawiono na rycinie 3 A i B.

Ryc. 3. Liczba noworodków objętych badaniem przesiewowym w kierunku toksoplazmozy wrodzonej w poszczególnych szpitalach województwa wielkopolskiego: (A) n na obecność swoistych przeciwciał IgM, (B) n na obecność przeciwciał IgA i IgM anty-T. gondii.
Podczas prowadzenia skryningu pilotażowego w kierunku przeciwtoksoplazmowych przeciwciał IgM, krew pobierano przy okazji rutynowych badań w kierunku fenyloketonurii i wrodzonej niedoczynności tarczycy, ale przy zastosowaniu oddzielnych kart bibuły. W udoskonalonym skryningu serologicznym, łączącym wykrywanie przeciwciał IgA i IgM, krew pobierano niezależnie i jak najwcześniej po urodzeniu, z zaleceniem pierwszej doby życia, kładąc szczególny nacisk na systematyczne badanie wszystkich noworodków. Wyeliminowano oddziały noworodkowe, które pobierały krew od wybranych dzieci w sposób przypadkowy.
Obecność przeciwtoksoplazmowych przeciwciał IgM wykryto w 13 noworodkowych kartach bibuły (6 noworodków płci żeńskiej, 7 noworodków płci męskiej). Częstość występowania przeciwciał IgM u noworodków wynosiła 1 na 2117 żywo urodzonych dzieci (0,47 na 1000), czyli 1 na 1185 dzieci (0,84 na 1000) urodzonych przez seronegatywne przed ciążą matki z potencjalnym ryzykiem pierwotnego zarażenia T. gondii w czasie ciąży, w odniesieniu do aktualnego odsetka seropozytywności w kierunku toksoplazmozy w badanej populacji wynoszącego 43,7% (25).
Spośród 13 pacjentów z obecnością swoistych przeciwciał IgM w skryningowym teście niekomercyjnym, u 12 potwierdzono obecność immunoglobulin IgA i IgM w surowicy żylnej krwi obwodowej w tradycyjnych technikach serologicznych, natomiast u jednego noworodka stwierdzono wysoki poziom swoistych przeciwciał IgM, przy granicznych wartościach immunoglobulin klasy IgA.
Dodatkowo, objawową toksoplazmozę wrodzoną rozpoznano u dwóch IgM-negatywnych noworodków, urodzonych na obszarze objętym badaniem skryningowym, u których krew pobrano do badań zbyt późno, odpowiednio w 5 i 8 dobie życia. We wszystkich 15 przypadkach wykazano obecność przeciwciał IgG o innej swoistości antygenowej i/lub syntetyzowanych w wyższym stężeniu niż immunoglobuliny matki w technice immunoblottingu, potwierdzając ostatecznie wrodzone zarażenie T. gondii. Całkowita częstość występowania wrodzonego zarażenia T. gondii u noworodków wielkopolskich wynosiła więc co najmniej 1 na 1834 żywych porodów (0,55 na 1000), czyli 1 na 1033 ciąże (0,97 na 1000) przebiegające z ryzykiem urodzenia dziecka z toksoplazmozą wrodzoną. Czułość diagnostyczna testu skryningowego wykrywającego przeciwciała IgM anty-T. gondii wynosiła nie więcej niż 86,7%, przy wysokiej swoistości diagnostycznej równej 99,9%.
Przy zastosowaniu nowego testu serologicznego, wykrywającego łącznie przeciwciała IgA i IgM, rozpoznano kolejnych 19 noworodków z wrodzonym zarażeniem T. gondii (8 noworodków płci żeńskiej, 11 noworodków płci męskiej). Częstość wykrywania swoistych przeciwciał IgA i/lub IgM anty-T. gondii wzrosła więc do 1 na 929 żywych porodów (1,08 na 1000), czyli 1 na 520 ciąż (1,92 na 1000) przebiegających z ryzykiem urodzenia dziecka z toksoplazmozą wrodzoną, w odniesieniu do odsetka kobiet pozbawionych przeciwciał przed ciążą.
Spośród 19 pacjentów z obecnością swoistych przeciwciał IgA i/lub IgM w krążkach bibuły filtracyjnej pobranej przy urodzeniu, u 12 potwierdzono obecność immunoglobulin IgA i IgM w surowicy żylnej krwi obwodowej w tradycyjnych testach serologicznych, w 3 przypadkach wykryto obecność tylko przeciwciał IgM, u jednego noworodka wykazano wyłącznie przeciwciała IgA, natomiast pozostałe 3 przypadki były potwierdzone w oparciu o analizę profilu immunologicznego porównawczego przeciwciał w surowicy krwi obwodowej dziecka i matki techniką Western blotu.
Dodatkowo wykryto jednego noworodka z opóźnioną produkcją swoistych przeciwciał IgM w 4 tygodniu życia, urodzonego przez matkę z serokonwersją w czasie ciąży, otrzymującą swoiste leczenie przeciwpasożytnicze przed potwierdzeniem wrodzonego zarażenia u płodu. Poza tym zidentyfikowano dwoje zarażonych dzieci, u których nie pobrano krwi na badanie przesiewowe w kierunku toksoplazmozy wrodzonej. Pierwszy przypadek był bezobjawowy po urodzeniu, a ocenę poziomu swoistych przeciwciał w kierunku T. gondii wykonano na prośbę matki w wieku 12 miesięcy, stwierdzając wysoki poziom czynnie syntetyzowanych przeciwciał IgG, stanowiący jednoznaczne potwierdzenie wrodzonej inwazji T. gondii. W drugim przypadku, wykazano obecność przeciwtoksoplazmowych przeciwciał IgA i IgM we krwi obwodowej krótko przed zgonem, który nastąpił w wieku 7 tygodni w wyniku uogólnionej parazytemii z niewydolnością wielonarządową. Po uwzględnieniu jednego przypadku, ujemnego w momencie prowadzenia badań skryningowych, z uwagi na zahamowanie syntezy IgM przez leki przeciwpasożytnicze stosowane w okresie prenatalnym, częstość wrodzonego zarażenia T. gondii w badanej populacji wynosiła co najmniej 1 na 883 żywych urodzeń (1,13 na 1000), czyli 1 na 497 porodów przebiegających z ryzykiem urodzenia dziecka z toksoplazmozą wrodzoną (2,0 na 1000), w odniesieniu do liczby seronegatywnych matek, podatnych na pierwotne zarażenie T. gondii w czasie ciąży. Czułość diagnostyczna kombinowanego testu skryningowego wykrywającego łącznie przeciwciała IgA i IgM anty-T. gondii wynosiła 95%, przy swoistości diagnostycznej 99,9%.
Długość utrzymywania się przeciwtoksoplazmowych przeciwciał IgM we krwi obwodowej zarażonych noworodków, nie leczonych w okresie życia płodowego, wynosiła od 1 do 20 tygodni życia (średnio 7,6 tygodni), natomiast swoiste przeciwciała IgA wykrywano nieco dłużej – od 1 tygodnia do 16 miesięcy po urodzeniu (średnio 10,5 tygodni).
Ocena kliniczna dzieci z wrodzonym zarażeniem T. gondii, rozpoznanym na podstawie serologicznych badań skryningowych była przedmiotem oddzielnej publikacji (27).
DYSKUSJA
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Aspöck H. Prevention of congenital toxoplasmosis in Austria. Arch. Pédiatr. 2003, 10:16-17. 2. Ambroise-Thomas P. et al.: Le prévention de la toxoplasmose congénitale en France. Évaluation des risques. Resultats et perspectives du dépistage anténatal et du suivi du nouveau-né. Bull Acad. Natlé. Méd. 2001, 185:665-688. 3. Berger R, Merkel S, Rudin C. Toxoplasmosis in pregnancy: findings from umbilical cord blood screening in 30,000 newborn infants. Schweiz Med Wochenschr 1995, 125:1168-1173. 4. Eaton R.B., Petersen E., Seppänen H., Tuuminen T. Multicenter evaluation of a fluorometric enzyme immunocapture assay to detect Toxoplasma-specific immunoglobulin M in dried blood filter paper specimens from newborns. J. Clin. Microbiol. 1996, 34:3147-3150. 5. Guerina N.G., Hsu H.W., Meissner H.C., Maguire J.H., Lynfield R., Stechenberg B., Abroms I., Pasternack M.S., Hoff R., Eaton R.B., Grady G.F. and the New England Regional Toxoplasma Working Group. Neonatal serologic screening and early treatment for congenital Toxoplasma gondii infection. N. Engl. J. Med. 1994, 330:1859-1863. 6. Lebech M., Petersen E.: Detection by enzyme immunosorbent assay of Toxoplasma gondii IgG antibodies in dried blood spots on PKU-filter paper from newborns. Scand. J. Infect. Dis. 1995, 27:259-263. 7. Lebech M., Andersen O., Christensen N.C., Hertel, Nielsen H.E., Peitersen B., Rechnitzer C., Larsen S.O., Nřrgaard-Pedersen B., Petersen E. and the Danish Congenital Toxoplasmosis Study Group. Feasibility of neonatal screening for Toxoplasma infection in the absence of prenatal treatment. Lancet 1999, 353:1834-1837. 8. Buffolano W. et al.: Risk factors for recent Toxoplasma infection in pregnant women in Naples. Epidemiol. Infect. 1996, 116:347-351. 9. Evengĺrd B. et al.: A retrospective study of seroconversion against Toxoplasma gondii during 3,000 pregnancies in Stockholm. Scand. J. Infect. Dis. 1999, 31:127-129. 10. Hohlfeld P.: Toxoplasmosis in pregnancy: arguments in favor of systematic screening in Switzerland. Arch. Gynecol. Obstet. 1995, 256:165-169. 11. Jenum P.A. et al.: Improved diagnosis of primary Toxoplasma gondii infection in early pregnancy by determination of antitoxoplasma immunoglobulin G avidity. J. Clin. Microbiol. 1997, 35:1972-1977. 12. Jenum P.A. et al.: Eng J. Incidence of Toxoplasma gondii infection in 35,940 pregnant women in Norway and pregnancy outcome for infected women. J. Clin. Microbiol. 1998, 36:2900-2906. 13. Foulon W. et al.: Prevention of congenital toxoplasmosis. J. Perinat. Med. 2000, 28:337-345. 14. Dzbeński T.H., Kopaczowa G.: Uwagi na temat epidemiologii i profilaktyki toksoplazmozy. Przegl. Epidemiol. 1984, 38:235-241. 15. Lipka B. i wsp.: Odległe następstwa toksoplazmozy wrodzonej u dzieci – na podstawie materiału Kliniki Niemowlęcej Instytutu „Pomnik – Centrum Zdrowia Dziecka”. Ped. Pol. 2001, 76:441-448. 16. Pawłowski Z.S.: Zwalczanie toksoplazmozy wrodzonej w Polsce. Wiad. Parazytol. 1993, 39:331-338. 17. Desmonts G., Couvreur J.: Toxoplasmose congénitale. Étude prospective de l´issue de la grossesse chez 542 femmes atteintes de toxoplasmose acquise en cours de gestation. Sem. Hôp. Paris 1986, 62:1418-1422. 18. Remington J.S. et al.: Toxoplasmosis. In: Remington JS, Klein JO, editors. Infectious Diseases of the Fetus and the Newborn Infant. 5th ed. Philadelphia: WB Saunders Company; 2001, 205-346. 19. Dzbeński T.H., Reizer A.: Toksoplazmoza w Polsce w latach 1986-1989. Przegl. Epidemiol. 1991, 45:117-120. 20. Ambroise-Thomas P., Okay T.: Variations inter et intra-cépales de pathogénicité chez Toxoplasma gondii. Conséquences cliniques et épidémiologiques. Bull. Acad. Natle. Méd. 1993, 177:1411-1421. 21. Pinon JM. et al.: Strategy for diagnosis of congenital toxoplasmosis: evaluation of methods comparing mothers and newborns and standard methods for postnatal detection of immunoglobulin G, M, and A antibodies. J. Clin. Microbiol. 2001, 39:2267-2271. 22. Pawłowski Z.S. i wsp.: Toksoplazmoza wrodzona w województwie poznańskim. Gin. Pol. 1994, 65:409-412. 23. Pawłowski Z.S.: Epidemiologia kliniczna toksoplazmozy w województwie poznańskim. Klin. Perin. Gin. 1995, Supl. XI:5-11. 24. Petersen E., Eaton R.: Control of congenital infection with Toxoplasma gondii by neonatal screening based on detection of specific immunoglobulin M antibodies eluted from phenylketonuria filter paper blood-spot samples. Acta. Paediatr. 1999, 432 (Suppl.):36-39. 25. Paul M. et al.: Prevalence of congenital Toxoplasma gondii infection among newborns from the Poznań region of Poland: validation of a new combined enzyme immunoassay for Toxoplasma gondii – specific immunoglobulin A and immunoglobulin M antibodies. J. Clin. Microbiol. 2001, 39:1912-1916. 26. Paul M. et al.: Neonatal screening for congenital toxoplasmosis in the Poznań region of Poland by analysis of Toxoplasma gondii – specific IgM antibodies eluted from filter-paper blood spots. Pediatr. Infect. Dis. J. 2000, 19:30-36. 27. Paul M. i wsp.: Ocena skuteczności leczenia dzieci z toksoplazmozą wrodzoną rozpoznaną na podstawie pourodzeniowych badań przesiewowych. Przegl. Ped., 2003, 33:46-53. 28. Couvreur J.: Toxoplasmose congénitale: prise on charge et devenir. Med. Mal. Infect. 1993, 23:176-182. 29. McAuley J, Boyer KM, Patel D, Mets M, Swisher C, Roizen N, Wolters C, Stein L, Stein M, Schey W, Remington J, Meier P, Johnson D, Heydeman P, Holfels E, Withers S, Mack D, Brown C, Patton D, McLeod R. Early and longitudinal evaluations of treated infants and children and untreated historical patients with congenital toxoplasmosis: the Chicago collaborative treatment trial. Clin. Infect. Dis. 1994, 18:38-72. 30. Patel D.V. t al.: Resolution of intracranial calcifications in infants with treated congenital toxoplasmosis. Radiology 1996, 199:433-440. 31. Roizen N. et al.: Neurologic and developmental outcome in treated congenital toxoplasmosis. Pediatrics 1995, 95:11-20. 32. Lebech M. et al.: Classification system and case definitions of Toxoplasma gondii infection in immunocompetent pregnant women and their congenitally infected offspring. J. Clin. Microbiol. Inf. Dis. 1996, 15:799-804. 33. Bessičres M.H. Et al.: IgA antibody response during acquired and congenital toxoplasmosis. J. Clin. Pathol. 1992, 45:605-608. 34. Decoster A. et al.: Anti-P30 IgA antibodies as prenatal markers of congenital Toxoplasma infection. Clin. Exp. Immunol. 1992, 87:210-315. 35. Duffy K.T. et al.: Assessment of immunoglobulin-M immunosorbent agglutination assay (ISAGA) for detecting Toxoplasma specific IgM. J. Clin. Pathol. 1989, 42:1291-1295. 36. Fricker-Hidalgo H. et al.: Congenital toxoplasmosis: contribution of postnatal biological follow-up. Presse Méd. 1996, 25:1868-1872. 37. Thulliez P. et al.: Évaluation de trois réactifs de détection par immunocapture des IgM spécifiques de la toxoplasmose. Rev. Fr. Lab. 1988, 169:25-31. 38. Naessens A. et al.: Diagnosis of congenital toxoplasmosis in the neonatal period: a multicenter evaluation. J. Pediatr.1999, 145:714-719. 39. Gras L. et al.: Effect of prenatal treatment on the risk of intracranial and ocular lesions in children with congenital toxoplasmosis. Int. J. Epidemiol. 2001, 30:1309-1313. 40. European Multicentre Study on Congenital Toxoplasmosis: Prusa A, Hayde M, Pollak A, Wallon M, Peyron F, Thulliez P, Romand S, Buffolano W, Franck J, Dumon H, Bastien P, Issert E, Bessičres MH, Ferret N, Marty P, Evengĺrd B, Malm G, Pelloux H, Fricker-Hidalgo H, Bost-Bru C, Semprini E, Savasi V, Paul M, Petersen E, Gilbert R, Gras R, Valenti L. Effect of timing and type of treatment on the risk of mother to child transmission of Toxoplasma gondii. Br. J. Obstet. Gynaecol. 2003, 110:112-120. 41. Marx-Chemla C. et al.: La surveillance immunologique d´une femme enceinte séronégative pour la toxoplasmose doit-elle s´arręter ŕ l´accouchement? Presse Méd. 1990, 19:367-368. 42. Foulon W. et al.: Treatment of toxoplasmosis during pregnancy: a multicenter study of impact on fetal transmission and children´s sequelae at age 1 year. Am. J. Obstet. Gynecol. 1999, 180:410-415. 43. Wallon M. et al.: Congenital toxoplasmosis: systematic review of evidence of efficacy of treatment in pregnancy. BMJ 1999, 318:1511-1514. 44. Wallon M. et al.: Diagnosis of congenital toxoplasmosis at birth: what is the value of testing for IgM and IgA? Eur. J. Pediatr. 1999, 158:645-649. 45. Malm G. et al.: Three children with congenital toxoplasmosis: early report from a Swedish prospective screening study. Acta. Paediatr. 1999, 88:667-670. 46. Desmonts G. et al.: Toxoplasmose congénitale. Cinq cas de transmission ŕ l´enfant d´une infection maternelle antérieure ŕ la grossesse. Presse Méd. 1990, 19:1445-1449. 47. Fortier B. et al.: Toxoplasma gondii: 2 cas de recontamination sur terrain immune. Presse Méd. 1991, 20:2109. 48. Gavinet M.F. et al.: Congenital toxoplasmosis due to maternal reinfection during pregnancy. J Clin Microbiol 1997, 35:1276-1277. 49. Hennequin C. et al.: Congenital toxoplasmosis acquired from an immune woman. Pediatr. Infect. Dis. J. 1997, 16:75-77. 50. Hohlfeld P. et al.: Fetal toxoplasmosis: outcome of pregnancy and infant follow-up after in utero treatment. J. Pediatr. 1989, 115:765-769. 51. Luyasu V. et al.: Congenital toxoplasmosis and seroconversion in last weeks of pregnancy – clinical observations. Acta. Clin. Belgica 1997, 52:381-387.



