© Borgis - Nowa Pediatria 1/2004, s. 41-44
Janusz Książyk
Witamina D, osteopenia, krzywica i osteoporoza
Vitamin D, osteopenia, rickets and osteoporosis
z Instytutu „Pomnik – Centrum Zdrowia Dziecka” w Warszawie
Streszczenie
Vitamin deficiency results in rickets in children and osteoporosis in adults. Prematurely born infants are at risk of osteopenia and rickets. The serum level of 25(OH)D should exceed 80 nmol/L. Long-term breast feeding, without vitamin D supplementation, is a risk factor for the development of rickets. Present recommendation for vitamin D intake in adults probably underestimate the needs.

W początkach XX wieku odkryto, że olej z wątroby dorsza ma działanie lecznicze w krzywicy (1) a także, że podobny efekt wywiera światło słoneczne (2). Krzywica była chorobą społeczną w czasach rewolucji przemysłowej przełomu wieków, by zniknąć w praktyce klinicznej rozwiniętych krajów w latach pięćdziesiątych dwudziestego stulecia (3). To „zniknięcie” nie było trwałe, gdyż ponownie, od lat siedemdziesiątych XX wieku pojawiły się opisy tej choroby, przy czym dotyczyły one także dzieci długotrwale karmionych piersią (4). Częste występowanie krzywicy u czarnoskórych amerykańskich niemowląt karmionych wyłącznie piersią i pozbawionych suplementacji witaminą D (5) potwierdza konieczność takiej suplementacji. Oprócz witaminy D, wapń (Ca) i fosfor (P) odgrywają ogromną rolę w utrzymaniu prawidłowej mineralizacji kości. Wapń i fosfor są najpowszechniejszymi minerałami występującymi w ustroju ludzkim i wspólnie stanowią około 2 kg masy ciała dorosłej osoby. Najwięcej Ca i P występuje w kościach i zębach w postaci hydroksyapatytów. „Wagowy” udział Ca i P w budowie strukturalnej ciała jest bardzo znaczący, a ich rola w metabolizmie i regulacji funkcji komórek jest niezastąpiona. Fosfor jest składnikiem ATP i niezbędnym czynnikiem przemian węglowodanów, tłuszczu i białka. Wapń odgrywa ogromną rolę w kurczliwości mięśni, regulacji przepływu impulsów nerwowych i regulacji ciśnienia krwi.
Stężenie Ca we krwi jest regulowane poprzez wpływ hormonów (kalcitonina, parathormon i witamina D) na wchłanianie w jelicie cienkim, wydalanie z moczem oraz procesy formowania i rozpadu struktur kostnych. W patogenezie osteoporozy znaczącą rolę odgrywa też niedobór wapnia w diecie lub niewystarczające jego wchłanianie a następnie spadek poziomu krążących estrogenów (u kobiet po menopauzie).
U ludzi, 7-dehydrocholesterol jest prowitaminą D, która powstaje w wyniku działania światła słonecznego. Ergosterol jest prowitaminą D w roślinach. Szybkość wchłaniania witamin D zależy od efektywności transportu z komórek nabłonka jelitowego z wytworzeniem chylomikronów jako składnika chłonki. Witamina D nie jest tak naprawdę witaminą a raczej jest hormonem. Z ergosterolu powstaje (pod wpływem promieni ultrafioletowych) ergokalcyferol (witamina D2) a z 7-dehydrocholesterolu – cholekalcyferol (witamina D3-kalcidiol). Cholekalcyferol (z pokarmów i z syntezy skórnej) przenoszony jest do wątroby, gdzie ulega hydroksylacji. Powstaje 25-hydroksycholekalcyferol [25(OH)D], który jest magazynowany w wątrobie oraz uczestniczy w krążeniu jelitowo-wątrobowym. W nerkach oraz w kościach i łożysku 25-hydroksycholekalcyferol ulega hydroksylacji do 1,25-dihydroksycholekalcyferolu [1,25(OH)2D-kalcitriol], który jest najbardziej aktywną formą witaminy D. Hydroksylacja w pozycji 24 prowadzi do powstania nieaktywnej formy witaminy – 24,25-dihydroksycholekalcyferolu [(24,25(OH)2D]. Rycina 1 (str. 42) przedstawia przemiany witaminy D u zwierząt i ludzi. Hydroksylacja do 1,25(OH)2D (kalcitriol) jest kontrolowana przez parathormon (PTH), hipokalcemię i hipofosfatemię.
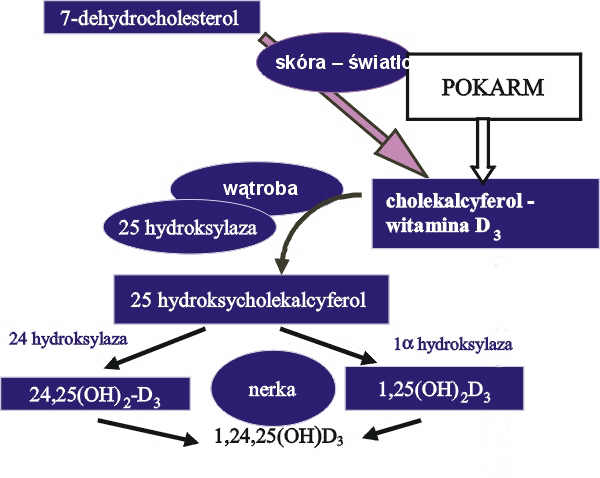
Ryc. 1. Przemiany witaminy D.
Krzywica, zależna od żywieniowych niedoborów witaminy D (czego wyrazem jest niski poziom 25(OH)D w surowicy), wyraża się klinicznie wtórną nadczynnością przytarczyc. Wtórna nadczynność przytarczyc wynika z zaburzeń jelitowego wchłaniania wapnia i zaburzeń uwalniania wapnia z kości (6) i ma, początkowo, na celu stymulację aktywności osteoblastów (co demonstruje się podwyższonym poziomem fosfatazy alkalicznej w surowicy). Następnie, w wyniku wzrostu aktywności parathormonu następuje normalizacja poziomu wapnia w surowicy, w wyniku jego mobilizacji z kości (wzrasta aktywność osteoklastów). We wczesnym okresie choroby, diagnostyczne znaczenie poziomu surowiczego 1,25(OH) 2 D jest mniejsze niż 25(OH)D, gdyż hipokacemia i hipofosfatemia stymulują nerkową syntezę kalcitriolu, co powoduje, że jego poziom może nie odzwierciedlać niedoborów żywieniowych witaminy D.
Stan nadczynności przytarczyc trwa, mimo przywrócenia prawidłowego poziomu wapnia w surowicy, gdyż krążący kalcitriol-1,25(OH)2D) – nie jest wystarczający dla zahamowania aktywności przytarczyc (7). Degradacja kości skutkuje objawami klinicznymi krzywicy.
Formowanie i rozpad struktur kostnych jest stałym procesem dynamicznym. Tworzenie kości płaskich polega na tym, że komórki mezenchymy różnicują się do osteoblastów z powstaniem włókien kolagenowych i odkładaniem fosforanu wapnia. W kościach długich komórki mezenchymy różnicują się do chondrocytów, układających się beleczkowato i tworzących wapniejącą płytkę wzrostową, która jest rozpuszczana przez osteoklasty z następowym wnikaniem w nią naczyń i namnażania się osteoblastów. Laboratoryjne cechy krzywicy charakteryzują się więc: spadkiem poziomu 25OHD3, hipokalcemią, hipofosfatemią, wzrostem poziomu fosfatazy alkalicznej i parathormonu.
W badaniu moczu stwierdza się wzrost wydalania fosforanów, nieznaczne wydalanie wapnia i aminoacidurię
Osteopenia jest terminem określającym niedostateczną mineralizację kośćca a w badaniach laboratoryjnych stwierdza się obniżenie stężenia fosforu, podwyższenie poziomu fosfatazy alkalicznej i metabolitu witaminy D: 1,25(OH)2D3. Osteopenia (czasami nazywana metaboliczną chorobą kości) jest wynikiem zbyt małej – wobec potrzeb rosnącego dziecka – podaży wapnia i fosforu w pokarmie. Zalecenia dotyczące zawartości Ca i P w mieszankach przeznaczonych dla dzieci urodzonych przedwcześnie zakładają zwiększone potrzeby dziecka. W stanach niedoboru witaminy D mineralizacja kości jest niedostateczna z proliferacją chrząstki. Poszerzenie nasad kości wynika z nieregularnej mineralizacji beleczek pod płytką wzrostową i powiększenia niezmineralizowanej macierzy kostnej. W pierwszym okresie mogą ujawnić się kliniczne objawy hipokalcemii, następnie objawy osłabienia mineralizacji.
Niedobory wapniowo-fosforanowe i witaminy D w wieku dorosłym skutkować mogą rozwojem osteoporozy, która polega na zmniejszeniu masy kostnej i jej zwiększoną łamliwością. Do czynników ryzyka rozwoju osteoporozy należą: wywiad rodzinny, płeć żeńska, szczupłość, wczesna menopauza i nie zachodzenie w ciążę. Ważne jest też współistnienie czynników dietetycznych i środowiskowych takich jak: niskie spożycie wapnia i wysokie białka oraz palenie tytoniu, picie alkoholu, siedzący tryb życia.
Zapobieganie osteoporozy obejmuje wystarczające spożycie wapnia i fosforu oraz odpowiednią podaż witaminy D i stymulację skórnej syntezy witaminy D. Ważne jest uprawianie ćwiczeń fizycznych i unikanie środowiskowych czynników ryzyka.
Wyróżnić można trzy stopnie tak zwanej „osteopatii z hipowitaminozy D” (8):
1. zaburzenia wchłaniania wapnia z jednoczesną kompensacją tego zjawiska poprzez podwyższony poziom PTH i zmiany w budowie kości, czego wynikiem jest osteoporoza,
2. zaburzenia wchłaniania wapnia, zmniejszenie masy kostnej, histologiczny obraz kości jak w osteomalacji,
3. objawy kliniczne krzywicy i osteomalacji bez dokonujących się zmian w budowie kości [z powodu braku 1,25(OH)2D oraz blokowania dostępu osteoklastom przez niezmineralizowany osteoid].
Zalecane obecnie dawki witaminy D zabezpieczają przed wystąpieniem objawów krzywicy i osteomalacji ale mogą być niewystarczające dla zapobieżeniu osteoporozie.
Nadmierna podaż witaminy D może prowadzić do wystąpienia objawów niepożądanych, takich jak: nadmierne wchłanianie Ca i P z przewodu pokarmowego ze zwapnieniami w tkankach miękkich (nerki, serce, płuca, wątroba).
Cholekalcyferol jest niezbędnym składnikiem diety lub innej formy egzogennej podaży witaminy D u tych osób, które pozbawione są możliwości skórnej syntezy (strefa podbiegunowa, szczelne ubranie, przebywanie w zamkniętych pomieszczeniach). Skórna synteza może być bardzo efektywna i sięgać 10 000 IU (250 ěg) przy ekspozycji całego ciała na promienie słoneczne.
Najnowsze spostrzeżenia dotyczące zaopatrzenia organizmu ludzkiego w witaminę D zakładają, że poziomy 25(OH)D powinny być wyższe niż 80 nmol/L a nawet 100 nmol/L (9). Poziomy te odnoszą się do ludzi żyjących w tych rejonach świata, gdzie ekspozycja na światło słoneczne jest wysoka przez większość roku. Z tego powodu obecnie uznawane rekomendacje dotyczące podaży witaminy D będą musiały być prawdopodobnie zmienione i ustalone (dla osób dorosłych) na poziomie 4000 IU (100 ěg) – ze źródeł egzogennych i endogennych łącznie – po to by poziom surowiczy 25(OH)D przekroczył 100 nmol/L.
Opisywano toksyczny efekt podaży zaledwie 1200 IU witaminy D (10) co w świetle powyższych uwag może budzić zdziwienie. Vieth wyjaśnia jednak (9), że to iż 1200 IU jest niewystarczające dla jednych a toksyczne dla innych, wynika z czynników środowiskowych, skoro samo światło słoneczne może dać surowicze poziomy 25(OH)D do 210 nmol/L.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Mellanby E.: Accessory food factors (vitamins) in the feeding of infants. Lancet 1920, 1:856-62. 2. Huldschinsky K.: Heilung von Rachites durch Künstliche Höhensonne. Dtsch. Med. Wschr. 1919, 45:712. 3. Cone T.E. Jr.: 200 years of feeding infants in America. Columbus (OH): Ross Laboratories; 1976, 72. 4. Gallagher J.C., Riggs B.L:. Current concepts in nutrition: nutrition and bone disease. N. Engl. J. Med. 1978, 298:193-7. 5.Kreiter S.R. et al.: Nutritional rickets in African American breast-fed infants. J. Pediatr. 2000, 137:153-157. 6. Arnaud C.D.: Parathyroid hormone and its role in the pathophysiology of the common forms of rickets and osteomalacia. In: Glorieux FH, ed. Rickets. Nestlé Nutrition Workshop Series; vol 21. New York: Raven Press, 1991, 47-61. 7. Markestad T. et al.: Plasma concentrations of vitamin D metabolites before and during treatment of vitamin D deficiency rickets in children. Acta Paediatr. Scand. 1984, 73:225-31. 8. Parfitt A.M.: Osteomalacia and related disorders. W: Avioli LV, Krane SM, ed. Metabolic bone disease and clinically related disorders. 2nd ed. Philadelphia: WB Saunders, 1990, 329-96. 9. Vieth R.: Vitamin D supplementation, 25-hydroksyvitamin D concentrations, and safety. Am. J. Clin. Nutr. 1999, 69:842-56. 10. Adams J.S., Lee G.: Gains in bone mineral density with resolution of vitamin intoxication. Ann. Intern. Med. 1997, 127:203-6. 11. Tjellesen L. et al.: Serum concentration of vitamin D metyabolites during treatment with vitamin D2 and D3 in normal premenopausal women. Bone Miner 1986, 1:407-13. 12. Dawson-Hughes B. et al.: Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older. N. Engl. J. Med. 1997, 337:670-676. 13. Standing Committee on the Scientific Evaluation of Dietary Reference Intakes. Dietary reference intakes: calcium, phosphorus, magnesium, vitamin D, and fluoride. Washington, DC: National Academy Press 1997. 14. Watson K.E. et al.: Active serum vitamin D levels are inversely correlated with coronary calcification. Circulation 1997, 96:1755-60. 15. Optimal Calcium Intake. NIH Consensus Statement 1994 June 6-8, 12(4):1. 16. Dorea J.G.: Calcium and phosphorus in human milk. Nutr. Res. 1999, 19:709. 17. Donangelo C.M., Dorea J.G.: Mercury and lead exposure during early human life as affected by food and nutritional staus. Environ Nutr. Interact. 1998, 2:169. 18. Manz F.: Why is phosphorus in human milk exeptionally low. Monatsschr Kinderheikd 1992, 140:S35. 19. Senterre J. et al.: Effect of witamin D and phosphorus supplementation on calcium retention in preterm infants fed banked human milk. J. Pediatr. 1983, 103:305. 20. Recommended Dietary Allowance. National Academy Press 10th Ed. Washington 1989, 174. 21. Stolarczyk A.: Dzienne zapotrzebowanie na składniki pokarmowe. W: Żywienie dzieci zdrowych i chorych (red. J. Socha), Wydawnictwo Lekarskie PZWL, Warszawa; 1998, 39. 22. ESGAN Committee report: Nutrition and feeding of preterm infants. Act. Ped. Scand. 1987, supl. 336. 23. De Vizia B., Mansi A.: Calcium and phosphates metabolism in full-term infants. Monatsschr Kinderheilkd 1992, 140 suppl. 1 S:8. 24. Welch T.R. et al.: Vitamin D – deficient rickets: The reemergence of a once-conquered disease. J. Pediatr. 2000, 137:143-5.

